神经胶质瘤是指原发于中枢神经系统的以高度血管生成为特点的恶性肿瘤,具有弥漫侵袭的特性,对强化联合治疗和抗VEGF治疗均有耐药性,预后大都不良,2年生存率低于30%。胶质瘤干细胞(glioma stem cell,GSC)是参与胶质瘤自我更新、分化等胶质瘤病理生理的特定细胞群体,受低氧信号传导途径的调节[1]。GSC在胶质瘤发生、发展和促进维持方面都有一定作用,胶质瘤增殖快速, 造成内部高度缺氧,但瘤体能够高度血管化来保证增殖[2]。研究表明GSC能够在特定条件下向内皮细胞迁移,分化为血管周细胞维持血管生长及稳定[3]。此外,肿瘤细胞边缘存在缺氧灶是胶质瘤的主要特征之一,低氧被认为是驱动胶质瘤在病灶核心运动的因素之一[4],但缺氧能否促进GSC迁移,缺氧信号是直接作用于GSC或是通过其他途径到达GSC而促进GSC迁移,还要进一步探索。
Janus激酶(Janus kinase,JAK)/信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)是胶质瘤中肿瘤细胞存活、生长和侵袭的重要机制,是胶质瘤中旁分泌白血病抑制因子、IL-6或促红细胞生成素信号通路传导的下游常见途径[5]。STAT3已成为神经胶质瘤的重要治疗靶标,并且STAT3上游调节剂Janus kinase 2(JAK2)的许多小分子抑制剂目前正在进行胶质瘤的临床前研究。已证明用AG490或更强效的第二代类似物WP1066靶向抑制JAK2可降低U87和U251胶质瘤细胞的存活和增殖,降低U87在皮下异种移植物中的致瘤性[6-7]。
外泌体(exosome, Exo)是参与细胞外环境信号交流的重要载体。外泌体起源于多泡体,系脂质双层球形结构,直径40~150 nm不等[8]。外泌体内可包含酶、配体、受体、DNA、互补DNA(cDNA)、mRNA、微小RNA(miR)等,本身携带CD9、CD63、CD81、CD83、Alix、Tsg101等标志物,可以调节受体细胞内的信号转导、基因转录翻译及关键酶促反应过程[9]。几乎所有的细胞都可分泌外泌体,外泌体可以反映供体细胞的部分信息,并将这部分信息传达给受体细胞,实现细胞之间的“间接交流”。研究表明:外泌体是促进细胞间通信和肿瘤微环境内串扰的一种胞外囊泡(extracellular vesicle,EV)[10],胶质瘤衍生的EV包含不同促血管生成因子和促进内皮细胞增殖、迁移、分化需要的miR和胞外蛋白酶[11]。外泌体被靶细胞摄取后,外泌体内的成分也被转移到靶细胞内发挥病理生理作用。如胃癌细胞衍生的外泌体增强周细胞的增殖和迁移,诱导周细胞表达肿瘤相关成纤维细胞(CAFs)的标记物,而PI3K/AKT和MEK/ERK途径被胃癌细胞衍生的外泌体激活,BMP途径的抑制能够逆转癌症外泌体诱导的CAFs转变[12]。胶质瘤的肿瘤微环境具有异质性和复杂性,依赖于该环境许多不同组成部分之间的信号交流。因此,由肿瘤细胞衍生的外泌体诱导的微环境改变对靶向原发性肿瘤的生长和转移可能是有一定作用的。在常氧和缺氧条件下,胶质瘤细胞分泌的外泌体内含物的性质和数量是有差异的[13],鉴于外泌体具有信号交流载体的特征,本研究旨在探讨外泌体可否将缺氧信号由胶质瘤细胞传递至GSC,进而影响GSC的迁移能力。
1 材料与方法 1.1 主要材料人胶质瘤细胞株U87来源于中国科学院细胞库。表皮生长因子(epidermal growthfactor, EGF)购自美国Peprotech公司,碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自美国Peprotech公司,B-27、DMEM高糖培养基、DMEM/F12培养基、胎牛血清和木瓜蛋白酶均购自美国Gibco公司,多聚赖氨酸购自美国Sigma公司,鼠抗人巢蛋白(Nestin)单克隆抗体、兔抗人Sox2单克隆抗体购自中国Proteintech公司,兔抗人CD81单克隆抗体、兔抗人CD9单克隆抗体、兔抗人GRP94单克隆抗体、兔抗人Tsg101单克隆抗体和JAK/ p-JAK单克隆抗体均购自美国Abcam公司,STAT3/p-STAT3购自美国CST公司,外泌体DIO染色试剂盒购自中国润基生物公司,Transwell小室购自美国BD公司。
1.2 方法 1.2.1 U87胶质瘤干细胞培养将对数生长期的U87细胞经胰酶消化成单个细胞,1 000 r/min离心5 min,弃上清用无血清培养基(SFM,EGF 20 ng/mL,bFGF 20 ng/mL,2% B-27,1%双抗)重悬,种于低吸附6孔板,置于37 ℃、5%CO2细胞培养箱中培养。4~5 d用木瓜蛋白酶消化,按1 :3比例传代,均用SFM培养。
1.2.2 U87胶质瘤干细胞标志物鉴定取24孔板,孔内放入细胞爬片,用0.01%多聚赖氨酸进行包被30 min,37 ℃,弃去多聚赖氨酸,无菌PBS润洗2次。将U87胶质瘤干细胞球和U87接种于24孔板内,37 ℃过夜,观察细胞贴壁后取出细胞爬片,冰PBS洗3次,4%多聚甲醛固定30 min后弃去,PBS清洗3次,即用型山羊血清封闭30 min,用PBS按1 :200比例配置Sox2和Nestin一抗孵育爬片, 4 ℃过夜。次日用PBST洗3次去多余一抗,荧光素标记二抗室温孵育1 h,PBST洗涤3次加DAPI孵育3 min, 再洗涤,抗荧光衰减剂封片后阴暗处风干,荧光显微镜下采集图像。
取U87和疑似胶质瘤干细胞的U87神经球,PBS润洗2次,置于冰上,加300 μL RIPA裂解液、3 μL PMSF和3 μL磷酸酶抑制剂于冰上裂解20 min。将混合液4 ℃、13 300 r/min,离心30 min,取上清,BCA标准曲线法测浓度后加入1/4体积5×蛋白上样缓冲液,金属浴100 ℃变性5 min,按30 μg/孔上样,8%和12% SDS-PAGE分离,250 mA转至0.22 μm PVDF膜上,脱脂牛奶封闭2 h,TBST洗涤后分别放入1 :1 000一抗稀释液配置的Nestin、Sox2、GAPDH一抗中4 ℃孵育过夜。次日分别放入对应兔鼠二抗中室温孵育1 h后,洗涤,发光显色。
1.2.3 外泌体提取将对数生长至70%左右的U87细胞更换为DMEM基础培养基,分为2组,常氧组:置于常氧(20%O2)37 ℃、5%CO2;缺氧组:置于缺氧(1%O2)37 ℃、5%CO2,分别处理48 h后,取上清。300×g离心20 min后,取上清,再以10 000×g离心30 min后,取上清0.22 μm过滤,120 000×g离心120 min后,弃上清,PBS重悬沉淀后再120 000×g离心70 min,弃上清,200 μL PBS重悬外泌体沉淀,BCA标准曲线法测定悬液蛋白浓度,-80 ℃保存。
1.2.4 Western blot检测外泌体标志蛋白表达取外泌体悬液加入1/4体积5×蛋白上样缓冲液,金属浴100 ℃变性5 min,与U87细胞蛋白按10 μg/孔上样,15% SDS-PAGE分离,250 mA转至0.22 μm PVDF膜上,封闭2 h,TBST洗涤后分别放入1 :1 000稀释液配置的CD81、CD9、Tsg101、GRP94一抗中,4 ℃孵育过夜。次日放入兔二抗中室温孵育1 h后洗涤发光显色。
1.2.5 外泌体动态光散射分析(DLS)将外泌体样本用PBS稀释100倍,使用马尔文ZEN3600仪器进行检测。
1.2.6 透射电镜检测外泌体形态将外泌体样本在碳支持膜铜网放置3~5 min,然后用滤纸吸去多余液体。将2%磷钨酸滴在碳支持膜铜网放置2~3 min, 用滤纸吸去多余液体。在透射电子显微镜(HITACHI HT7700)下观察,采集图像进行分析。
1.2.7 外泌体摄取实验取试剂盒复温,加5 μL DIO染料至50 μL反应液,混合至完全溶解。向混合液中加入50 μL外泌体样本混合,37 ℃孵育30 min。准备分离柱,吸去上层保护液,加200 μL灭菌PBS 50×g离心90 s清洗2次。将孵育好的外泌体样本加入分离柱上层,50×g离心90 s更换EP管为避光1.5 mL EP管,分离柱上层加入200 μL灭菌PBS,50×g离心90 s所得到的液体包含荧光标记外泌体。取24孔板,0.01%多聚赖氨酸包被细胞爬片,加入适量U87胶质瘤干细胞,并将荧光标记外泌体样本加入;以加入等量PBS作为对照,37 ℃孵育过夜后取出,用鼠抗人α-Tubulin单克隆抗体(1 :200)染色细胞骨架4 ℃过夜,隔夜洗涤后染DAPI后封片荧光显微镜下观察。
1.2.8 CCK-8法测定U87胶质瘤干细胞增殖取U87胶质瘤干细胞,木瓜蛋白酶消化成单细胞,离心后用DMEM/F12重悬计数,取96孔板,边缘孔加满PBS,每孔加入3 000个细胞,并分别加常氧(20%O2Exo)和缺氧(1%O2Exo)提取的外泌体,浓度梯度依次为1、5、10、20、40 μg/mL,补充SFM至100 μL/孔,每组设置5个复孔,分别于12、24、48、72 h加CCK-8试剂后37℃孵育4 h,于450 nm波长处测定光密度值D(450)。细胞活力=[加外泌体组D(450)值-空白组D(450)值]/[未加外泌体组D(450)值-空白组D(450)值]×100%。
1.2.9 Transwell法测U87胶质瘤干细胞迁移取U87胶质瘤干细胞,木瓜蛋白酶消化成单细胞,离心后用DMEM/F12重悬计数,将细胞稀释至105/mL,分为3组,空白组:加入等量PBS,常氧组:加入常氧提取的外泌体(20%O2Exo)50 μg/mL,缺氧组:加入缺氧提取的外泌体(1%O2Exo)50 μg/mL。取出Transwell小室,向每组上室加入200 μL细胞悬液,下室加入500 μL含10%FBS的DMEM高糖培养液,置于37 ℃培养箱中培养24、48、72 h。随后将小室取出,棉签擦去上室细胞,PBS清洗3次,4%多聚甲醛固定30 min后PBS冲洗,放于结晶紫染液中染色30 min,再用PBS洗涤后晾干,于200倍正置显微镜下每个小室随机取3个视野计数细胞。
1.2.10 Western blot检测胶质瘤干细胞迁移相关蛋白表达取U87胶质瘤干细胞,木瓜蛋白酶消化成单细胞,离心后用SFM重悬,分组同1.2.9,于48 h提取蛋白,Western blot检测JAK/STAT3通路总蛋白变化和蛋白磷酸化情况。
1.3 统计学分析采用Image J分析Western blot条带灰度值并对Transwell结果进行细胞计数。使用GraphPad Prism 6进行统计学分析。数据以x ± s表示, 两组间差异分析采用独立样本t检验。P < 0.05即认为差异具有统计学意义。
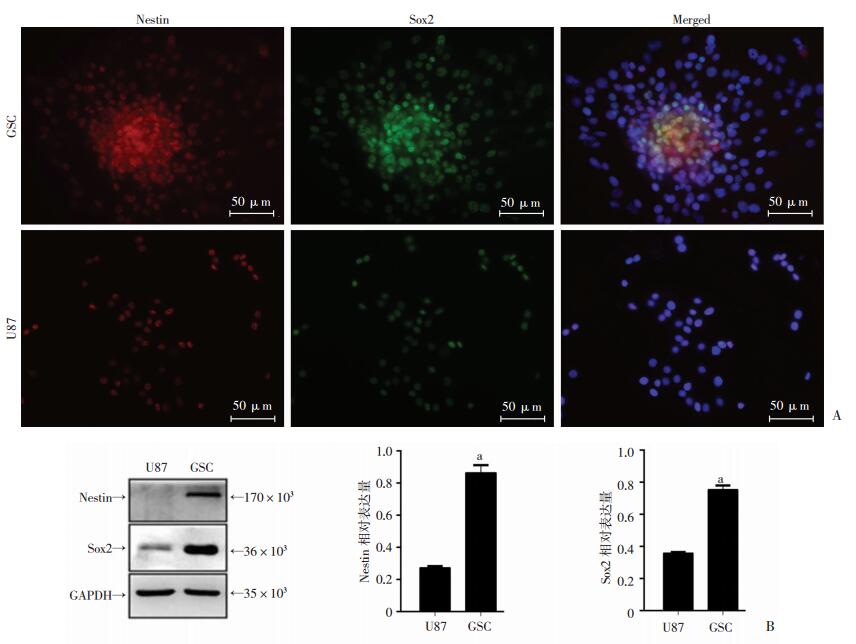
2 结果 2.1 胶质瘤干细胞标志物的免疫荧光和Western blot鉴定胶质瘤干细胞通常表达Nestin、Sox2、CD133等标志物。U87来源的胶质瘤干细胞免疫荧光检测结果显示:与U87细胞株比较,U87胶质瘤干细胞更高地表达Nestin(红色荧光)和Sox2(绿色荧光)。该结果在Western blot中也得到了相同的验证(图 1)。
|
| A:U87胶质瘤干细胞(GSC)和U87免疫荧光鉴定;B:Western blot检测U87和GSC中Nestin和Sox2的表达(n=3) a: P < 0.05,与U87比较 图 1 胶质瘤干细胞标志物测定 |
2.2 超高速离心法分离外泌体的鉴定
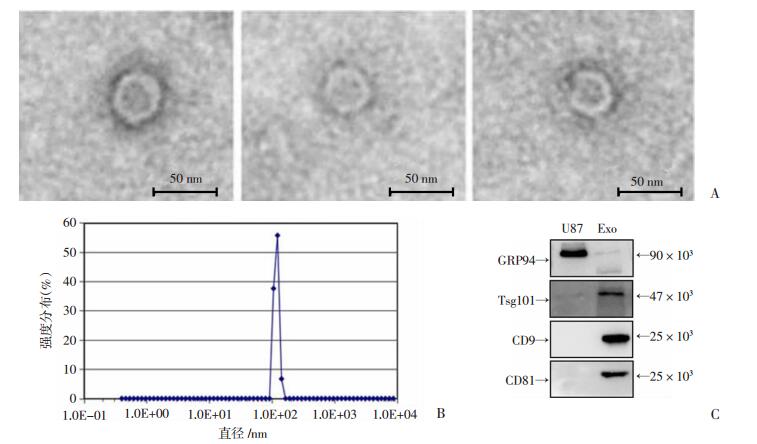
采用超高速离心法提取细胞上清中的外泌体,透射电镜显示外泌体直径约为50 nm(图 2A)。动态散射光分析显示在PBS水溶液中,考虑水化膜等因素影响,粒子直径集中在100 nm左右(图 2B)。此外,Tsg101、CD9、CD81等外泌体标记物也在提取的外泌体样本中检测到有表达,提取的外泌体样本几乎不表达阴性对照GRP94(图 2C)。表明外泌体样本中几乎不含细胞碎片等杂质。
|
| A:透射电镜下显示不同外泌体虽有个体差异,但形态上都呈经典的茶皿状(n>3);B:动态散射光(DLS)分析外泌体样本直径(n=3);C:Western blot检测外泌体标志蛋白Tsg101、CD9、CD81的表达,GRP94为阴性对照 图 2 超高速离心法分离的外泌体鉴定 |
2.3 胶质瘤来源的外泌体能被胶质瘤干细胞摄取
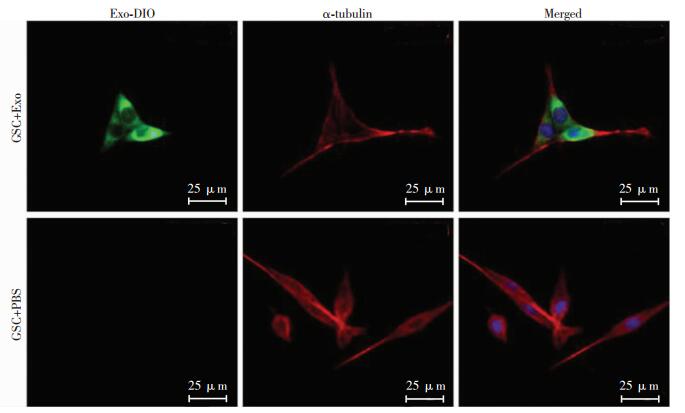
将外泌体用DIO标记后,加入胶质瘤干细胞培养基中共培养12 h,在胶质瘤干细胞的胞质中检测到外泌体携带的荧光染料DIO(图 3)。表明胶质瘤干细胞摄取了外泌体,并暂时储存于近细胞核部位的胞质中。
|
| 外泌体(DIO染色,绿光)和胶质瘤干细胞(α-tubulin,红光)共培养12 h后能被胶质瘤干细胞摄取 图 3 免疫荧光显微镜观察GSC摄取染色外泌体 |
2.4 Transwell实验检测胶质瘤干细胞迁移能力
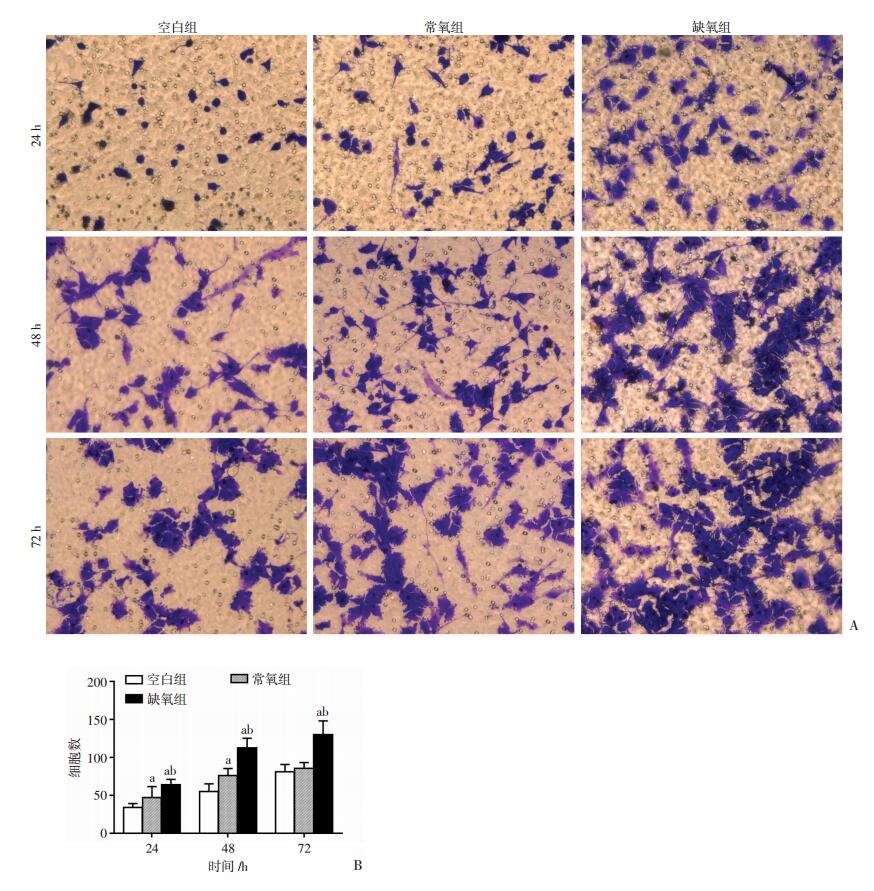
培养24、48 h,各组胶质瘤干细胞迁移能力差异均有统计学意义(P < 0.05);培养72 h,常氧组的胶质瘤干细胞迁移能力和空白组差异无统计学意义(P>0.05),但缺氧组的胶质瘤干细胞迁移能力较空白组仍然有明显提升(P < 0.05, 图 4)。
|
| A:不同时间各组胶质瘤干细胞迁移能力(× 200);B:每个视野下的细胞个数a: P<0.05, 与空白组比较; b: P<0.05, 与常氧组比较 图 4 Transwell实验检测胶质瘤干细胞迁移能力 |
2.5 CCK-8检测胶质瘤干细胞增殖能力
CCK-8检测结果显示:提取的外泌体以不同浓度(1、5、10、20、40 μg/mL)处理不同时间(12、24、48、72 h)后,常氧组和缺氧组胶质瘤干细胞的细胞活力差异无统计学意义(图 5)。可以排除迁移实验中的迁移能力差异是由胶质瘤干细胞内化外泌体后增殖能力提升造成的。
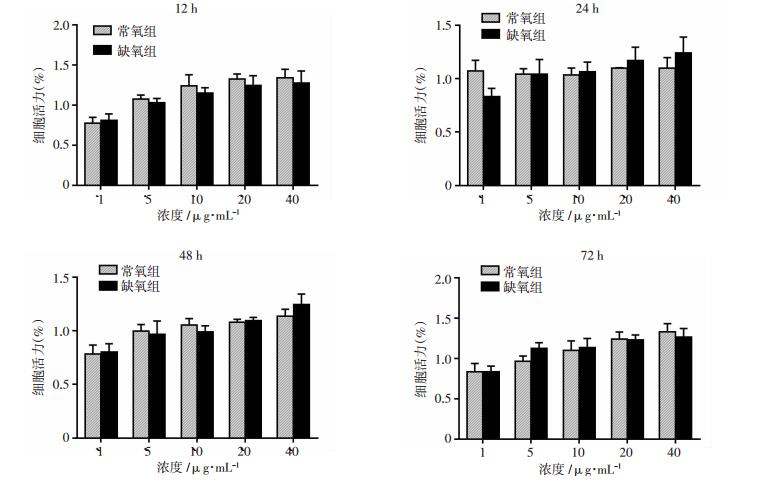
|
| 图 5 CCK-8检测胶质瘤干细胞增殖能力 (n=3) |
2.6 Western blot检测JAK/STAT3通路蛋白变化
培养48 h,缺氧组胶质瘤干细胞中的JAK/STAT3磷酸化水平较空白组和常氧组明显提高(P < 0.05,图 6)。
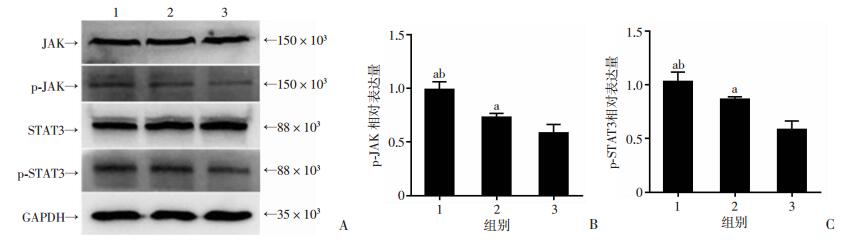
|
|
1:缺氧组;2:常氧组;3:空白组;a:P < 0.05,与空白组比较;b:P < 0.05,与常氧组比较 A:Western blot检测JAK/STAT3总蛋白和磷酸化蛋白的表达;B:p-JAK水平分析;C:p-STAT3水平分析 图 6 Western blot检测GSC中JAK/STAT3蛋白表达 |
3 讨论
胶质瘤的高速增殖对人类健康造成极大的危害。因胶质瘤增长极快,瘤内遍布缺氧灶,但是缺氧不仅没有限制胶质瘤的快速增殖,反而促进内皮细胞增殖、迁移和血管生成。胶质瘤干细胞是胶质瘤中具有特定病理特征细胞群体,携带CD133、Nestin、Sox2、Olig2、Nanog等特征性蛋白,拥有自我更新、分化、放化疗抗性以及处于静止期的能力[14],是协助肿瘤增殖和促成肿瘤复发的关键。研究表明胶质瘤干细胞在特定的条件下可以向血管周细胞分化稳定血管[3],可部分拮抗抗血管生成药物效力,低化疗药物血管壁的穿透率[3],保证胶质瘤增殖速率,使胶质瘤预后更差。
近年来,外泌体作为肿瘤细胞微环境交流介质被研究、探索,外泌体可以促进肿瘤生长、血管生成、拮抗放化疗药物、促进肿瘤转移、预形成转移微环境等[9]。目前,肿瘤细胞接收来自干细胞外泌体方面的研究较多,如胶质母细胞瘤接收Wharton’s Jelly间充质干细胞来源的miR-124后,抑制其增殖和迁移,同时增强化疗药物敏感性[15],而肿瘤细胞在不同环境条件下的外泌体对于其干细胞功能的影响有待进一步深入研究。外泌体可以传递与血管生成相关的生长因子如VEGF、TGF-β、miR-21、CXCR4等来促进血管生成[9]。缺氧信号可能直接作用于胶质瘤干细胞促成血管生成[2, 16],本研究主要探讨缺氧信号可否由胶质瘤细胞通过外泌体传递给胶质瘤干细胞,由外泌体在微环境中的传递来促进胶质瘤干细胞发生一系列行为学和形态学变化。
胶质瘤细胞在缺氧条件下生成的外泌体具有提升胶质瘤干细胞迁移能力的作用,处理后的胶质瘤干细胞可能会向血管迁移并进一步分化,促进肿瘤血管的稳定。本研究结果显示:与空白组和常氧组比较,低氧组胶质瘤干细胞的迁移能力明显提高,该现象部分是通过上调p-JAK和p-STAT3的水平来实现的。空白组和常氧组在细胞迁移能力上表现出一定差异,低氧组胶质瘤干细胞的迁移能力提高更显著。这说明胶质瘤细胞在常氧浓度处理后,分泌的外泌体本身就可以传递部分促迁移的信号,而低氧浓度处理后分泌的外泌体在此基础上传递了更多的缺氧信号,导致干细胞迁移能力进一步上升。此外,本研究对胶质瘤细胞常氧浓度和缺氧浓度分泌的外泌体从浓度梯度(1~40 μg/mL)和时间梯度(12~72 h)检测其能否促进胶质瘤干细胞的增殖来造成迁移能力的提高。结果显示:胶质瘤细胞常氧浓度和缺氧浓度分泌的外泌体对胶质瘤干细胞的增殖促进作用没有明显的差异,说明胶质瘤干细胞迁移能力的组间差异不是由胶质瘤干细胞增殖能力的差异造成的。外泌体可传递多种可促细胞迁移的信号物质,如外泌体可以向乳腺癌细胞传递miR-130a-3p,促进其迁移[17],向人脐静脉内皮细胞传递miR-126,促进其迁移[18]。外泌体增加细胞迁移能力可能通过Wnt/β-catenin[19]、PI3K/AKT/mTOR[20]、SDF-1α/CXCR4[21]等通路刺激胶质瘤干细胞迁移。本研究对可能造成细胞迁移能力改变的蛋白通路如Wnt通路、MAPK通路和JAK通路进行验证,发现胶质瘤干细胞和胶质瘤缺氧条件下生成的外泌体共培养后,JAK和STAT3的磷酸化水平明显提高,Wnt通路、MAPK通路蛋白的表达量差异无统计学意义(数据未展示),表明胶质瘤缺氧条件下生成的外泌体至少部分是通过提高JAK/STAT3通路磷酸化水平来促进GSC迁移的。有研究表明抗坏血酸可靶向JAK/STAT信号级联,继而抑制MMP-2介导的迁移和侵袭[22];抑制核糖体蛋白L34可以抑制JAK/STAT3信号通路,下调p-JAK和p-STAT3表达,抑制神经胶质瘤细胞的增殖和迁移[23];miR-30的下调能够抑制JAK/STAT3通路并降低胶质瘤干细胞的致癌性[24];ALK4的过表达通过抑制脑胶质瘤中JAK/STAT3信号通路的活化抑制细胞增殖和迁移[25]。在今后的研究中可对胶质瘤缺氧条件下生成的外泌体内部传递的因子及通路上下游关系、不同氧浓度处理的外泌体微阵列分析或高通量测序作进一步研究;此外,SAR317461为JAK2/STAT3通路的抑制剂[26],或可设定SAR317461抑制组,进一步佐证胶质瘤缺氧条件下生成的外泌体对胶质瘤干细胞迁移能力的影响是否部分通过JAK/STAT3通路。
| [1] |
KARSY M, GUAN J, JENSEN R, et al. The impact of hypoxia and mesenchymal transition on glioblastoma pathogenesis and cancer stem cells regulation[J]. World Neurosurg, 2016, 88: 222-236. DOI:10.1016/j.wneu.2015.12.032 |
| [2] |
KUCHARZEWSKA P, CHRISTIANSON H C, WELCH J E, et al. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development[J]. Proc Natl Acad Sci U S A, 2013, 110(18): 7312-7317. DOI:10.1073/pnas.1220998110 |
| [3] |
ZHOU W C, CHEN C, SHI Y, et al. Targeting glioma stem cell-derived pericytes disrupts the blood-tumor barrier and improves chemotherapeutic efficacy[J]. Cell Stem Cell, 2017, 21(5): 591-603. DOI:10.1016/j.stem.2017.10.002 |
| [4] |
KAHLERT U D, SUWALA A K, RAABE E H, et al. ZEB1 promotes invasion in human fetal neural stem cells and hypoxic glioma neurospheres[J]. Brain Pathol, 2015, 25(6): 724-732. DOI:10.1111/bpa.12240 |
| [5] |
STECHISHIN O D, LUCHMAN H A, RUAN Y B, et al. On-target JAK2/STAT3 inhibition slows disease progression in orthotopic xenografts of human glioblastoma brain tumor stem cells[J]. Neuro Oncol, 2013, 15(2): 198-207. DOI:10.1093/neuonc/nos302 |
| [6] |
RAHAMAN S O, HARBOR P C, CHERNOVA O, et al. Inhibition of constitutively active STAT3 suppresses proliferation and induces apoptosis in glioblastoma multiforme cells[J]. Oncogene, 2002, 21(55): 8404-8413. DOI:10.1038/sj.onc.1206047 |
| [7] |
IWAMARU A, SZYMANSKI S, IWADO E, et al. A novel inhibitor of the STAT3 pathway induces apoptosis in malignant glioma cells both in vitro and in vivo[J]. Oncogene, 2007, 26(17): 2435-2444. DOI:10.1038/sj.onc.1210031 |
| [8] |
XU H, ZHANG K, ZONG H, et al. Exosomal communication in glioma-a review[J]. J BUON, 2016, 21(6): 1368-1373. |
| [9] |
QUEZADA C, TORRES Á, NIECHI I, et al. Role of extracellular vesicles in glioma progression[J]. Mol Aspects Med, 2018, 60: 38-51. DOI:10.1016/j.mam.2017.12.003 |
| [10] |
GOURLAY J, MOROKOFF A P, LUWOR R B, et al. The emergent role of exosomes in glioma[J]. J Clin Neurosci, 2017, 35: 13-23. DOI:10.1016/j.jocn.2016.09.021 |
| [11] |
CHENG L, HUANG Z, ZHOU W C, et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth[J]. Cell, 2013, 153(1): 139-152. DOI:10.1016/j.cell.2013.02.021 |
| [12] |
NING X F, ZHANG H R, WANG C, et al. Exosomes released by gastric cancer cells induce transition of pericytes into cancer-associated fibroblasts[J]. Med Sci Monit, 2018, 24: 2350-2359. DOI:10.12659/msm.906641 |
| [13] |
ZHANG G B, ZHANG Y S, CHENG S, et al. CD133 positive U87 glioblastoma cells-derived exosomal microRNAs in hypoxia- versus normoxia-microenviroment[J]. J Neurooncol, 2017, 135(1): 37-46. DOI:10.1007/s11060-017-2566-x |
| [14] |
BAO S D, WU Q L, MCLENDON R E, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J]. Nature, 2006, 444(7120): 756-760. DOI:10.1038/nature05236 |
| [15] |
SHARIF S, GHAHREMANI M H, SOLEIMANI M. Delivery of exogenous miR-124 to glioblastoma multiform cells by wharton's jelly mesenchymal stem cells decreases cell proliferation and migration, and confers chemosensitivity[J]. Stem Cell Rev Rep, 2018, 14(2): 236-246. DOI:10.1007/s12015-017-9788-3 |
| [16] |
SUN X, MA X T, WANG J J, et al. Glioma stem cells-derived exosomes promote the angiogenic ability of endothelial cells through miR-21/VEGF signal[J]. Oncotarget, 2017, 8(22): 36137-36148. DOI:10.18632/oncotarget.16661 |
| [17] |
KONG X J, ZHANG J F, LI J, et al. MiR-130a-3p inhibits migration and invasion by regulating RAB5B in human breast cancer stem cell-like cells[J]. Biochem Biophys Res Commun, 2018, 501(2): 486-493. DOI:10.1016/j.bbrc.2018.05.018 |
| [18] |
SUN Y, LIU X L, ZHANG D, et al. Platelet-derived exosomes affect the proliferation and migration of human umbilical vein endothelial cells via miR-126[J]. Curr Vasc Pharmacol, 2019, 17(4): 379-387. DOI:10.2174/1570161116666180313142139 |
| [19] |
MA T, FU B C, YANG X, et al. Adipose mesenchymal stem cell-derived exosomes promote cell proliferation, migration, and inhibit cell apoptosis via Wnt/β-catenin signaling in cutaneous wound healing[J]. J Cell Biochem, 2019, 120(6): 10847-10854. DOI:10.1002/jcb.28376 |
| [20] |
HUANG W Y, DING X P, YE H B, et al. Hypoxia enhances the migration and invasion of human glioblastoma U87 cells through PI3K/Akt/mTOR/HIF-1α pathway[J]. Neuroreport, 2018, 29(18): 1578-1585. DOI:10.1097/WNR.0000000000001156 |
| [21] |
LI M, LU Y, XU Y C, et al. Horizontal transfer of exosomal CXCR4 promotes murine hepatocarcinoma cell migration, invasion and lymphangiogenesis[J]. Gene, 2018, 676: 101-109. DOI:10.1016/j.gene.2018.07.018 |
| [22] |
CHO H J, PARK J H, NAM J H, et al. Ascochlorin suppresses MMP-2-mediated migration and invasion by targeting FAK and JAK-STAT signaling Cascades[J]. J Cell Biochem, 2018, 119(1): 300-313. DOI:10.1002/jcb.26179 |
| [23] |
JI P G, WANG L, LIU J H, et al. Knockdown of RPL34 inhibits the proliferation and migration of glioma cells through the inactivation of JAK/STAT3 signaling pathway[J]. J Cell Biochem, 2019, 120(3): 3259-3267. DOI:10.1002/jcb.27592 |
| [24] |
CHE S S, SUN T T, WANG J P, et al. MiR-30 overexpression promotes glioma stem cells by regulating Jak/STAT3 signaling pathway[J]. Tumour Biol, 2015, 36(9): 6805-6811. DOI:10.1007/s13277-015-3400-8 |
| [25] |
SONG C J, FAN B, XIAO Z Z. Overexpression of ALK4 inhibits cell proliferation and migration through the inactivation of JAK/STAT3 signaling pathway in glioma[J]. Biomed Pharmacother, 2018, 98: 440-445. DOI:10.1016/j.biopha.2017.12.039 |
| [26] |
MUKTHAVARAM R, OUYANG X, SAKLECHA R, et al. Effect of the JAK2/STAT3 inhibitor SAR317461 on humanglioblastoma tumorspheres[J]. J Transl Med, 2015, 13: 269. DOI:10.1186/s12967-015-0627-5 |



