2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:老年与特勤医学科
2. Department of Gerontology and Secret Service Medicine, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种多因素综合征,多由低氧性呼吸衰竭引起,发病率和死亡率高[1-2]。其特点是气体交换不足和肺力学缺乏,导致低氧血症、呼吸困难和呼吸衰竭。2012年的柏林定义被广泛用于ARDS的诊断[3]。尽管对ARDS的发病机制有了更深入的了解,但是预测ARDS的发展和风险分层的能力仍然有限。ARDS与炎症反应密切相关,肺损伤触发的炎症级联反应涉及炎症细胞的激活和介质的释放。血浆或者BAL液中促炎细胞因子和抗炎细胞因子水平的变化都可能作为ARDS的诊疗标记物。促炎通路主要由肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等触发,同时TNF-α可以通过释放ROS间接促进肺水肿的增加[4]。而血浆或者BAL液中白细胞介素-6(interleukin-6, IL-6)水平早期的增加与ARDS的预后不良密切相关[5]。
目前血清/血浆或体液中炎症因子(如TNF-α、IL-6)水平的分析评估主要是依赖酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)方法。随着大量的应用,ELISA的缺点也逐渐凸显出来:ELISA每次仅能检测一个指标,操作时间长、费用高、假阳性或假阴性结果较多、对操作者的操作要求较高等。因此,亟待需要探索一种新的检测方法能够同时进行多个因子的快速准确检测。本研究采用两种因子同步检测方法同时检测炎症因子TNF-α及IL-6的水平,进而探讨其对ARDS发生及预后的预测价值。
1 资料与方法 1.1 一般资料收集2018年6月至2019年4月本院呼吸与危重症医学科的30例高危患者。高危患者纳入标准:①1周内起病;②因重症肺炎、严重创伤及急性重症胰腺炎起病;③氧合指数(PaO2 /FiO2) > 300 mmHg。30例患者的病因分别为重症肺炎(n=23)、严重创伤(n=3)和急性重症胰腺炎(n=4)。对受试者入院后进行每日持续观察,除了抗感染、维持水电解质平衡、给予营养支持、调节免疫水平等常规治疗,其中17例(11例有创呼吸机辅助通气,6例无创呼吸机辅助通气)接受机械通气治疗,7例接受CRRT治疗,同时评估患者是否进展为ARDS。ARDS患者纳入标准:①符合ARDS的柏林定义;②1周内起病;③因重症肺炎、严重创伤及急性重症胰腺炎起病;④氧合指数≤300 mmHg。排除标准:①妊娠;②肺动脉栓塞;③严重心率失常或急性心肌缺血;④非ARDS引起的严重脏器功能不全;⑤终末期患者(预计生存时间 < 6个月);⑥心肺复苏后;⑦慢性阻塞性肺疾病(终末期);⑧间质性肺疾病。30例患者中有13例患者进展为ARDS(ARDS组),其余17例高危患者直至出院/死亡未进展为ARDS(高危组)。研究方案经本院伦理学委员会审议通过(2017研第014-02),并与患者及家属充分沟通签订知情同意书。
1.2 血液样本采集留取入组患者入院24 h内的血液标本,以及健康体检中心的18名正常人(对照组)的血液标本。以3 000 r/min速度离心15 min,取上清的血浆标本分装在EP管中,将血浆保存在-80 ℃冰箱备测。
1.3 流式细胞术检测血浆炎性因子TNF-α、IL-6水平血浆TNF-α、IL-6的同步检测分析采用LEGENDplexTM Human Inflammation Panel试剂盒(美国Biolegend公司),严格按照说明书进行操作。将25 μL血浆样本稀释1倍后取25 μL加入25 μL Assay buffer,标准品用Assay buffer倍比稀释后加入25 μL Mitrix B。将25 μL混合Beads加入各管后,再加入25 μL检测抗体到各孔,避光下摇床振荡室温孵育2 h。在各管中继续加入25 μL SA-PE,避光孵育30 min,用Wash buffer洗涤2次后将Beads用流式细胞仪检测。具体见图 1。数据用LEGENDplex软件进行分析。
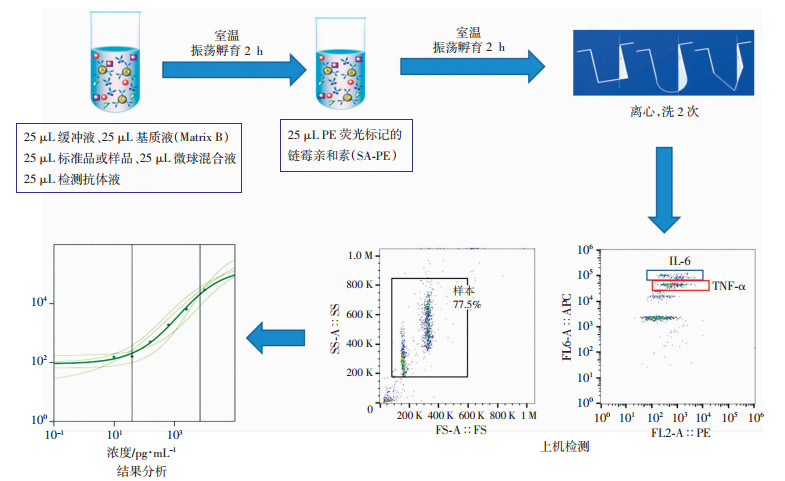
|
| 图 1 两种因子同步检测方法示意图 |
1.4 统计学分析
使用SPSS 22.0统计软件进行分析。计量资料行正态性检验和方差齐性检验,满足正态分布者以 x±s表示,不满足正态分布者以M(P25,P75)表示。同时满足正态性和方差齐性,两组比较采用两独立样本t检验,3组组间比较行单因素方差分析;不满足方差齐性,采用校正t检验;不满足正态性,则采用秩和检验。计数资料以百分比(%)表示,组间比较采用χ2检验。采用logistic逐步回归法分析导致ARDS发生及死亡的危险因素,变量入选标准为P=0.05,剔除标准为P=0.1。P < 0.05为差异有统计学意义。
2 结果 2.1 ARDS组与高危组患者临床资料比较ARDS组患者(n=13)和高危组患者(n=17)在性别、年龄方面差异均无统计学意义(P>0.05)。ARDS组患者死亡9例,高危组患者死亡6例,ARDS组患者的死亡高于高危组,但差异无统计学意义(P=0.065,表 1)。
| 临床资料 | ARDS组(n=13) | 高危组(n=17) | t/z/χ2值 | P值 |
| 性别(男)/例 | 10 | 13 | 0.001 | 0.977 |
| 年龄/岁 | 52.92±13.97 | 57.88±16.99 | 0.854 | 0.401 |
| 死亡人数/例 | 9 | 6 | 3.394 | 0.065 |
| APACHE-Ⅱ评分 | 14.08±4.91 | 9.71±4.93 | 2.410 | 0.023 |
| Glasgow评分 | 15(8.5, 15) | 15(12, 15) | 0.849 | 0.483 |
| 白细胞计数/109·L-1 | 13.17±7.59 | 10.76±5.37 | 1.019 | 0.317 |
| C反应蛋白/mg·L-1 | 166.0(41.2, 196.9) | 30.0(8.8, 50.0) | 2.696 | 0.006 |
| 降钙素原/ng·mL-1 | 1.76(0.27, 23.76) | 0.24(0.04, 0.72) | 2.075 | 0.037 |
| 血沉/mm·h-1 | 23.0(20.1, 35.5) | 24.0(12.8, 56.8) | 0.218 | 0.830 |
| 尿素/mmol·L-1 | 9.06(6.06, 14.16) | 8.03(4.30, 18.40) | 0.774 | 0.457 |
| 肌酐/μmol·L-1 | 73.0(67.3, 141.1) | 68.8(60.3, 125.5) | 0.816 | 0.432 |
| 尿酸/mmol·L-1 | 262.30(168.85, 372.70) | 255.30(194.25, 322.55) | 0.188 | 0.869 |
| 总蛋白/g·L-1 | 56.01±8.25 | 61.77±7.15 | 2.047 | 0.050 |
| 白蛋白/g·L-1 | 31.71±4.64 | 36.19±5.20 | 2.452 | 0.021 |
| 总胆红素/μmol·L-1 | 19.25±7.32 | 14.49±7.46 | 1.743 | 0.092 |
| 直接胆红素/μmol·L-1 | 7.81±4.45 | 3.16±1.64 | 3.986 | 0.003 |
| 氧合指数/mmHg | 159.08±77.82 | 389.47±41.48 | 8.857 | < 0.001 |
| 血糖/mmol·L-1 | 10.20±4.61 | 7.33±2.72 | 1.951 | 0.066 |
| 乳酸/mmol·L-1 | 1.79±0.67 | 1.20±0.79 | 2.070 | 0.049 |
ARDS组和高危组患者APACHE-Ⅱ评分、C反应蛋白、降钙素原、白蛋白、直接胆红素、氧合指数、血浆乳酸含量差异有统计学意义(P < 0.05,表 1)。此外,两组患者的Glasgow评分、白细胞计数、血沉、尿素、肌酐、尿酸、血浆总蛋白、总胆红素、血糖差异无统计学意义(P>0.05,表 1)。
2.2 各组患者血浆TNF-α水平的比较ARDS组患者血浆TNF-α水平[(69.29±13.31)pg/mL]明显高于高危组[(57.82±8.01)pg/mL, P=0.012]及对照组[(49.60±13.60)pg/mL, P < 0.001],高危组患者血浆TNF-α水平明显高于对照组(P=0.046)。
2.3 各组患者血浆IL-6水平的比较ARDS组患者血浆IL-6水平[(82.72, 905.55) pg/mL]明显高于高危组[66.4(44.69, 187.51)pg/mL, P=0.015]及对照组[9.58(7.70, 13.51)pg/mL, P < 0.001],高危组患者血浆IL-6水平明显高于对照组(P < 0.001)。
2.4 血浆TNF-α水平与高危组进展成为ARDS有关通过单变量分析筛选出TNF-α、IL-6、氧合指数、APACHE-Ⅱ评分、C反应蛋白、血浆白蛋白、直接胆红素是可能导致ARDS发生的危险因素(P < 0.05,表 2)。将上述变量进行二元logistic回归分析显示,血浆TNF-α水平升高明显增加高危组进展成为ARDS的风险,而氧合指数增高明显降低高危组进展成为ARDS的风险(表 2),提示血浆TNF-α水平是高危组患者进展成为ARDS的高危因素,与ARDS的发生具有密切关联,可作预测ARDS发生的潜在指标。
| 变量 | 单因素Logistics回归 | 多因素Logistics回归 | |||
| OR(95%CI) | P值 | OR(95%CI) | P值 | ||
| TNF-α | 1.117(1.015~1.231) | 0.004 | 1.373(1.275~1.497) | 0.018 | |
| IL-6 | 1.006(0.999~1.012) | 0.022 | 1.002(0.993~1.012) | 0.601 | |
| 氧合指数 | 0.970(0.949~0.991) | 0.006 | 0.973(0.950~0.997) | 0.028 | |
| APACHE-Ⅱ | 1.214(1.011~1.458) | 0.038 | 1.080(0.779~1.497) | 0.644 | |
| C反应蛋白 | 1.018(1.004~1.033) | 0.012 | 1.011(0.992~1.032) | 0.252 | |
| 白蛋白 | 0.829(0.697~0.986) | 0.034 | 0.681(0.452~1.026) | 0.066 | |
| 直接胆红素 | 1.739(1.116~2.709) | 0.014 | 1.257(0.657~2.408) | 0.490 | |
| 降钙素原 | 1.017(0.985~1.050) | 0.310 | |||
| 乳酸 | 3.626(0.884~14.880) | 0.074 | |||
2.5 死亡患者与存活患者临床资料比较
30例患者中死亡与存活均为15例,两组患者性别、年龄无显著差异。死亡组患者和存活组患者的APACHE-Ⅱ评分、C反应蛋白、尿素、尿酸、血浆总蛋白、血浆白蛋白、氧合指数差异有统计学意义(P < 0.05)。此外,两组患者的Glasgow评分、白细胞计数、降钙素原、血沉、肌酐、总胆红素、直接胆红素、血糖、乳酸差异无统计学意义(P>0.05,表 3)。
| 临床资料 | 死亡组(n=15) | 存活组(n=15) | t/z/χ2值 | P值 |
| 性别(男)/例 | 11 | 12 | 0.186 | 0.666 |
| 年龄/岁 | 59.40±14.12 | 52.07±16.80 | 1.294 | 0.206 |
| APACHE-Ⅱ评分 | 14.87±3.93 | 8.33±4.50 | 4.238 | < 0.001 |
| Glasgow评分 | 15(6, 15) | 15(15, 15) | 1.297 | 0.267 |
| 白细胞计数/109·L-1 | 13.06±6.81 | 10.56±5.80 | 1.069 | 0.294 |
| C反应蛋白/mg·L-1 | 76.6(34.4, 196.0) | 22.1(10.7, 50.1) | 2.328 | 0.019 |
| 降钙素原/ng·mL-1 | 0.75(0.24, 8.20) | 0.21(0.08, 0.75) | 1.498 | 0.142 |
| 血沉/mm·h-1 | 34.9(20.0, 74.0) | 21.0(15.0, 29.0) | 1.171 | 0.256 |
| 尿素/mmol·L-1 | 10.89(6.95, 18.33) | 5.72(3.95, 9.06) | 2.261 | 0.023 |
| 肌酐/μmol·L-1 | 84.9(61.8, 171.3) | 68.8(61.5, 73.0) | 1.141 | 0.267 |
| 尿酸/mmol·L-1 | 335.37±154.47 | 239.43±71.88 | 2.181 | 0.038 |
| 总蛋白/g·L-1 | 54.88±8.08 | 63.67±5.26 | 3.530 | 0.001 |
| 白蛋白/g·L-1 | 31.14±4.86 | 37.36±3.95 | 3.848 | 0.001 |
| 总胆红素/μmol·L-1 | 17.27±8.11 | 15.83±7.38 | 0.508 | 0.615 |
| 直接胆红素/μmol·L-1 | 5.97±3.98 | 4.38±3.77 | 1.121 | 0.272 |
| 氧合指数/mmHg | 222.88±115.81 | 339.79±87.02 | 2.980 | 0.006 |
| 血糖/mmol·L-1 | 9.41±3.55 | 8.08±4.53 | 0.840 | 0.409 |
| 乳酸/mmol·L-1 | 1.3(0.9, 1.8) | 1.2(0.9,1.9) | 0.156 | 0.878 |
2.6 死亡组患者与存活组患者血浆TNF-α及IL-6水平
死亡组患者血浆TNF-α水平为(60.51±9.69)pg/mL,存活组患者血浆TNF-α水平为(65.07±13.76)pg/mL,死亡组患者的血浆TNF-α水平较存活组高,但差异不明显(P=0.303)。死亡组患者血浆IL-6水平为144.76(63.13, 369.08)pg/mL,存活组患者血浆IL-6水平为67.58(48.76, 200.45)pg/mL,死亡组患者的血浆IL-6水平较存活组高,差异亦不明显(P=0.412)。此外,二元logistic回归分析显示入院时血浆TNF-α、IL-6的水平与患者的预后没有明显的关联性(P=0.298,P=0.986)。
3 讨论对30例高危患者进行前瞻性研究,其中有13例患者进展为ARDS,其发生率为43.33%。本研究应用两种因子同步检测方法同时评估血浆TNF-α及IL-6的水平,发现高危受试者进展到ARDS(ARDS组)中入院时血浆TNF-α及IL-6的水平显著高于未进展为ARDS的高危受试者(高危组)。进一步分析发现入院时血浆TNF-α水平与高危患者进展成为ARDS有密切关联。同时通过对死亡和存活的受试者进行分析,发现两组血浆TNF-α及IL-6的水平无显著差异,也与受试者是否死亡无密切关联。
ARDS是内、外、妇、儿等多学科的临床常见危重症,常由感染、严重创伤、误吸、大量输血、重症胰腺炎等病因引起[6]。目前认为ARDS是由于炎症失控引起的肺泡上皮、毛细血管以及肺实质的损害,发生肺水肿、肺泡内透明膜形成和肺不张,最终导致肺的氧合功能障碍和顽固性低氧血症。因此,炎症水平可能是评估ARDS发生、发展的重要指标[7-8]。我们采用流式细胞仪对血浆中的可溶性蛋白(TNF-α和IL-6)进行定量检测分析。与传统的ELISA方法相比灵敏度更高,更加节省样本,最低只需要使用12.5 μL样本即可完成检测;而且更加高效,最多可以实现多个炎症因子的同步检测分析,大幅缩短分析时间,同时也可以根据自身需求,有目的的选择两个至多个炎症因子进行同步检测,目的性更加明确,更加节约成本,有效减少了大批量操作导致的人工误差,提高检测效率。因此, 使用该技术可能更全面、快速地评估患者炎症状态,为患者合理、及时救治提供依据。
在目前ARDS救治率无明显改善的情况下,普遍认为阻止患者从高危状态进展到ARDS状态以及早期诊断ARDS是成功救治患者的关键[9-11],而ARDS的预防性治疗以及早期治疗大多是基于对高危患者进展的预测及ARDS的早期诊断。本研究发现,进展成为ARDS的高危患者第1天的血浆TNF-α及IL-6水平显著高于未进展患者,提示炎症失控可能是发生ARDS的重要因素之一[12-13]。同时,入院时TNF-α水平与高危患者进展到ARDS有密切联系,提示入院时TNF-α水平可能预测高危组是否进展成为ARDS。同样地,AISIKU等[14]研究指出血浆炎症因子IL-6、IL-8和IL-10是严重脑损伤(ARDS高危因素之一)发展成为ARDS的分子标志物。此外,VILLAR等[15]进行了的多中心数据分析研究发现患者的年龄、PaO2/FiO2、肺外组织衰竭情况是预测高危患者进展到ARDS的重要临床数据。本研究同样也发现一些临床指标,如APACHE-Ⅱ评分、直接胆红素、血浆乳酸含量及氧合指数等,在进展成为ARDS的高危患者与未进展成为ARDS的高危组患者有明显差异,提示这些临床数据也可能作为预测是否发生ARDS的重要指标[16-17]。
本研究对死亡组和存活组的患者进行了分析,发现两组患者入组第1天的血浆TNF-α及IL-6水平无明显差异,提示初始的炎症因子水平无法判断患者的进展及预后。这可能是由于患者的病情及治疗过程的有较大的个体化差异。死亡组患者APACHE-Ⅱ评分、C反应蛋白、尿素、尿酸均高于存活组,而血浆总蛋白、白蛋白、氧合指数水平均低于存活组,提示器官损伤及营养状况可能更影响患者的预后。PANITCHOTE等[18]的研究同样也发现急性肾损伤进展到ARDS患者的预后与临床症状密切相关。这可能是由于在进展成为ARDS的过程中,机体的免疫反应由过度免疫反应转变为免疫抑制,炎症因子水平在升高到一定程度后不再增加,甚至降解,但对器官进行持续的损伤,最终导致不可逆的呼吸系统等器官衰竭[15, 19]。
本研究也有一定的不足:①研究的病例数相对较少,可能会导致结果的数据偏倚,今后还需要通过多中心、大样本的队列研究来证实;②检测的炎症因子不够全面,后期仍需加大样本量及其他炎症因子的检测。同时由于样本量较小,本研究未按ARDS患者的病因进行进一步分组,后期可以加大样本量,进一步细化分组研究。
综上所述,基于两种因子同步检测方法可同时检测受试者血浆中TNF-α及IL-6的水平,并且血浆中TNF-α水平升高与高危患者进行成为ARDS有密切关联,可作为预测高危患者进展成为ARDS的标志物。
| [1] |
BELLANI G, LAFFEY J G, PHAM T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [2] |
VILLAR J, KACMAREK R M, GUÉRIN C. Clinical trials in patients with the acute respiratory distress syndrome: burn after reading[J]. Intensive Care Med, 2014, 40(6): 900-902. DOI:10.1007/s00134-014-3288-6 |
| [3] |
ARDS DEFINITION TASK FORCE, RANIERI V M, RUBENFELD G D, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [4] |
ROTEN R, MARKERT M, FEIHL F, et al. Plasma levels of tumor necrosis factor in the adult respiratory distress syndrome[J]. Am Rev Respir Dis, 1991, 143(3): 590-592. DOI:10.1164/ajrccm/143.3.590 |
| [5] |
PARSONS P E, EISNER M D, THOMPSON B T, et al. Lower tidal volume ventilation and plasma cytokine markers of inflammation in patients with acute lung injury[J]. Crit Care Med, 2005, 33(1): 1-6; discussion 230-232. DOI:10.1097/01.ccm.0000149854.61192.dc.
|
| [6] |
CALFEE C S, JANZ D R, BERNARD G R, et al. Distinct molecular phenotypes of direct vs indirect ARDS in single-center and multicenter studies[J]. Chest, 2015, 147(6): 1539-1548. DOI:10.1378/chest.14-2454 |
| [7] |
DOLINAY T, KIM Y S, HOWRYLAK J, et al. Inflammasome-regulated cytokines are critical mediators of acute lung injury[J]. Am J Respir Crit Care Med, 2012, 185(11): 1225-1234. DOI:10.1164/rccm.201201-0003OC |
| [8] |
DING Q, LIU G Q, ZENG Y Y, et al. Role of IL-17 in LPS-induced acute lung injury: an in vivo study[J]. Oncotarget, 2017, 8(55): 93704-93711. DOI:10.18632/oncotarget.21474 |
| [9] |
LYNN H, SUN X G, CASANOVA N, et al. Genomic and genetic approaches to deciphering acute respiratory distress syndrome risk and mortality[J]. Antioxid Redox Signal, 2019, 31(14): 1027-1052. DOI:10.1089/ars.2018.7701 |
| [10] |
GONG M N, THOMPSON B T. Acute respiratory distress syndrome: shifting the emphasis from treatment to prevention[J]. Curr Opin Crit Care, 2016, 22(1): 21-37. DOI:10.1097/MCC.0000000000000275 |
| [11] |
NIEMAN G F, GATTO L A, BATES J H T, et al. Mechanical ventilation as a therapeutic tool to reduce ARDS incidence[J]. Chest, 2015, 148(6): 1396-1404. DOI:10.1378/chest.15-0990 |
| [12] |
BARADARAN RAHIMI V, RAKHSHANDEH H, RAUCCI F, et al. Anti-inflammatory and anti-oxidant activity of Portulaca oleracea extract on LPS-induced rat lung injury[J]. Molecules, 2019, 24(1): E139. DOI:10.3390/molecules24010139 |
| [13] |
BHARGAVA R, JANSSEN W, ALTMANN C, et al. Intratracheal IL-6 protects against lung inflammation in direct, but not indirect, causes of acute lung injury in mice[J]. PLoS ONE, 2013, 8(5): e61405. DOI:10.1371/journal.pone.0061405 |
| [14] |
AISIKU I P, YAMAL J M, DOSHI P, et al. Plasma cytokines IL-6, IL-8, and IL-10 are associated with the development of acute respiratory distress syndrome in patients with severe traumatic brain injury[J]. Crit Care, 2016, 20: 288. DOI:10.1186/s13054-016-1470-7 |
| [15] |
VILLAR J, AMBRÓS A, MOSTEIRO F, et al. A prognostic enrichment strategy for selection of patients with acute respiratory distress syndrome in clinical trials[J]. Crit Care Med, 2019, 47(3): 377-385. DOI:10.1097/CCM.0000000000003624 |
| [16] |
XU Z, WU G M, LI Q, et al. Predictive value of combined Lips and ANG-2 level in critically ill patients with ARDS risk factors[J]. Mediators Inflamm, 2018, 2018: 1739615. DOI:10.1155/2018/1739615 |
| [17] |
王冉, 张巧, 杨旭, 等. 急性呼吸窘迫综合征进展及预后的危险因素研究[J]. 解放军医学杂志, 2017, 42(5): 456-462. WANG R, ZHANG Q, YANG X, et al. Research of the risk factors predicting progression and prognosis of acute respiratory distress syndrome[J]. Med J Chin PLA, 2017, 42(5): 456-462. DOI:10.11855/j.issn.0577-7402.2017.05.17 |
| [18] |
PANITCHOTE A, MEHKRI O, HASTINGS A, et al. Clinical predictors of renal non-recovery in acute respiratory distress syndrome[J]. BMC Nephrol, 2019, 20(1): 255. DOI:10.1186/s12882-019-1439-2 |
| [19] |
VILLAR J, MARTÍNEZ D, MOSTEIRO F, et al. Is overall mortality the right composite endpoint in clinical trials of acute respiratory distress syndrome?[J]. Crit Care Med, 2018, 46(6): 892-899. DOI:10.1097/CCM.0000000000003022 |



