缺氧是常见的病理过程,通常由氧供不足或组织细胞氧利用障碍引发。巨噬细胞是一种重要的固有免疫细胞,广泛存在于机体不同的器官组织中,执行多种不同的功能,包括对抗入侵的病原体和肿瘤细胞、协调伤口愈合、参与获得性免疫应答中抗原提呈等[1]。巨噬细胞对缺氧十分敏感,被激活的巨噬细胞可通过表达和分泌某些炎症细胞因子和趋化因子,活化和招募其他炎症细胞,进而参与缺氧区域的组织损伤和重塑[2]。缺氧诱导的巨噬细胞炎症反应在多种临床疾病如缺氧性肺动脉高压、代谢综合征等的发生发展中发挥了重要作用[3-6]。因此,探讨缺氧诱导的巨噬细胞炎症反应及其调控机制,对缺氧相关疾病的防治具有重要意义。
双特异性磷酸酶1(dual specificity phosphatase-1, DUSP1),也被称作丝裂素活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase-1, MKP-1),是一种既能去磷酸化酪氨酸,又能去磷酸化苏氨酸的磷酸酶[7]。DUSP1主要催化细胞内已激活的MAPK家族成员(P38、JNK与ERK)中特异性基序TXY磷酸基团的水解,从而抑制它们的活性,进而阻断其下游相关生物学反应[8]。研究显示,DUSP1在TLR配体刺激引起的巨噬细胞炎症免疫反应中发挥着重要的负调控作用[9]。DUSP1是否参与调控缺氧诱导的巨噬细胞炎症反应尚不清楚。我们推测缺氧可能通过上调巨噬细胞中DUSP1的表达,从而防止巨噬细胞过度炎症免疫反应。因此,本研究拟通过观察缺氧处理不同时间RAW264.7巨噬细胞中DUSP1和炎症相关细胞因子IL-1β, IL-10和TNF-α的表达情况,以及下调DUSP1表达对缺氧RAW264.7巨噬细胞中IL-1β, IL-10和TNF-α表达的影响,初步探讨DUSP1在缺氧诱导的巨噬细胞炎症免疫反应中的调控作用,为缺氧诱导的巨噬细胞炎症免疫反应的调控寻找潜在的干预靶点。
1 材料和方法 1.1 主要实验材料与试剂小鼠RAW264.7巨噬细胞由陆军军医大学(第三军医大学)生物化学与分子生物学教研室何凤田教授课题组惠赠。高糖DMEM培养基、Opti-MEM培养基均购自Gibco公司。胎牛血清(FBS)购自Hyclone公司。PBS、TBS、封闭蛋白干粉、IL-1β ELISA试剂盒、IL-10 ELISA试剂盒和TNF-α ELISA试剂盒均购自博士德公司。细胞组织快速裂解液(RIPA裂解液)、PMSF、BCA蛋白浓度测定试剂盒、彩色预染蛋白分子量标准、辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠IgG和Western一抗二抗去除液(强碱性)等均购自碧云天公司。总RNA提取试剂盒购自Omega公司。反转录试剂盒、SYBR Green购自TaKaRa公司。Lipofectamine RNAiMAX购自Invitrogen公司。PCR引物由Invitrogen公司设计合成(表 1)。抗DUSP1抗体(sc-373841)购自Santa公司。抗β-actin抗体(a2228)购自Sigma公司。ECL Plus显色液购自葆光生物。针对Dusp1基因的干扰序列及阴性对照为双链RNA,由广州锐博公司设计合成(表 2)。
| 基因 | 引物序列(5′→3′) |
| β-actin | 正义:GGCTGTATTCCCCTCCATCG |
| 反义:CCAGTTGGTAACAATGCCATGT | |
| Dusp1 | 正义:GTTGTTGGATTGTCGCTCCTT |
| 反义:TTGGGCACGATATGCTCCAG | |
| Il1b | 正义:GCAACTGTTCCTGAACTCAACT |
| 反义:ATCTTTTGGGGTCCGTCAACT | |
| Tnfa | 正义:CCCTCACACTCAGATCATCTTCT |
| 反义:GCTACGACGTGGGCTACAG | |
| Il10 | 正义:CTTACTGACTGGCATGAGGATCA |
| 反义:GCAGCTCTAGGAGCATGTGG |
| 编号 | 靶序列 |
| si-Dusp1-001 | GCTCCACTCAAGTCTTCTT |
| si-Dusp1-002 | GCTTACCTCATGAGGACTA |
| si-Dusp1-003 | GCATCACCGCCTTGATCAA |
1.2 方法 1.2.1 细胞培养与实验处理
RAW264.7细胞在含10%FBS、1%青-链霉素溶液的DMEM高糖培养基中常规培养。每2~3天换液,细胞融合至80%左右,进行传代。在观察缺氧对DUSP1和炎症相关细胞因子表达的影响时将RAW264.7细胞分别在缺氧(1%O2)条件下培养不同时间(12、24、36 h),常氧(缺氧0 h)组在常氧(21%O2)条件下培养。研究干扰Dusp1表达对缺氧RAW264.7细胞炎症相关细胞因子表达的影响时分为两组:干扰序列阴性对照组(NC),干扰序列组(si-Dusp1)。细胞转染采用脂质体法。转染前1 d,接种细胞至6孔板,使转染时的细胞密度为30%~50%。按照试剂说明书进行转染。转染后24 h进行细胞换液,然后将细胞置于低氧工作站中缺氧(1%O2)培养24 h,随后收集标本。
1.2.2 qRT-PCR按照总RNA提取试剂盒说明书提取细胞总RNA。取2 μg总RNA,使用TaKaRa公司反转录试剂盒反转录为cDNA。获得的cDNA用DEPC水稀释4倍。扩增反应体系终体积为10 μL,包含SYBR Green 5 μL,上、下游引物各0.5 μL, cDNA 2.5 μL和DEPC水1.5 μL,每个样本设3个平行复孔。qRT-PCR反应条件如下:95℃,30 s预变性;95℃,5s;60℃,30s;循环40次。以β-actin为内参,根据2-ΔΔCt计算各基因的相对表达量。
1.2.3 Western blot检测用已加入PMSF的RIPA裂解液裂解细胞,提取各组细胞的总蛋白。采用BCA法测定蛋白浓度。行SDS-聚丙烯酰胺凝胶电泳(5%浓缩胶,60 V;10%分离胶,100 V)。PVDF转膜100 V、1 h。5%封闭蛋白溶液室温封闭1 h。TBST漂洗10 min×2次后剪膜,放入抗DUSP1抗体(1:1 000)溶液中,4 ℃摇床孵育过夜。TBST漂洗10 min × 4次,将膜转移至辣根酶标山羊抗小鼠抗体(1:2 000)溶液中,室温孵育1 h。TBST漂洗10 min ×3次。最后以化学发光法显色,用Bio-Rad凝胶成像仪显像。由于DUSP1与β-actin的相对分子质量接近,因此在DUSP1条带显影完成后,使用一抗二抗去除液洗涤膜,然后进行封闭等Western blot的后续操作,抗β-actin抗体的稀释比例为1:2 000,余操作同前。使用Image J软件对条带进行灰度值分析,以DUSP1与β-actin灰度值比值作为DUSP1的相对表达量。
1.2.4 ELISA按照试剂盒说明书稀释标准品,然后将稀释好的标准品及待测样品按100 μL/孔加入孔中,1孔只加样品稀释液作为零孔。盖上封板膜,37 ℃反应90 min,甩去孔中的液体,不洗。然后按100 μL/孔加入准备好的生物素标记抗体工作液,盖上封板膜,37 ℃反应60 min。弃去孔中的液体,1×洗涤缓冲液洗涤3次,每次浸泡1 min左右。然后按100 μL/孔加入准备好的已在37 ℃预热30 min的ABC工作液,盖上封板膜,37 ℃反应30 min。弃去孔中的液体,1×洗涤缓冲液洗涤5次,每次浸泡1 min左右。然后按90 μL/孔加入已在37 ℃预热30 min的TMB显色液,盖上封板膜,37 ℃避光反应20~25 min。待标准品孔出现梯度蓝色后,按100 μL/孔加入TMB终止液,然后用酶标仪在450 nm测定D值。以细胞的总蛋白浓度对检测值进行校正。
1.3 统计学方法采用SPSS 20统计软件。计量资料采用
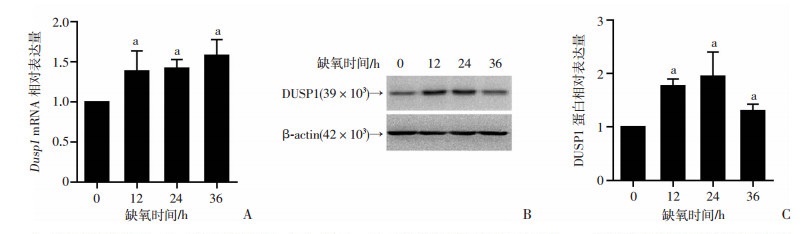
采用qRT-PCR和Western blot检测缺氧(1%O2)培养对RAW264.7细胞中DUSP1 mRNA和蛋白表达的影响。结果显示,与常氧组相比,缺氧暴露12、24和36 h RAW264.7细胞中DUSP1的mRNA表达水平和蛋白表达水平均显著升高(P < 0.05,图 1)。
|
|
A:qRT-PCR检测Dusp1 mRNA表达水平; B、C: Western blot检测DUSP1蛋白表达水平; a: P < 0.05,与常氧组(缺氧0 h)比较
图 1
缺氧上调RAW264.7细胞中DUSP1的表达(n=3, |
2.2 缺氧对RAW264.7细胞中Il1b、Il10和Tnfa mRNA表达的影响
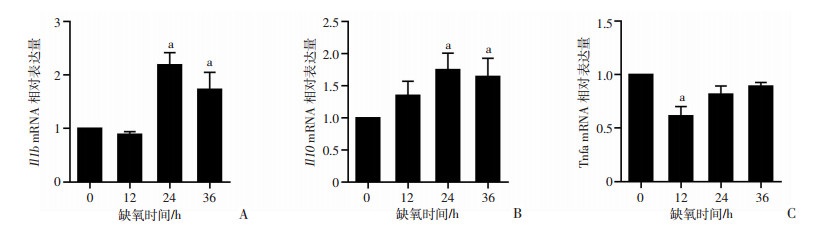
采用qRT-PCR检测缺氧(1%O2)培养对RAW264.7细胞中炎症相关细胞因子Il1b、Il10和Tnfa mRNA表达的影响。与常氧组相比,缺氧暴露12 h Il1b、Il10 mRNA表达无明显变化(P>0.05,图 2),缺氧暴露24和36 h Il1b、Il10 mRNA表达均较常氧组显著升高(P < 0.05,图 2)。与常氧组相比,缺氧暴露12 h Tnfa mRNA表达明显降低(P < 0.05,图 2),缺氧24和36 h Tnfa mRNA表达无明显变化(P>0.05,图 2)。
|
|
A: Il1b; B: Il10; C: Tnfa mRNA;a:P < 0.05,与常氧组(缺氧0 h)比较
图 2
缺氧对RAW264.7细胞中Il1b、Il10和Tnfa mRNA表达的影响(n=3, |
2.3 缺氧对RAW264.7细胞IL-1β、IL-10和TNF-α分泌水平的影响
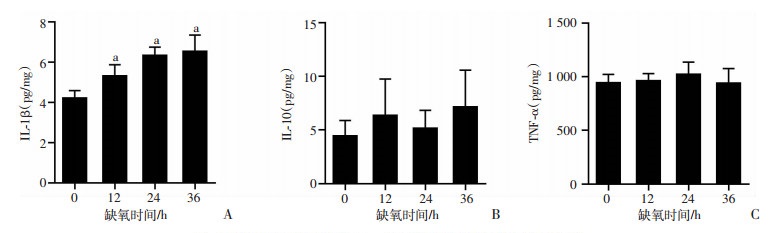
采用ELISA检测缺氧(1%O2)RAW264.7细胞培养上清中IL-1β、IL-10和TNF-α的分泌水平。与常氧组相比,缺氧处理12、24和36 h RAW264.7细胞IL-1β分泌水平明显增加(P < 0.05,图 3)。与常氧组相比,缺氧暴露12、24和36 h RAW264.7细胞IL-10和TNF-α的分泌水平无明显变化(P>0.05,图 3)。
|
|
A: IL-1β;B:IL-10;C:TNF-α;a:P < 0.05,与常氧组(缺氧0 h)比较
图 3
缺氧对RAW264.7细胞IL-1β、IL-10和TNF-α分泌水平的影响(n=3, |
2.4 DUSP1对缺氧RAW264.7细胞中Il1b、Il10和Tnfa mRNA表达的影响
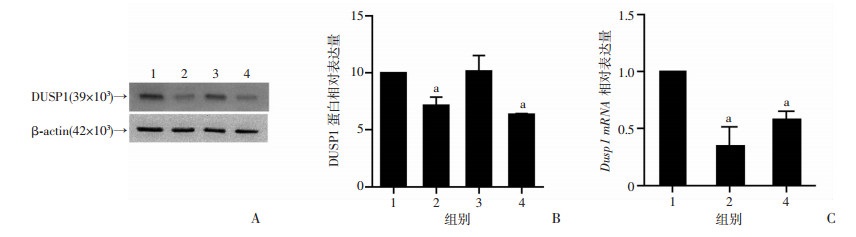
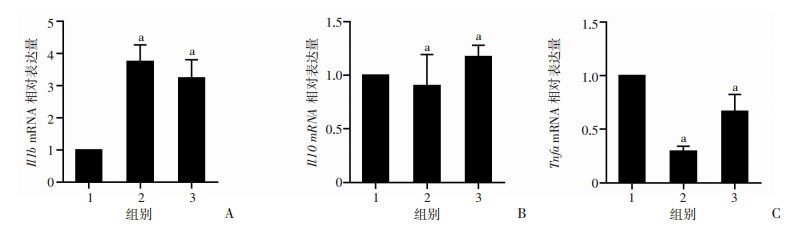
转染编号为si-Dusp1-001和si-Dusp1-003的干扰序列能够显著降低缺氧RAW264.7细胞中DUSP1的mRNA和蛋白表达(P < 0.05,图 4)。干扰Dusp1表达后,与干扰序列对照组相比,缺氧暴露24 h后RAW264.7细胞中Il1b mRNA表达水平明显升高(P < 0.05,图 5),Il10 mRNA表达水平无明显改变(P>0.05,图 5),而Tnfa mRNA表达水平明显降低(P < 0.05,图 5)。
|
|
1: NC;2: si-Dusp1-001; 3: si-Dusp1-002; 4: si-Dusp1-003; A、B:Western blot检测转染si-Dusp1后缺氧RAW264.7细胞DUSP1蛋白的表达水平;C: qRT-PCR检测转染si-Dusp1后缺氧RAW264.7细胞Dusp1 mRNA的表达水平;a:P < 0.05,与NC组比较
图 4
转染si-Dusp1下调缺氧RAW264.7细胞中DUSP1的表达(n=3, |
|
|
1: NC;2: si-Dusp1-001; 3: si-Dusp1-003; A: Il1b; B: Il10; C: Tnfa mRNA;a:P < 0.05,与NC组比较
图 5
转染si-Dusp1对缺氧RAW264.7细胞中Il1b、Il10和Tnfa mRNA表达的影响(n=3, |
2.5 DUSP1对缺氧RAW264.7细胞IL-1β、IL-10和TNF-α分泌水平的影响
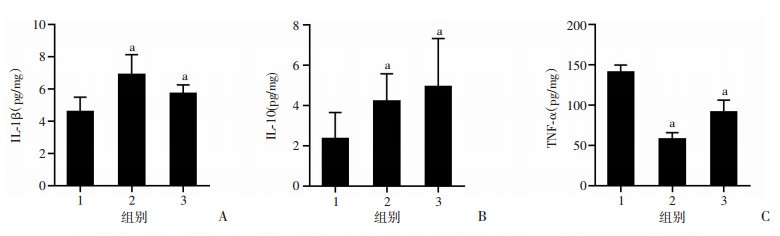
采用ELISA检测转染si-Dusp1后缺氧RAW264.7细胞培养上清中IL-1β、IL-10和TNF-α的分泌水平。干扰Dusp1表达后,缺氧暴露24 h后RAW264.7细胞IL-1β和IL-10的分泌水平较干扰序列对照组明显增高(P < 0.05,图 6),而TNF-α的分泌水平较干扰序列对照组明显降低(P < 0.05,图 6)。
|
|
1: NC;2: si-Dusp1-001; 3: si-Dusp1-003; A: IL-1β; B: IL-10; C: TNF-α;a:P < 0.05,与NC组比较
图 6
转染si-Dusp1对缺氧RAW264.7细胞IL-1β、IL-10和TNF-α分泌水平的影响(n=3, |
3 讨论
探讨缺氧诱导的巨噬细胞炎症反应及其调控机制,对缺氧相关疾病的防治具有重要意义。本研究中,我们采用qRT-PCR和ELISA检测了缺氧(1%O2)对RAW264.7巨噬细胞中炎症相关细胞因子IL-1β、IL-10和TNF-α表达和分泌的影响。缺氧能够诱导RAW264.7细胞中Il1b的mRNA表达显著上调,并且引起IL-1β分泌水平显著增加[10-11]。白瑜珊等[12]报道低氧可引起RAW264.7细胞中Il1b的mRNA表达上调,并且放大LPS诱导的IL-1β mRNA和蛋白表达。本研究结果与既往文献报道基本一致。LAHAT等[13]报道在缺氧处理24 h的RAW264.7细胞中,尽管Tnfa的mRNA表达水平有上升趋势,但差异并无统计学意义。本研究结果也显示,缺氧对RAW264.7巨噬细胞中TNF-α的mRNA表达及分泌水平的影响不明显,仅在缺氧暴露12 h时观察到Tnfa mRNA表达下调。目前关于缺氧对巨噬细胞中IL-10表达和分泌影响的研究报道较少。WANG等[14]报道缺氧可引起人外周血单个核细胞中IL10 mRNA表达水平降低,此外,缺氧还可抑制LPS诱导的IL10 mRNA表达。在本实验中,我们发现,在缺氧处理后的RAW264.7巨噬细胞中,Il10的mRNA表达上调,IL-10的分泌水平呈现增高趋势。KOSCS等[15]报道在TLR配体刺激活化的小鼠小胶质细胞中,外源性腺苷可通过激活A2B腺苷受体(A2B adenosine receptors,A2BAR)促进Il10的mRNA表达增加,Il10基因启动子中的CREB结合区域介导了腺苷对Il10转录的增强作用。缺氧引起的微环境中腺苷增加可能是缺氧诱导RAW264.7巨噬细胞中Il10 mRNA表达增加的原因之一。缺氧暴露后RAW264.7巨噬细胞中促炎细胞因子Il1b mRNA表达增加,与此同时抑炎细胞因子Il10 mRNA表达也增加,这可能反映了缺氧应激情况下巨噬细胞炎症免疫反应的一种自身调控过程。
DUSP家族是拓展的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)家族中的一员,因其既能够去磷酸化酪氨酸残基,又能够去磷酸化丝/苏氨酸残基而得名[16]。DUSP1是DUSP家族中最早被鉴定也是其中最重要的成员。研究显示,多种外界刺激因子如紫外线、病原体蛋白等可以引起DUSP1表达上调[17]。本研究室前期对平原人急进5 300 m高原前后全血转录组学的研究结果显示,进入高原后DUSP1基因的转录水平较进入高原前升高[18]。在本研究中,我们观察到缺氧暴露12、24和36 h均能显著上调RAW264.7细胞中DUSP1 mRNA和蛋白表达。目前关于缺氧引起DUSP1表达增加的机制仍不完全清楚。KUCˇERA等[19]报道缺氧以不依赖HIF的方式上调胚胎干细胞中DUSP1的表达。SETA等[20]报道使用p38 MAPK通路抑制剂SB203580预处理抑制p38激酶活性,可显著降低缺氧诱导的Dusp1 mRNA表达,提示低氧诱导的Dusp1表达上调至少部分通过p38激酶介导。MISHRA等[21]报道低氧暴露60 min后小鼠脑组织中DUSP1的蛋白表达水平增高,但是其活性降低,缺氧引起的DUSP1表达升高和活性降低可能是由NO介导。
近来的研究发现,DUSP1在炎症及免疫应答中发挥重要的调节作用。在TLR配体刺激引起的巨噬细胞炎症免疫反应中发挥重要的负调控作用,在适应性免疫反应中,DUSP1参与调节T细胞分化、发育和活化等细胞生命过程,并与多种自身免疫性疾病的发生发展有关[9]。本研究中,我们采用RNA干扰技术对DUSP1在缺氧诱导的巨噬细胞炎症反应中的作用进行了初步探讨。我们发现干扰Dusp1表达后发现,相较于NC组,缺氧RAW264.7细胞中IL-1β的mRNA表达和分泌水平明显增加,TNF-α的mRNA表达和分泌水平明显降低,尽管Il10的mRNA表达无明显改变,但IL-10的分泌水平明显增加。既往研究提示DUSP1主要通过调节P38 MAPK通路调控LPS诱导的巨噬细胞炎症反应。TALWAR等[22]报道在LPS刺激的Dusp1-/-小鼠骨髓来源的巨噬细胞中,活性氧(reactive oxygen species, ROS)的产生和HIF-1α表达增高,DUSP1通过调节p38 MAPK的活性调节ROS产生和HIF-1α表达,进而介导LPS刺激引起的IL-1β的转录和蛋白表达增加。SMALLIE等[23]报道LPS刺激的Dusp1-/-小鼠骨髓来源的巨噬细胞TNF-α和IL-10的mRNA和蛋白表达水平升高,DUSP1-p38 MAPK-MK2调控模块通过调控RNA结合蛋白锌指蛋白36(tristetraprolin,TTP)的表达和翻译后修饰影响mRNA的稳定性来调节细胞因子的表达。与TLR配体诱导的巨噬细胞炎症反应不同的是,干扰Dusp1表达后,缺氧RAW264.7细胞中TNF-α的表达和分泌均明显降低。在接受LPS刺激后,Dusp1-/-小鼠来源巨噬细胞中Tnfa mRNA的过度表达仅在接受LPS刺激后的早期出现,而Il10的mRNA表达水平则持续高于LPS刺激的野生型小鼠来源巨噬细胞;在LPS刺激后期Dusp1 -/-小鼠来源巨噬细胞中Tnfa mRNA表达低于野生型组的原因可能与增加的IL-10对Tnfa表达的抑制有关,因为在LPS刺激之前给予野生型和Dusp1 -/-小鼠来源巨噬细胞IL-10中和抗体能够明显增加LPS诱导的TNF-α的mRNA表达[24]。因此,干扰Dusp1表达后,缺氧RAW264.7细胞中TNF-α的mRNA表达和分泌水平明显降低可能与IL-10的增加有关。有关DUSP1调节缺氧诱导的RAW264.7巨噬细胞中上述炎症相关细胞因子表达的具体机制有待进一步研究。
综上所述,本研究发现,缺氧暴露下,RAW264.7细胞中DUSP1的表达增加,炎症相关细胞因子Il1b、Il10的mRNA表达增加,IL-1β的分泌水平增加;干扰Dusp1表达后缺氧处理的RAW264.7细胞中IL-1β表达和分泌明显增加,TNF-α的表达和分泌明显降低,IL-10的分泌水平明显增加,提示DUSP1通过调节IL-1β、IL-10和TNF-α的表达和(或)分泌参与调控缺氧诱导的RAW264.7巨噬细胞炎症免疫反应。DUSP1是干预缺氧诱导的巨噬细胞炎症免疫反应的潜在靶点。
| [1] |
RAHAT M A, BITTERMAN H, LAHAT N. Molecular mechanisms regulating macrophage response to hypoxia[J]. Front Immunol, 2011, 2: 45. DOI:10.3389/fimmu.2011.00045 |
| [2] |
CHEN T, YANG C, LI M, et al. Alveolar hypoxia-induced pulmonary inflammation: from local initiation to secondary promotion by activated systemic inflammation[J]. J Vasc Res, 2016, 53. DOI:10.1159/000452800 |
| [3] |
杨诚忠, 李满满, 罗羽莎, 等. LIGHT在低氧性肺动脉高压形成中的作用及机制[J]. 第三军医大学学报, 2018, 40(8): 643-651. YANG C Z, LI M M, LUO Y S, et al. Role of LIGHT in development of hypoxic pulmonary hypertension in mice[J]. J Third Mil Med Univ, 2018, 40(8): 643-651. DOI:10.16016/j.1000-5404.201711151 |
| [4] |
VERGADI E, CHANG M S, LEE C, et al. Early macrophage recruitment and alternative activation are critical for the later development of hypoxia-induced pulmonary hypertension[J]. Circulation, 2011, 123(18): 1986-1995. DOI:10.1161/CIRCULATIONAHA.110.978627 |
| [5] |
WEISBERG S P, MCCANN D, DESAI M, et al. Obesity is associated with macrophage accumulation in adipose tissue[J]. J Clin Invest, 2003, 112(12): 1796-1808. DOI:10.1172/JCI19246 |
| [6] |
CULLBERG K B, FOLDAGER C B, LIND M, et al. Inhibitory effects of resveratrol on hypoxia-induced inflammation in 3T3-L1 adipocytes and macrophages[J]. J Funct Foods. DOI:10.1016/j.jff.2014.02.015 |
| [7] |
BOUTROS T, CHEVET E, METRAKOS P. Mitogen-activated protein (MAP) kinase/MAP kinase phosphatase regulation: roles in cell growth, death, and cancer[J]. Pharmacol Rev, 2008, 60(3): 261-310. DOI:10.1124/pr.107.00106 |
| [8] |
KIM H S, ASMIS R. Mitogen-activated protein kinase phosphatase 1 (MKP-1) in macrophage biology and cardiovascular disease. A redox-regulated master controller of monocyte function and macrophage phenotype[J]. Free Radic Biol Med, 2017, 109(75)83. DOI:10.1016/j.freeradbiomed.2017.03.020 |
| [9] |
LANG R, RAFFI F. Dual-specificity phosphatases in immunity and infection: An update[J]. Int J Mol Sci, 2019, 20(11): 1-26. DOI:10.3390/ijms20112710 |
| [10] |
WANG Y, CHEN J C, MA Y Y, et al. Upregulations of glucocorticoid-induced leucine zipper by hypoxia and glucocorticoid inhibit proinflammatory cytokines under hypoxic conditions in macrophages[J]. J Immunol, 2012, 188(1): 222-229. DOI:10.4049/jimmunol.1002958 |
| [11] |
HUANG G, SU J, ZHANG M, et al. RhoB regulates the function of macrophages in the hypoxia-induced inflammatory response[J]. Cell Mol Immunol, 2017, 14(3): 265-275. DOI:10.1038/cmi.2015.78 |
| [12] |
白瑜珊, 焦时宇, 曲爱娟. 低氧增强巨噬细胞中脂多糖诱导的IL-1β表达[J]. 基础医学与临床, 2018, 38(5): 610-615. BAI Y S, JIAO S Y, QU A J.. Hypoxia amplifies lipopolysaccharide-induced IL-1β expression in macrophages[J]. Basic Clin Med, 2018, 38(5): 610-615. |
| [13] |
LAHAT N, RAHAT M A, KINARTY A, et al. Hypoxia enhances lysosomal TNF-alpha degradation in mouse peritoneal macrophages[J]. Am J Physiol Cell Physiol, 2008, 295(1): C2-C12.. DOI:10.1152/ajpcell.00572.2007 |
| [14] |
WANG P L. The effect of hypoxia on the production of interleukin-10 (IL-10) in human mononuclear cells[D]. Leicester: University of Leicester. 2010.
|
| [15] |
KOSCSÓ B, CSOKA B, SELMECZY Z, et al. Adenosine augments IL-10 production by microglial cells through an A2B adenosine receptor-mediated process[J]. J Immunol, 2012, 188(1): 445-453. DOI:10.4049/jimmunol.1101224 |
| [16] |
ALONSO A, PULIDO R. The extended human PTPome: a growing tyrosine phosphatase family[J]. FEBS J, 2016, 283(8): 1404-1429. DOI:10.1111/febs.13600 |
| [17] |
彭华志. DUSP1在人正常及骨关节炎滑膜细胞中的表达及对骨关节炎的保护作用[D].西安: 第四军医大学, 2017. PENG H Z. The expression of DUSP1 in human normal and osteoarthritis fibroblast-like synoviocytes and its protective role in osteoarthritis[D]. Xi'an: Fourth Military Medical University, 2017. |
| [18] |
LIU B, CHEN J, ZHANG L, et al. IL-10 dysregulation in acute mountain sickness revealed by transcriptome analysis[J]. Front Immunol, 2017, 8: 628. DOI:10.3389/fimmu.2017.00628 |
| [19] |
KUČERA J, NETUSILOVA J, SLADECEK S, et al. Hypoxia downregulates MAPK/ERK but not STAT3 signaling in ROS-dependent and HIF-1-independent manners in mouse embryonic stem cells[J]. Oxid Med Cell Longev, 2017, 2017: 4386947. DOI:10.1155/2017/4386947 |
| [20] |
SETA K A, KIM R, KIM H W, et al. Hypoxia-induced regulation of MAPK phosphatase-1 as identified by subtractive suppression hybridization and cDNA microarray analysis[J]. J Biol Chem, 2001, 276(48): 44405-44412. DOI:10.1074/jbc.M103346200 |
| [21] |
MISHRA O P, DELIVORIA PAPADOPOULOS M. Effect of hypoxia on the expression and activity of mitogen-activated protein(MAP)kinase-phosphatase-1(MKP-1)and MKP-3 in neuronal nuclei of newborn piglets: the role of nitric oxide[J]. Neuroscience, 2004, 129(3): 665-673. DOI:10.1016/j.neuroscience.2004.09.005 |
| [22] |
TALWAR H, BAUERFELD C, BOUHAMDAN M, et al. MKP-1 negatively regulates LPS-mediated IL-1β production through p38 activation and HIF-1α expression[J]. Cell Signal, 2017, 34: 1-10. DOI:10.1016/j.cellsig.2017.02.018 |
| [23] |
SMALLIE T, ROSS E A, AMMIT A J, et al. Dual-Specificity Phosphatase 1 and Tristetraprolin Cooperate To Regulate Macrophage Responses to Lipopolysaccharide[J]. J Immunol, 2015, 195(1): 277-288. DOI:10.4049/jimmunol.1402830 |
| [24] |
CHI H, BARRY S P, ROTH R J, et al. Dynamic regulation of pro- and anti-inflammatory cytokines by MAPK phosphatase 1 (MKP-1) in innate immune responses[J]. Proc Natl Acad Sci U S A, 2006, 103(7): 2274-2279. DOI:10.1073/pnas.0510965103 |



