2. 400016 重庆,重庆医科大学:附属第一医院临床分子医学检测中心
2. Center for Clinical Molecular Medical Detection, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种高侵袭性、高致死性的消化系统常见恶性肿瘤。因其临床表现隐匿、病情进展迅速和对放化疗抵抗,患者的5年生存率极低,约为8%[1]。有研究提出:随着胰腺癌发生率的逐年增高,预计到2030年,胰腺癌将成为所有癌症相关死亡的第2大原因[2]。因此,探讨胰腺癌的发生、发展过程,了解其生长、侵袭和转移的机制,加强胰腺癌的预防和提高其治疗效果显得尤为重要。
胰腺炎症作为胰腺癌的重要风险因素[3],使得胰腺癌的患病率明显增加[4]。更为重要的是,胰腺炎症的存在为胰腺癌的迁移和侵袭等恶性生物学行为提供了有利条件。一方面,炎症细胞产生的炎症介质可以通过激活胰腺癌的NF-κB、STAT3、COX-2等炎症信号通路促进细胞的增殖、上皮间质转变[5]以及新生血管的形成[6]等;另一方面,胰腺癌细胞炎症信号激活以后产生的炎症介质反过来也会招募更多的炎症细胞浸润。因此,炎症环境与胰腺癌细胞的相互作用使得胰腺癌快速增殖、侵袭和转移。
成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)属于FGF家族非典型成员[7]。目前研究表明其在糖脂代谢[8-9]及抗炎抗氧化[10-11]中起着重要作用,并且几乎没有促进细胞有丝分裂的功能。研究发现FGF21在正常胰腺组织中呈高表达,其通过自分泌的方式对胰腺组织本身发挥着重要的生理作用。高脂饮食喂养的小鼠给予FGF21治疗后胰腺炎症减轻,胰腺癌的发生与发展受到抑制[11],提示FGF21可以用于胰腺癌的预防或治疗,但作用机制不清楚。当胰腺炎症发生时,FGF21表达迅速升高以减少胰腺的炎症反应。研究证实FGF21对炎症中胰腺组织的炎症因子的产生和炎症信号的激活起着抑制作用[12]。既然炎症与胰腺癌的关系密切,而FGF21又能显著抑制胰腺本身的炎症反应,我们据此推测:FGF21可能通过抑制胰腺组织的炎症而阻止胰腺癌细胞的恶性生物学行为。为此,本课题组观察FGF21在胰腺组织及胰腺癌中的表达及其对炎症环境下胰腺癌细胞迁移和侵袭的影响,探讨其作用机制是否与抑制胰腺癌细胞的炎性反应相关[13],以期为临床上胰腺癌的治疗提供思路。
1 资料与方法 1.1 材料 1.1.1 组织切片收集重庆医科大学临床病理诊断中心2013年9月至2016年9月60例胰腺癌和55例正常胰腺组织的石蜡切片。纳入研究的患者均未进行放化疗,组织收集均经过患者和家属的知情同意,2016年12月通过重庆医科大学医学研究伦理委员会审查。
1.1.2 主要实验材料Capan-1和AsPC-1冻存于重庆医科大学分子医学与肿瘤研究中心。RNA提取和逆转录试剂盒购自日本TaKaRa公司。引物由上海生物工程技术服务有限公司合成。脂多糖(LPS)购自美国Sigma公司,成纤维细胞生长因子21(FGF21)购自以色列PROSPEC公司。免疫组化试剂盒购自福建迈新生物技术开发有限公司。兔抗MMP-9购自美国Selleck公司,鼠抗β-actin购自美国ABclonal公司。
1.2 方法 1.2.1 免疫组化及结果判定免疫组化染色步骤按照试剂盒说明书进行。抗FGF21抗体以1:200稀释,4 ℃下孵育过夜。染色结果半定量分析按阳性细胞百分比结合着色强度综合评分。按照阳性细胞百分比评分:<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。按照染色强度评分:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。然后两者的乘积评分如下:0~1为“-”,2~4为“+”,5~8为“+ +”,9~12为“+ + +”。免疫组化染色评分由2名病理科医师采用双盲法独立判定。
1.2.2 RT-qPCR检查按照RNA提取试剂盒说明书从细胞中获得总RNA,将RNA逆转录成cDNA,分别进行FGF21、MMP-9、IL-6和β-actin的基因扩增。FGF21上游引物:5′-ATGGATCGCTCCACTTTGACC-3′, 下游引物: 5′-GGGCTTCGGACTGGTAAACAT-3′,长度87 bp;MMP-9上游引物:5′-TGGGCTACGTGACCTATGAC-3′,下游引物:5′-CAAAGGTGAGAAGAGAGGGC-3′,长度191 bp;IL-6上游引物:5′-ATGAGGAGACTTGCCTGGTGAA-3′,下游引物:5′-GTTGGGTCAGGGGTGGTTATT-3′, 长度190 bp;β-actin上游引物:5′-CCTGGCACCCAGCACAAT-3′,下游引物:5′-GGGCCGGAC-TCGTCATAC-3′, 长度为144 bp。
1.2.3 细胞培养及炎症环境的建立Capan-1及AsPC-1细胞株均用含10%胎牛血清的RPMI1640培养基培养。采用不同浓度的LPS处理胰腺癌细胞24 h,通过RT-qPCR检测炎症因子IL-6 mRNA的相对表达量,筛选LPS的最佳浓度和确立炎症环境的建立。
1.2.4 划痕实验按每孔1×106个细胞接种于6孔板。待细胞贴壁并铺满6孔板后,用无菌10 μL枪头划痕,倒置显微镜下采集图像并记录。接着给予各组不同的LPS或FGF21处理,放入孵箱培养24 h,倒置显微镜下再次采集图像,观察各组细胞迁移情况。细胞迁移率=[(0 h划痕宽度-培养24 h划痕宽度)/0 h划痕宽度]×100%。每组采集5张图片,分别用Image J进行数据分析。
1.2.5 Transwell实验迁移实验:分别消化各组细胞,用RPMI1640重悬、计数。小室上室加入200 μL细胞悬液(含1×105个细胞),下室加入600 μL完全培养基,孵箱培养24 h后取出,固定染色,计数穿膜细胞。侵袭实验:Matrigel基质胶与RPMI1640按1 :8的比例混合,每个小室上室加入50 μL(避免产生气泡),并放入孵箱4~6 h,待其凝固后,其余步骤同迁移实验。
1.2.6 Westernblot检测提取总蛋白,BCA法测蛋白浓度,每孔按30 μg上样量进行SDS-PAGE电泳分离,然后250 mA恒流转至PVDF膜上。5%脱脂乳封闭条带2 h,MMP-9一抗(1 :500)和β-actin一抗(1 :1 000)4 ℃孵育过夜,二抗(1 :5 000)恒温孵育1 h,通过ECL显影。数据用Quantity One软件分析。
1.3 统计学分析数据以x ± s表示,采用SPSS 25.0统计软件行单因素方差分析,免疫组化结果通过Wilcoxon秩和检验进行分析。P < 0.05表示差异有统计学意义。
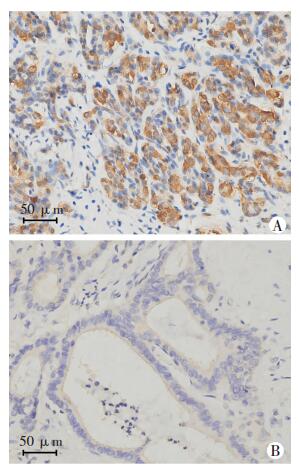
2 结果 2.1 FGF21在胰腺癌及正常胰腺组织中的表达免疫组化结果显示:FGF21在胰腺癌中的阳性表达明显低于正常胰腺组织(P < 0.01,表 1、图 1)。
| 组织 | n | FGF21阳性 | P值 | |||
| - | + | ++ | +++ | |||
| 正常胰腺组织 | 55 | 1 | 7 | 13 | 34 | <0.01 |
| 胰腺癌组织 | 60 | 5 | 30 | 18 | 7 | |
|
| A:人正常胰腺组织;B:人胰腺癌组织 图 1 FGF21在人正常胰腺组织及胰腺癌组织中的表达 (S-P) |
2.2 Capan-1、AsPC-1炎症环境的建立
RT-qPCR检测结果显示:0、10、100、1 000 ng/mL LPS作用细胞24 h后,Capan-1细胞IL-6 mRNA相对表达量分别为(0.960±0.057)、(1.194±0.086)、(1.705±0.046)、(3.024±0.182);AsPC-1细胞IL-6 mRNA相对表达量分别为(0.907±0.132)、(1.868±0.132)、(3.045±0.214)、(5.204±0.574)。随着LPS浓度的增加,IL-6 mRNA的表达均呈递增趋势,差异均有统计学意义(P < 0.05)。因此,选取效果最佳的1 000 ng/mL作为LPS的终浓度,进行后续实验。
2.3 划痕实验实验分6组:Control组、FGF21 1 μg/mL组、LPS组、LPS+FGF21 1 μg/mL、LPS+FGF21 2 μg/mL组和LPS+FGF21 4 μg/mL组。Capan-1各组细胞的迁移率分别为(7.025±4.836)%、(8.175±1.758)%、(17.902± 3.626)%、(8.444±2.404)%、(5.826±1.247)%和(4.222±3.736)%;AsPC-1各组细胞的迁移率分别为(30.798±2.174)%、(25.216±2.567)%、(80.418±5.693)%、(49.179±4.234)%、(39.655±6.269)%和(25.853±3.026)%。与Control组比较,LPS组迁移率显著增强(P < 0.05),而FGF21干预后迁移率较LPS组明显降低,并且随着FGF21浓度的增加,抑制作用逐渐增强,差异有统计学意义(P < 0.01)。Control组与FGF21组之间差异无统计学意义(图 2)。选择1 μg/mL作为FGF21后续实验的终浓度。

|
| 图 2 不同浓度FGF21对炎症环境下胰腺癌细胞Capan-1(A)、AsPC-1(B)迁移的影响 |
2.4 Transwell实验
在迁移实验中,LPS组Capan-1、AsPC-1的迁移细胞数明显多于Control组和FGF21组,而FGF21+LPS组的迁移细胞数较LPS组明显减少,差异均有统计学意义(P < 0.01),Control组与FGF21组之间差异无统计学意义(表 2,图 3)。
| 组别 | 迁移细胞数 | 侵袭细胞数 | |||
| Capan-1细胞(n=8) | AsPC-1细胞(n=5) | Capan-1细胞(n=8) | AsPC-1细胞(n=5) | ||
| Control组 | 126±11a | 197±8a | 71±18a | 90±9a | |
| FGF21组 | 124±19a | 170±10a | 69±10a | 70±12a | |
| LPS组 | 186±10 | 382±29 | 246±25 | 151±9 | |
| FGF21+LPS组 | 153±6a | 214±11a | 120±11a | 38±13a | |
| a:P < 0.01,与LPS组比较 | |||||

|
| 图 3 FGF21对胰腺癌细胞迁移(A)及侵袭(B)的影响 (× 200) |
在侵袭实验中,LPS组Capan-1、AsPC-1的侵袭细胞数明显多于Control组和FGF21组,而FGF21+LPS组的侵袭细胞数较LPS组明显减少,差异均有统计学意义(P < 0.01),Control组与FGF21组之间差异无统计学意义(表 2,图 3)。
2.5 FGF21对炎症环境下Capan-1及AsPC-1细胞IL-6和MMP-9 mRNA表达的影响LPS组Capan-1及AsPC-1的IL-6 mRNA相对表达量明显高于Control组和FGF21组,而FGF21+LPS组IL-6 mRNA相对表达量明显低于LPS组,差异均有统计学意义(P < 0.05,表 3),Control组与FGF21组之间差异无统计学意义。LPS组Capan-1及AsPC-1的MMP-9 mRNA相对表达量明显高于Control组和FGF21组,而FGF21+LPS组MMP-9 mRNA相对表达量明显低于LPS组,差异均有统计学意义(P < 0.01),Control组与FGF21组之间差异无统计学意义(表 3)。
| 组别 | Capan-1细胞 | AsPC-1细胞 | |||
| IL-6 | MMP-9 | IL-6 | MMP-9 | ||
| Control组 | 0.784±0.173a | 0.713±0.096a | 0.885±0.010b | 0.799±0.029b | |
| FGF21组 | 0.899±0.036a | 0.666±0.064a | 0.795±0.210b | 0.885±0.032b | |
| LPS组 | 1.138±0.086 | 1.019±0.029 | 1.132±0.031 | 1.194±0.094 | |
| FGF21+LPS组 | 0.885±0.093a | 0.736±0.096a | 0.864±0.102b | 0.792±0.165b | |
| a:P < 0.05,b:P < 0.01,与LPS组比较 | |||||
2.6 Western blot检测FGF21对炎症环境下胰腺癌细胞Capan-1、AsPC-1的MMP-9蛋白表达的影响
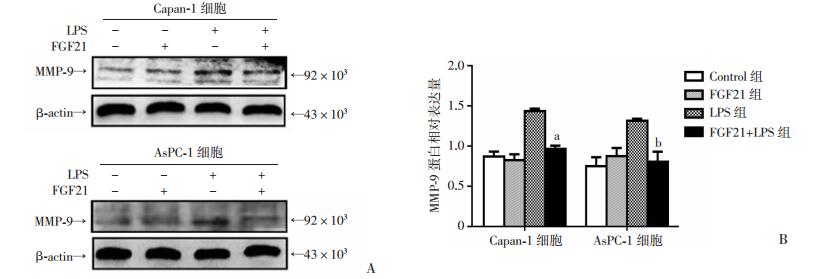
LPS组MMP-9蛋白表达较Control组和FGF21组明显升高,而FGF21干预后其表达较LPS组显著降低,差异均有统计学意义(P < 0.05)。FGF21组与Control组之间差异无统计学意义(图 4)。
|
| A: Western blot检测;B:半定量分析 a:P < 0.05,b:P < 0.01,与LPS组比较 图 4 Western blot检测FGF21对胰腺癌细胞Capan-1、AsPC-1中MMP-9蛋白表达的影响 |
3 讨论
胰腺癌5年生存率低,主要在于诊断晚、进展迅速、转移率极高,几乎90%的患者存在转移[14],而胰腺炎的存在为胰腺癌的浸润和转移提供了有利的环境[15]。
与胰腺炎症相关的因素包括各种炎症因子(IL-6、IL-1、TNF-α),活性氧(ROS)和炎症通路介质(如NF-κB和环氧合酶-2)。它们能促进胰腺腺泡导管化生、上皮间质转变和血管生成等促进胰腺癌的恶性转化及远处转移等[4, 16]。本研究发现:FGF21在正常胰腺腺泡中高表达,在胰腺导管腺癌中表达明显降低;而外源性给予FGF21能抑制高脂饮食喂养小鼠的胰腺炎症和胰腺癌的发生与发展,提示FGF21可以用于胰腺癌的预防或治疗[11]。同时,研究表明FGF21属于诱导型蛋白,因炎症刺激而迅速升高,并具有抑制炎症的作用[9-10, 12, 17]。我们推测FGF21可能参与了胰腺癌的进展,并可能与胰腺炎症有关。本研究从干预胰腺癌细胞炎症反应的角度,探讨FGF21对炎症环境下胰腺癌迁移、侵袭的影响。
FGF21是一种FGF家族非典型成员,无明显促有丝分裂作用[7]。临床研究发现在类风湿关节炎患者的血清和滑液中FGF21能明显升高,在通过Ⅱ型胶原蛋白构建的小鼠类风湿关节炎模型中,外源性给予FGF21治疗,发现FGF21能通过抑制NF-κB抑制炎症因子TNF-α、IL-1β、IL-6、IFN-γ和MMP-3的表达,从而抑制炎症的进一步损伤[17]。在高脂饮食诱导的高脂血症中,FGF21能抑制脂毒性引起的炎症[9]。在雨蛙肽诱导的小鼠胰腺炎中,也观察到胰腺组织中FGF21表达增加,在FGF21敲除的小鼠中观察到更严重的炎症损伤[18]。临床研究表明:人急性胰腺炎发生时,FGF21能迅速升高,并伴随着IL-6的降低[12]。可见FGF21能通过降低炎症介质的表达达到抗炎的效果,可能与AMPK/NF-κB分子通路有关。
众所周知,脂多糖(LPS)是革兰阴性菌细胞壁中的一种成分,可在体内和体外实验中用作免疫增强剂,可用于模拟体内和体外实验的炎症环境[19-21]。本研究首先给予胰腺癌细胞株Capan-1和AsPC-1不同浓度的脂多糖,筛选出最佳药物作用浓度,接着通过划痕实验和Transwell实验观察各组细胞的迁移及侵袭情况。结果显示:FGF21干预能明显抑制炎症环境对Capan-1及AsPC-1迁移与侵袭的促进作用,FGF21单独处理组与空白对照组差异无统计学意义。提示FGF21单独作用于胰腺癌的效果不佳,而FGF21干预组效果明显可能是FGF21通过抑制脂多糖诱导的炎症反应来发挥作用。进一步检测FGF21干预后IL-6、MMP-9的表达情况,结果显示FGF21干预组胰腺癌细胞IL-6、MMP-9的表达显著降低。目前研究认为:MMP-9可以降解细胞外基质、促进血管的形成[22],而IL-6亦可以通过上调基质金属蛋白酶及血管生成因子等参与胰腺癌的侵袭行为[23]。因此,FGF21可能通过抑制IL-6、MMP-9表达而阻止炎症环境中胰腺癌细胞的迁移和侵袭。作为NF-κB的下游分子,IL-6、MMP-9的表达下降是否与胰腺癌细胞NF-κB信号通路的抑制有关,还需进一步研究。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
RAHIB L, SMITH B D, AIZENBERG R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States[J]. Cancer Res, 2014, 74(11): 2913-2921. DOI:10.1158/0008-5472.CAN-14-0155 |
| [3] |
RYAN D P, HONG T S, BARDEESY N. Pancreatic adenocarcinoma[J]. N Engl J Med, 2014, 371(11): 1039-1049. DOI:10.1056/nejmra1404198 |
| [4] |
KIRKEGÅRD J, MORTENSEN F V, CRONIN-FENTON D. Chronic pancreatitis and pancreatic cancer risk: A systematic review and meta-analysis[J]. Am J Gastroenterol, 2017, 112(9): 1366-1372. DOI:10.1038/ajg.2017.218 |
| [5] |
LIOU G Y, DÖPPLER H, NECELA B, et al. Macrophage-secreted cytokines drive pancreatic acinar-to-ductal metaplasia through NF-κB and MMPs[J]. J Cell Biol, 2013, 202(3): 563-577. DOI:10.1083/jcb.201301001 |
| [6] |
HONORATI M C, CATTINI L, FACCHINI A. IL-17, IL-1β and TNF-α stimulate VEGF production by dedifferentiated chondrocytes[J]. Osteoarthr Cartil, 2004, 12(9): 683-691. DOI:10.1016/j.joca.2004.05.009 |
| [7] |
KHARITONENKOV A, ADAMS A C. Inventing new medicines: The FGF21 story[J]. Mol Metab, 2014, 3(3): 221-229. DOI:10.1016/j.molmet.2013.12.003 |
| [8] |
BERGLUND E D, LI C Y, BINA H A, et al. Fibroblast growth factor 21 controls glycemia via regulation of hepatic glucose flux and insulin sensitivity[J]. Endocrinology, 2009, 150(9): 4084-4093. DOI:10.1210/en.2009-0221 |
| [9] |
SINGHAL G, FISHER F M, CHEE M J, et al. Fibroblast growth factor 21 (FGF21) protects against high fat diet induced inflammation and islet hyperplasia in pancreas[J]. PLoS ONE, 2016, 11(2): e0148252. DOI:10.1371/journal.pone.0148252 |
| [10] |
GÓMEZ-SÁMANO M Á, GRAJALES-GÓMEZ M, ZUARTH- VÁZQUEZ J M, et al. Fibroblast growth factor 21 and its novel association with oxidative stress[J]. Redox Biol, 2017, 11: 335-341. DOI:10.1016/j.redox.2016.12.024 |
| [11] |
LUO Y D, YANG YY, LIU M Y, et al. Oncogenic KRAS reduces expression of FGF21 in acinar cells to promote pancreatic tumorigenesis in mice on a high-fat diet[J]. Gastroenterology, 2019, 157(5): 1413-1428. DOI:10.1053/j.gastro.2019.07.030 |
| [12] |
JOHNSON C L, WESTON J Y, CHADI S A, et al. Fibroblast growth factor 21 reduces the severity of cerulein-induced pancreatitis in mice[J]. Gastroenterology, 2009, 137(5): 1795-1804. DOI:10.1053/j.gastro.2009.07.064 |
| [13] |
朱莎莎. FGF21对炎症环境下人胰腺癌细胞迁移侵袭的影响及其机制研究[D].重庆: 重庆医科大学, 2019. ZHU S S. Effect of FGF21 on migration and invasion of human pancreatic cancer cells in inflammatory environment and its possible mechanism[D]. Chongqing: Chongqing Medical Univesity, 2019. |
| [14] |
HRUBAN R H, GAIDA MM, THOMPSON E, et al. Why is pancreatic cancer so deadly? The pathologist's view[J]. J Pathol, 2019, 248(2): 131-141. DOI:10.1002/path.5260 |
| [15] |
DESCHÊNES-SIMARD X, MIZUKAMI Y, BARDEESY N. Macrophages in pancreatic cancer: starting things off on the wrong track[J]. J Cell Biol, 2013, 202(3): 403-405. DOI:10.1083/jcb.201307066 |
| [16] |
LIOU G Y. Inflammatory cytokine signaling during development of pancreatic and prostate cancers[J]. J Immunol Res, 2017, 2017: 7979637. DOI:10.1155/2017/7979637 |
| [17] |
YU Y H, LI S M, LIU Y N, et al. Fibroblast growth factor 21 (FGF21) ameliorates collagen-induced arthritis through modulating oxidative stress and suppressing nuclear factor-kappa B pathway[J]. Int Immunopharmacol, 2015, 25(1): 74-82. DOI:10.1016/j.intimp.2015.01.005 |
| [18] |
JOHNSON C L, MEHMOOD R, LAING S W, et al. Silencing of the Fibroblast growth factor 21 gene is an underlying cause of acinar cell injury in mice lacking MIST1[J]. Am J Physiol Endocrinol Metab, 2014, 306(8): E916-E928. DOI:10.1152/ajpendo.00559.2013 |
| [19] |
IKEBE M, KITAURA Y, NAKAMURA M, et al. Lipopolysaccharide (LPS) increases the invasive ability of pancreatic cancer cells through the TLR4/MyD88 signaling pathway[J]. J Surg Oncol, 2009, 100(8): 725-731. DOI:10.1002/jso.21392 |
| [20] |
KHURANA A, SIKHA M S, RAMESH K, et al. Modulation of cerulein-induced pancreatic inflammation by hydroalcoholic extract of curry leaf (Murraya koenigii)[J]. Phytother Res, 2019, 33(5): 1510-1525. DOI:10.1002/ptr.6344 |
| [21] |
SONG J K, ZHANG W, WANG J H, et al. Activation of Nrf2 signaling by salvianolic acid C attenuates NF-κB mediated inflammatory response both in vivo and in vitro[J]. Int Immunopharmacol, 2018, 63: 299-310. DOI:10.1016/j.intimp.2018.08.004 |
| [22] |
ROY R, YANG J, MOSES M A. Matrix metalloproteinases as novel biomarkers and potential therapeutic targets in human cancer[J]. J Clin Oncol, 2009, 27(31): 5287-5297. DOI:10.1200/JCO.2009.23.5556 |
| [23] |
LESINA M, WÖRMANN S M, NEUHÖFER P, et al. Interleukin-6 in inflammatory and malignant diseases of the pancreas[J]. Semin Immunol, 2014, 26(1): 80-87. DOI:10.1016/j.smim.2014.01.002 |



