心血管疾病(cardiovascular disease,CVD)的治疗一般使用自体的健康血管进行手术移植,然而患者的自体血管常由于各类疾病(如高血压、糖尿病等)而不宜进行移植[1-2]。组织工程血管(tissue-engineered blood vessel,TEBVs)虽能够缓解供体血管的短缺状况[3],但在移植后常面临血栓、胶原或内膜增生等问题,导致移植失败[4-6]。内皮细胞(endothelial cells,ECs)位于血管内膜,发挥代谢、物质交换[7]、合成分泌细胞因子、抑制血小板集聚等作用[5],故促进移植后TEBVs的内皮化进程可减少上述病理情况的发生,从而保证移植的成功[8-9]。研究发现Rg1可促进ECs增殖、迁移和血管形成[10-12],且该作用与VEGFR2有关[13-15],研究两者间关系将为后续实验提供理论基础。环糊精家族作为经典的药物载体,其中(2-羟丙基)-γ-环糊精[(2-hydroxypropyl)-cyclodextrin,HGC][16-17]因其优异的水溶性、空腔容积和生物相容性,已被应用于口腔、皮肤和肠道给药[18-19]。为了解决移植后TEBVs可能产生的病理问题,本研究拟探讨人参皂苷Rg1(Ginsenoside Rg1,Rg1)对ECs增殖和迁移的影响,同时构建Rg1-(2-羟丙基)-γ-环糊精颗粒(Rg1-HGC/CS NPs,以下简称NPs)并修饰至天然血管以构建促内皮化进程的TEBVs,发挥促进血管内皮化进程的作用,为临床治疗CVD提供实验依据。
1 材料与方法 1.1 细胞和动物ECs购于ATCC公司;8~10周的SD大鼠来自陆军军医大学实验动物中心。
1.2 主要试剂RPMI培养基、青霉素-链霉素购自HyClone公司;胎牛血清(FBS)、胰酶(2.5%)购自Gibco公司;Rg1、CCK-8试剂盒、多聚甲醛固定液(4%)购自Beyotime公司;XL184(Cabozantinib malate,VEGFR2抑制剂)购自Selleck公司;HGC、壳聚糖、冰醋酸购自Aladdin公司;碘海醇造影剂购自扬子江药业;三聚磷酸钠(TPP)购自Sangon公司;胶原购自Kensey Nash公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)购自BBI公司;Hoechst 33342购自Sigma-Aldrich公司;流式凋亡检测试剂盒购自CWBIO公司。
1.3 实验方法 1.3.1 配制1640培养基与细胞培养使用RPMI培养基配制含有10% FBS的1640完全培养基,并加入1%的青霉素-链霉素。使用1640完全培养基培养ECs,置于37 ℃、5%CO2细胞培养箱。换液时,使用PBS漂洗3次后加入1640完全培养基。当细胞几乎铺满培养瓶时,使用胰酶(2.5%)消化后传代。
1.3.2 细胞增殖能力检测计数ECs并接种于96孔板内[(0.8~1.0)×104/孔]并培养过夜。细胞贴壁后使用PBS漂洗,然后每组加入含有不同浓度Rg1的培养基(0、7.81、15.63、31.25、62.5、125、250、500、1 000、2 000 μmol/L),每组6个复孔,培养48 h。吸除孔内液体,每孔加入含有10% CCK-8的培养基100 μL,温箱内继续孵育1.5 h。酶标仪(Tecan Infinite M200 Pro)测量每组450 nm处的光密度值[D(450)]。再将细胞分为3组,分别用普通培养基(对照组)、Rg1(15.63 μmol/L)培养基(Rg1处理组)和XL184(0.5 μg/mL)+Rg1(15.63 μmol/L)联合培养基(联合处理组)培养ECs,每组8个复孔,48 h后测定相应D(450)值。
1.3.3 细胞划痕实验6孔板内种植ECs,待细胞几乎铺满时,垂直于水平面进行细胞划痕操作。PBS漂洗后,每孔加入丝裂霉素(1 μg/mL)处理约1 h以抑制有丝分裂,结束后再次漂洗。分别使用普通培养基(对照组)、Rg1(15.63 μmol/L)培养基(Rg1处理组)和XL184(0.5 μg/mL)+Rg1(15.63 μmol/L)联合培养基(联合处理组)培养ECs,以上所有分组的培养基均无FBS,以排除细胞分裂对实验的影响,48 h后漂洗、固定并染色,显微镜下拍照,Image J测算相对划痕面积和划痕闭合率。
1.3.4 流式细胞凋亡检测ECs分为对照组和Rg1处理组,种植于6孔板内,其中Rg1处理组使用Rg1(15.6 μmol/L)培养基处理,而对照组仅使用普通培养基处理。48 h后收集两组细胞,1 000 r/min离心5 min后漂洗,然后使用缓冲液重悬,加入Annexin V-FITC和PI避光孵育15 min,流式细胞仪(BD Accuri C6)上样检测。
1.3.5 Rg1-HGC/CS NPs的制备将Rg1溶液(4 mg/mL)缓慢滴入HGC溶液(4.53 mg/mL)并中速搅拌4 h,冷冻干燥后得到Rg1-HGC。将35.0 mg壳聚糖溶于35.0 mL的冰醋酸溶液(1%,体积分数),调节溶液pH约为5,制得壳聚糖溶液。将7.78 mL的TPP溶液(1.0 mg/mL)缓慢滴入壳聚糖溶液并连续搅拌4 h(50 ℃),冷冻干燥后制得空白壳聚糖CS颗粒。重复上述步骤,将10.0 mg的Rg1-HGC溶于7.78 mL的TPP溶液,缓慢滴入壳聚糖溶液并连续搅拌4 h(50 ℃),冷冻干燥后制得Rg1-HGC/CS NPs。
1.3.6 TEBVs的构建和移植水合氯醛(10%)麻醉大鼠,逐层分离颈部组织,剥离颈动脉鞘并暴露颈总动脉,夹闭血管两端并剪下血管,在肝素生理盐水中冲洗血管腔,置于冰上保存。使用胰酶(0.2%)消化血管(37 ℃,30 min)得到脱细胞血管,PBS漂洗后与胶原溶液(4 mg/mL)混合,4 ℃振荡孵育24 h,得到胶原处理的血管。将胶原处理的血管置于EDC/NHS混合溶液(各5 mmol/L)中,4 ℃振荡孵育24 h以活化胶原分子的羧基和氨基。处理完毕后将血管样本浸入NPs溶液(15 μmol/L)中,4 ℃振荡交联24 h得到NPs修饰的促内皮化TEBVs。动物血管移植实验分为胶原组、空白CS组和实验组,将各组血管分别移植到大鼠的左侧颈总动脉(每组6只),消毒后予以缝合。置于舒适的环境中饲养,尾静脉注射肝素化生理盐水1周。
1.3.7 血管的生物相容性检测体外环境下,取得脱细胞血管和构建的促内皮化TEBVs,置于(5~10)×104 /mL的ECs悬液培养48 h(37 ℃,5%CO2)。PBS轻柔漂洗以去除尚未附着的细胞,多聚甲醛(4%)浸没样本固定20 min,PBS漂洗后使用Hoechst 33342工作液(1 :2 000)染色10 min,将血管置于载玻片上压片观察,每组取4个随机视野观察并拍照。
1.3.8 材料和血管的表征将各样本的干态粉末与溴化钾混匀并研磨压片,FTIR仪(Thermo Fisher Nicolet iS 50)检测Rg1、HGC、CS、Rg1-HGC和Rg1-HGC/CS的红外波谱;DLS仪(Malvern Nano S90)分析NPs的粒径和多分散性指数(PDI);对各组血管进行固定、乙醇和叔丁醇梯度脱水和喷金处理后,使用SEM(Zeiss Crossbeam 340)拍照。
1.3.9 小动物超声和Micro-CT检测血管通畅情况血管移植30 d后,将各组大鼠麻醉并备皮,使用小动物超声仪(Esaote SL3323)检测血流速度和通畅情况。90 d后,将各组大鼠麻醉,切开腹部并逐层分离组织,探查至膈肌后将其剪开,于心尖处迅速注射造影剂(0.4 mL/100 g),必要时剪开肋骨进行心外按压以使造影剂进入循环系统,将大鼠朝上置于Micro-CT仪(Perkin Elmer Quantum FX)扫描颈总动脉。获取各组大鼠的左侧颈总动脉样本并妥善处理遗体。
1.3.10 切片染色检测各组血管的内皮化效果获取胶原组、空白CS组和实验组大鼠的左侧颈总动脉,使用HE、Masson和CD31免疫荧光染色观察每组样本的内皮化效果,该实验由Servicebio公司进行;另外,对实验组血管使用CD31(红)和vWF(绿)双荧光染色,观察内皮化效果并拍照。
1.4 统计学分析采用GraphPad Prism和Origin对数据进行统计学分析,数据以x±s表示,两组间比较采用t检验。检验水准α=0.05。
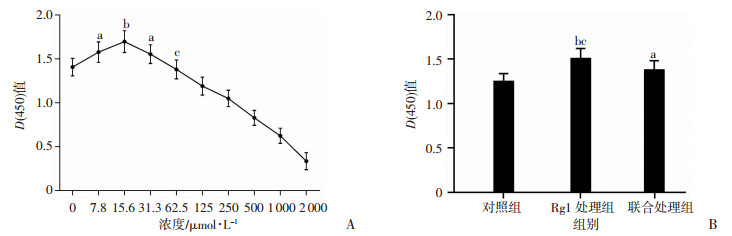
2 结果 2.1 Rg1通过VEGFR2产生促进ECs增殖的作用细胞培养48 h后,细胞活力最高的为15.6 μmol/L Rg1处理组。当Rg1浓度小于15.6 μmol/L时,D(450)值随着浓度的增加而升高,提示此范围内浓度与促增殖效果成正比(P < 0.05);当Rg1浓度大于15.6 μmol/L时,D(450)值随着浓度的增加而降低,提示此范围内浓度与促增殖效果成反比(P < 0.05);其中62.5 μmol/L Rg1处理后细胞活力较15.6 μmol/L Rg1处理显著降低(P < 0.01),而与0 μmol/L Rg1处理组差异无统计学意义。提示当上升至此浓度时,促增殖效果已不明显甚至发生抑制增殖作用(图 1A)。使用15.6 μmol/L浓度的Rg1和XL184分别处理细胞48 h,Rg1处理组D(450)值高于对照组(P < 0.01)和联合处理组(P < 0.05),联合处理组D(450)值高于对照组(P < 0.05),表明Rg1可通过VEGFR2途径促进ECs增殖,且该作用可被XL184部分阻断(图 1B)。
|
| A:不同浓度Rg1培养ECs 48 h后对细胞增殖的影响(n=6) a:P < 0.05,b:P < 0.01,与0 μmol/L比较;c:P < 0.01,与15.6 μmol/L比较;B:各组处理48 h后细胞增殖能力变化(n=8) a: P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,与联合处理组比较 图 1 Rg1通过VEGFR2产生促进ECs增殖的作用 |
2.2 Rg1通过VEGFR2产生促进ECs迁移的作用
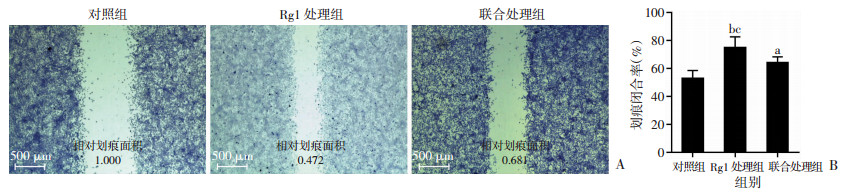
图 2中被染为紫色的细胞为ECs,中央空白部分为划痕区域(图 2A)。Rg1处理组的划痕闭合率显著高于对照组(P < 0.01)和联合处理组(P < 0.05),平均值之比为3 :2和15 :13;联合处理组的划痕闭合显著率高于对照组(P < 0.05),其平均值之比约为13 :10。提示Rg1可促进ECs迁移,促使划痕愈合,且该作用可被XL184部分阻断(图 2B)。
|
| A:各组细胞划痕实验;B:划痕闭合率a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,与联合处理组比较 图 2 Rg1通过VEGFR2产生促进ECs迁移的作用 |
2.3 Rg1对ECs无明显的凋亡影响
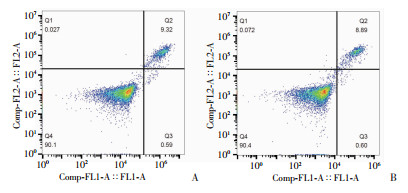
采用流式细胞术进一步对空白处理(对照组)和Rg1处理(处理组)后的细胞进行凋亡检测,每组实验重复3次。结果显示,对照组和处理组的早期凋亡率分别为0.59%、0.56%、0.81%和0.79%、0.60%、0.56%;晚期凋亡率分别为9.32%、9.80%、9.44%和8.35%、8.89%、8.18%。早期凋亡率方面两组未见明显差异晚期凋亡率表现处理组略低于对照组,而结合其差异值(< 1%)和实际情况分析,认为Rg1对ECs抑制凋亡作用不明显,也从另一方面提示该浓度的Rg1对ECs无明显的凋亡作用(图 3)。
|
| A:对照组;B:Rg1处理组;Q1、Q2、Q3、Q4分别代表坏死、晚期凋亡、早期凋亡和存活细胞的比率 图 3 Rg1对ECs无明显的凋亡影响 |
2.4 FTIR和DLS检测
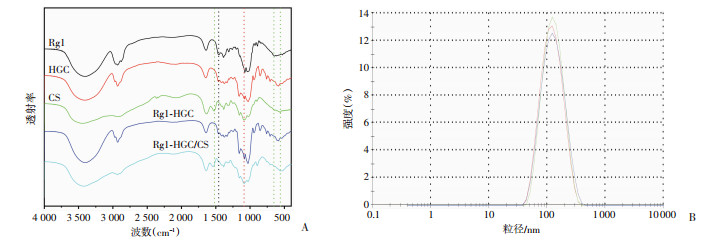
FTIR显示,HGC在1 084 cm-1处具有二级羟基C-O吸收峰,符合HGC的结构特征;Rg1和Rg1-HGC在1 450 cm-1处可见较宽C=C吸收峰,符合Rg1结构特征,且在HGC未见该吸收峰,说明HGC可与Rg1结合;CS在1 525 cm-1、650 cm-1和560 cm-1处可见C-N和N-H的吸收频率,符合CS结构特征,且上述频率同样没有出现在Rg1-HGC/CS中,提示CS可将Rg1-HGC包被形成Rg1-HGC/CS(图 4A)。粒径分析显示所合成的Rg1-HGC/CS直径在40~400 nm之间,大部分集中于130 nm,PDI为0.187 < 0.3,表明粒径值的分布均匀且集中(图 4B)。
|
| A: FTIR谱线;B:Rg1-HGC/CS的DLS粒径分析 图 4 各组样本的FTIR和DLS检测 |
2.5 SEM检测各组血管内表面的形态结构
正常组(正常血管)可见ECs(8~10 μm)同向均匀地生长于内表面(图 5A);脱细胞组血管可见较细的无序网状结构(暴露于内膜层的血管胶原纤维) (图 5B);胶原组血管内表面较平滑且未见明显ECs和胶原纤维,说明胶原已均匀地孵育至内表面(图 5C);实验组(NPs修饰血管)可见内表面均匀分布有大量球形微粒(图 5D),直径介于50~200 nm之间,与前期DLS结果一致,提示NPs已经被成功地修饰至内表面。

|
| A:正常组;B:脱细胞组;C:胶原组;D:实验组 图 5 各组血管样本内表面的形态结构观察 |
2.6 促内皮化TEBV的生物相容性较脱细胞血管良好
使用荧光显微镜观察并随机选取4个视野拍照,使用Image J对细胞进行计数。结果显示,脱细胞血管的计数为321、319、286、311,其平均值为309(图 6A);促内皮化TEBV的计数为545、589、498、485,其平均值为529(图 6B)。说明所构建的促内皮化TEBV生物相容性较好,利于细胞的贴附,有助于血管移植后ECs的生长、增殖和迁移。

|
| A:脱细胞处理的血管支架;B:促内皮化的TEBVs;每组选取4个随机视野,右上角数字为该视野的细胞计数值 图 6 ECs与血管支架和促增殖TEBVs的共培养情况 |
2.7 促内皮化TEBVs的构建和血管移植
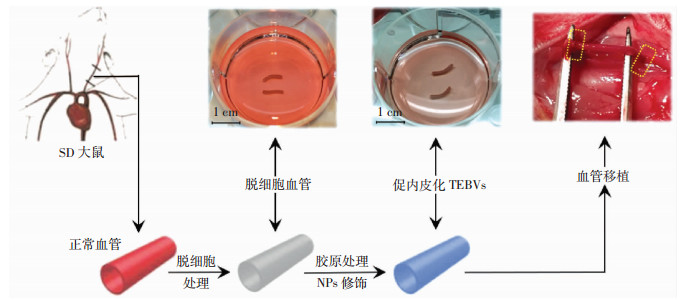
脱细胞组血管呈白色管状结构,长约1 cm,周围附着少量絮状物(血管外膜纤维);胶原组血管周围未见明显絮状物;实验组血管的形态与胶原组相似。在血管移植过程中,将各组血管移植至SD大鼠的左侧颈总动脉后,松开止血夹可见血管缝合口处有微量渗血,数分钟后渗血自行停止,同时血管由苍白色逐渐转变为浅红色,说明移植处血流状况良好,可以进行缝合(图 7)。
|
| 黄色虚线框为移植血管两侧的缝合部位 图 7 促内皮化TEBVs的构建和血管移植 |
2.8 各组大鼠的血管通畅情况和内皮化效果
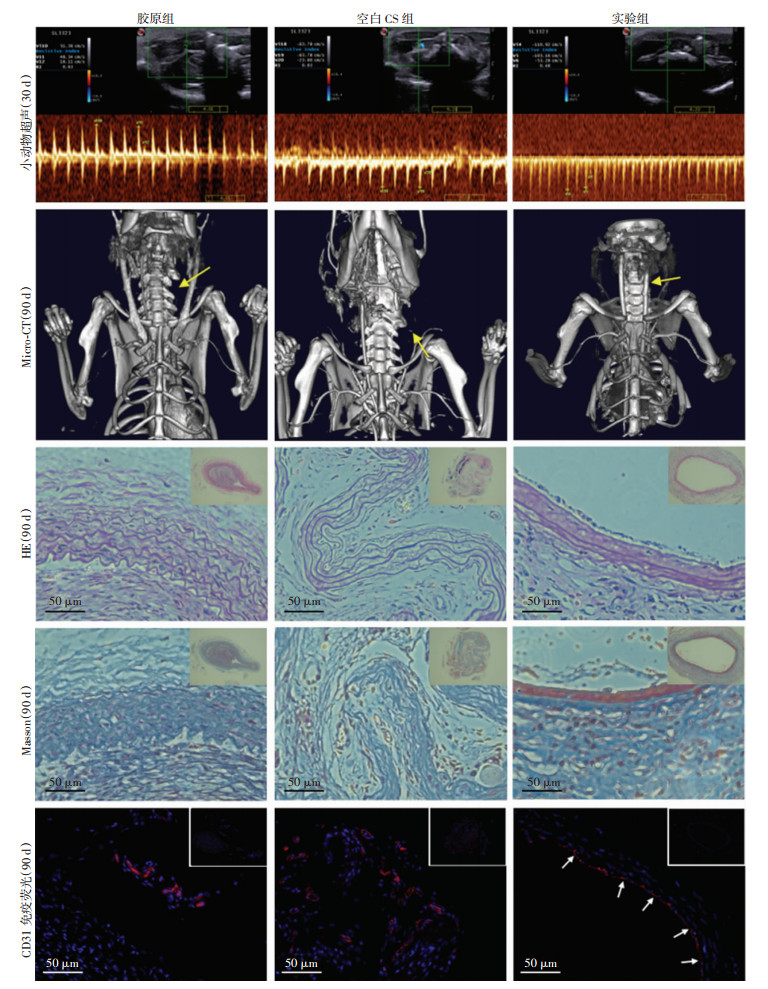
移植后30 d时,使用小动物超声仪检测各组大鼠的血液流速,实验组(110.92 cm/s)>空白CS组(63.78 cm/s) ≥胶原组(51.36 cm/s),提示在此时间节点,实验组的通畅度与其他组相比较好。移植后第90 d时,Micro-CT扫描发现,胶原组和空白CS组大鼠的左侧颈总动脉缺失,其走行方向未见血管及其分支轮廓,而实验组可见沿大鼠脊柱方向走行的左侧颈总动脉,其轮廓较为清晰,提示移植90 d后,实验组大鼠的通畅度仍较其他组良好;HE切片染色观察,发现胶原组和空白CS组的血管壁发生内向塌陷,已呈现出不规则外形,血管内腔几乎完全阻塞,而实验组的血管壁外形完好,未发生明显形变,血管内腔较通畅;Masson切片染色观察,发现胶原组和空白CS组的血管内腔除发生阻塞外,血管壁和内腔可见明显的胶原纤维(蓝色)增生现象,而实验组血管未发生明显该现象,通畅度良好;CD31免疫荧光观察,可见胶原组和空白CS组血管内腔中,杂乱分布的细胞和机化再通形成的小血管,构成血管阻塞现象,而实验组血管的通畅度较好,其内腔表面可见单层或数层的内皮细胞覆盖(图 8),提示实验组血管在此时间点已基本完成内皮化进程。
|
| Micro-CT(90 d):黄色箭头示大鼠左侧颈总动脉移植的位置;CD31免疫荧光(90 d):CD31(红),DAPI(蓝),白色箭头示附着生长于血管内表面的内皮细胞 图 8 各组大鼠的血管通畅情况和内皮化效果 |
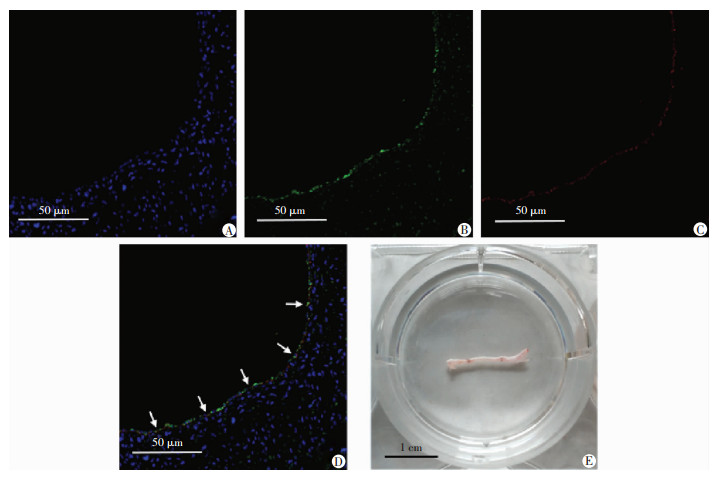
另外对实验组的血管样本进行vWF(绿色)和CD31(红色)免疫荧光双标志染色,可见细胞核(蓝色)、vWF和CD31共定位于血管内表面的细胞,提示细胞种类为内皮细胞(图 9)。
|
| A:细胞核染色(蓝);B:vWF染色(绿);C:CD31染色(红);D:融合图像白色箭头示ECs;E:实验组血管实物 图 9 实验组血管的免疫荧光双标志染色(vWF和CD31)和实物图 |
3 讨论
CVD在现代社会的发病趋势愈发严峻,临床治疗一般需要进行血管移植手术,而良好的血管供体却供不应求,为了解决临床血管供体短缺和移植后所产生的各种问题,本文包载Rg1构建出了促内皮化的TEBVs。研究表明,人参的有效成分Rg1在血管生成方面表现出促ECs增殖和迁移的作用,其机制除本研究的VEGFR2之外,还有PI3k/Akt、MiR-23a/RUNX2/VEGF-A、HIF-1α非依赖性上调等机制[10-12],同时Rg1具有类似雌激素的活性,可作用于雌激素受体而发挥促进细胞增殖的作用[20-21]。
本研究首先观察了Rg1对ECs促进增殖和迁移的作用,同时阐述了该作用和VEGFR2之间的联系,为后续实验提供理论基础。在探究Rg1的作用浓度时,得出Rg1促进ECs增殖的浓度范围为7.8~31.3 μmol/L,而在此区间内15.6 μmol/L的促进增殖作用较明显,故本文将Rg1的工作浓度设定为15.6 μmol/L。本研究发现Rg1虽表现出抑制ECs晚期凋亡的作用,但结合实际效应,可认为Rg1对ECs抑制凋亡作用不显著,从另一方面提示该药物对细胞无明显的凋亡影响,对细胞和组织较安全。其次,本研究使用CS包裹Rg1-HGC,利用EDC/NHS共同产生催化作用,使NPs修饰至血管内表面,其原理大致为:壳聚糖分子的氨基与胶原分子的羧基在EDC/NHS的催化作用下发生脱水缩合反应形成酰胺键,使CS包裹的Rg1-HGC以共价键的形式牢固修饰于血管内表面[22],减少因血流冲刷所造成的药物损失。然后,本研究对所制备的NPs进行表征,FTIR和DLS结果显示Rg1-HGC/CS NPs的粒径约为130 nm且大小均匀。
在动物实验中,本研究以SD大鼠的颈总动脉作为基础材料,通过使用低浓度的胰酶将血管的细胞消化裂解,目的在于减少移植后因同种异体的细胞或组织产生的免疫排斥反应。使用胶原孵育血管,一方面可以覆盖脱细胞处理后的血管内表面所暴露的胶原纤维,阻止因暴露的胶原纤维而产生的凝血系统激活效应,另一方面能够为接下来的TEBVs修饰提供化学基团(如氨基和羧基)。SEM证实NPs能够均匀地修饰于TEBVs内腔面,表明已成功构建促内皮化的TEBVs。在构建完成促内皮化TEBVs后,将ECs与脱细胞血管和促内皮化TEBVs进行共培养,以观察其生物相容性,结果显示后者较好,利于细胞贴附和生长。在移植后30 d和90 d,对各组大鼠进行了血管通畅率的检测,两个时间点的检测结果显示实验组的通畅度优于其他两组,说明所构建的促内皮化TEBVs能够保持移植后血管的通畅率。对移植90 d后的各组血管进行HE、Masson和CD31+vWF免疫荧光染色,以观察血管的内皮化效果,结果显示实验组的血管比较于其他两组,已基本完成内皮化进程,最终维持血管的通畅性。综上所述,本研究所构建的促内皮化TEBVs可促进ECs的增殖和迁移作用,保证移植后通畅率,为临床治疗CVD提供了理论支撑和实验依据。
由于生物体的内环境是一套高度复杂且动态变化的系统,血管的生成和修复也不例外。血管在移植后首先将面临血栓(或栓塞)形成的问题,移植后的短期内可能诱发急性免疫排斥反应导致血管被免疫细胞攻击而失去功能,移植后的长期阶段则会面临着慢性免疫排斥反应和神经化支配的问题,关于血管移植后神经化的问题有待在后续研究中进一步探究和阐明。
| [1] |
DAHL S L, KYPSON A P, LAWSON J H, et al. Readily available tissue-engineered vascular grafts[J]. Sci Transl Med, 2011, 3(68): 68ra9. DOI:10.1126/scitranslmed.3001426 |
| [2] |
GAUDINO M, ANTONIADES C, BENEDETTO U, et al. Mechanisms, consequences, and prevention of coronary graft failure[J]. Circulation, 2017, 136(18): 1749-1764. DOI:10.1161/CIRCULATIONAHA.117.027597 |
| [3] |
RATCLIFFE A. Tissue engineering of vascular grafts[J]. Matrix Biol, 2000, 19(4): 353-357. DOI:10.1016/s0945-053x(00)00080-9 |
| [4] |
MEDZHITOV R. Inflammation 2010: new adventures of an old flame[J]. Cell, 2010, 140(6): 771-776. DOI:10.1016/j.cell.2010.03.006 |
| [5] |
SEIFU D G, PURNAMA A, MEQUANINT K, et al. Small-diameter vascular tissue engineering[J]. Nat Rev Cardiol, 2013, 10(7): 410-421. DOI:10.1038/nrcardio.2013.77 |
| [6] |
SONG H G, RUMMA R T, OZAKI C K, et al. Vascular tissue engineering: progress, challenges, and clinical promise[J]. Cell Stem Cell, 2018, 22(3): 340-354. DOI:10.1016/j.stem.2018.02.009 |
| [7] |
VAN HINSBERGH V W. Endothelium: role in regulation of coagulation and inflammation[J]. Semin Immunopathol, 2012, 34(1): 93-106. DOI:10.1007/s00281-011-0285-5 |
| [8] |
SERBO J V, GERECHT S. Vascular tissue engineering: biodegradable scaffold platforms to promote angiogenesis[J]. Stem Cell Res Ther, 2013, 4(1): 8. DOI:10.1186/scrt156 |
| [9] |
MELCHIORRI A J, HIBINO N, FISHER J P. Strategies and techniques to enhance the in situ endothelialization of small-diameter biodegradable polymeric vascular grafts[J]. Tissue Eng Part B Rev, 2013, 19(4): 292-307. DOI:10.1089/ten.TEB.2012.0577 |
| [10] |
WU X D, GUO T, LIU L, et al. MiR-23a targets RUNX2 and suppresses ginsenoside Rg1-induced angiogenesis in endothelial cells[J]. Oncotarget, 2017, 8(35): 58072-58085. DOI:10.18632/oncotarget.19489 |
| [11] |
SENGUPTA S, TOH S A, SELLERS L A, et al. Modulating angiogenesis: the Yin and the Yang in ginseng[J]. Circulation, 2004, 110(10): 1219-1225. DOI:10.1161/01.CIR.0000140676.88412.CF |
| [12] |
LEUNG K W, NG H M, TANG M K, et al. Ginsenoside-Rg1 mediates a hypoxia-independent upregulation of hypoxia-inducible factor-1α to promote angiogenesis[J]. Angiogenesis, 2011, 14(4): 515-522. DOI:10.1007/s10456-011-9235-z |
| [13] |
YANCOPOULOS G D, DAVIS S, GALE N W, et al. Vascular-specific growth factors and blood vessel formation[J]. Nature, 2000, 407(6801): 242-248. DOI:10.1038/35025215 |
| [14] |
VEIKKOLA T, ALITALO K. VEGFs, receptors and angiogenesis[J]. Semin Cancer Biol, 1999, 9(3): 211-220. DOI:10.1006/scbi.1998.0091 |
| [15] |
YANG J Y, WEI K Y, WANG Y Q, et al. Construction of a small-caliber tissue-engineered blood vessel using icariin-loaded β-cyclodextrin sulfate for in situ anticoagulation and endothelialization[J]. Sci China Life Sci, 2018, 61(10): 1178-1188. DOI:10.1007/s11427-018-9348-9 |
| [16] |
REKHARSKY M V, INOUE Y. Complexation thermodynamics of cyclodextrins[J]. Chem Rev, 1998, 98(5): 1875-1918. DOI:10.1021/cr970015o |
| [17] |
SZEJTLI J. Medicinal applications of cyclodextrins[J]. Med Res Rev, 1994, 14(3): 353-386. DOI:10.1002/med.2610140304 |
| [18] |
UEKAMA K. Design and evaluation of cyclodextrin-based drug formulation[J]. Chem Pharm Bull, 2004, 52(8): 900-915. DOI:10.1248/cpb.52.900 |
| [19] |
UEKAMA K, HIRAYAMA F, IRIE T. Cyclodextrin drug carrier systems[J]. Chem Rev, 1998, 98(5): 2045-2076. DOI:10.1021/cr970025p |
| [20] |
CHAN R Y, CHEN W F, DONG A, et al. Estrogen-like activity of ginsenoside Rg1 derived from Panax notoginseng[J]. J Clin Endocrinol Metab, 2002, 87(8): 3691-3695. DOI:10.1210/jcem.87.8.8717 |
| [21] |
LU X Z, WANG J H, WU X, et al. Ginsenoside Rg1 promotes bone marrow stromal cells proliferation via the activation of the estrogen receptor-mediated signaling pathway[J]. Acta Pharmacol Sin, 2008, 29(10): 1209-1214. DOI:10.1111/j.1745-7254.2008.00874.x |
| [22] |
BUTTAFOCO L, ENGBERS-BUIJTENHUIJS P, POOT A A, et al. Physical characterization of vascular grafts cultured in a bioreactor[J]. Biomaterials, 2006, 27(11): 2380-2389. DOI:10.1016/j.biomaterials.2005.10.017 |



