2. 400038 重庆, 陆军军医大学(第三军医大学)高原军事医学系:极端环境医学教育部重点实验室;
3. 400038 重庆, 陆军军医大学(第三军医大学)高原军事医学系:全军高原医学重点实验室;
4. 400016 重庆, 重庆医科大学基础医学院干细胞与组织工程研究室病理生理学教研室
2. Key Laboratory of Extreme Environmental Medicine of Ministry of Education, Facalty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of High Altitude Physiology and Pathology, Facalty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
4. Department of Pathophysiology, Department of Stem Cell and Tissue Engineering, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
围绕氧平衡的组织重塑是机体适应缺氧的重要反应,但是过度重塑也会引起多种疾病。缺氧时,肺动脉压增高、呼吸膜增宽变薄等习服表现均是组织重塑的结果。肺动脉壁的过度重塑,引起肺血管壁硬度增加,是引起缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)的关键机制。HPH患者或动物的肺动脉外膜层存在大量成纤维细胞等间质细胞[1-3]。肺血管过度重塑导致HPH持续恶化和难以逆转,其发病机制还不完全清楚[4]。在HPH形成过程中炎症细胞可以从外膜层之外浸润进入外膜层[5]。在动物的肺动脉高压模型中,外膜成纤维细胞能够招募和激活巨噬细胞,部分通过旁分泌IL-6,从而激活STAT3和HIF1信号通路,因此,肺成纤维细胞在HPH有着十分重要的作用。另外,多项研究表明肺成纤维细胞可通过释放多种介质促进其他细胞增殖分化,产生大量的细胞外基质,如Ⅰ型胶原和Ⅲ型胶原[6],在组织重塑中发挥重要作用。
甲酰肽受体(formyl peptide receptors,FPRs)是一个七次跨膜的G蛋白偶联受体(G protein-coupled chemokine receptors,GPCRs)[7-8],它主要有三个成员,FPR1,FPR2和FPR3[9]。FPR1能介导细胞的趋化和细菌甲酰化趋化肽的激活,参与广泛的病理生理过程,包括炎症、伤口愈合、胶质母细胞瘤的发展和宿主对丙型肝炎病毒感染的防御等[7]。FPRs被激活后,不仅可以强烈地介导趋化反应,而且可以促进细胞增殖、分化与分泌。但是,在缺氧条件下,FPR1及其激活物在成纤维细胞中的变化特点目前尚未见报道,在本研究中,我们利用大鼠肺成纤维细胞为模型,从FPRs激活、FPRs的激活物等方面研究了这一问题,探讨缺氧对大鼠成纤维细胞FPR1及其激活物表达的影响,为HPH形成的机制提供新的依据。
1 材料与方法 1.1 实验材料小鼠抗β-actin抗体、兔抗FPR1抗体(Santa cruz公司),小鼠抗Annexin A1抗体(Santa cruz公司),辣根过氧化物酶标记山羊抗小鼠IgG+IgM、辣根过氧化物酶标记山羊抗兔IgG+IgM(中杉金桥生物有限公司),总RNA提取试剂盒(天根生化科技有限公司),PrimeScript cDNA Synthesis Kit和PCR相关产品(宝生物大连工程有限公司),细胞培养用DMEM高糖培养基、胰酶、胎牛血清(Gibco公司),HE染色试剂盒(上海碧云天生物技术有限公司),fMLF和tBoc(Sigma-Aldrich公司),其余常规试剂为国产分析纯。Boyden趋化小室(美国Neuro Probe公司),超净工作台(苏州净化设备厂),CO2培养箱(NUAIR公司),低氧培养箱(Thermo Scientific科技中国有限公司);PCR仪(Bio-Rad公司)。
1.2 实验动物及大鼠肺成纤维细胞的原代培养利用组织块法分离大鼠肺成纤维细胞。取9周龄雌性SD大鼠(由陆军军医大学实验动物中心SPF级动物房提供),腹主动脉放血后处死,无菌术开胸。取肺组织,置于含有100 U/mL青链霉素的PBS中反复冲洗4次,去除血液、脂肪和结缔组织。用眼科剪剪去肺门处的支气管和血管,用含有青链霉素的PBS冲洗1遍,再用组织块剪成1 mm×1 mm×1 mm大小,用眼科镊将组织块均匀放置于培养皿中,每小块间隔5 mm左右。用含10%胎牛血清的DMEM、100 U/mL青链霉素配制成DMEM完全培养基,每48 h换液1次。贴块贴壁72 h后,镜下可见大量成纤维细胞爬出,将组织块去除,继续培养2~3 d,待细胞长满,即可用0.25%胰酶常规消化传代。传代完成后,采用差速贴壁法纯化细胞,细胞贴壁1 h后(即绝大部分成纤维细胞都已经贴壁),弃去未贴壁的细胞和培养液,更换新的培养液,取第3~5代细胞用于实验。
1.3 趋化实验检测大鼠肺成纤维细胞上FPRs的功能性表达使用48孔趋化小室(AP48,美国Neuro Probe公司)来评估细胞的趋化活性。利用不同浓度(0、10、100、1 000 nmol/L)的FPR激动剂(fMLF)30 μL作为趋化剂,趋化上室加入50 μL肺成纤维细胞悬液(1×106/mL),上室与下室之间通过10 μm孔径的聚碳酸酯膜(美国Neuro Probe公司)分离,5% CO2、37 ℃趋化2 h后取下膜刮去上室面细胞,对下室面细胞进行HE染色,用光学显微镜拍照(×400),计算穿过的细胞数,每孔随机选取3个视野取平均值,最后将数据转换为趋化指数(chemotaxis index, CI,即实验组细胞数与0 nmol/L组细胞数的比值)[10]。
1.4 趋化实验检测缺氧对大鼠肺成纤维细胞FPR激活物趋化活性的影响将细胞分为常氧组,缺氧组,分别置常氧培养箱(5% CO2,95%空气,37 ℃)和低氧培养箱(1% O2,5% CO2,94% N2, 37 ℃)中培养24 h,取其培养上清离心去除细胞备用。在趋化下室加入常氧和缺氧各组细胞培养上清30 μL作为趋化剂,趋化上室加入50 μL肺成纤维细胞悬液(1×106/mL),并加入tBoc,后续步骤同1.3。我们使用C表示常氧组或缺氧组的趋化指数,T表示常氧+tBoc组或缺氧+tBoc组的趋化指数,按下面公式计算细胞趋化抑制率(CIFA):CIFA=(C-T)/C×100%,分别得到常氧和缺氧细胞的趋化抑制率。
1.5 细胞缺氧与处理肺成纤维细胞在含10%胎牛血清、100 U/mL青链霉素的DMEM高糖培养基中进行培养,以5×105/mL的密度进行传代培养,接种于60 mm培养皿中,待培养皿中细胞长至约80%后,分别进行以下几种处理:FPR激动剂实验,使用不同浓度(0、10、100、1 000 nmol/L)的FPR激动剂(fMLF),在常氧培养箱中(95%空气, 5% CO2, 37 ℃)孵育30 min后进行后续实验;细胞缺氧实验,将细胞分为缺氧0、2、12、24 h组,缺氧0 h组细胞置常氧培养箱(95%空气、5% CO2、37 ℃)培养,其余各组细胞置低氧培养箱(1% O2、5% CO2、94% N2)中培养后进行后续实验;tBoc抑制实验,将配制好的tBoc加入细胞中,在常氧培养箱中(95%空气、5% CO2、37 ℃)孵育2 h,然后将细胞分为常氧组和缺氧组,分别放入常氧培养箱和低氧培养箱中进行后续实验。
1.6 Western blot检测FPR1、AnxA1蛋白表达水平细胞经Western blot及IP裂解液裂解后(碧云天)提取总蛋白,12 000×g,4 ℃离心10 min后取上清,用BCA法测定蛋白浓度。加入1/4体积的5×loading buffer,100 ℃水浴锅中变性10 min后取40 μg进行SDS-PAGE凝胶电泳(12%的分离胶,5%的浓缩胶),采用湿转将蛋白转移到PVDF膜上,5%脱脂奶粉室温(25 ℃)封闭1 h,分别剪下相应条带加入一抗4 ℃孵育过夜,其中抗β-actin抗体(1:500),抗FPR1抗体(1:500),抗AnAX1抗体(1:500),TBST洗膜3次,每次10 min,加入辣根过氧化物酶标记的山羊抗小鼠或山羊抗兔二抗(1:1 000),室温(25 ℃)摇床孵育1 h,孵育完成后,TBST洗膜3次,每次10 min,加入ECL进行显影,使用凝胶成像系统进行曝光。实验结束后,用Image J图像分析软件对条带进行分析。
1.7 PCR检测FPR1、AnxA1 mRNA水平使用总RNA提取试剂盒(天根)提取成纤维细胞总RNA,用反转录试剂盒(TaKaRa)将mRNA反转录为cDNA,再利用PCR试剂盒进行PCR扩增。PCR反应程序为(反应体系为20 μL):95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火25 s,72 ℃延伸25 s,35个循环后再72 ℃延伸。1.5%的琼脂糖凝胶电泳后观察结果。引物设计如下,FPR1的上游引物为5′-CACCTTTGTGCTTGGAGTCT-3′,下游引物为5′-TAAAATGGCAAAGTGGAGGTG-3′,139 bp;AnxA1上游引物为5′-TCA-TCTGTTCCAAGTCCCT-3′,下游引物为5′-CCTACCCTTCCTTCAATCC-3′,289 bp;β-actin的上游引物为5′-GTGGGCCGCCCTAGGCACCA-3′,下游引物为5′-CGGTTGGCCTTAGGGTTCAGAGGG-3′,245 bp。
1.8 统计学方法采用SPSS 19.0软件进行统计学分析,实验数据用
细胞趋化实验显示,FPR激动剂可引起大鼠成纤维细胞明显的趋化反应。10 nmol/L组趋化的细胞数是0 nmol/L组的(1.145±0.318)倍,无统计学意义(P>0.05);100 nmol/L组引起的趋化反应最强。100、1 000 nmol/L组趋化的细胞数分别是0 nmol/L组的(1.445±0.235)倍和(0.690±0.091)倍,差异具有统计学意义(P < 0.05,图 1)。
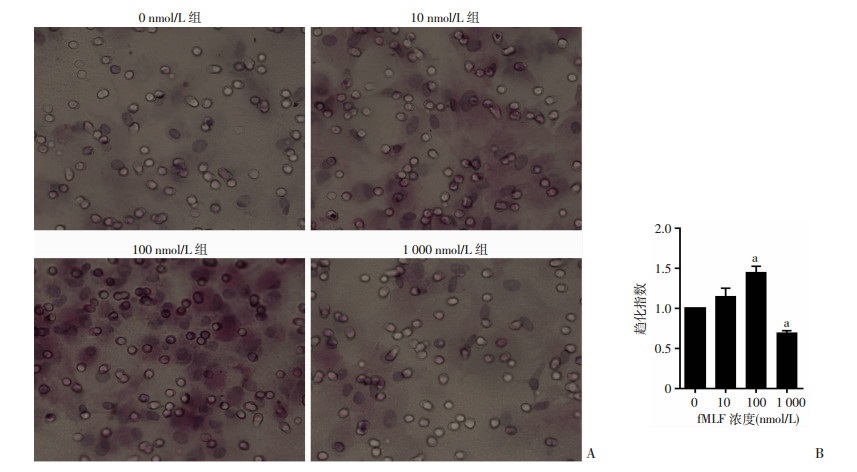
|
|
A: fMLF诱导的趋化B:趋化指数(n=9, |
2.2 缺氧促进大鼠肺成纤维细胞分泌FPR激活物
大鼠肺成纤维细胞缺氧处理后,其培养上清趋化的细胞数是常氧上清组的(1.362±0.199)倍,差异具有统计学意义(P < 0.05)。常氧+tBoc组的培养上清趋化的细胞数较常氧组虽减少,减少8.40%,但无统计学意义(P>0.05);缺氧+tBoc组的培养上清趋化的细胞数较缺氧组显著减少(P < 0.05),减少16.94%,使用FPR拮抗剂tBoc处理,缺氧上清减少程度与常氧上清减少程度之间的差异具有统计学意义(P < 0.05,图 2)。
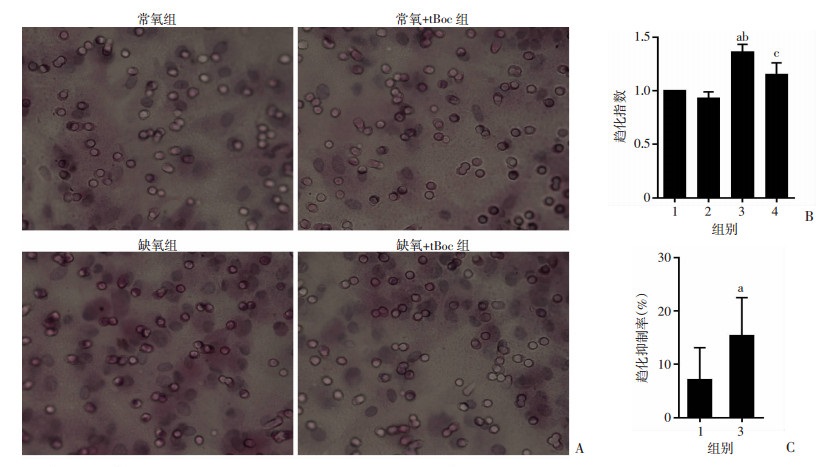
|
|
1:常氧组;2:常氧+tBoc组;3:缺氧组;4:缺氧+tBoc组; A:缺氧上清的趋化活性;B:趋化指数;C:趋化抑制率(n=9, |
2.3 缺氧上调大鼠肺成纤维细胞FPR1、AnxA1蛋白水平和mRNA水平
Western blot结果显示(图 3),大鼠肺成纤维细胞表达FPR1,在1%的缺氧条件下缺氧12 h后FPR1的蛋白表达与缺氧0 h组相比显著增加,差异具有统计学意义(P < 0.05); 缺氧2、24 h组与缺氧0 h组相比差异无统计学意义(P>0.05)。缺氧12、24 h与缺氧0 h组相,AnxA1的蛋白表达显著增加,差异均具有统计学意义(P < 0.05);缺氧2 h与缺氧0 h组相比,虽然蛋白表达增加,但无统计学意义(P>0.05)。PCR结果显示(图 3),肺成纤维细胞缺氧2、12、24 h的FPR1、AnxA1的电泳条带与缺氧0 h组相比显著加深,而内参β-actin的变化不明显,通过灰度分析发现(图 3),缺氧2、12、24 h组FPR1、AnxA1的mRNA水平均较缺氧0 h组显著增加,差异具有统计学意义(P < 0.05)。

|
|
A:Western blot检测结果;B:Western blot电泳结果半定量分析; C: PCR电泳结果;D:PCR电泳半定量分析a:P < 0.05,与0 h组比较
图 3
缺氧对肺成纤维细胞FPR1、AnxA1表达的影响(n=6, |
2.4 fMLF上调肺成纤维细胞FPR1、AnxA1的蛋白水平
随着fMLF浓度的升高,FPR1和AnxA1的蛋白表达水平逐渐增加,100、1 000 nmol/L组与0 nmol/L组相比,具有显著性差异(P < 0.05);10 nmol/L组与0 nmol/L组相比,差异无统计学意义(P>0.05,图 4)。

|
|
1:0 nmol/L组;2:10 nmol/L组; 3: 100 nmol/L组; 4: 1 000 nmol/L组A:Western blot检测结果;B:Western blot电泳结果半定量分析(n=3, |
2.5 FPR拮抗剂tBoc对缺氧大鼠肺成纤维细胞FPR1、AnxA1表达的影响
与常氧组相比,缺氧组细胞中FPR1和AnxA1的蛋白水平升高,差异具有统计学意义(P < 0.05);缺氧+tBoc组与缺氧组相比,FPR1和AnxA1表达水平显著降低,差异具有统计学意义(P < 0.05);缺氧+tBoc组与常氧+tBoc组相比,差异无统计学意义(P>0.05,图 5)。
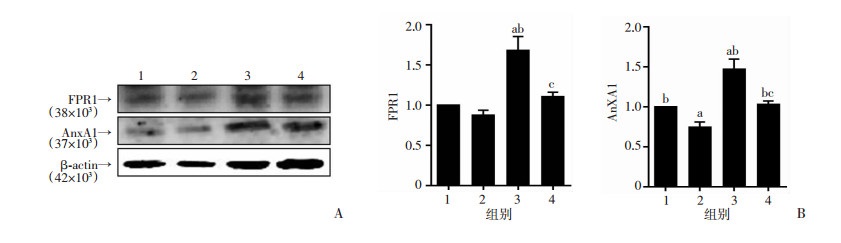
|
|
1:常氧组;2:常氧+tBoc组;3:缺氧组;4:缺氧+tBoc组; A:Western blot检测结果;B:Western blot电泳结果半定量分析(n=3, |
3 讨论
趋化实验显示FPR特异性激动剂fMLF可以引起肺成纤维细胞的趋化反应,100 nmol/L组的趋化反应最为强烈,这符合fMLF引起趋化反应时的典型“钟型”剂量效应曲线。可见,我们分离培养的大鼠肺成纤维细胞表达FPR,且FPR具有介导趋化的功能。1 000 nmol/L组反而使趋化的细胞数显著回降,而且低于0 nmol/L组,其原因可能至少有两种:首先,受体具有高浓度的趋化因子的饱和度,从而消除了任何有意义的梯度,因此降低了细胞的趋化性;第二,暴露于高浓度的激动剂会使化学引诱剂受体发生脱敏,导致对随后的激动剂刺激的反应性降低[11]。我们进一步通过免疫印迹和PCR实验证实,原代培养的大鼠肺成纤维细胞上表达FPR1。FPRs属于G蛋白偶联受体,是一种经典的趋化受体,能够介导强烈的趋化反应。最初发现其主要表达于有吞噬功能的白细胞[12],在肝细胞、星状细胞、肺上皮细胞、单核细胞、巨噬细胞、树突状细胞和小胶质细胞中都有表达[13-15],提示FPR可能具有更复杂的功能。这些受体在宿主防御和炎症反应中起重要作用,当激动剂将其激活后,能使细胞活化,引起趋化运动和炎症介质的释放等生物学效应。缺氧后肺成纤维细胞FPR1表达上调可能与氧感受信号途径有关,也可能是肺成纤维细胞自分泌的其他物质作用的结果。
肺成纤维细胞上的FPR在缺氧时发挥作用需要相应的激活物或配体进行激活。我们的研究结果发现,成纤维细胞缺氧培养上清可以诱导强烈的趋化反应,而且此趋化反应可以被FPR拮抗剂所抑制,说明在缺氧时,大鼠肺成纤维细胞释放了FPR的激活物。在缺氧条件下,组织或细胞会释放大量的化学物质,无论是作为刺激主动分泌的物质,还是作为损伤因素被动释放的物质,都会对细胞产生一定的影响,如HMGB1和线粒体DNA,可激活Toll样受体(TLR),从而诱导各种病理生理反应,包括高原习服、创伤愈合、动脉粥样硬化等。线粒体被认为是一种寄生在体内的古生菌进化而来的,具有细菌的属性。受损的线粒体或功能不足的线粒体,如果不被及时处理,可释放甲酰化肽,激活FPRs介导的信号通路[16]。因此,与其他化学引诱剂不同,N-甲酰肽可以是内源性的,如线粒体蛋白或破裂的宿主细胞。除此之外,其他内源性的蛋白或多肽也可以是FPR的激活物,如AnxA1。有文献[17]报道,AnxA1可释放到细胞外,参与炎症反应。在1%的氧浓度下12 h,大鼠肺成纤维细胞上的AnxA1表达增多,但是AnxA1的启动子区域没有缺氧反应元件,可能是其它原因。由于其在细胞培养上清中的含量很低,所以不能检测其在缺氧上清中的变化。除了AnxA1这种激活物以外,细胞是否还释放了其他FPR激活物?这些激活物发挥怎样的作用?另外,FPR拮抗剂并没有完全消除缺氧对培养上清趋化活性的增强作用,说明缺氧还可刺激其他趋化活性物质的产生,这些物质是什么?均有待下一步的实验研究。
通过人工合成获得的fMLF是第一个外源性的FPR特异性激动剂。我们用fMLF刺激肺成纤维细胞,发现其可以上调FPR1与AnxA1的表达。而且,当用FPR特异性拮抗剂处理成纤维细胞后,缺氧对FPR1、AnxA1表达的上调作用被削弱。因此,我们认为细胞在缺氧条件下FPR可以被自分泌的激活物如AnxA1所激活,再进一步促进FPR与AnxA1的表达,形成正反馈,使FPR信号及功能活性放大。当激活物与FPR结合时,FPRs会发生构象变化,通过G蛋白、酪氨酸蛋白激酶等介导的多种信号通路,如AKT、PI3K、p38、ERK等,在细胞向感染部位和炎症部位迁移以及细胞的增殖、分泌、分化等事件中发挥作用[18]。现已证明AnxA1能抑制核因子NFκb的激活和促炎性细胞因子的产生。据报道,使用AnxA1(或由AnxA1的N末端包含残基2-26的肽AC2-26)进行治疗可保持AnxA1蛋白的抗炎活性,从而对一系列炎症疾病提供保护,如内毒素血症、结肠炎、关节炎和缺血再灌注中心脏、肝脏、肾脏和大脑的损伤[19-20]。
缺氧可引起肺血管收缩,血流阻力增大,从而引起肺动脉压力增高。持续的肺动脉高压还伴有肺血管壁的结构改建,即血管壁增厚,管腔狭窄,从而引起肺动脉压进一步升高。在肺血管改建的过程中,除了通常认为的肺血管内皮细胞和平滑肌细胞外,肺成纤维细胞也在缺氧性肺血管收缩中发挥重要作用。肺成纤维细胞是组成肺血管的重要细胞,在刺激因素的作用下,能快速增殖、迁移,合成大量的细胞外基质,并分泌细胞因子和生长因子等。低氧可能会诱导其表型发生变化,使其分化为肌成纤维细胞,趋化迁移至炎症灶,同时合成的Ⅰ型胶原和Ⅲ型胶原增多,促进与其他细胞的相互作用,加速血管重塑和肺动脉高压的形成。我们的研究结果表明,在缺氧条件下,肺成纤维细胞上调FPR水平,并释放激活物,这些激活物可以激活自身或其他细胞上的FPR,促进细胞表达或释放FPR激活物AnxA1。后者进一步上调FPR及其激活物水平,放大FPR的作用。因此,我们认为缺氧时肺组织(包括常驻肺部的成纤维细胞)分泌多种FPR激活物,引起肺组织其他区域以及血液中的成纤维细胞、炎症细胞趋化至肺组织周围,在FPR的介导下,这些常驻的或外来的成纤维细胞、炎症细胞进一步增殖、分化,并分泌一些趋化因子募集更多的细胞参与炎症反应与组织重塑。成纤维细胞则可以合成分泌大量的细胞外基质。有研究[21]指出,缺氧时肺组织其他细胞(如血管内皮细胞)被激活,随之产生大量的活性物质,从而使肺成纤维细胞发生表型的转变,分泌细胞外基质成分。在缺氧时,肺血管内皮细胞、平滑肌细胞等来源的FPR激活物在肺成纤维细胞趋化至炎症灶,参与组织重塑过程中可能也发挥重要的作用。这些细胞产生哪些活性物质,是否含有FPR激活物,在哪一阶段发挥作用等,有待下一步的实验证实。成纤维细胞参与的组织重塑反应,如果适度,则产生对机体有利的效果;如果过度,则可产生不利效果; 例如缺氧时肺血管外膜层积累大量成纤维细胞等间质细胞并产生大量细胞基质,会造成肺动脉壁硬化,形成缺氧性肺动脉高压。因此,针对FPR这一新靶点,可以设计相应干预措施,适时适度地控制成纤维细胞的数量与活性,对构建缺氧性肺动脉高压等疾病的防治措施有较好的实用价值。
| [1] |
PUGLIESE S C, POTH J M, FINI M A, et al. The role of inflammation in hypoxic pulmonary hypertension: from cellular mechanisms to clinical phenotypes[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(3): L229-L252. DOI:10.1152/ajplung.00238.2014 |
| [2] |
PUGLIESE S C, KUMAR S, JANSSEN W J, et al. A time- and compartment-specific activation of lung macrophages in hypoxic pulmonary hypertension[J]. J Immunol, 2017, 198(12): 4802-4812. DOI:10.4049/jimmunol.1601692 |
| [3] |
LUO Y, DONG H Y, ZHANG B, et al. MiR-29a-3p attenuates hypoxic pulmonary hypertension by inhibiting pulmonary adventitial fibroblast activation[J]. Hypertension, 2015, 65(2): 414-420. DOI:10.1161/HYPERTENSIONAHA.114.04600 |
| [4] |
ZHANG N, DONG M Q, LUO Y, et al. Danshensu prevents hypoxic pulmonary hypertension in rats by inhibiting the proliferation of pulmonary artery smooth muscle cells via TGF-β-smad3-associated pathway[J]. Eur J Pharmacol, 2018, 820: 1-7. DOI:10.1016/j.ejphar.2017.12.010 |
| [5] |
EL KASMI K C, PUGLIESE S C, RIDDLE S R, et al. Adventitial fibroblasts induce a distinct proinflammatory/profibrotic macrophage phenotype in pulmonary hypertension[J]. J Immunol, 2014, 193(2): 597-609. DOI:10.4049/jimmunol.1303048 |
| [6] |
WANG X, LIN L J, CHAI X Y, et al. Hypoxic mast cells accelerate the proliferation, collagen accumulation and phenotypic alteration of human lung fibroblasts[J]. Int J Mol Med, 2020, 45(1): 175-185. DOI:10.3892/ijmm.2019.4400 |
| [7] |
ZHANG L, WANG H Y, YANG T S, et al. Formylpeptide receptor 1 mediates the tumorigenicity of human hepatocellular carcinoma cells[J]. Oncoimmunology, 2016, 5(2): e1078055. DOI:10.1080/2162402X.2015.1078055 |
| [8] |
LIU M Y, CHEN K Q, YOSHIMURA T, et al. Formylpeptide receptors mediate rapid neutrophil mobilization to accelerate wound healing[J]. PLoS ONE, 2014, 9(6): e90613. DOI:10.1371/journal.pone.0090613 |
| [9] |
WANG G, ZHANG L, CHEN X X, et al. Formylpeptide receptors promote the migration and differentiation of rat neural stem cells[J]. Sci Rep, 2016, 6: 25946. DOI:10.1038/srep25946 |
| [10] |
POISSONNIER A, LEGEMBRE P. Boyden chamber assay to study of cell migration induced by metalloprotease cleaved-CD95L[J]. Methods Mol Biol, 2017, 1557: 117-123. DOI:10.1007/978-1-4939-6780-3_12 |
| [11] |
YE R D, BOULAY F, WANG J M, et al. International Union of Basic and Clinical Pharmacology. LXXⅢ. Nomenclature for the formyl peptide receptor (FPR) family[J]. Pharmacol Rev, 2009, 61(2): 119-161. DOI:10.1124/pr.109.001578 |
| [12] |
LEE H Y, JEONG Y S, LEE M, et al. Intracellular formyl peptide receptor regulates na-ve CD4 T cell migration[J]. Biochem Biophys Res Commun, 2018, 497(1): 226-232. DOI:10.1016/j.bbrc.2018.02.060 |
| [13] |
CHEN K Q, BAO Z Y, GONG W H, et al. Regulation of inflammation by members of the formyl-peptide receptor family[J]. J Autoimmun, 2017, 85: 64-77. DOI:10.1016/j.jaut.2017.06.012 |
| [14] |
SCHEPETKIN I A, KHLEBNIKOV A I, GIOVANNONI M P, et al. Development of small molecule non-peptide formyl peptide receptor (FPR) ligands and molecular modeling of their recognition[J]. Curr Med Chem, 2014, 21(13): 1478-1504. DOI:10.2174/0929867321666131218095521 |
| [15] |
HARIDAS V, SHETTY P, SARATHKUMAR E, et al. Reciprocal regulation of pro-inflammatory Annexin A2 and anti-inflammatory Annexin A1 in the pathogenesis of rheumatoid arthritis[J]. Mol Biol Rep, 2019, 46(1): 83-95. DOI:10.1007/s11033-018-4448-5 |
| [16] |
CAI Y Q, HUANG J, XING H Y, et al. Contribution of FPR and TLR9 to hypoxia-induced chemoresistance of ovarian cancer cells[J]. Onco Targets Ther, 2019, 12: 291-301. DOI:10.2147/OTT.S190118 |
| [17] |
OKANO M, KUMAMOTO K, SAITO M, et al. Upregulated Annexin A1 promotes cellular invasion in triple-negative breast cancer[J]. Oncol Rep, 2015, 33(3): 1064-1070. DOI:10.3892/or.2015.3720 |
| [18] |
LIAO W I, WU S Y, WU G C, et al. Ac2-26, an annexin A1 peptide, attenuates ischemia-reperfusion-induced acute lung injury[J]. Int J Mol Sci, 2017, 18(8): E1771. DOI:10.3390/ijms18081771 |
| [19] |
ZOU Z, ZUO D, YANG J, et al. The ANXA1 released from intestinal epithelial cells alleviate DSS-induced colitis by improving NKG2A expression of Natural Killer cells[J]. Biochem Biophys Res Commun, 2016, 478(1): 213-220. DOI:10.1016/j.bbrc.2016.07.066 |
| [20] |
SENCHENKOVA E Y, ANSARI J, BECKER F, et al. Novel role for the AnxA1-Fpr2/ALX signaling Axis as a key regulator of platelet function to promote resolution of inflammation[J]. Circulation, 2019, 140(4): 319-335. DOI:10.1161/CIRCULATIONAHA.118.039345 |
| [21] |
刘艳华, 李宾公, 王裕勤, 等. 敲低Runt相关转录因子3(RUNX3)抑制低氧诱导的内皮细胞间质转分化[J]. 细胞与分子免疫学杂志, 2016, 32(12): 1627-1631. LIU Y H, LI B G, WANG Y Q, et al. Knockdown of RUNX3 inhibits hypoxia-induced endothelial-to-mesenchymal transition of human cardiac microvascular endothelial cells[J]. Chin J Cell Mol Immunol, 2016, 32(12): 1627-1631. DOI:10.13423/j.cnki.cjcmi.007979 |



