在所有经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的冠脉病变中,冠状动脉分叉病变约占15%~20%[1],其手术操作难度大,术后远期预后差,不良心血管事件发生率高[2]。冠脉分叉病变介入治疗术中抗凝药物的使用,对减少冠脉分叉病变围手术期不良事件发生具有重要作用[3]。
比伐卢定是一种新型的直接凝血酶抑制剂[4],已被广泛用于心血管抗栓治疗。既往多项研究表明:与普通肝素相比,比伐卢定能够明显减少临床出血事件,而并不增加缺血风险[5-6]。近期基于中国冠脉介入治疗人群的BRIGHT研究也显示:比伐卢定的抗凝疗效不劣于普通肝素且显著减少了总体出血事件。然而,既往研究多是针对冠脉介入治疗总体人群,缺乏对冠状动脉分叉病变人群冠脉介入治疗围手术期抗凝策略的研究。因此,本研究观察比伐卢定应用于冠状动脉分叉病变介入治疗中的有效性和安全性,为临床用药积累研究数据。
1 资料与方法 1.1 一般资料本研究为回顾性队列研究,连续纳入2016年1-12月于本科经冠脉造影明确的冠脉分叉病变介入治疗患者。入选标准为:①18岁 < 年龄 < 80岁,性别不限;②分叉病变定义为病变在冠状动脉分叉处,且狭窄≥50%,病变同时或单独累及主支和分支,主支血管直径≥2.5 mm,分支血管直径≥2.0 mm;③分叉病变主支支架植入(单支架植入)。排除标准:①冠状动脉造影后适合行冠脉搭桥术治疗的患者;②对非罪犯血管需要在30 d内行血运重建者;③长期服用华法林治疗者或PCI术前4 h内静脉注射过普通肝素者;④PCI术前48 h内行溶栓再灌注治疗者;⑤有明显出血倾向及活动性出血不宜行PCI者;⑥活动性胃溃疡, 溃疡性结肠炎或其他可能导致2次出血疾病的患者;⑦患有心包炎、主动脉夹层、亚急性感染性心内膜炎者;⑨严重粒细胞减少和血小板缺乏不宜行PCI者,或有肝素诱导的血小板减少症病史者;⑧目前没有控制的严重高血压(≥180/110 mmHg)患者;⑨肝功谷丙转氨酶或谷草转氨酶大于正常值3倍以上(不包括因心肌梗死或心力衰竭导致肝功能异常),利用MDRD法计算肾功能eGFR<30 mL/min;⑩近1个月内有深部穿刺病史者;⑪对肝素类或生物制品过敏者;⑫孕妇、哺乳期或有生育计划女性;⑬恶性肿瘤患者;⑭既往有颅内肿瘤病史或脑血管畸形者。
研究对象按冠脉介入治疗时抗凝方案的不同,分为肝素组和比伐卢定组;肝素组178例患者,中位年龄65岁,男性140例,占78.7%;比伐卢定组151例患者,中位年龄65岁,男性119例,占78.8%。研究对象均接受双联抗血小板治疗和他汀治疗,双联抗血小板药物为阿司匹林+氯吡格雷或阿司匹林+替格瑞洛,且双联抗血小板时间不少于12个月。比伐卢定为深圳信立泰药业股份有限公司产品(商品名为泰加宁,0.25 g/瓶)。比伐卢定组:在术前首先静脉给予比伐卢定负荷量(0.75 mg/kg),然后以1.75 mg/(kg·h)持续静脉点滴4 h。普通肝素组:术前静脉内注入普通肝素100 U/kg。
1.2 资料收集、录入收集患者的一般资料,包括人口学数据、既往病史、诊疗史及用药史等,同时录入住院期间的实验室检测指标。冠脉病变影像学资料来源于心导管室的冠脉造影数据,分叉病变分型采用国际通用的Medina分型标准,分型的3位数字分别代表主支近段病变、主支远端病变和分支病变,有无存在病变以1或0进行表示,0.1.1、1.0.1、1.1.1这三种分型为真分叉病变。冠脉分叉病变数据由2名经验丰富的介入医师进行测量与评估,分别录入分叉病变的位置、分型、主支/分支病变长度、主支/分支血管直径、主支支架长度和主支支架直径。
1.3 随访与结局利用电话访谈和门诊随访的方式对研究对象进行预后随访。随访起始于患者入院时,限定随访期限为12个月,末次随访时间为2017年12月。观察比伐卢定对冠脉分叉病变介入治疗人群的有效性和安全性,有效性终点包括心源性死亡、心肌梗死、卒中及支架内血栓形成在内的主要不良心血管事件(major adverse cardiovascular events, MACE),安全性终点包括出血事件和主要出血事件。心肌梗死的定义参照国际指南共识;卒中定义为至少超过24 h的持续神经功能缺损,而不考虑相关症状是否由缺血或出血事件造成;支架内血栓的定义参照国际研究共识,包括确定和疑似的支架内血栓形成。出血事件包括BARC出血标准的各种类型,而BARC分级≥3的出血事件则被视为主要出血事件。
1.4 统计学分析采用SPSS 24.0统计软件。采用Kolmogorov-Simironov方法检验计量数据的正态分布,符合正态分布的连续变量以x±s表示,不符合正态分布的连续变量以中位数(P25-P75)表示,分类变量以频数(%)表示。在组间比较中,分类变量采用χ2或Fisher精确概率法进行检验,正态分布且方差齐性的连续变量采用t检验,非正态分布的连续变量采用Mann-Whitney U检验。多因素分析采用Cox回归模型,将性别、年龄、高血压、糖尿病、高血脂、吸烟史、是否为ACS、分叉病变位置(是否位于左主干、前降支、回旋支或右冠)、是否为真分叉病变、是否服用替格瑞洛等变量纳入多元模型进行校正,并根据校正结果绘出结局事件的累积风险曲线。检验水准:α=0.05。
2 结果 2.1 一般资料两组患者在人口学资料、既往病史、ACS比例、重要实验室指标和药物治疗方面基线数据差异无统计学意义(表 1)。
| 临床特征 | 肝素组(n=178) | 比伐卢定组(n=151) | t/Z/χ2值 | P值 |
| 年龄/岁 | 65(55-71) | 65(56-71) | -0.002 | 0.998 |
| 男性 | 140(78.7) | 119(78.8) | 0.001 | 0.972 |
| BMI/kg·m-2 | 24.4(22.0-26.6) | 24.6(22.8-26.9) | -1.256 | 0.209 |
| 吸烟史 | 88(49.7) | 89(58.9) | 4.198 | 0.123 |
| 糖尿病 | 46(25.8) | 46(30.5) | 0.866 | 0.352 |
| 高血压 | 100(56.5) | 91(60.3) | 0.476 | 0.490 |
| 高血脂 | 40(22.5) | 40(26.5) | 0.717 | 0.397 |
| 收缩压/mmHg | 130.3±20.1 | 132.5±21.6 | -0.926 | 0.355 |
| 舒张压/mmHg | 76.1±12.2 | 79.6±11.7 | -2.633 | 0.009 |
| 既往心梗 | 20(11.2) | 10(6.6) | 2.098 | 0.147 |
| 既往冠脉介入治疗 | 25(14.0) | 13(8.6) | 2.363 | 0.124 |
| ACS | 176(98.9) | 148(98.0) | 0.407 | 0.524 |
| 肌酐(μmol/L) | 78.1(68.0-90.2) | 76.4(65.2-90.1) | -0.779 | 0.436 |
| 空腹血糖/mmol·L-1 | 5.12(4.64-6.04) | 5.14(4.66-6.09) | -0.228 | 0.820 |
| BNP/pmol·L-1 | 47.1(20.6-155.2) | 80.5(22.0-252.0) | -1.877 | 0.06 |
| 替格瑞洛 | 115(64.6) | 83(55.0) | 3.168 | 0.075 |
| ACEI/ARB | 136(76.4) | 128(84.8) | 3.605 | 0.058 |
| β-受体阻滞剂 | 135(75.8) | 110(72.8) | 0.385 | 0.535 |
| BMI:体质量指数;ACS:急性冠脉综合征;BNP:B型钠尿肽;ACEI/ARB:血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂 | ||||
2.2 两组患者冠脉分叉病变特征
在分叉病变特征方面,两组患者的分叉病变位置、分叉病变类型、真分叉比例、主支及分支血管的长度和直径差异均无统计学意义(表 2)。
| 冠脉分叉病变情况 | 肝素组 (n=178) |
比伐卢定组 (n=151) |
t/Z/χ2值 | P值 |
| 分叉部位 | ||||
| LM/LAD/LCX | 32(18.0) | 20(13.2) | 1.375 | 0.241 |
| LAD/对角支 | 109(61.2) | 105(69.5) | 2.476 | 0.116 |
| LCX/钝缘支 | 21(11.8) | 14(9.3) | 0.548 | 0.459 |
| 右冠远端 | 16(9.0) | 12(7.9) | 0.114 | 0.736 |
| Medina分型 | ||||
| 0.1.0 | 25(14.0) | 13(8.6) | 2.363 | 0.124 |
| 0.1.1 | 18(10.1) | 27(17.9) | 4.176 | 0.041 |
| 1.0.0 | 11(6.2) | 9(6.0) | 0.007 | 0.934 |
| 1.0.1 | 16(9.0) | 13(8.6) | 0.015 | 0.904 |
| 1.1.0 | 30(16.9) | 19(12.6) | 1.176 | 0.278 |
| 1.1.1 | 78(43.8) | 70(46.4) | 0.213 | 0.645 |
| 真分叉病变 | 113(63.5) | 110(72.8) | 3.281 | 0.070 |
| 主支病变长度/mm | 14.67±6.10 | 14.98±5.74 | -0.477 | 0.633 |
| 分支病变长度/mm | 8.68±4.83 | 9.99±4.64 | -2.500 | 0.013 |
| 主支血管直径/mm | 3.04±0.43 | 3.04±0.39 | -0.011 | 0.991 |
| 分支血管直径/mm | 2.43±0.45 | 2.39±0.41 | 0.885 | 0.377 |
| 主支支架长度/mm | 21.29±5.75 | 21.06±6.21 | 0.351 | 0.726 |
| 主支支架直径/mm | 3.52±4.32 | 3.80±6.16 | 0.447 | 0.634 |
| LM:冠脉左主干;LAD:左冠前降支;LCX:左冠回旋支 | ||||
2.3 两组患者PCI术后24 h内及术后1周心血管事件及出血事件
两组患者PCI术后24 h内及术后1周,肝素及比伐卢定组均无MACE事件发生,肝素组有3例患者出现出血事件(为穿刺处血肿形成),无主要出血事件发生;比伐卢定组有5例患者出现出血事件(其中2例为牙龈出血、2例为皮肤黏膜出血、1例为穿刺处血肿形成),主要出血事件1例(消化道出血);两组间差异无统计学意义(P=0.477,P=0.459)。
2.4 两组患者PCI术后12个月心血管事件及出血事件随访12个月后,肝素组有20例患者出现MACE,比伐卢定组有15例患者出现MACE,在校正了可能对心血管结局有重要影响的临床变量后,多因素分析显示:比伐卢定对分叉病变PCI术后的MACE较肝素组差异无统计学意义(HR=0.839,95%CI:0.420~1.676,P=0.619)。
随访12个月后,肝素组有49例患者出现出血事件,主要出血事件6例;比伐卢定组有27例患者出现出血事件,主要出血事件3例;多因素分析显示:比伐卢定较肝素显著减少分叉病变介入术后患者出血事件的风险(HR=0.557,95%CI:0.355~0.937,P=0.026);而在主要出血事件风险方面,二者之间差异无统计学意义(HR=0.535, 95%CI:0.130~2.206,P=0.387,表 3)。
| 因素 | 肝素组 (n=178) |
比伐卢定组 (n=151) |
HR(95%CI) | P值 |
| MACE | 20(11.2) | 15(9.9) | 0.839(0.420~1.676) | 0.619 |
| 心源性死亡 | 3(1.7) | 3(2.0) | 0.985(0.172~5.631) | 0.986 |
| 心肌梗死 | 11(6.2) | 8(5.3) | 0.872(0.336~2.260) | 0.778 |
| 卒中 | 3(1.7) | 2(1.3) | 0.516(0.055~4.887) | 0.564 |
| 支架内血栓 | 4(2.2) | 3(2.0) | 0.152(0.017~1.350) | 0.091 |
| 出血事件 | 49(27.5) | 27(17.9) | 0.577(0.355~0.937) | 0.026 |
| 主要出血事件 | 6(3.4) | 3(2.0) | 0.535(0.130~2.206) | 0.387 |
2.5 两组患者PCI术后12个月心血管事件和出血事件的累积风险曲线
随访12个月后,比伐卢定组MACE的累积风险与肝素组比较差异无统计学意义(P=0.619);比伐卢定组出血事件累积风险较肝素组显著降低(P=0.026,图 1)。
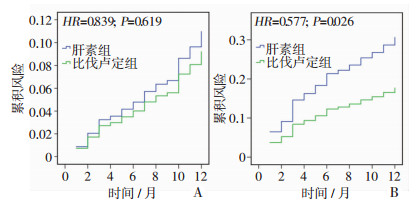
|
| A:主要不良心血管事件;B:出血事件 图 1 两组患者PCI术后12个月主要不良心血管事件和出血事件的累积风险曲线 |
3 讨论
冠状动脉分叉病变占所有PCI治疗总量的15%~20%,其手术操作难度大,术后远期预后差,不良心血管事件发生率高[2]。冠脉分叉病变介入治疗术中抗凝药物的使用,对减少冠脉分叉病变围手术期不良事件发生具有重要作用[3]。
比伐卢定中的水蛭素衍生物是发挥抗凝作用的主要成分[7],通过直接抑制凝血酶来达到抗凝血的作用,并且也可以抑制已经与血栓结合的凝血酶,具有高的特异性。比伐卢定可以可逆性地抑制凝血酶,其半衰期较短,在抗凝后其结果预测非常准确[8]。由于比伐卢定的半衰期较短(T1/2为25 min),药物起效以及降解均很快, 经注射后5 min内抗凝效果就可以达到顶峰,停药1 h左右, 患者的凝血功能就会恢复到正常状态。因此针对出血高风险患者,使用比伐卢定可降低MACE发生率,从而使患者获益[9]。比伐卢定降解的途径主要有两种,即通过肾脏清除和蛋白降解酶从血浆中清除,因此肾功能受到损害的心肌梗死患者也可以安全地使用[10-11]。
既往包括HEAT-PPCI、HORIZONS-AMI、EUROMAX等在内的多项随机对照临床试验比较了比伐卢定和肝素在冠脉介入治疗中的有效性和安全性,结果表明:与普通肝素相比,比伐卢定能够显著减少临床出血事件,而并不增加MACE事件发生率[5-6]。近期基于中国PCI治疗人群的BRIGHT研究也显示:比伐卢定的抗凝疗效不劣于普通肝素且显著减少了总体出血事件。其中,ACUITY研究显示:在中高危的非ST段抬高型ACS患者中,与使用肝素(UFH)与糖蛋白Ⅱb/Ⅲa抑制剂(GPI)联用组相比,单独应用比伐卢定组1年随访出血事件降低而缺血性事件发生率无差异,总临床终点(缺血性或严重出血事件的总和)发生率显著降低[12]。HORIZONS-AMI研究显示:在急性ST抬高心梗行直接冠脉介入治疗的患者中,单用比伐卢定组较普通肝素与GPI联用组30 d大出血以及不良反应事件均显著降低[13];3年随访结果显示比伐卢定优势仍然显著[14-15]。BRIGHT研究显示:在急性心梗患者中,比伐卢定与肝素和肝素+替罗非班治疗组,死亡、心梗、靶血管事件和缺血性中风发生率3组间差异无统计学意义,但比伐卢定(围手术期延时注射)显著降低严重出血风险。上述研究分别探讨了比伐卢定在非ST段抬高型ACS、STEMI等冠脉疾病人群中的应用,研究结果均显示比伐卢定不增加冠脉介入治疗术后MACE发生率,而显著降低出血风险。然而,既往研究多是针对PCI治疗总体人群,缺乏对冠状动脉分叉病变人群CPI治疗围手术期抗凝策略的研究。因此,本研究对比伐卢定应用于冠状动脉分叉病变介入治疗中的有效性和安全性开展研究。
本研究结果也表明:在特定的冠脉复杂分叉病变人群中,比伐卢定的有效性和安全性与既往研究结果一致。近期发布的临床指南虽然将比伐卢定的推荐级别下调,然而临床实践具有复杂性,抗栓治疗策略个体差异性大,本研究探讨了基于冠脉复杂病变(分叉病变)的围手术期抗凝策略,提示比伐卢定的抗栓效果不劣于普通肝素,但显著减少出血风险。这显示在特定的冠脉介入治疗人群围手术期的抗凝治疗中,比伐卢定较肝素仍具有独特的竞争优势,而且基于指南的个体化抗凝策略也应该被重视。
比伐卢定在冠脉介入治疗中确切的抗栓效应可以归因于:①无需抗凝血酶参与而直接抑制凝血酶活性[11, 16];②能同时抑制可溶性和与血栓结合的凝血酶[17];③不与血浆蛋白结合,更容易预测其抗凝效果[18-19];其减少出血事件可能归因于抑制作用短暂而具有可逆性[20],同时在介入术中通过检测APTT和ACT能够灵活的应用比伐卢定。本研究结果显示:在冠状动脉分叉病变介入治疗人群中,比代卢定在术后24 h内及1周内,抗凝疗效不劣于普通肝素,且不增加MACE和出血事件发生;随访12个月,比伐卢定较普通肝素显著降低出血风险,而并不增加MACE事件发生率。
综上所述,比伐卢定在冠脉分叉病变围手术期具有确切的抗凝疗效,特别针对高出血风险的患者是一个可靠的选择。然而冠脉复杂病变冠脉介入治疗围手术期的抗凝策略仍然需要充分论证和个体化评估。本研究也存在包括诸如回顾性研究、小样本、单中心、随访时间短等局限性,其结论有待前瞻性、多中心、大样本的研究予以验证。
| [1] |
LASSEN J F, BURZOTTA F, BANNING A P, et al. Percutaneous coronary intervention for the left main stem and other bifurcation lesions: 12th consensus document from the European Bifurcation Club[J]. Euro Intervention, 2018, 13(13): 1540-1553. DOI:10.4244/EIJ-D-17-00622 |
| [2] |
LASSEN J F, HOLM N R, BANNING A, et al. Percutaneous coronary intervention for coronary bifurcation disease: 11th consensus document from the European Bifurcation Club[J]. EuroIntervention, 2016, 12(1): 38-46. DOI:10.4244/EIJV12I1A7 |
| [3] |
BANNING A P, LASSEN J F, BURZOTTA F, et al. Percutaneous coronary intervention for obstructive bifurcation lesions: the 14th consensus document from the European Bifurcation Club[J]. EuroIntervention, 2019, 15(1): 90-98. DOI:10.4244/EIJ-D-19-00144 |
| [4] |
QADERDAN K, VOS G A, MCANDREW T, et al. Outcomes in elderly and young patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention with bivalirudin versus heparin: Pooled analysis from the EUROMAX and HORIZONS-AMI trials[J]. Am Heart J, 2017, 194: 73-82. DOI:10.1016/j.ahj.2017.08.009 |
| [5] |
SANBORN T A, TOMEY M I, MEHRAN R, et al. Femoral vascular closure device use, bivalirudin anticoagulation, and bleeding after primary angioplasty for STEMI: results from the HORIZONS-AMI trial[J]. Catheter Cardiovasc Interv, 2015, 85(3): 371-379. DOI:10.1002/ccd.25663 |
| [6] |
GUERCHICOFF A, STONE G W, MEHRAN R, et al. Analysis of biomarkers for risk of acute kidney injury after primary angioplasty for acute ST-segment elevation myocardial infarction: results of the HORIZONS-AMI trial[J]. Catheter Cardiovasc Interv, 2015, 85(3): 335-342. DOI:10.1002/ccd.25620 |
| [7] |
STONE G W, MEHRAN R, GOLDSTEIN P, et al. Bivalirudin versus heparin with or without glycoprotein IIb/IIIa inhibitors in patients with STEMI undergoing primary percutaneous coronary intervention: pooled patient-level analysis from the HORIZONS-AMI and EUROMAX trials[J]. J Am Coll Cardiol, 2015, 65(1): 27-38. DOI:10.1016/j.jacc.2014.10.029 |
| [8] |
PATEL H, GARRIS R, BHUTANI S, et al. Bivalirudin versus heparin during percutaneous coronary intervention in patients with acute myocardial infarction[J]. Cardiol Res, 2019, 10(5): 278-284. DOI:10.14740/cr921 |
| [9] |
BHOGAL S, MUKHERJEE D, BAGAI J, et al. Bivalirudin versus heparin during intervention in acute coronary syndrome: A systematic review of randomized trials[J]. Cardiovasc Hematol Disord Drug Targets, 2019. DOI: 10.2174/1871529X19666190626124057.[Epubaheadofprint]
|
| [10] |
COHEN D J, BAKHAI A, SHI C X, et al. Cost-effectiveness of sirolimus-eluting stents for treatment of complex coronary stenoses: results from the sirolimus-eluting balloon expandable stent in the treatment of patients with de novo native coronary artery lesions (SIRIUS) trial[J]. Circulation, 2004, 110(5): 508-514. DOI:10.1161/01.CIR.0000136821.99814.43 |
| [11] |
OLMEDO W, VILLABLANCA P A, SANINA C, et al. Bivalirudin versus heparin in patients undergoing percutaneous peripheral interventions: A systematic review and meta-analysis[J]. Vascular, 2019, 27(1): 78-89. DOI:10.1177/1708538118807522 |
| [12] |
NDREPEPA G, NEUMANN F J, DELIARGYRIS E N, et al. Bivalirudin versus heparin plus a glycoprotein IIb/IIIa inhibitor in patients with non-ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention after clopidogrel pretreatment: pooled analysis from the ACUITY and ISAR-REACT 4 trials[J]. Circ Cardiovasc Interv, 2012, 5(5): 705-712. DOI:10.1161/CIRCINTERVENTIONS.112.972869 |
| [13] |
NIKOLSKY E, MEHRAN R, DANGAS G D, et al. Cerebrovascular events after a primary percutaneous coronary intervention strategy for acute ST-segment-elevation myocardial infarction: analysis from the HORIZONS-AMI trial[J]. Circ Cardiovasc Interv, 2015, 8(4): e002283. DOI:10.1161/CIRCINTERVENTIONS.114.002283 |
| [14] |
MADHAVAN M V, GÉNÉREUX P, KIRTANE A J, et al. Is routine post-procedural anticoagulation warranted after primary percutaneous coronary intervention in ST-segment elevation myocardial infarction? Insights from the HORIZONS-AMI trial[J]. Eur Heart J Acute Cardiovasc Care, 2017, 6(7): 650-658. DOI:10.1177/2048872615592246 |
| [15] |
BRENER S J, MEHRAN R, LANSKY A J, et al. Pretreatment with aspirin in acute coronary syndromes: Lessons from the ACUITY and HORIZONS-AMI trials[J]. Eur Heart J Acute Cardiovasc Care, 2016, 5(5): 449-454. DOI:10.1177/2048872615624848 |
| [16] |
VENETSANOS D, LAWESSON S S, JAMES S, et al. Bivalirudin versus heparin with primary percutaneous coronary intervention[J]. Am Heart J, 2018, 201: 9-16. DOI:10.1016/j.ahj.2018.03.014 |
| [17] |
SOUZA C F, DOI H, MINTZ G S, et al. Morphological changes and clinical impact of unstable plaques within untreated segments of acute myocardial infarction patients during a 3-year follow-up: an analysis from the HORIZONS-AMI trial[J]. Coron Artery Dis, 2015, 26(6): 469-475. DOI:10.1097/MCA.0000000000000251 |
| [18] |
WARREN J, MEHRAN R, BABER U, et al. Incidence and impact of acute kidney injury in patients with acute coronary syndromes treated with coronary artery bypass grafting: insights from the harmonizing outcomes with revascularization and stents in acute myocardial infarction (HORIZONS-AMI) and acute catheterization and urgent intervention triage strategy (ACUITY) trials[J]. Am Heart J, 2016, 171(1): 40-47. DOI:10.1016/j.ahj.2015.07.001 |
| [19] |
KIRTANE A J, SANDHU P, MEHRAN R, et al. Association between intraprocedural thrombotic events and adverse outcomes after primary percutaneous coronary intervention for ST-segment elevation myocardial infarction (a harmonizing outcomes with revascularization and stents in acute myocardial infarction [HORIZONS-AMI] Substudy)[J]. Am J Cardiol, 2014, 113(1): 36-43. DOI:10.1016/j.amjcard.2013.08.034 |
| [20] |
IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation[J]. Rev Esp Cardiol (Engl Ed), 2017, 70(12): 1082. DOI:10.1016/j.rec.2017.11.010 |



