高原低氧环境对人体健康有负面影响。以往有关高原环境对人体健康影响研究多集中于心、脑、肺和血液系统等,而低氧环境对男性生殖功能的影响关注相对较少,并且低氧对男性生殖功能的负面影响主要集中在睾丸生精上皮脱落,精子生成数量减少。近年来随着人类在青藏线周边活动大大增加和生活水平提高后,人们对生殖健康质量尤其重视。
大量研究报道了低氧环境诱导人、大鼠等的生精上皮精母细胞脱落及凋亡[1-4]。国内有研究人员用低压舱模拟海拔5 000 m高原实验,发现在所有生精细胞中,精母细胞对低氧最为敏感[5],这表明低氧阻滞精子生成的中心环节是精母细胞凋亡。以上这些文献均从在体的角度来探讨低氧诱导精子浓度减少,无法排除下丘脑-垂体-性腺轴这一神经分泌和间质细胞及支持细胞旁分泌对精母细胞凋亡的影响。所以我们想进一步阐释低氧环境与精母细胞凋亡之间的直接关系。本文旨在模拟1%氧浓度缺氧环境下离体培养小鼠精母细胞,探讨低氧引起的精母细胞凋亡是否由低氧直接诱导,并深入观察低氧环境引起精母细胞凋亡现象。
1 材料与方法 1.1 实验材料高糖DMEM(HYCLONE)、0.25%胰蛋白酶(HYCLONE)、胎牛血清(HYCLONE)、小鼠精母细胞株(中原生物)、Annexin V-FITC细胞凋亡检测试剂盒(C1063,碧云天)、一步法TUNEL细胞凋亡检测试剂盒(C1086,碧云天)、乳酸脱氢酶细胞毒性检测试剂盒(C0017,碧云天),乳酸脱氢酶(M002,南京建成),caspase-3活性检测试剂盒(C1116,碧云天),caspase-8活性检测试剂盒(C1152,碧云天),caspase-9活性检测试剂盒(C1158,碧云天)
1.2 动物建模、取材及HE染色将来源于陆军军医大学基础医学院比较动物学实验室的SPF级别3周龄成年雄性Balb/c小鼠随机分成4个组:常氧组、低氧15 d组、低氧30 d组和低氧60d组,每组10只。将低氧组小鼠暴露在模拟海拔6 000 m低压氧舱分别饲养15、30、60 d,将常氧组小鼠放置到海拔300 m平原环境饲养。
取材当天,人进入低压舱,减压到达指定海拔高度后平衡0.5 h开始取材。取小鼠左侧睾丸放70%乙醇中固定48 h,石蜡切片、HE染色。
1.3 TUNEL检测曲精小管生精细胞和GC-2细胞凋亡石蜡切片进行抗原修复:柠檬酸盐缓冲液中95 ℃孵育15 min,室温冷却20 min;石蜡切片和细胞爬片分别用PBS清洗25 s;4 ℃预冷的4%多聚甲醛固定30 min;PBS洗1次,0.1%Triton X-100的PBS孵育2 min;PBS洗2次,37 ℃、TUNEL检测液孵育1 h;PBS洗3次;DAPI染色15 min;PBS洗3次;封片,激光共聚焦显微镜检测(200倍)。
按5×105/mL接种GC-2细胞至35 mm培养板,样品孔放至直径为10 mm盖玻片,常氧组细胞放至37 ℃、5%CO2、21%O2培养箱中分别孵育48、60和72 h;低氧组细胞放37 ℃、5%CO2、1%O2培养箱中分别孵育48、60和72 h;TUNEL和DAPI双染检测GC-2细胞凋亡步骤同石蜡切片。
1.4 睾丸组织和GC-2细胞caspase-3/8/9值测定按0、10、20、50、100和200 μmol/L 4-硝基苯胺(p-nitroaniline, pNA)标准品测定D(405)作标准曲线;睾丸组织匀浆和消化细胞后分别加入caspase 3/8/9裂解液;4 ℃, 18 000×g离心10 min;检测体系如下:样品孔为检测缓冲液70 μL/孔+样品20 μL/孔+Ac-DEVD-pNA(2 mmol/L)/Ac-IETD-pNA(2 mmol/L)/ Ac-LEHD- pNA (2 mmol/L) 10 μL/孔,空白对照孔为检测缓冲液90 μL/孔+Ac-DEVD-pNA(2 mmol/L)/Ac-IETD-pNA (2 mmol)/Ac-LEHD-pNA(2 mmol/L) 10 μL/孔;37 ℃避光孵育16 h,测定D(405),样品的D(405)扣除空白对照的D(405),即为样品中caspase-3/8/9催化产生的pNA产生的吸光度,通过标准曲线的对比就可以计算出样品中催化产生了多少量的pNA。
1.5 睾丸组织和GC-2细胞LDH活力测定睾丸组织匀浆并对各组设置反应体系:15 μL匀浆液+300 μL LDH检测工作液(TE0151,北京雷根生物),设置酶标仪参数:37 ℃、延迟时间90 s、检测时间180 s,测定D(340)并记录待测样品吸光度升高速率。组织LDH(U/L)=样品吸光度升高速率×3 376。
各细胞培养孔分组如下:无细胞的培养液孔(背景空白对照孔)、常氧处理的对照细胞孔(样品对照孔)、常氧处理的用于后续裂解的细胞孔(样品最大酶活性对照孔)、低氧处理的细胞孔(低氧处理样品孔),处理结束前1 h,“样品最大酶活性对照孔”中加入LDH释放试剂,然后继续孵育到处理结束;400×g离心5 min,按120 μL/孔转移上清至96孔板,按60 μL/孔加入LDH检测液(C0016,碧云天);室温避光孵育30 min,测定D(490)。LDH相对值=(低氧处理样品吸光度-样品对照孔吸光度) / (细胞最大酶活性的吸光度-样品对照孔吸光度)×100%,测得的各组吸光度均应减去背景空白对照孔吸光度。按照0、6.5、12.5、25、50、100 U/mL稀释乳酸脱氢酶(M002,南京建成)测定D(490),作LDH标准曲线并计算样品LDH值。
1.6 流式细胞术检测生精细胞百分比和GC-2细胞凋亡率在低氧暴露时间结束后,用200 mg/L胶原酶消化睾丸组织30 min后,用40 μm滤器过滤2次去除支持细胞聚集物和组织碎片,500×g离心10 min;清洗细胞两次并用70%乙醇固定生精细胞,用25 mg/L的溴化乙啶(Sigma)染色,流式细胞仪分析样本(BD生物,San Jose,加利福尼亚州,美国),激发波长488 nm。
低氧处理结束后收集细胞上清液,胰酶消化和PBS洗1次。按100 μL/管加入10×Binding buffer(0.1 mol/L HEPES+1.4 mol/LNaCl+25 mmol/LCaCl2), 混匀;配制各管反应体系:对照组:①10 μL 10×Binding buffer;②FITC单标组:5 μL AnnexinV-FITC+5 μL 10×Binding buffer;③PI单标组:5 μL PI+5 μL 10×Binding buffer;混匀并避光孵育15 min;按400 μL/管加入10×Binding buffer;流式细胞术检测细胞凋亡。
1.7 统计学分析采用SPSS 16.0统计软件,数据均以
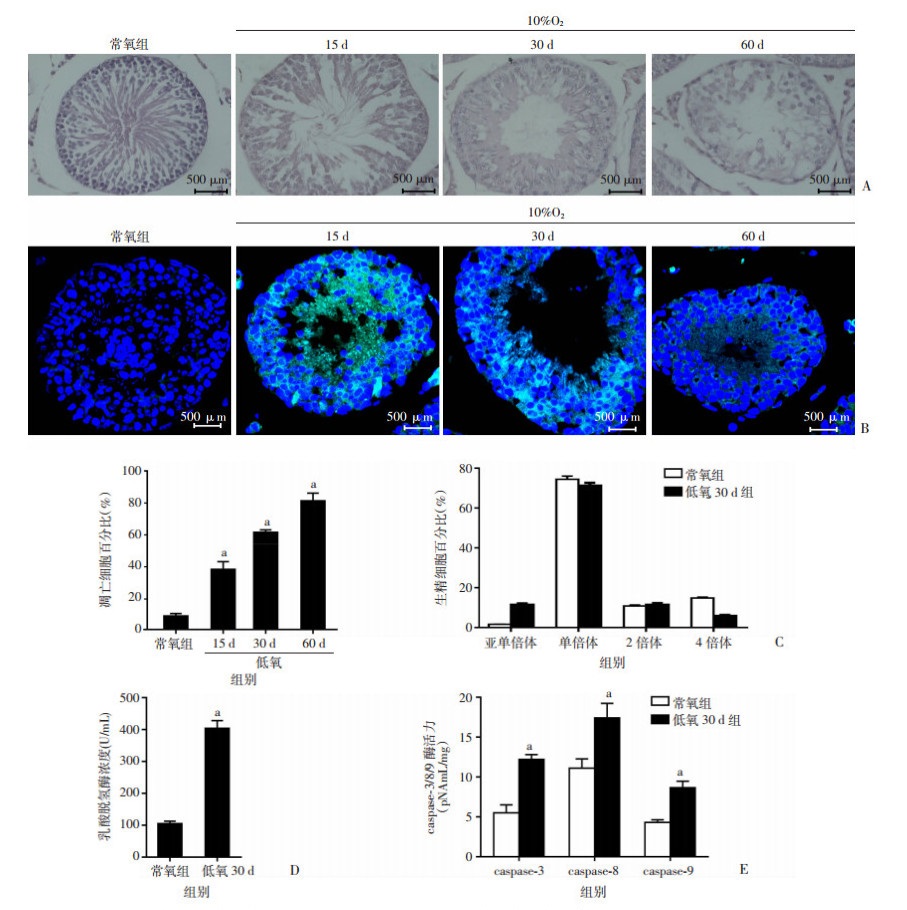
本课题组通过模拟海拔6 000 m低氧环境并先后暴露小鼠15、30和60 d。HE染色观察发现,与常氧组比较,低氧30 d组小鼠生精小管腔中生精细胞出现大面积脱落并出现空腔;TUNEL检测结果表明,与常氧对照组相比,低氧15 d后凋亡生精细胞显著增加,且差异具有显著性(P < 0.01),并呈低氧暴露时间依赖性增加(图 1A和图 1B);此外,低氧30 d组小鼠精母细胞占生精细胞百分比较常氧对照组显著降低(P < 0.01);与常氧组相比,低氧30 d组小鼠睾丸组织乳酸脱氢酶和caspase-3/8/9显著下降(P < 0.01)。
|
|
A:HE染色观察生精小管结构变化;B:TUNEL法染色观察曲精小管生精细胞凋亡;C:流式细胞术检测不同生精细胞占比;D:酶标法检测低氧30 d组小鼠睾丸LDH活力;E:酶标法检测低氧30 d组小鼠睾丸caspase-3/8/9活力a:P < 0.01,与常氧组比较
图 1
模拟高原6 000 m低氧对小鼠睾丸生精小管病理损伤的影响(n=3, |
2.2 低氧对小鼠精母细胞(GC-2细胞)凋亡率的影响
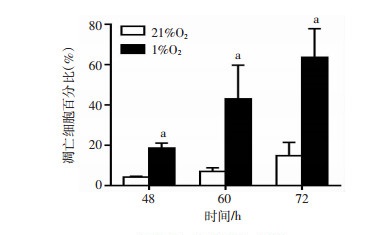
本课题组建立了1%O2暴露下的GC-2细胞凋亡模型,流式细胞术结果表明,分别与21%O2暴露48、60、72 h组比较,1%O2氧暴露48、60、72 h组GC-2细胞凋亡率分别显著升高,且差异具有显著性(P < 0.01),见图 2。激光共聚焦观察发现(200×),分别与21%O2暴露48、60、72 h组比较,1%O2氧暴露48、60、72 h组凋亡GC-2细胞数/视野分别显著增多,见图 3。
|
|
a:P < 0.01,与21%O2比较
图 2
低氧对GC-2细胞凋亡率的影响(n=3, |
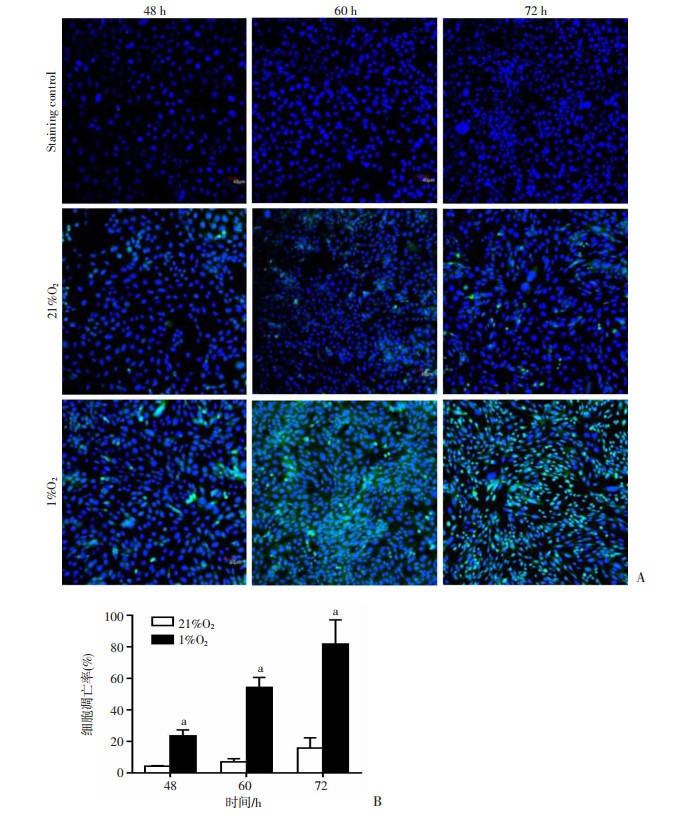
|
|
A:TUNEL法染色观察GC-2细胞凋亡(×200);B:半定量分析(n=3, |
2.3 低氧对GC-2细胞培养上清中LDH的影响
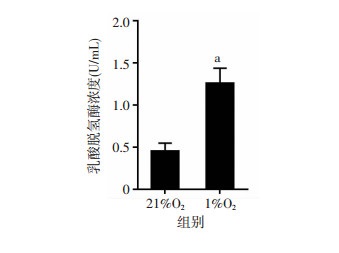
细胞膜破坏是细胞凋亡起始环节,细胞膜破坏后,细胞质内的酶特别是酶活性较为稳定的乳酸脱氢酶(lactic acid dehydrogenase, LDH)释放到培养液里,通过检测从质膜破裂的细胞中释放到培养液中的LDH的活性,就可以实现对细胞毒性的定量分析。结果表明,与21%O2暴露48 h组比较,1%O2暴露48 h组GC-2细胞培养液中LDH值显著升高且差异具有显著性(P < 0.01, 图 4)。
|
|
a:P < 0.01,与21%O2比较
图 4
低氧对GC-2细胞LDH活性影响(n=3, |
2.4 低氧对GC-2细胞caspase-3/8/9影响
细胞凋亡途径分为外源性凋亡途径和内源性凋亡途径,其中外源性凋亡途径下游关键分子caspase-8和内源性凋亡途径下游关键分子caspase-9汇合并激活caspase-3,产生凋亡。结果表明,与21%O2暴露48 h组比较,1%O2暴露48 h组GC-2细胞培养液中caspase-3/8/9酶活力显著升高且差异具有显著性(P < 0.01)。见图 5。
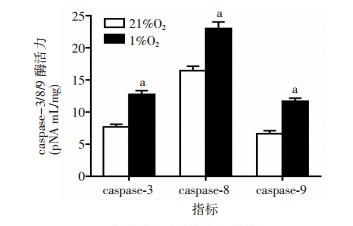
|
| a:P < 0.01,与21%O2比较 图 5 低氧对GC-2细胞凋亡关键分子caspase-3/8/9活性影响 |
3 讨论
精子发生过程本身所需氧耗量大,并且缺氧环境能刺激机体优先保证心脑血液供应,改变全身血流分布,所以高原长期低氧环境导致睾丸内部氧分压持续降低,睾丸的缺氧程度尤其严重,国外相关研究也表明低氧能诱导动物睾丸生精上皮脱落,生精细胞凋亡增多[6-8],并且低张性缺氧导致生精细胞中脂质过氧化物升高,破坏细胞膜进而损伤细胞[9],那么低氧诱导生殖细胞凋亡是否是缺氧直接作用的结果,而不是通过旁分泌与神经分泌调控下丘脑-垂体-性腺轴分泌LH(促黄体生成素)与FSH(卵泡刺激素)而分别作用于间质细胞及支持细胞间接调控生殖细胞凋亡。我们查阅相关文献报道甚少。本研究采用模拟低氧环境下睾丸内部1%氧浓度培养GC-2细胞,检测GC-2细胞凋亡率、凋亡细胞数/视野、LDH活性与caspase-3/8/9变化。
文献[10]报道低氧引起精细胞破坏、生精小管基底膜折叠和生精小管腔间隙增大,进而抑制精子生成。我们模拟海拔6 000 m低氧暴露小鼠15 d后,发现生精上皮出现脱落,并伴有生精细胞凋亡明显增多,这与文献报道一致。此外,文献[11]报道低氧通过氧化应激进而激活生精细胞的凋亡途径,最终抑制精子生成;但是在本研究中并未进行相关探索,所以关于低氧抑制精子生成的机制还有待进一步探讨。
根据流式细胞术检测发现低氧暴露48 h后,GC-2细胞凋亡率[(15.43±1.47)%]显著高于常氧48 h组(4.18±1.4%, P < 0.01),并且48 h相对于60 h与72 h来说,坏死的GC-2细胞并不多,此外,TUNEL实验结果也证实低氧暴露48 h组凋亡GC-2细胞数/视野也显著高于常氧48 h组,所以我们采用低氧48 h来刺激GC-2细胞并检测细胞培养液中caspase-3/8/9和乳酸脱氢酶变化。低氧诱导GC-2细胞凋亡的机制可能是由于低氧激活了胞外死亡受体凋亡途径,诱导产生了由pro-caspase-8与FADD(fas-associated death domain)组装的死亡诱导信号复合物(DISC),进而断裂pro-caspase-8和激活了caspase-8,以及caspase-8下游的效应分子如caspase-3/6/7,细胞出现DNA浓缩和凋亡[12];此外,低氧还可能激活了GC-2细胞线粒体凋亡途径,线粒体外膜释放细胞色素c(cyt-C)并激活caspase-9,以及caspase-9下游的效应分子如caspase-3[13];我们的结果表明1%氧暴露48 h后GC-2细胞caspase-3/8/9均显著高于21%氧组,这表明低氧激活了GC-2细胞死亡受体凋亡途径和线粒体凋亡途径。而且,细胞培养液上清LDH检测结果表明1%氧暴露48 h组精母细胞LDH值为1.28±0.18,显著高于常氧48 h组LDH值(0.48±0.09, P < 0.01),这表明低氧环境诱导小鼠精母细胞凋亡后,细胞膜通透性增大,乳酸脱氢酶大量释放进入培养液。高原低氧对精母细胞凋亡的影响和机制还不清楚,国内外相关研究甚少。我们的实验结果提示1%氧浓度处理小鼠精母细胞48、60和72 h后,精母细胞凋亡率、凋亡精母细胞数/视野均显著升高,1%氧浓度处理小鼠精母细胞48 h后,培养液上清中LDH活性显著升高,细胞凋亡途径下游关键分子caspase-3/8/9活力明显增加。低氧诱导精母细胞凋亡的机制值得进一步探讨。
综上所述,我们研究发现,模拟海拔6 000 m低氧环境暴露小鼠15 d后,睾丸生精小管出现病损,生精细胞凋亡增加,模拟1% O2诱导小鼠精母细胞凋亡率、凋亡精母细胞数/视野及培养上清中乳酸脱氢酶活性均显著升高。
| [1] |
ZHENG S J, LIU Y S, LI P, et al. Short-term high-altitude exposure (3 600 m) alters the type distribution of sperm deformity[J]. High Alt Med Biol, 2019, 20(2): 198-202. DOI:10.1089/ham.2018.0133 |
| [2] |
HE J, CUI J H, WANG R, et al. Exposure to hypoxia at high altitude (5 380 m) for 1 year induces reversible effects on Semen quality and serum reproductive hormone levels in young male adults[J]. High Alt Med Biol, 2015, 16(3): 216-222. DOI:10.1089/ham.2014.1046 |
| [3] |
COFR- E, PERALTA O A, RAGGI A, et al. Ram Semen deterioration by short-term exposure to high altitude is prevented by improvement of antioxidant status[J]. Animal, 2018, 12(5): 1007-1014. DOI:10.1017/S1751731117002452 |
| [4] |
ZHAO Y L, LU X L, CHENG Z P, et al. Comparative proteomic analysis of Tibetan pig spermatozoa at high and low altitudes[J]. BMC Genomics, 2019, 20(1): 569. DOI:10.1186/s12864-019-5873-0 |
| [5] |
LIAO W G, CAI M C, CHEN J, et al. Hypobaric hypoxia causes deleterious effects on spermatogenesis in rats[J]. Reproduction, 2010, 139(6): 1031-1038. DOI:10.1530/REP-09-0557 |
| [6] |
HUNG Y C, PAN T L, HU W L. Roles of reactive oxygen species in anticancer therapy with Salvia miltiorrhiza bunge[J]. Oxid Med Cell Longev, 2016, 2016: 5293284. DOI:10.1155/2016/5293284 |
| [7] |
GHANDEHARI-ALAVIJEH R, TAVALAEE M, ZOHRABI D, et al. Hypoxia pathway has more impact than inflammation pathway on etiology of infertile men with varicocele[J]. Andrologia, 2019, 51(2): e13189. DOI:10.1111/and.13189 |
| [8] |
TORRES M, LAGUNA-BARRAZA R, DALMASES M, et al. Male fertility is reduced by chronic intermittent hypoxia mimicking sleep apnea in mice[J]. Sleep, 2014, 37(11): 1757-1765. DOI:10.5665/sleep.4166 |
| [9] |
AGARWAL A, BUI A D. Oxidation-reduction potential as a new marker for oxidative stress: Correlation to male infertility[J]. Investig Clin Urol, 2017, 58(6): 385-399. DOI:10.4111/icu.2017.58.6.385 |
| [10] |
JANKOVIC VELICKOVIC L, STEFANOVIC V. Hypoxia and spermatogenesis[J]. Int Urol Nephrol, 2014, 46(5): 887-894. DOI:10.1007/s11255-013-0601-1 |
| [11] |
ZEPEDA A B, FIGUEROA C A, CALAF G M, et al. Male reproductive system and antioxidants in oxidative stress induced by hypobaric hypoxia[J]. Andrologia, 2014, 46(1): 1-8. DOI:10.1111/and.12039 |
| [12] |
IVANISENKO N V, LAVRIK I N. Mechanisms of procaspase-8 activation in the extrinsic programmed cell death pathway[J]. Mol Biol (Mosk), 2019, 53(5): 830-837. DOI:10.1134/S0026898419050094 |
| [13] |
WYATT J, M-LLER M M, TAVASSOLI M. Cancer treatment Goes viral: using viral proteins to induce tumour-specific cell death[J]. Cancers (Basel), 2019, 11(12): E1975. DOI:10.3390/cancers11121975 |



