2. 710032 西安,空军军医大学附属第一医院急诊科
2. Department of Emergency, First Affiliated Hospital, Air Force Medical University, Xi'an, Shaanxi Province, 710032, China
脑生发基质出血(germinal matrix hemorrhage,GMH)是指未成熟脑组织室管膜下区或脑室周围区域的胚性出血[1]。早产儿(< 37周)和低体质量儿(< 1 500 g) GMH发生率约为3.5‰,是新生儿严重的神经系统疾病之一。出血性脑积水(post-hemorrhagic hydrocephalus,PHH)是新生儿GMH最常见、最严重的并发症,可引起严重的、长期的精神运动和认知功能障碍,预后不良[2]。目前,脑室分流术是脑积水的主要临床治疗方法,但其治疗效果还远不能令人满意[3]。炎症在PHH中起重要作用[4]。GMH后炎症因子,如IL-1β、IL-6、TNF-α、TGF-β1上调,促进神经胶质增生,引起血脑屏障(blood-brain barrier,BBB)损伤和蛛网膜下腔广泛纤维化,增加水通道蛋白4(aquaporin 4,AQP4)表达,最终加重脑积水[5-6]。作为目前发现的最强促炎因子,脑卒中后,补体C3能够促进小胶质细胞活化和中性粒细胞浸润,从而增强炎性反应,加重脑水肿,预后不良[7]。另外,补体C3在正常压力脑积水患者的脑脊液中被发现激活[8]。众多权威研究表明:脑组织中C3主要表达于星形胶质细胞,C3aR主要表达于小胶质细胞[9-10]。然而,GMH后C3是否上调?星形胶质细胞表达的C3与小胶质细胞表面的C3aR的交互作用是否加重PHH?目前尚不清楚。本研究以新生大鼠GMH模型为基础,探索补体C3/C3aR信号在GMH后脑积水的作用,希望能为GMH后脑积水提供新的治疗靶点。
1 材料与方法 1.1 实验动物出生第7天SD大鼠由陆军军医大学实验动物中心提供的大鼠繁殖获取,体质量为15~17 g。实验均按照陆军军医大学动物伦理委员会批准的动物保护指南实施。每组使用同等数量的雄性和雌性幼鼠。除6只大鼠在注射胶原酶(Ⅶ-S型)后24 h内死亡外,其余144只被用于本研究。
1.2 GMH模型建立和实验分组GMH模型由胶原酶(Ⅶ-S型)注射到大脑右侧基底神经节诱导[11]。用3%异氟醚麻醉动物后,俯卧位固定于立体定位仪。头皮区域消毒,暴露前囟。以前囟为参照点向前1.8 mm、向右1.5 mm在颅骨钻孔(1 mm),直至硬脑膜。Hamilton微量注射泵吸入3个单位胶原酶(Ⅶ-S型,美国Sigma公司),然后以1 mm/min的速度插入硬脑膜下2.8 mm深,以0.05 μL/min的速度推注胶原酶。注射后保持针头在位10 min,以防止药物返流。取出针后,用骨蜡封住钻孔,缝合切口,37 ℃复温箱复温后放回母鼠身边。
为检测C3aR拮抗剂(complement C3 receptor antagonist,C3aRA)的效果,将新生大鼠按随机数字表法分为假手术组、安慰剂组和C3aRA组,每组每个时间点6只。C3aRA组于GMH后6 h开始腹腔注射1 mg/kg C3aRA(Merck Millipore公司,德国,SB 290157-CAS 1140525-25-2-Calbiochem),每日1次,连续1周[12],安慰剂组接受等量的磷酸盐缓冲液(PBS),假手术组动物只进针不给胶原酶。
1.3 免疫荧光染色和细胞计数麻醉大鼠后,先用0.9%生理盐水心脏灌注,接着用4%多聚甲醛灌注。剥离脑组织并浸泡于4%多聚甲醛,4 ℃条件固定24 h,转入30%蔗糖溶液脱水3~5 d。冰冻切片机将脱水后的脑组织沿冠状位切成层厚30 μm的切片,放入预先配好的防冻液中,置于-20 ℃存储备用。游离切片在PBS中广泛洗涤后,用5%牛血清白蛋白(BSA)封闭1 h,然后用如下一抗孵育,4 ℃过夜:兔来源Iba-1抗体(Wako公司,日本,019-19741)与小鼠来源C3aR抗体(Thermo Fisher公司,美国,MA5-17473)共标;鸡来源GFAP抗体(Abcam公司,美国,ab81355)与C3aR抗体双标;GFAP抗体与兔来源AQP4抗体(Abcam公司,ab81355)共标。第2天用PBS清洗切片,对应二抗室温下孵育1 h。最后用DAPI对细胞核进行染色。共聚焦荧光显微镜(Zeiss,LSM780)观察染好的切片,每个随机视野统计细胞数(荧光显微镜×200)。
1.4 Western blot分析取大鼠各时间点脑室周围组织100 mg,在加入蛋白酶抑制剂和磷酸酶抑制剂的裂解液中匀浆(13 000 r/min,20 min)。收集上清液,然后用紫外分光光度法测蛋白浓度。提取蛋白按比例加入上样缓冲液,在95 ℃条件下煮5 min,分装后-80 ℃储存备用。将30 μg蛋白样品用移液枪注入SDS-PAGE凝胶孔,电泳后转移到聚偏氟乙烯膜,然后用5%的脱脂奶粉封闭1 h。封闭后的膜分别用如下一抗孵育,4 ℃摇床过夜:鸡来源GFAP抗体(Abcam公司,ab4674);兔来源C3抗体(Abcam公司,ab200999);小鼠来源C3aR抗体(Thermo Fisher公司,MA5-17473);兔来源AQP4抗体(Abcam公司,ab81355);兔来源IL-1β抗体(Gene Tex公司,美国,55675);小鼠来源IL-6抗体(Santa Cruz公司,美国,sc-57315);兔来源TNF-α抗体(Affinity公司,美国,AF7014);兔来源TGF-β1抗体(Abcam公司,ab92486)。洗膜缓冲液(TBST)洗膜后37℃条件下用对应的辣根过氧化物酶(HRP)偶联的二抗孵育1 h,TBST再洗膜3次。ECL+化学发光试剂盒(Thermo Fisher公司,32106)显影目的条带。Image Lab软件对条带进行密度定量。
1.5 MRI检查GMH后1 d和28 d的大鼠麻醉后俯卧位置于MRI球管中,7.0 T/200 mm Varian核磁共振扫描仪(Bruker公司,美国)中,采用T2快速自旋回波序列(TR/TE=3 000/45 ms)扫描。扫描视野为3.5 cm×3.5 cm,矩阵是256×256。取11个冠状面切片(厚度1.0 mm)覆盖整个侧脑室轴。将血肿、侧脑室和海马区勾画出来,用ImageJ软件测量其面积。所有切片的面积和乘以层扫厚度计算体积[13]。每张包含侧脑室的MRI照片中,测量6个固定位置软脑膜表面到皮质下白质的距离,得到平均值,即皮质厚度。图像分析均采用双盲法观察。
1.6 水迷宫实验大鼠在GMH后第23~28天接受Morris水迷宫测试,以评估学习和记忆功能。从测试前5 d起,每天2次,将大鼠放在1个水迷宫池(深50 cm,直径200 cm)装满水(25 ℃),训练120 s内从4个象限的任意起始点中找到水下平台(直径15 cm)。跟踪监测,记录找到平台前的逃避潜伏期时间和距离。测试当天撤掉水下平台,进行120 s探针实验,每只大鼠测试2次,统计其穿越平台次数和目标象限内的时间和距离百分比。
1.7 统计学分析采用SPSS 19.0统计软件,数据以x±s表示。组织学染色和细胞计数由2名不知分组及给药情况的研究人员进行。采用单因素方差分析或独立样本t检验,然后进行post hoc检验。检验水准:α=0.05。
2 结果 2.1 新生大鼠GMH后3 d脑室周围补体C3、C3aR表达上调免疫荧光染色结果显示:GMH后3 d脑室周围小胶质细胞和星形胶质细胞被激活,数量显著增加。C3aR主要表达在小胶质细胞表面,但几乎不与GFAP共标(图 1A)。统计C3aR/Iba-1共标记细胞的数量,发现GMH后,C3aR/Iba-1共标细胞数量显著增加,3 d达到高峰,并逐渐回归,28 d时与假手术组差异无统计学意义(图 1B)。C3aR的Western blot检测结果与免疫荧光结果一致(图 1C)。在不同时间点对C3进行Western blot检测,结果显示:C3在GMH后显著上调,在3 d达到峰值,然后缓慢下降,28 d时恢复(图 1D)。说明GMH后补体C3和C3aR明显上调,在3 d达到高峰。

|
| A:免疫荧光染色;B:细胞计数;C:Western blot检测C3aR表达;D:Western blot检测C3表达 a:P < 0.01,b:P < 0.05,与假手术组比较;V示侧脑室 图 1 补体C3和C3aR在新生大鼠GMH后脑室周围的表达趋势 |
2.2 C3aRA能够减轻新生大鼠GMH后脑积水
GMH后1 d,安慰剂组和C3aRA组血肿体积基本一致,差异无统计学意义(图 2A、B),3组动物的侧脑室均未见扩张。GMH后28 d,C3aRA组侧脑室扩张程度明显小于安慰剂组(P < 0.01,图 2C)。C3aRA干预可减轻脑积水对海马体积(P < 0.01,图 2D)和皮层厚度(P < 0.01,图 2E)的压迫。

|
| A:MRI表现 T2WI图像(冠状位),黄色虚线表示血肿,白色虚线表示海马,白色实线表示皮层厚度;B:血肿体积;C:侧脑室体积;D:海马体积;E:大脑皮层厚度 a:P < 0.01,与假手术组比较;b:P < 0.01,与安慰剂组比较 图 2 C3aRA对新生大鼠GMH后脑积水的影响 |
2.3 C3aRA能改善GMH新生大鼠的认知功能障碍
Morris水迷宫实验结果显示:在连续5 d的学习中,C3aRA治疗显著降低了潜伏期的时间和距离(图 3,图 4A、B),说明C3aRA可以减轻GMH引起的学习障碍。探针试验中,C3aRA组比安慰剂组在目标象限穿越平台的次数更多(P < 0.05,图 4C),花费时间更多(P < 0.05,图 4D),游泳距离更长(P < 0.05,图 4E)。表明C3aR拮抗剂能够改善GMH诱导的神经功能缺陷。
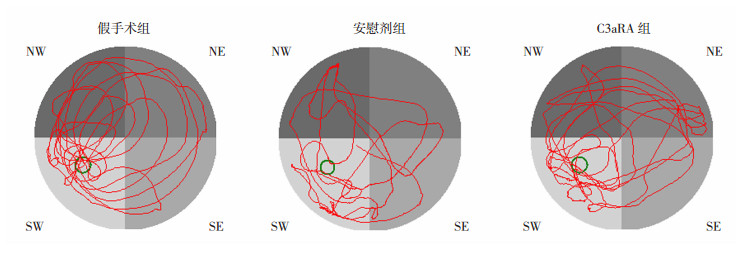
|
| 图 3 各组新生大鼠Morris水迷宫实验 |
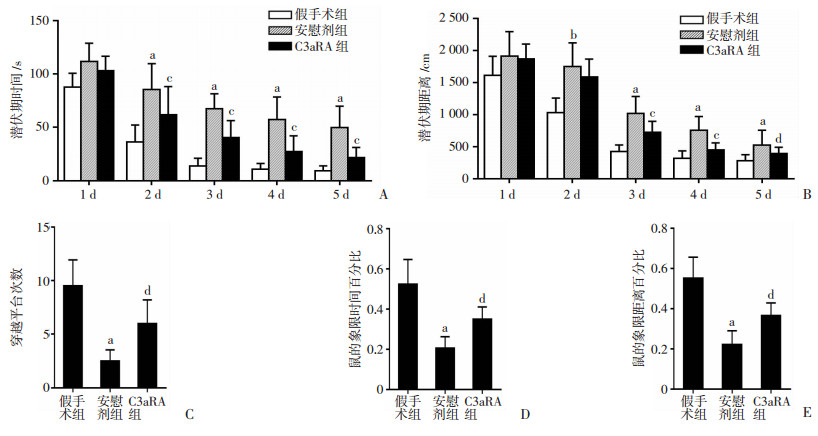
|
| A:潜伏期时间;B:潜伏期距离;C:穿越平台次数;D:目的象限时间百分比;E:目的象限距离百分比 a:P < 0.01,b:P < 0.05,与假手术组比较;c:P < 0.01,d:P < 0.05,与安慰剂组比较 图 4 C3aRA对新生大鼠GMH后认知功能的影响 |
2.4 C3aRA可以减轻新生大鼠GMH后脑室周围的神经炎症
Western blot结果显示:与安慰剂组比较,GMH后假手术组脑室周围IL-1β、IL-6、TNF-α和TGF-β1的表达明显增加(P < 0.01),C3aRA能够减少这些炎症因子表达(P < 0.01,图 5)。
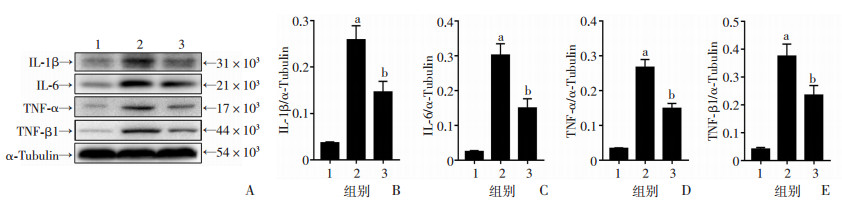
|
| A:Wester blot检测炎症因子表达;B:半定量分析 1:假手术组;2:安慰剂组;3:C3aRA组;a:P < 0.01,与假手术组比较;b:P < 0.01,与安慰剂组比较 图 5 C3aRA对新生大鼠GMH后急性炎症的影响 |
2.5 C3aRA可以降低GMH后急性期AQP4的表达,抑制GMH后慢性期AQP4异位表达
免疫荧光结果显示:GMH后3 d,脑室周围星形胶质细胞和AQP4表达明显增加(P < 0.01),C3aRA有效抑制了AQP4(P < 0.05,图 6A、B)和星形胶质细胞(P < 0.05,图 6A、E)表达增加。Western blot检测结果显示了相似的结果(图 6C、D、F、G)。GMH后第28天,3组间AQP4表达差异无统计学意义(图 6A~D)。星形细胞增多、胶质瘢痕、AQP4异位表达导致脑脊液循环受阻,可能在GMH后脑积水形成中发挥重要作用。GMH后28 d时脑室周围可见明显的星形细胞增多症、胶质瘢痕和AQP4表达错位,即血管周围AQP4表达明显降低,而非血管区域AQP4表达增加,C3aRA可以减少上述改变。
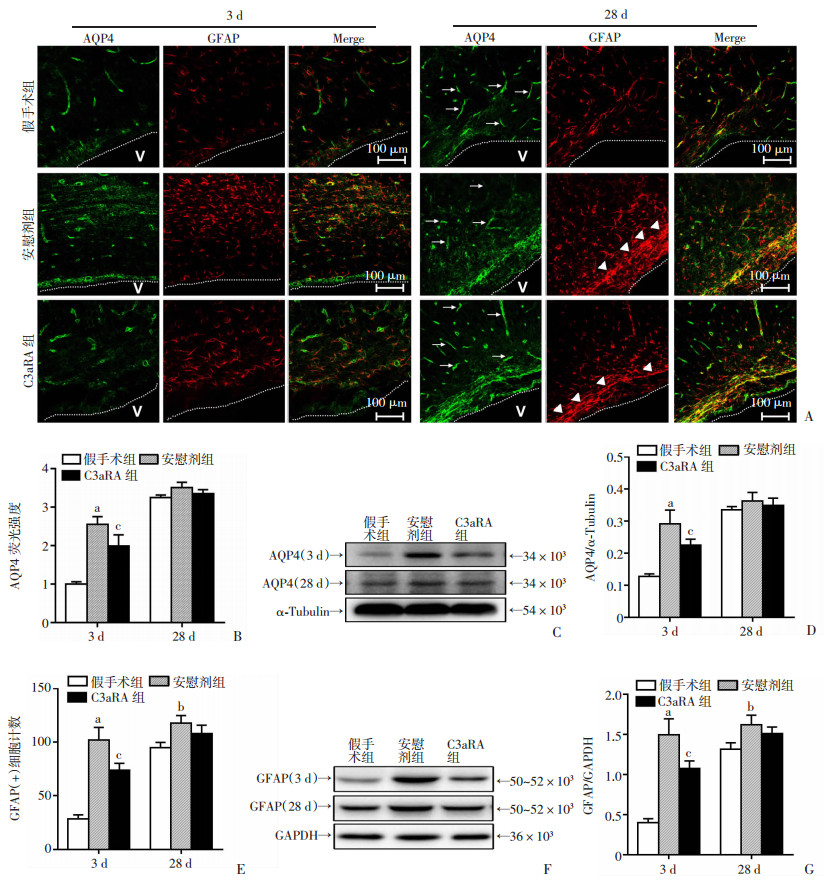
|
| A:免疫荧光染色 ↑示血管壁AQP4,▲示胶质瘢痕;B荧光强度分析;C:Western blot检测AQP4表达;D:AQP4表达半定量分析;E:GFAP细胞计数;F:Western blot检测GFAP表达;G:GFAP表达半定量分析 a:P < 0.01,b:P < 0.05,与假手术组比较;c:P < 0.05,与安慰剂组比较;V示侧脑室 图 6 C3aRA对新生大鼠GMH后3、28 d时脑室周围星形胶质细胞增殖及其表达AQP4的影响 |
3 讨论
GMH患儿常出现脑瘫、认知障碍、脑积水等严重并发症,其中PHH最常见,且最严重[2]。脑室分流术是目前临床上治疗脑积水的主要方法。但由于脑室分流术的频繁阻塞和感染,脑积水的复发率较高[14],常需再次手术。其他方法,如连续腰椎穿刺、脑室外引流、脑室内接入装置、脑室帽状腱膜下分流术、内镜下脉络膜丛凝固术等治疗效果均不佳[15]。因此,迫切需要一种非侵入性治疗方法来改善GMH患者的长期生活质量。
炎症反应与PHH形成密切相关。文献[16-17]报道IL-1β、IL-6和TNF-α能够增加反应性星形胶质细胞增生,过量的TGF-β可直接导致PHH[18]。本研究发现C3aRA能显著降低GMH后脑室周围炎性因子的表达,这或许可以解释GMH后C3aRA干预可减轻脑积水。补体C3作为目前公认的最有效的促炎因子,能够促进IL-1、IL-6、TNF-α等促炎因子的表达,诱导中性粒细胞浸润,导致脑出血急性期促炎反应加重[19]。另外,补体C3在常压脑积水患者的脑脊液中被发现激活[13],提示补体C3可能参与PHH的形成和发展。有研究报道C3和C3aR分别在星形胶质细胞和小胶质细胞中表达[9-10]。LIAN等[9]研究发现阿尔兹海默症模型小鼠中星形胶质细胞和小胶质细胞通过C3/C3aR信号交互作用损害了小胶质细胞吞噬β-淀粉样蛋白(Aβ)的能力。本研究结果表明:GMH后小胶质细胞C3aR表达增加与星形胶质细胞C3表达上调趋势一致,提示星形胶质细胞-小胶质细胞通过C3/C3aR信号交互作用可能在PHH中发挥重要作用,需要进一步研究。
AQP4是脑内最丰富的水通道蛋白,主要表达于星形胶质细胞足突,参与脑脊液循环调节[20-21]。在GMH后急性期,炎性因子IL-1β、IL-6和TNF-α通过NF-κB或MAPK信号通路调控AQP4的表达[22-23]。AQP4表达增加可促进炎症反应,加重脑水肿[24]。在GMH后慢性期,反应性星形胶质细胞增多可导致AQP4异位表达(从足突转移到整个胶质细胞膜),组织液清除受阻,脑脊液潴留,脑积水形成[25]。本研究中,GMH后3 d,AQP4在脑室周围星形胶质细胞中的表达显著增加,28 d时AQP4的分布发生改变,这与前期研究一致[26]。C3aRA干预显著降低了GMH后急性期(第3天)星形胶质细胞中AQP4的表达,降低了AQP4慢性期(第28天)异位表达,可能在减轻GMH后脑积水中发挥重要作用。
本研究结果表明:脑室周围星形胶质细胞-小胶质细胞交互作用是GMH后脑积水发生、发展的关键过程;C3/C3aR信号是星形胶质细胞和小胶质细胞之间交互作用的一个新的“桥梁”;C3aR拮抗剂可抑制C3/C3aR信号,改善GMH后脑积水及神经功能障碍。本研究为新生儿GMH后脑积水的治疗提供了新的靶点和治疗策略。
| [1] |
BALLABH P. Intraventricular hemorrhage in premature infants: mechanism of disease[J]. Pediatr Res, 2010, 67(1): 1-8. DOI:10.1203/PDR.0b013e3181c1b176 |
| [2] |
ELLENBOGEN J R, WAQAR M, PETTORINI B. Management of post-haemorrhagic hydrocephalus in premature infants[J]. J Clin Neurosci, 2016, 31: 30-34. DOI:10.1016/j.jocn.2016.02.026 |
| [3] |
WU Y, GREEN N L, WRENSCH M R, et al. Ventriculoperitoneal shunt complications in California: 1990 to 2000[J]. Neurosurgery, 2007, 61(3): 557-562. DOI:10.1227/01.NEU.0000290903.07943.AF |
| [4] |
KARIMY J K, ZHANG J W, KURLAND D B, et al. Inflammation-dependent cerebrospinal fluid hypersecretion by the choroid plexus epithelium in posthemorrhagic hydrocephalus[J]. Nat Med, 2017, 23(8): 997-1003. DOI:10.1038/nm.4361 |
| [5] |
GIMSA U, MITCHISON N A, BRUNNER-WEINZIERL M C. Immune privilege as an intrinsic CNS property: astrocytes protect the CNS against T-cell-mediated neuroinflammation[J]. Mediators Inflamm, 2013, 2013: 320519. DOI:10.1155/2013/320519 |
| [6] |
WANG C, YAN M Y, JIANG H, et al. Mechanism of aquaporin 4 (AQP4) up-regulation in rat cerebral edema under hypobaric hypoxia and the preventative effect of puerarin[J]. Life Sci, 2018, 193: 270-281. DOI:10.1016/j.lfs.2017.10.021 |
| [7] |
YANG S X, NAKAMURA T, HUA Y, et al. The role of complement C3 in intracerebral hemorrhage-induced brain injury[J]. J Cereb Blood Flow Metab, 2006, 26(12): 1490-1495. DOI:10.1038/sj.jcbfm.9600305 |
| [8] |
SEELE J, KIRSCHFINK M, DJUKIC M, et al. Cisterno-lumbar gradient of complement fractions in geriatric patients with suspected normal pressure hydrocephalus[J]. Clin Chim Acta, 2018, 486: 1-7. DOI:10.1016/j.cca.2018.07.008 |
| [9] |
LIAN H, LITVINCHUK A, CHIANG A C, et al. Astrocyte-microglia cross talk through complement activation modulates amyloid pathology in mouse models of Alzheimer's disease[J]. J Neurosci, 2016, 36(2): 577-589. DOI:10.1523/JNEUROSCI.2117-15.2016 |
| [10] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [11] |
TANG J, CHEN Q W, GUO J, et al. Minocycline attenuates neonatal germinal-matrix-hemorrhage-induced neuroinflammation and brain edema by activating cannabinoid receptor 2[J]. Mol Neurobiol, 2016, 53(3): 1935-1948. DOI:10.1007/s12035-015-9154-x |
| [12] |
RYNKOWSKI M A, KIM G H, GARRETT M C, et al. C3a receptor antagonist attenuates brain injury after intracerebral hemorrhage[J]. J Cereb Blood Flow Metab, 2009, 29(1): 98-107. DOI:10.1038/jcbfm.2008.95 |
| [13] |
OKAUCHI M, HUA Y, KEEP R F, et al. Effects of deferoxamine on intracerebral hemorrhage-induced brain injury in aged rats[J]. Stroke, 2009, 40(5): 1858-1863. DOI:10.1161/STROKEAHA.108.535765 |
| [14] |
KAHLE K T, KULKARNI A V, LIMBRICK D D Jr, et al. Hydrocephalus in children[J]. Lancet, 2016, 387(10020): 788-799. DOI:10.1016/S0140-6736(15)60694-8 |
| [15] |
TULLY H M, DOBYNS W B. Infantile hydrocephalus: a review of epidemiology, classification and causes[J]. Eur J Med Genet, 2014, 57(8): 359-368. DOI:10.1016/j.ejmg.2014.06.002 |
| [16] |
GIMSA U, MITCHISON N A, BRUNNER-WEINZIERL M C. Immune privilege as an intrinsic CNS property: astrocytes protect the CNS against T-cell-mediated neuroinflammation[J]. Mediators Inflamm, 2013, 2013: 320519. DOI:10.1155/2013/320519 |
| [17] |
FUKUDA S, ABEMATSU M, MORI H, et al. Potentiation of astrogliogenesis by STAT3-mediated activation of bone morphogenetic protein-smad signaling in neural stem cells[J]. Mol Cell Biol, 2007, 27(13): 4931-4937. DOI:10.1128/MCB.02435-06 |
| [18] |
LIPINA R, REGULI S, NOVÁCKOVÁ L, et al. Relation between TGF-beta 1 levels in cerebrospinal fluid and ETV outcome in premature newborns with posthemorrhagic hydrocephalus[J]. Childs Nerv Syst, 2010, 26(3): 333-341. DOI:10.1007/s00381-009-1011-7 |
| [19] |
YANG S X, NAKAMURA T, HUA Y, et al. The role of complement C3 in intracerebral hemorrhage-induced brain injury[J]. J Cereb Blood Flow Metab, 2006, 26(12): 1490-1495. DOI:10.1038/sj.jcbfm.9600305 |
| [20] |
YASUI M. Roles of aquaporins in the central nervous system[J]. Masui, 2008, 57(Suppl): S28-S33. |
| [21] |
MCALLISTER J P 2nd, MILLER J M. Aquaporin 4 and hydrocephalus[J]. J Neurosurg, 2006, 105(6 Suppl): 457-458. DOI:10.3171/ped.2006.105.6.457 |
| [22] |
ASAI H, KAKITA H, AOYAMA M, et al. Diclofenac enhances proinflammatory cytokine-induced aquaporin-4 expression in cultured astrocyte[J]. Cell Mol Neurobiol, 2013, 33(3): 393-400. DOI:10.1007/s10571-013-9905-z |
| [23] |
WANG C, YAN M Y, JIANG H, et al. Mechanism of aquaporin 4 (AQP 4) up-regulation in rat cerebral edema under hypobaric hypoxia and the preventative effect of puerarin[J]. Life Sci, 2018, 193: 270-281. DOI:10.1016/j.lfs.2017.10.021 |
| [24] |
FUKUDA A M, BADAUT J. Aquaporin 4: a player in cerebral edema and neuroinflammation[J]. J Neuroinflamm, 2012, 9: 279. DOI:10.1186/1742-2094-9-279 |
| [25] |
TOURDIAS T, DRAGONU I, FUSHIMI Y, et al. Aquaporin 4 correlates with apparent diffusion coefficient and hydrocephalus severity in the rat brain: a combined MRI-histological study[J]. Neuroimage, 2009, 47(2): 659-666. DOI:10.1016/j.neuroimage.2009.04.070 |
| [26] |
DING Y, ZHANG T Y, WU G Y, et al. Astrogliosis inhibition attenuates hydrocephalus by increasing cerebrospinal fluid reabsorption through the glymphatic system after germinal matrix hemorrhage[J]. Exp Neurol, 2019, 320: 113003. DOI:10.1016/j.expneurol.2019.113003 |



