2. 400038 重庆, 陆军军医大学(第三军医大学)军事预防医学系火箭军医学教研室,创伤、烧伤与复合伤国家重点实验室;
3. 646000 四川 泸州,西南医科大学附属医院肿瘤科
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department of Rocket Force Medicine, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Oncology, Affiliated Hospital of Southwest Medical University, Luzhou, Sichuan Province, 646000, China
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种慢性、进展性、致死性的肺部疾病,其病理特征包括肺泡上皮细胞损伤、肺结构被重塑、细胞外基质沉积、成纤维细胞和肌成纤维细胞累积等[1-2]。目前尚没有有效的靶向药物来治疗特发性肺纤维化。越来越多的研究证据表明肺成纤维细胞的异常活化在特发性肺纤维化的发病机制中起着至关重要的作用[3], 抑制肺成纤维细胞的转分化和细胞外基质的分泌是治疗特发性肺纤维化的潜在策略。本课题组前期鉴定了1组七甲川花菁类线粒体靶向荧光小分子,对成纤维细胞功能可能具有潜在的调控作用[4]。本研究通过构建博来霉素致大鼠肺纤维化模型,发现IR-61能够靶向到博莱霉素处理的肺组织,并改善博来霉素引起的肺损伤和纤维化。
1 材料与方法 1.1 材料及动物IR-61由所在实验室合成和纯化,合成方法和分子结构同前期研究[4];博来霉素粉剂(bleomycin, BLM)购自美国MEC公司;苏木精伊红(HE)及马松三色染色试剂盒、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;F12K培养基购自上海中乔新舟公司;PVDF膜购自美国Millipore公司;反转录试剂盒购自美国Thermo公司;荧光定量试剂盒购自日本TaKaRa公司;TRIzol购自北京康为世纪生物科技有限公司;Collagen-1、α-SMA、Fibronectin等抗体及引物购自武汉三鹰公司。
1.2 实验动物及分组清洁级(SD)大鼠40只,雄性,6~8周龄,体质量230~250 g, 从陆军军医大学实验动物中心购买。根据陆军军医大学实验动物中心制订的实验室动物的护理和使用指导原则进行体内实验,所有程序经陆军军医大学实验动物中心动物保护和使用委员会批准。适应性喂养2周后,采用随机数字表法分为4组:正常对照组、IR-61处理组、BLM处理组和BLM+IR-61处理组,每组10只。采用气管内滴注博莱霉素建立大鼠肺纤维化模型,除正常对照组、IR-61处理组外,其余两组以0.1%戊巴比妥腹腔注射麻醉大鼠,按2.5 mg/kg缓慢往大鼠气管内注入博莱霉素建立肺纤维化模型。BLM+IR-61处理组经博莱霉素气管滴注30 min,IR-6处理组腹腔注射IR-61(2.0 mg/kg,用PBS溶解),随后该两组以每周2次的频率腹腔注射IR-61。每天观察。所有大鼠于博莱霉素治疗后28 d处死,取肺及其他器官作进一步分析。
1.3 近红外荧光成像(near infrared fluorescence imaging,NIR)大鼠行气管内滴注博莱霉素10 d后,取正常对照组、IR-61处理组和BLM+IR-61处理组大鼠各3只,IR-61处理组和BLM+IR-61处理组大鼠尾静脉注射剂量为2.0 mg/kg的IR-61,24 h后腹腔注射1%戊巴比妥钠麻醉大鼠,分离大鼠肺及重要内脏进行NIR,观测大鼠肺及重要内脏荧光信号情况,进一步研究IR-61的肺蓄积特性。
1.4 组织学检查28 d后处死各组大鼠,将大鼠肺固定于4%多聚甲醛,包埋于石蜡中,按3 μm切片,按照实验规程进行HE染色,光学显微镜观察组织细胞变化。采用Masson三色染色法评价肺纤维化的严重程度,使用Image J对Masson染色结果进行半定量分析。为了区分胶原纤维和其他纤维,采用Masson染色法将细胞核染成黑色,细胞质和肌肉呈红色,胶原蛋白呈蓝色。
1.5 细胞培养及处理从新生SD大鼠中分离出原代大鼠肺成纤维细胞。大鼠肺成纤维细胞在第3代和第6代之间使用。人肺成纤维细胞株(human fetal lung fibroblast, HFL1)购自美国ATCC。原代大鼠肺成纤维细胞与HFL1均培养在F12K(添加10%胎牛血清和1%链霉素/青霉素)培养基中。细胞均在37℃、CO2含量为5%的恒温孵育箱中生长。
TGF-β1是调节纤维化过程的重要促纤维化细胞因子[5],可以影响细胞的增生、转分化、凋亡和细胞外基质生成来调节组织的形态发生及转分化。肺成纤维细胞在受到TGF-β1刺激后,向肌成纤维细胞转化,并分泌细胞外基质蛋白来促进胶原的沉积和纤维化的发生[6],因此,本研究对IR-61抗纤维化作用进行了体外研究。原代大鼠肺成纤维细胞与HFL1用IR-61预处理后,再用TGF-β1刺激24 h。将细胞分为4组:正常对照组、IR-61处理组、TGF-β1处理和TGF-β1+IR-61处理组。IR-61处理组与TGF-β1+IR-61处理组在37 ℃的黑暗条件下,用20 μmol/L IR-61(溶解在无血清的培养基中)预处理细胞15 min,除去游离染料后,细胞用PBS洗涤2次,然后在新鲜的完全培养基中培养。在IR-61预处理后,TGF-β1和TGF-β1+IR-61处理组加入20 μmol/L TGF-β1, 恒温孵育箱培养24 h后提取RNA或蛋白。
1.6 Western blot分析将处理后4组(正常对照组、IR-61处理组、TGF-β1处理组和TGF-β1+IR-61处理组)原代肺成纤维细胞和HFL1于24 h后提取总蛋白,用BCA法测定蛋白浓度,配平后沸水浴10 min使蛋白变性,取40 μg蛋白样品于10% SDS-PAGE凝胶中,电泳1.5 h后经转膜至PVDF膜上。用快速封闭液常温封闭30 min,抗体Fibronectin、Collagen、α-SMA、Gapdh和Actin于4 ℃孵育一抗过夜。TBST洗膜3次,10 min/次,于TBST中,按照1 :1 000加入二抗孵育1 h。TBST洗膜4次,15 min/次,ECL显影成像。
1.7 RT-PCR分析将处理后4组(正常对照组、IR-61处理组、TGF-β1处理组和TGF-β1+IR-61处理组)原代肺成纤维细胞和HFL1于24 h后用TRIzol一步法提取转染细胞总RNA,反转录,使用SYBR Green qPCR (TaKaRa)进行实时PCR。检测相关转分化、增殖、迁移特异性基因(Collagen-1、Collagen-3、α-SMA、Fibronectin、FOXM1、CCNB1、CDC25b和AURKB)的表达。引物序列见表 1。
| 引物 | 上游引物(5′ →3′) | 下游引物(5′ →3′) | 片段大小/bp |
| COL1A1(Rat) | CCTGCCGATGTCGCTATCC | CTTCTTGAGGTTGCCAGTCTGTT | 126 |
| COL1A1(Homo) | GTGCGATGACGTGATCTGTGA | CGGTGGTTTCTTGGTCGGT | 119 |
| COL3A1(Rat) | TGCCACCCTGAACTCAAGAGC | AGCACCAGCATCTGTCCACCA | 162 |
| COL3A1(Homo) | GCCAAATATGTGTCTGTGACTCA | GGGCGAGTAGGAGCAGTTG | 145 |
| α-SMA(Rat) | TGAACCCTAAGGCCAACCG | TCCAGAGTCCAGCACAATACCA | 140 |
| α-SMA(Homo) | GATGCTCCCAGGGCTGTTTT | CCTCTTTTGCTCTGTGCTTCGTC | 135 |
| Fibronectin(Rat) | GACACTATGCGGGTCACTTGG | GCTGTTCGTACACGCTGGAGA | 193 |
| Fibronecti(Homo) | GGAGAATTCAAGTGTGACCCT | TGCCACTGTTCTCCTACGTGG | 184 |
| Aurkb(Rat) | CGCACCTGAAACATCCCAATA | TCCGCTCTTCTGTAGTTCCTTGTA | 122 |
| Aurkb(Homo) | CAGTGGGACACCCGACATC | GTACACGTTTCCAAACTTGCC | 94 |
| Ccnb1(Rat) | CCCTACCAAAACCTGTGGACAA | CACATCGGAGAAAGCCTGACA | 194 |
| Ccnb1(Homo) | AATAAGGCGAAGATCAACATGGC | TTTGTTACCAATGTCCCCAAGAG | 111 |
| Cdc25b(Rat) | CATCCCATCACGCCTTGTAAC | AACTCCTTGTAGCCGCCTTTG | 179 |
| Cdc25b(Homo) | ACGCACCTATCCCTGTCTC | CTGGAAGCGTCTGATGGCAA | 195 |
| Foxm1(Rat) | CCACAGAACTCTATTCGTCACAACC | CCAATGTCAAGTAGCGATTAGCAC | 121 |
| Foxm1(Homo) | GGAGCAGCGACAGGTTAAGG | GTTGATGGCGAATTGTATCATGG | 115 |
1.8 细胞划痕实验
有研究表明在肺纤维化的发展进程中,肺成纤维细胞迁移和侵袭性增强[7-8]。因此,本研究采用细胞划痕实验观察各组细胞迁移情况。将原代肺成纤维细胞和HFL1铺于6孔板上生长,直至形成汇合的单层细胞。用无菌的200 μL微吸管针尖作划痕,用PBS清洗细胞。取4孔分为4组(正常对照组、IR-61处理组、TGF-β1处理组和TGF-β1+IR-61处理组),经相应处理后,通过相差显微镜观察细胞迁移情况。
1.9 统计学分析采用SPSS 13.0统计软件。所有数据以x ± s表示,采用学生t检验和单因素方差分析。检验水准:α=0.05。
2 结果 2.1 IR-61靶向博莱霉素损伤的肺组织将正常对照组、IR-61处理组和BLM+IR-61处理组大鼠行NIR,IR-61处理组和BLM+IR-61处理组尾静脉注射IR-61(2.0 mg/kg),于24 h后用近红外成像仪比较不同组肺组织的荧光强度。结果显示:BLM+IR-61组肺组织荧光强度强,且未行气管内滴注BLM的IR-61组肺组织荧光强度弱,进一步证实了IR-61可相对靶向蓄积于受损伤肺组织(图 1)。表明IR-61选择性地蓄积到受损伤肺组织中,在体内成像和跟踪方面表现出良好的光学特性。

|
| A:大鼠各脏器形态观察1:心;2:肝;3:肠;4:肾;5:睾丸;6:肺;7:脾;B:近红外成像仪观察IR-61在各脏器的分布 图 1 近红外成像仪下观察IR-61在各组大鼠体内的分布 |
2.2 IR-61减轻BLM诱导的肺损伤和纤维化
在形态学方面,BLM处理组的动物表现为肺组织塌陷、表面粗糙,有白色/灰色纤维结节形成,BLM+IR-61处理组大鼠肺形态改善,肺塌陷少,纤维结节少。经组织学鉴定,与正常对照组相比博莱霉素可增强肺炎症反应,肺泡间隔增厚和肺泡间隙塌陷(图 2)。HE染色和Masson三色染色及定量分析结果表明:博莱霉素诱导的大鼠经IR-61处理后,肺纤维化的严重程度要低得多。单独接受IR-61的大鼠与对照组大鼠相比,对肺没有明显的影响,表明IR-61体内具有较强的抗纤维化作用和较好的安全性。

|
| A:肺组织形态;B:肺组织Masson三色染色;C:肺组织HE染色;D: Masson染色定量分析 1:正常对照组; 2: IR-61处理组;3:BLM处理组;4: BLM+ IR-61处理组;a: P < 0.05,与BLM组比较 图 2 各组大鼠肺组织病理学观察 |
2.3 IR-61抑制肺成纤维细胞转分化
原代大鼠肺成纤维细胞与HFL1用IR-61预处理后,再用TGF-β1刺激24 h,收集蛋白和RNA。Western blot检测结果显示:IR-61可以降低TGF-β1诱导的Fibronectin、Collagen和α-SMA蛋白表达;RT-PCR分析结果与Western blot一致,TGF-β1+IR-61组较TGF-β1组Collagen-1、Collagen-3、α-SMA、Fibronectin的mRNA水平明显下调(图 3、4)。表明IR-61抑制了TGF-β1诱导的肺成纤维细胞转分化。
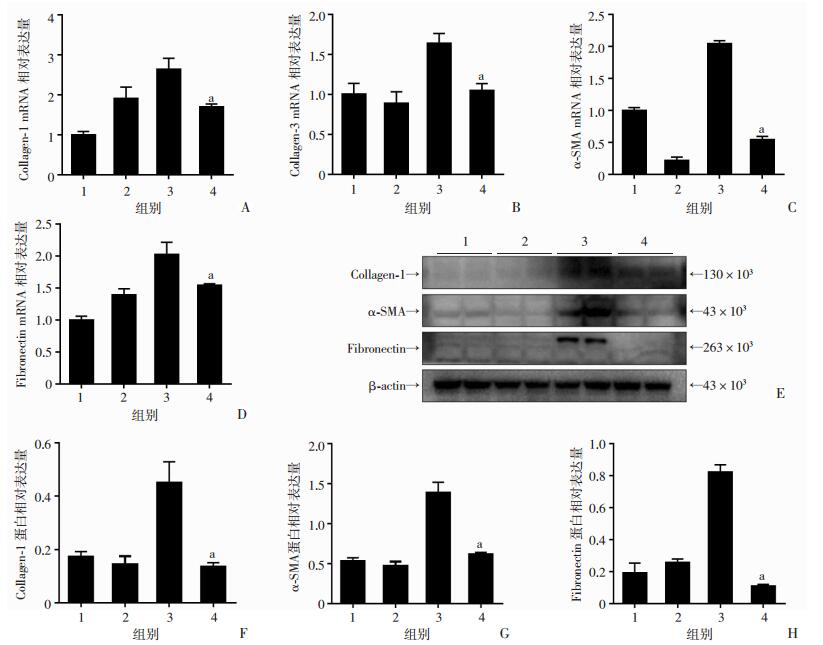
|
|
1:正常对照组; 2: IR-61处理组;3:TGF-β1处理组;4:TGF-β1+IR-61处理组;a:P < 0.05,与TGF-β1处理组比较 A~D:RT-PCR检测Collagen-1、Collagen-3、α-SMA和Fibronectin的mRNA表达;E:Western blot检测Collagen-1、α-SMA和Fibronectin的蛋白表达;F~H:Collagen-1、α-SMA和Fibronectin相对表达量分析 图 3 RT-PCR和Western blot检测大鼠原代肺成纤维细胞Collagen、α-SMA和Fibronectin的mRNA和蛋白表达 |
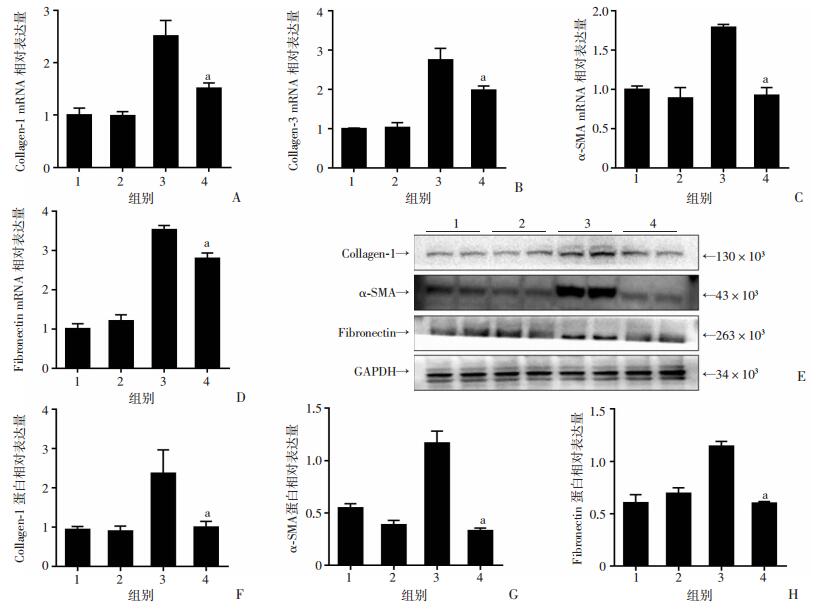
|
|
1:正常对照组; 2: IR-61处理组;3:TGF-β1处理组;4: TGF-β1+IR-61处理组;a:P < 0.05,与TGF-β1处理组比较 A~D:RT-PCR检测Collagen-1、Collagen-3、α-SMA和Fibronectin的mRNA表达;E:Western blot检测Collagen-1、α-SMA和Fibronectin的蛋白表达;F~H:Collagen-1、α-SMA和Fibronectin相对表达量分析 图 4 RT-PCR和Western blot检测人肺成纤维细胞(HFL1)Collagen、α-SMA和Fibronectin的mRNA和蛋白表达 |
2.4 IR-61抑制肺成纤维细胞增殖和迁移
TGF-β1刺激成纤维细胞后,增殖特异性FOXM 1、CCNB 1、CDC25b和AURKB基因的表达增加,而IR-61可以抑制TGB-β1的作用(图 5、6)。细胞划痕实验结果显示(图 7):TGF-β1处理引起细胞迁移水平增强,而IR-61可以明显降低HFL1和原代肺成纤维细胞的迁移能力。提示IR-61可以抑制肺纤维化过程中TGF-β1诱导的肺成纤维细胞的增殖和迁移。
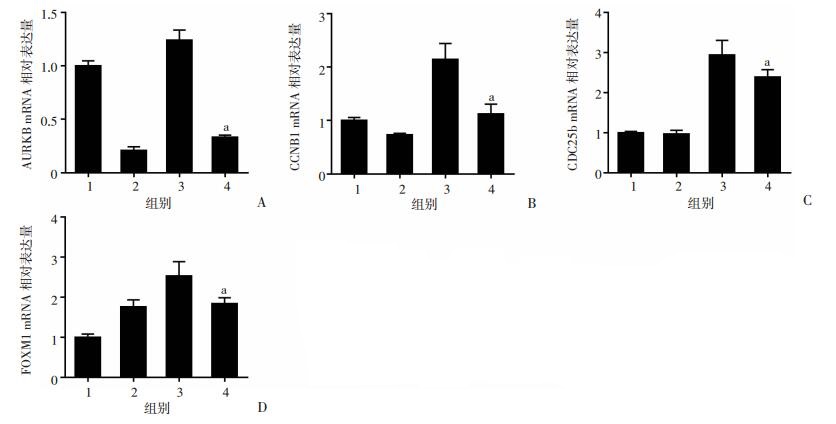
|
|
1:正常对照组; 2:IR-61处理组; 3: TGF-β1处理组; 4: TGF-β 1+IR-61处理组; a: P < 0.05, 与TGF-β 1比较 A~D:分别为AURKB、CCNB1、CDC25b、FOXM 1 mRNA表达分析 图 5 RT-PCR检测大鼠原代肺成纤维细胞增殖相关基因的mRNA表达 |

|
| 1:正常对照组; 2: IR-61处理组;3:TGF-β1处理组;4:TGF-β1+IR-61处理组;a: P < 0.05,与TGF-β1组比较 图 6 RT-PCR检测人肺成纤维细胞(HFL1)增殖相关基因的mRNA表达 |
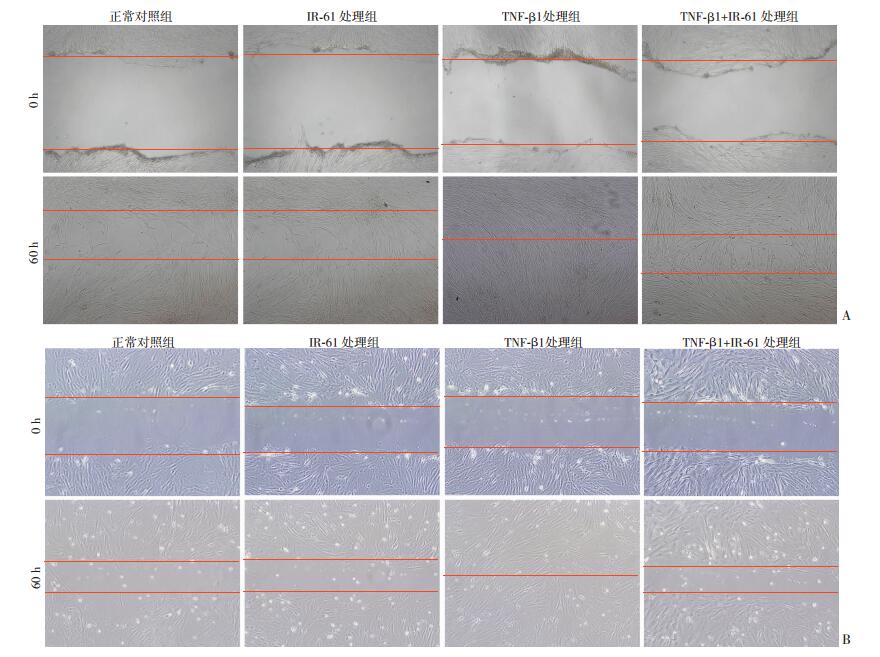
|
| A:大鼠原代肺成纤维细胞;B:人肺成纤维细胞(HFL1) 图 7 光学显微镜观察肺成纤维细胞划痕愈合情况 (×400) |
3 讨论
纤维化是组织损伤异常修复的结果,发生在包括肺在内的许多器官[9]。IPF是进展性的肺部疾病,尚没有有效的治疗方法。IPF的特点是肌成纤维细胞的无序积聚和过度的基质沉积。本课题组在前期研究中,通过对七甲川花菁类近红外荧光小分子的侧链进行化学结构修饰,改变其水溶性和电离常数,合成了一系列具有特定生物学活性的新型线粒体靶向荧光小分子[10-12]。本研究发现新型小分子染料七甲川花菁类荧光小分子IR-61可以靶向博来霉素损伤的肺组织。形态学、HE、Masson染色等研究结果显示:BLM处理大鼠28 d后,肺纤维化程度严重,肺组织塌陷、表面粗糙,有白色/灰色纤维结节形成,IR-61干预组大鼠的肺与BLM处理组相比,肺纤维化程度得到有效改善,肺塌陷少,形态改善,纤维结节少并减少了胶原沉积,为肺纤维化的靶向治疗研究提供了依据。
在肺纤维化过程中,由于各种细胞因子的刺激和信号通路的激活,肺泡上皮细胞和气道上皮细胞发生间质转化,并促使成纤维细胞转分化为肌成纤维细胞[13]。肺成纤维细胞是纤维化的关键效应细胞,肺成纤维细胞聚集、增殖和细胞外基质重构是肺纤维化的重要病理特征,可导致肺结构的不可逆损伤,以肺成纤维细胞功能为靶点的治疗已被证明是延缓IPF进展的有效方法[14]。本研究通过Western blot和RT-PCR分析发现:IR-61可有效降低肺成纤维细胞纤维化标志物Collagen-1、Collagen-3、α-SMA和Fibronectin的表达。此外,肺成纤维细胞迁移和浸润也在IPF发病机制中发挥重要作用[14]。有研究表明:与正常肺成纤维细胞相比,IPF肺成纤维细胞表现出高度增殖和迁移的表型[6]。为了确定IR-61在肺纤维化过程中是否调节肺成纤维细胞的增殖, 本研究评估了HFL1和原代肺成纤维细胞的增殖情况。RT-PCR结果显示:TGF-β1诱导的肺成纤维细胞增殖特异性基因FOXM1、CCNB1、CDC25b和AURKB的表达增高,且IR-61处理的肺成纤维细胞组增殖特异性基因的表达趋于正常化水平,从而达到抑制肺成纤维细胞增殖的作用。细胞划痕实验结果也显示IR-61可抑制肺成纤维细胞迁移。
综上所述,七甲川花菁类荧光小分子IR-61可以靶向到受损伤肺组织并通过抑制肺成纤维细胞的转分化、增殖和迁移来抑制肺纤维化的发生、发展,其具体作用机制有待进一步研究。
| [1] |
FANER R, ROJAS M, MACNEE W, et al. Abnormal lung aging in chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med, 2012, 186(4): 306-313. DOI:10.1164/rccm.201202-0282PP |
| [2] |
ROCKEY D C, BELL P D, HILL J A. Fibrosis: A common pathway to organ injury andfailure[J]. N Engl J Med, 2015, 372(12): 1138-1149. DOI:10.1056/nejmra1300575 |
| [3] |
Selman M, Pardo A. Revealing the pathogenic and aging-related mechanisms of the enigmatic idiopathic pulmonary fibrosis. an integral model[J]. Am J Respir Crit Care Med, 2014, 189(10): 1161-1172. DOI:10.1164/rccm.201312-2221PP |
| [4] |
WANG X, CHEN Z L, LUO S L, et al. Development of therapeutic small-moleculefluorophore for cell transplantation[J]. Adv Funct Mater, 2016, 26(46): 8397-8407. DOI:10.1002/adfm.201600996 |
| [5] |
WILLIS B C, BOROK Z. TGF-beta-induced EMT: mechanisms and implications for fibrotic lungdisease[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(3): L525-L534. DOI:10.1152/ajplung.00163.2007 |
| [6] |
AL-TAMARI H M, DABRAL S, SCHMALL A, et al. FoxO3 an important player infibrogenesis and therapeutic target for idiopathic pulmonary fibrosis[J]. EMBO Mol Med, 2018, 10(2): 276-293. DOI:10.15252/emmm.201606261 |
| [7] |
THIERY J P, SLEEMAN J P. Complex networks orchestrate epithelial-mesenchymal transitions[J]. Nat Rev Mol Cell Biol, 2006, 7(2): 131-142. DOI:10.1038/nrm1835 |
| [8] |
BLACK M, MILEWSKI D, LE T E, et al. FOXF1 inhibits pulmonary fibrosis by preventing CDH2-CDH11 cadherin switch inmyofibroblasts[J]. Cell Rep, 2018, 23(2): 442-458. DOI:10.1016/j.celrep.2018.03.067 |
| [9] |
WYNN T A, RAMALINGAM T R. Mechanisms of fibrosis: therapeutic translation for fibroticdisease[J]. Nat Med, 2012, 18(7): 1028-1040. DOI:10.1038/nm.2807 |
| [10] |
HUANG Y H, ZHOU J, LUO S L, et al. Identification of a fluorescent small-molecule enhancer for therapeutic autophagy in colorectal cancer by targeting mitochondrial proteintranslocase TIM44[J]. Gut, 2018, 67(2): 307-319. DOI:10.1136/gutjnl-2016-311909 |
| [11] |
WANG Y, LIAO X Y, SUN J G, et al. Characterization of HIF-1α/glycolysis hyperactive cell population via small-molecule-based imaging of mitochondrial transporteractivity[J]. Adv Sci (Weinh), 2018, 5(3): 1700392. DOI:10.1002/advs.201700392 |
| [12] |
WANG Y, LUO S L, ZHANG C, et al. An NIR-fluorophore-based therapeutic endoplasmic reticulum stress inducer[J]. Adv Mater, 2018, 1: e1800475. DOI:10.1002/adma.201800475 |
| [13] |
JOHNSON N A, SACHINWALLA T, WALTON D W, et al. Aerobic exercise training reduces hepatic and visceral lipids in obese individuals without weightloss[J]. Hepatology, 2009, 50(4): 1105-1112. DOI:10.1002/hep.23129 |
| [14] |
曾仁凤, 何振华, 张秀峰. 上皮细胞间质转化与肺纤维化的研究进展[J]. 当代医学, 2014, 20(2): 12-13. ZENG R F, HE Z H, ZHANG X F, et al. Research progress of interstitial transformation of epithelial cells and pulmonary fibrosis[J]. Contemp Med, 2014, 20(2): 12-13. DOI:10.3969/j.issn.1009-4393.2014.2.007 |



