2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:胸外科;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:呼吸与危重症医学中心
2. Department of Thoracic Surgery,Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China;
3. Center of Respiratory and Critical Care Medicine, Army Medical University (Third Military Medical University), Chongqing, 400037, China
肺癌是我国乃至全世界发病率和死亡率较高的恶性肿瘤之一,已经逐渐成为危害我国居民健康的主要疾病负担[1]。按照病理类型,肺癌可以分为小细胞肺癌和非小细胞肺癌(包括腺癌、鳞癌和大细胞肺癌),其中非小细胞肺癌在所有肺癌中约占85%。虽然在过去几十年,肺癌的诊断和治疗都取得了巨大的进步,然而肺癌患者的5年生存率仍只有约15%[2]。因此,进一步深入了解肺癌发生、发展的机制,寻找肺癌早期诊断和预后的分子标志物至关重要。
长链非编码RNA(long non-coding RNA,lncRNA)是指长度超过200个核苷酸的非编码RNA[3]。研究表明,lncRNA广泛参与基因的表达调控,而且在细胞增殖、凋亡、侵袭、转移以及肿瘤的发生、发展中发挥着不可忽视的作用[4-5]。lncRNA在肺癌的发生、发展中也起到关键的作用[6]。在前期工作中,我们发现一个新的可能与肺癌相关的lncRNA OSER1-AS1(oxidative stress responsive serine-rich 1 antisense RNA 1)。本研究检测lncRNA OSER1-AS1在肺癌与癌旁正常组织中的表达差异,分析其与预后的关联,并构建OSER1-AS1过表达细胞模型,从细胞水平探究过表达OSER1-AS1对非小细胞肺癌细胞株增殖、迁移、侵袭与凋亡的影响,为后续该lncRNA在非小细胞肺癌的机制研究奠定基础。
1 材料与方法 1.1 材料与试剂 1.1.1 细胞株人支气管上皮样细胞HBE和人非小细胞肺癌细胞株A549、H1299、SPCA1购于中科院上海细胞生物学研究所细胞库。
1.1.2 组织样本样本来自陆军军医大学第二附属医院2013年4月至2014年10月诊断的非小细胞肺癌患者,共计25例。纳入标准:①经术后病理诊断为非小细胞肺癌;②患者在手术前未进行任何放射或化疗治疗;③临床资料和病理组织样本完整。排除标准:①合并其他恶性肿瘤;②患有精神疾病;③有慢病史和有合并症的肺癌患者。患者均签署了知情同意书,且本研究2016年3月通过陆军军医大学伦理委员会批准。
1.1.3 试剂胎牛血清(FBS)购自Lonsera公司,青霉素-链霉素溶液购自碧云天公司,0.25%胰酶、RPMI1640培养基购自HyClone公司,Lipofectamine 2000购自Invitrogen公司,RNAiso Plus、逆转录试剂盒和qRT-PCR试剂盒均购自TaKaRa公司,CCK-8试剂盒购自日本同仁化学研究所,Transwell小室购自康宁公司,Matrigel基质胶购自美国BD公司,细胞凋亡检测试剂盒购自江苏凯基生物公司。
1.2 方法 1.2.1 lncRNA OSER1-AS1过表达载体的构建在NCBI网站获取lncRNA OSER1-AS1的全长序列ENST00000439943.5,合成该序列并构建至pcDNA3.1(上海生工公司合成构建),从而得到pcDNA3.1-OSER1-AS1过表达载体。将过表达载体转化至大肠杆菌感受态细胞,提取质粒,测序鉴定;将质粒转染肺癌细胞株,提取细胞总RNA,使用qRT-PCR方法检测不同肺癌细胞的过表达效果。
1.2.2 细胞培养及转染A549、H1299、SPCA1和HBE细胞用含有10%的胎牛血清和1%青霉素-链霉素溶液的RPMI1640培养基培养于培养箱(37 ℃,5%CO2)中,常规换液传代。取对数生长期的肺癌细胞株,0.25%胰酶消化,接种于6孔板,使用Lipofectamine 2000转染pcDNA3.1(空质粒对照组)和pcDNA3.1-OSER1-AS1(过表达组),转染按试剂说明书进行。
1.2.3 总RNA提取使用RNAiso Plus试剂盒提取RNA,按说明书推荐使用量加入细胞裂解液裂解细胞提取总RNA,提取后使用分光光度仪进行定量并检测纯度。
1.2.4 qRT-PCR检测基因表达量使用TaKaRa逆转录试剂盒的说明书将提取的RNA逆转录为cDNA,-20 ℃保存备用。根据荧光定量PCR试剂盒说明书的要求,配置25 μL的反应体系,其中cDNA 1 μL,上下游引物各1 μL,TB Green Premix Ex TaqⅡ 12.5 μL,无RNA酶水9.5 μL,PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,共计40个循环。其中引物序列为:OSER1-AS1基因上游引物序列5′-TTGTGTTCCCCAGTGTCTGC-3′,下游引物序列5′-CACTTTGTTAGCCAAGATGGTCTCG-3′;内参基因β-actin上游引物序列5′-CCACGAAACTACCTTCAACTCC-3′,下游引物序列5′-GTGATCTCCTTCTGCATCCTGT-3′。lncRNA OSER1-AS1和内参基因β-actin引物由上海生工公司生产。采用2-ΔΔCt法计算目的基因的相对表达水平。
1.2.5 CCK-8实验过表达组和空质粒对照组分别接种于96孔板,每孔加入100 μL细胞悬液,约2.5×103个细胞,每组设置3个复孔,分别在接种后24、48、72、96、120 h每孔加入10 μL CCK-8试剂孵育2 h,测定波长450 nm处的光密度值[D(450)]。实验重复3次。
1.2.6 细胞迁移过表达组和空质粒对照组经胰酶消化后,以无血清的培养基重悬接种于Transwell小室(2×104/孔),下室加入500 μL培养基(含10%血清),在培养箱继续培养12 h后取出Transwell小室,甲醇固定,结晶紫染色15 min。倒置显微镜下观察,取6个视野计数,实验重复3次。
1.2.7 细胞侵袭用预冷的无血清培养基将Matrigel基质胶按说明书要求稀释,每个Transwell小室加入60 μL稀释后的基质胶,在培养箱孵育30 min。过表达组和空质粒对照组经胰酶消化后,以无血清的培养基重悬接种于Transwell小室(5×104/孔),下室加入500 μL培养基(含10%血清),在培养箱继续培养24 h后取出Transwell小室,甲醇固定,结晶紫染色15 min。倒置显微镜下观察,取6个视野计数,实验重复3次。
1.2.8 细胞凋亡实验过表达组和空质粒对照组用不含EDTA的胰酶消化收集,用PBS洗涤细胞2次(2 000 r/min离心5 min)收集(1~5)×105细胞,根据细胞凋亡检测试剂盒说明书操作染色后,用流式细胞仪进行检测。实验重复3次。
1.3 统计学分析应用SPSS 9.0统计软件进行分析,计量资料以 表示,两组间比较采用独立样本t检验。利用Kaplan-Meier plotter网站(http://kmplot.com/analysis/index.php?p= service&cancer=lung)分析GEO和TCGA数据库中非小细胞肺癌患者lncRNA OSER1-AS1的表达与总生存率的关联,利用Kaplan-Meier方法绘制生存曲线,并进行对数秩检验和单因素Cox回归分析。检验水准α=0.05。
表示,两组间比较采用独立样本t检验。利用Kaplan-Meier plotter网站(http://kmplot.com/analysis/index.php?p= service&cancer=lung)分析GEO和TCGA数据库中非小细胞肺癌患者lncRNA OSER1-AS1的表达与总生存率的关联,利用Kaplan-Meier方法绘制生存曲线,并进行对数秩检验和单因素Cox回归分析。检验水准α=0.05。
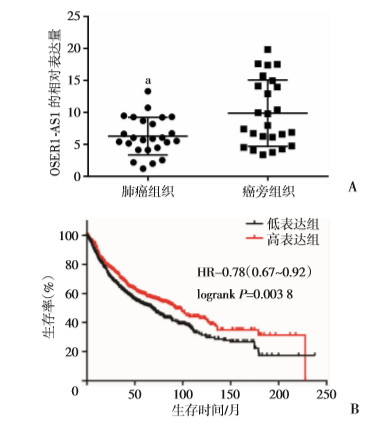
qRT-PCR检测lncRNA OSER1-AS1在25例非小细胞肺癌患者癌组织及其配对癌旁正常组织的表达水平,结果显示,癌组织中lncRNA OSER1-AS1的表达水平显著低于癌旁组织(P < 0.01,图 1A)。同时,利用Kaplan-Meier plotter网站分析1 145例非小细胞肺癌患者中lncRNA OSER1-AS1的表达与总生存率的关联。结果表明,lncRNA OSER1-AS1低表达与较低的总生存相关,且差异有统计学意义(P < 0.05,图 1B)。
|
| A:25对非小细胞肺癌患者癌组织与癌旁组织中lncRNA OSER1-AS1的表达 a:P < 0.01, 与癌旁组织比较;B:lncRNAOSER1-AS1的表达水平与预后的关系 图 1 lncRNA OSER1-AS1在肺癌组织与癌旁组织中的表达及其与预后的关系 |
2.2 lncRNA OSER1-AS1在非小细胞肺癌细胞中的表达
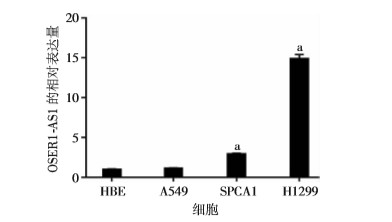
qRT-PCR检测人支气管上皮样细胞株HBE以及3株非小细胞肺癌细胞株(A549、H1299、SPCA1)中lncRNA OSER1-AS1的相对表达水平。与HBE细胞比较,A549细胞中lncRNA OSER1-AS1的表达差异并无统计学意义(P=0.06), 而SPCA1和H1299细胞中lncRNA OSER1-AS1的表达水平均显著升高(P < 0.01,图 2)。
|
| a:P < 0.01,与HBE比较 图 2 qRT-PCR检测lncRNA OSER1-AS1在各非小细胞肺癌株中的表达 |
2.3 lncRNA OSER1-AS1过表达载体的构建及过表达效果的鉴定
通过化学合成的方法合成lncRNA OSER1-AS1转录本ENST00000439943.5的序列,并由生工公司将其构建至pcDNA3.1载体,进而得到过表达载体pcDNA3.1-OSER1-AS1。在进行转染前,对过表达质粒进行双酶切,并进行了凝胶电泳,确认目的条带的大小符合预期(图 3A)。同时,对目的条带进行了测序,证明目的条带确实为lncRNA OSER1-AS1 ENST00000439943.5。将过表达载体分别瞬时转染至3种非小细胞肺癌细胞株,利用qRT-PCR检测了3种细胞的过表达效率。发现A549过表达了10.9倍,SPCA1细胞过表达了107.5倍,H1299细胞过表达了352倍(图 3B)。考虑到SPCA1和H1299细胞过表达效率更高,因此选择这两种细胞作为研究对象,继而研究lncRNA OSER1-AS1对肺癌细胞株生物学功能的影响。

|
| A:HindⅢ和NotⅠ双酶切产物电泳结果 1:DNA标准;2:过表达载体;B:qRT-PCR检测H1299、A549和H1299细胞中OSER1-AS1的表达水平 a:P < 0.01, 与空质粒对照组比较 图 3 OSER1-AS1过表达载体的构建及过表达效果的鉴定 |
2.4 lncRNA OSER1-AS1对细胞增殖能力的影响
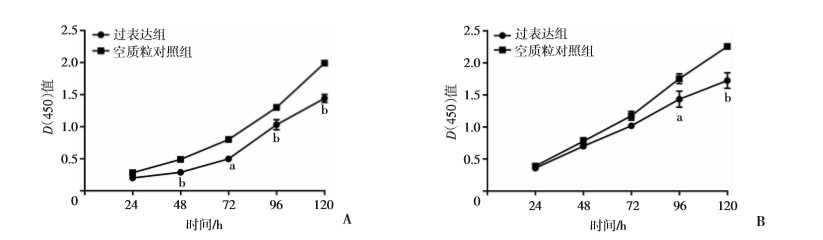
利用CCK-8法检测lncRNA OSER1-AS1对细胞增殖能力的影响,并绘制了生长曲线。发现在过表达lncRNA OSER1-AS1后,与空质粒对照组相比,可以显著降低H1299细胞和SPCA1细胞的增殖能力(P < 0.01,图 4)。
|
| A:H1299细胞;B:SPCA1细胞;a:P < 0.05, b:P < 0.01,与空质粒对照组比较 图 4 CCK-8检测OSER1-AS1过表达对H1299和SPCA1增殖能力的影响 |
2.5 lncRNA OSER1-AS1对细胞迁移能力的影响
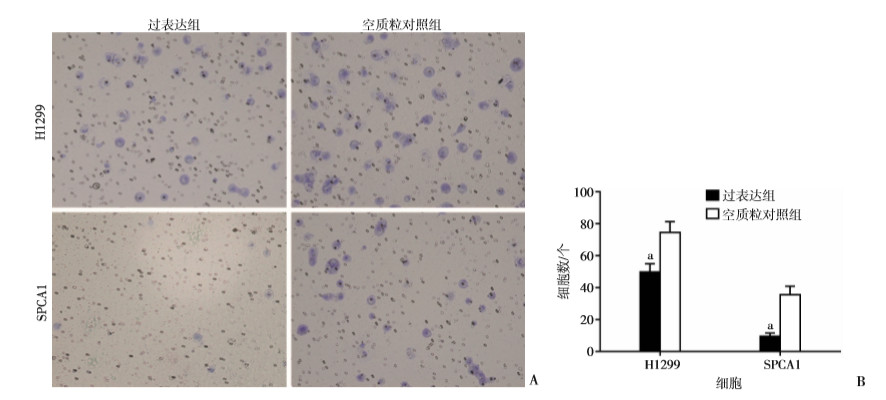
Transwell实验检测lncRNA OSER1-AS1对细胞迁移能力的影响,结果表明,在无基质胶的条件下,与空质粒对照组比较,过表达lncRNA OSER1-AS1可显著降低H1299和SPCA1细胞的迁移能力(P < 0.01,图 5)。
|
| A:Transwell细胞迁移实验结果(结晶紫×200);B:H1299和SPCA1迁移细胞数 a:P < 0.01,与空质粒对照组比较 图 5 过表达OSER1-AS1对H1299和SPCA1细胞迁移能力的影响 |
2.6 lncRNA OSER1-AS1对细胞侵袭能力的影响
Transwell实验检测lncRNA OSER1-AS1对细胞侵袭能力的影响,结果表明,在有基质胶的条件下,与空质粒对照组比较,过表达lncRNA OSER1-AS1可以显著降低H1299和SPCA1细胞的侵袭能力(P < 0.01,图 6)。
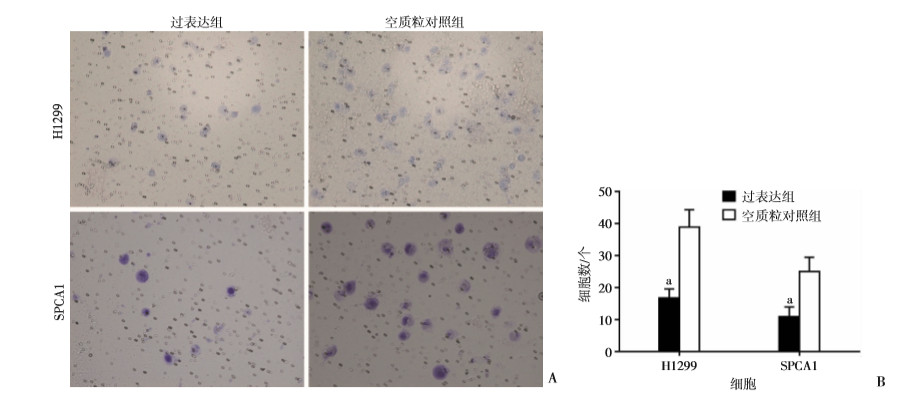
|
| A:Transwell细胞侵袭实验结果(结晶紫×200);B:H1299和SPCA1侵袭细胞数 a:P < 0.01,与空质粒对照组比较 图 6 过表达OSER1-AS1对H1299和SPCA1侵袭能力的影响 |
2.7 lncRNA OSER1-AS1对细胞凋亡的影响
利用流式细胞术检测lncRNA OSER1-AS1对细胞凋亡的影响,结果发现,与空质粒对照组比较,过表达lncRNA OSER1-AS1后H1299和SPCA1细胞的凋亡水平显著升高(P < 0.05,图 7)。
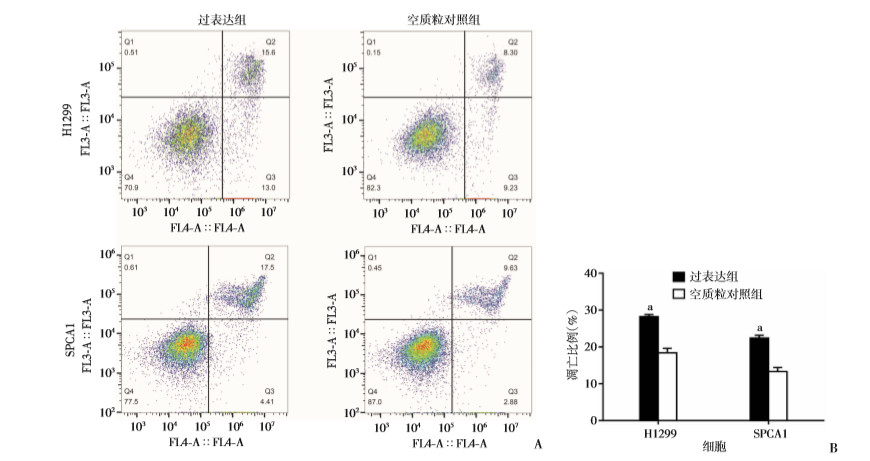
|
| A:流式细胞术检测结果;B:H1299和SPCA1凋亡分析 a:P < 0.05,与空质粒对照组比较 图 7 过表达OSER1-AS1对H1299和SPCA1细胞凋亡的影响 |
3 讨论
肺癌作为世界上最常见的恶性肿瘤,在2018年全球约有210万新发病例和180万死亡病例,严重威胁着人类的生命健康[7]。近年来,肺癌的临床诊断和治疗虽然取得了一定的进步,然而患者的5年生存率仍较低[8]。因此,深入探究肺癌的发生、发展机制,探究新的治疗策略仍十分重要。在早期的肿瘤研究中,人们对肺癌发病机制的研究局限在蛋白编码基因。然而,蛋白编码基因只占人类基因组转录本的2%,90%的基因并不能编码蛋白,而是转录为非编码RNA。按照编码长度,非编码RNA可以分为核苷酸长度少于200nt的短链非编码RNA和核苷酸长度大于200nt的长链非编码RNA。近期研究发现lncRNA在包括肺癌在内的多个肿瘤中表达异常,提示表达失调的lncRNA可能与肿瘤的发生发展密切相关[9]。
肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是最早发现与肺癌有关的lncRNA之一。其表达上调可以促进细胞增殖、转移和迁徙,并且和临床预后相关[10]。研究显示MALAT1通过多种机制发挥生物学功能,如MALAT1影响剪接因子的磷酸化水平进而调节mRNA前体的选择性剪接[11];此外,MALAT1还可以作为分子海绵,隔离mRNA前体剪接因子,进而调节靶基因的转录[12]。lncRNA H19在肺癌组织中高表达,过度表达的H19与患者不良预后相关,细胞实验和动物实验均证实H19在肺癌发挥促癌基因的作用[13],可能的机制为H19通过吸附miR-675上调Slug表达从而促进上皮间质转化过程[14]。此外,HOTAIR[15]、GAS5[16]、SPRY4-IT1[17]、UCA1[18]、MUC5B-AS1[19]等lncRNA在肺癌中的作用也受到了广泛关注。然而,对于lncRNA OSER1-AS1在肺癌功能和机制方面的研究尚未见报道。
生物信息学分析发现,lncRNA OSER1-AS1 ENST00000439943.5全长1 441 bp,有3个外显子,位于20q13.12染色体区域。本研究主要对lncRNA OSER1-AS1对肺癌细胞增殖、迁移、侵袭和凋亡的影响进行了初步探索。首先检测lncRNA OSER1-AS1在25例配对肺癌组织和癌旁组织中的表达水平,结果证实lncRNA OSER1-AS1在癌组织中的表达水平显著低于癌旁组织。同时利用在线网站Kaplan-Meier plotter分析lncRNA OSER1-AS1表达水平与总生存率的关系,证实低水平的lncRNA OSER1-AS1的表达与较低的总生存率相关。其次,检测lncRNA OSER1-AS1在不同非小细胞肺癌细胞株的表达水平,并挑选了过表达效率最高的H1299和SPCA1进行后续的功能研究。然后采用CCK-8、细胞迁移、侵袭实验和流式细胞术检测lncRNA OSER1-AS1对H1299和SPCA1细胞增殖、迁移、侵袭和凋亡的影响。结果显示,lncRNA OSER1-AS1可以抑制肺癌细胞的增殖、迁移和侵袭能力并促进凋亡。因此,我们初步推断该lncRNA可能在肺癌的发生、发展中起到抑癌基因的作用。
当然,本研究也存在一定的局限性。首先,本研究收集的组织标本较少,仅25对,无法继续分析癌组织OSER1-AS1表达水平与临床病理参数的关系;其次,本研究只观察了过表达lncRNA OSER1-AS1对肺癌细胞的影响,那么抑制该lncRNA是否会影响肺癌细胞的增殖、迁移、侵袭能力和凋亡水平,仍需要进一步研究;再次,本研究只对lncRNA OSER1-AS1进行了细胞功能的研究,关于该lncRNA如何发挥抑癌作用的分子机制仍需要继续探索;同时,目前本研究仅局限在细胞层面,后期我们将进行裸鼠成瘤实验与转移瘤实验,在动物水平进行实验验证。
综上所述,本研究显示,lncRNA OSER1-AS1可以抑制肺癌细胞株增殖、迁移和侵袭能力并促进凋亡,可能在肺癌的发生、发展中发挥抑癌的角色。后续我们将深入研究lncRNA OSER-AS1发挥抑癌作用的分子机制,为寻找新的诊断和治疗靶点提供理论依据。
| [1] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
CHEN Z, FILLMORE C M, HAMMERMAN P S, et al. Non-small-cell lung cancers: a heterogeneous set of diseases[J]. Nat Rev Cancer, 2014, 14(8): 535-546. DOI:10.1038/nrc3775 |
| [3] |
QUINN J J, CHANG H Y. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47-62. DOI:10.1038/nrg.2015.10 |
| [4] |
HUARTE M. The emerging role of lncRNAs in cancer[J]. Nat Med, 2015, 21(11): 1253-1261. DOI:10.1038/nm.3981 |
| [5] |
FATICA A, BOZZONI I. Long non-coding RNAs: new players in cell differentiation and development[J]. Nat Rev Genet, 2014, 15(1): 7-21. DOI:10.1038/nrg3606 |
| [6] |
WEI M M, ZHOU G B. Long non-coding RNAs and their roles in non-small-cell lung cancer[J]. Genom Proteom Bioinform, 2016, 14(5): 280-288. DOI:10.1016/j.gpb.2016.03.007 |
| [7] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [8] |
ANICHINI A, TASSI E, GRAZIA G, et al. The non-small cell lung cancer immune landscape: emerging complexity, prognostic relevance and prospective significance in the context of immunotherapy[J]. Cancer Immunol Immunother, 2018, 67(6): 1011-1022. DOI:10.1007/s00262-018-2147-7 |
| [9] |
RICCIUTI B, MENCARONI C, PAGLIALUNGA L, et al. Long noncoding RNAs: new insights into non-small cell lung cancer biology, diagnosis and therapy[J]. Med Oncol, 2016, 33(2): 18. DOI:10.1007/s12032-016-0731-2 |
| [10] |
GUTSCHNER T, HÄMMERLE M, EISSMANN M, et al. The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J]. Cancer Res, 2013, 73(3): 1180-1189. DOI:10.1158/0008-5472.CAN-12-2850 |
| [11] |
TRIPATHI V, ELLIS J D, SHEN Z, et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J]. Mol Cell, 2010, 39(6): 925-938. DOI:10.1016/j.molcel.2010.08.011 |
| [12] |
TRIPATHI V, SHEN Z, CHAKRABORTY A, et al. Long noncoding RNA MALAT1 controls cell cycle progression by regulating the expression of oncogenic transcription factor B-MYB[J]. PLoS Genet, 2013, 9(3): e1003368. DOI:10.1371/journal.pgen.1003368 |
| [13] |
ZHOU Y, SHENG B, XIA Q, et al. Association of long non-coding RNA H19 and microRNA-21 expression with the biological features and prognosis of non-small cell lung cancer[J]. Cancer Gene Ther, 2017, 24(8): 317-324. DOI:10.1038/cgt.2017.20 |
| [14] |
MATOUK I J, HALLE D, GILON M, et al. The non-coding RNAs of the H19-IGF2 imprinted loci: a focus on biological roles and therapeutic potential in Lung Cancer[J]. J Transl Med, 2015, 13: 113. DOI:10.1186/s12967-015-0467-3 |
| [15] |
LIU Z L, SUN M, LU K H, et al. The long noncoding RNA HOTAIR contributes to cisplatin resistance of human lung adenocarcinoma cells via downregualtion of p21(WAF1/CIP1) expression[J]. PLoS ONE, 2013, 8(10): e77293. DOI:10.1371/journal.pone.0077293 |
| [16] |
DONG S Y, QU X H, LI W Y, et al. The long non-coding RNA, GAS5, enhances gefitinib-induced cell death in innate EGFR tyrosine kinase inhibitor-resistant lung adenocarcinoma cells with wide-type EGFR via downregulation of the IGF-1R expression[J]. J Hematol Oncol, 2015, 8: 43. DOI:10.1186/s13045-015-0140-6 |
| [17] |
SUN M, LIU X H, LU K H, et al. EZH2-mediated epigenetic suppression of long noncoding RNA SPRY4-IT1 promotes NSCLC cell proliferation and metastasis by affecting the epithelial-mesenchymal transition[J]. Cell Death Dis, 2014, 5: e1298. DOI:10.1038/cddis.2014.256 |
| [18] |
NIE W, GE H J, YANG X Q, et al. LncRNA-UCA1 exerts oncogenic functions in non-small cell lung cancer by targeting miR-193a-3p[J]. Cancer Lett, 2016, 371(1): 99-106. DOI:10.1016/j.canlet.2015.11.024 |
| [19] |
王贵露, 袁帅, 胡泽曜, 等. 长链非编码RNA MUC5B-AS1在人肺腺癌细胞系中的功能研究[J]. 第三军医大学学报, 2017, 39(21): 2072-2077. WANG G L, YUAN S, HU Z Y, et al. Functional study of LncRNA MUC5B-AS1 in lung adenocarcinoma cell lines[J]. J Third Mil Med Univ, 2017, 39(21): 2072-2077. DOI:10.16016/j.1000-5404.201705020 |



