2. 400016 重庆,重庆医科大学:生命科学研究院骨发育与再生实验室
2. Laboratory of Bone Development and Regeneration, Institute of Life Sciences, Chongqing Medical University, Chongqing, 400016, China
我国每年因创伤骨折、骨肿瘤、股骨头缺血性坏死等造成的骨缺损患者高达200万人,骨缺损的修复重建是临床骨科学研究领域的热点课题[1-2]。骨髓基质细胞(bone marrow stromal cells,BMSCs)具有多向分化潜能,在体内处于相对静止状态,当受到各种生理或病理刺激时能分化为成骨细胞、软骨细胞、脂肪细胞、心肌细胞和骨骼肌细胞等[3],被视为骨再生的理想细胞来源[4]。骨骼中血管的生长与成骨紧密相关[5],但对其潜在细胞和分子机制尚不清楚。因此,如何诱导BMSCs定向分化成为成骨细胞和血管内皮细胞以促进骨再生和血管形成还需进一步探索。
生长因子,如骨形态发生蛋白(bone morphogenetic protein,BMP)、成纤维细胞生长因子(fibroblast growth factor,FGF)和转化生长因子(transforming growth factor beta,TGF-β),具有调节骨骼发育和稳态的功能[6]。其中TGF-β能够广泛调节细胞的生物活性,包括调节细胞增殖、分化和细胞外基质的合成等[7-8]。在TGF-β信号传导过程中,TGF-β配体与TGF-βⅡ型受体(transforming growth factor beta receptor Ⅱ,TGFBR2)结合后启动TGF-β信号,随后结合TGF-βⅠ型受体(TGFBR1),形成由2个TGFBR2和2个TGFBR1组成的异四聚体复合物,并启动下游信号传导,主要包括由磷酸化的Smad蛋白组成的经典通路和由有丝分裂原活化蛋白激酶(MAPK)JNK和p38α组成的非经典通路[9]。
在胚胎发育过程中敲除间充质细胞中TGFBR2,引起细胞增殖和成骨分化降低,导致骨发育缺陷[10]。提示在骨髓祖细胞成熟过程中TGFBR2至关重要,未成熟成骨细胞的增殖和成熟需要TGFBR2信号传导。此外,研究发现抑制成骨细胞中TGFBR2导致小鼠骨重塑减少和骨小梁骨量增加[11]。BMSCs不仅通过促进内皮细胞的迁移、侵袭,还通过表达内皮细胞特征进而诱导血管生成,并且这些过程受TGF-β的非经典途径中p38α信号的负调控。有研究显示沉默p38α可增强血管内皮标志物表达[12]。目前,TGFBR2在BMSCs的成骨分化和血管形成中的作用研究尚不明确,在成骨细胞不同成熟阶段TGFBR2所展现出截然不同的功能机制也未能阐明。因此,本研究拟采用针对TGFBR2的特异性抑制剂ITD-1[13],将整个TGF-β信号传导中断,探究ITD-1对BMSCs成骨分化过程及血管形成的影响,为开发促进骨和血管形成药物提供新的实验基础。
1 材料与方法 1.1 主要材料C57/BL6小鼠购自重庆医科大学实验动物中心。抑制剂ITD-1、细胞增殖-毒性检测试剂盒(cell countingkit-8,CCK-8)购自美国MedChemExpress公司;二甲亚砜(DMSO)购自美国MPBIO公司;BCIP/NBT碱性磷酸酯酶显色试剂盒检测试剂盒购自上海碧云天生物工程公司;茜素红S染色试剂购自北京索莱宝科技有限公司;Matrigel购自美国BD公司;胎牛血清、αMEM培养基购自美国赛默飞世尔科技公司;AnnexinV/PI双染试剂盒购自上海Bestbio公司;OPN、VEGF抗体、抗兔、抗鼠二抗购自武汉三鹰生物科技有限公司。CO2培养箱、台式低温离心机购自美国Thermo公司;定量PCR仪购自Bio-Rad公司;小动物骨密度仪购自美国KUBTEC公司;流式细胞仪购自美国BD公司。
1.2 骨髓基质细胞培养和分组小鼠乙醚麻醉后,脱颈处死,无菌条件下解剖,取其股骨和胫骨;采用含1%胎牛血清、链霉素100 mg/L和青霉素100 kU/L的αMEM培养液作为冲洗液,用注射器将股骨胫骨中骨髓冲出后过滤,加入含10%胎牛血清、链霉素100 mg/L和青霉素100 kU/L的αMEM培养液(αMEM完全培养基)中,于5%CO2饱和湿度、37 ℃培养箱孵育。培养3 d后换液,加入新鲜培养基,待其生长融合度达70%左右,经过胰酶消化后细胞按照2×105/cm2均匀接种于24孔板中。
细胞分3组:以ITD-1(10 μmol/L)处理的BMSCs为ITD-1组,以DMSO(1‰)处理的BMSCs作为DMSO组,另将以完全培养基培养的BMSCs作为空白组。
1.3 碱性磷酸酶(ALP)染色将BMSCs按照前述2×105/cm2接种于24孔板中,在空白组、DMSO组、ITD-1组分别添加100 μL的αMEM完全培养基、含1‰DMSO的αMEM完全培养基、含10 μmol/L ITD-1的αMEM完全培养基。每3天换液。待其生长至融合度80%~90%后,遵从BCIP/NBT碱性磷酸酶显色试剂盒说明书进行ALP染色。每组实验重复3次。
1.4 RNA提取及qPCR检测按上述铺板将BMSCs接种于24孔板中,按照分组分别作用细胞。待其生长融合度至80%~90%后提取RNA,经过基因组DNA去除反应和逆转录反应后得到cDNA。cDNA反应液进行稀释后,作为qPCR反应的模板。根据CFX96 Real-time PCR检测系统的操作步骤进行qPCR反应。全部样本结果以GAPDH的表达水平作标准。测定所使用的引物见表 1。
| 基因 | 上游引物(5′→3′) | 片段大小/bp | 下游引物(5′→3′) | 片段大小/bp |
| ALP | CACGGCGTCCATGAGCAGAAC | 21 | CAGGCACAGTGGTCAAGGTTGG | 22 |
| COL1 | GAGCGGAGAGTACTGGATCG | 20 | GCTTCTTTTCCTTGGGGTTC | 20 |
| OCN | AGACTCCGGCGCTACCTTGG | 20 | CGGTCTTCAAGCCATACTGGTCTG | 24 |
| GAPDH | GCACAGTCAAGGCCGAGAAT | 20 | GCCTTCTCCATGGTGGTGAA | 20 |
| OSX | CCCTTCTCAAGCACCAATGG | 20 | AAGGGTGGGTAGTCATTTGCATA | 23 |
| ANGPT1 | CCAGAACGGACCCTGCAG | 18 | TTCTCCAGCACCTGCAGC | 18 |
| VEGF | AGCACAGCAGATGTGAATGC | 20 | AATGCTTTCTCCGCTCTGAA | 20 |
1.5 凋亡检测
将BMSCs接种于6孔板中,按照分组分别处理细胞,每组重复3次独立实验,24 h后,收集包括漂浮在上清液内的所有细胞,根据AnnexinV/PI双染法说明书染色后,采用流式细胞仪检测细胞凋亡。
1.6 细胞增殖能力检测将BMSCs按照实验设计分组,每孔加入1 000个细胞,贴壁后,按照分组分别处理细胞,在37 ℃、5% CO2及饱和湿度条件下培养1、12、24、48 h后,每组重复5次独立实验。采用CCK-8检测试剂盒,每测试孔中分别添加10 μL CCK-8溶液,继续孵育4 h后,使用酶标仪于450 nm波长条件下测定每孔光密度值[D(450)],并且按照细胞数量的标准曲线计算得出细胞数量。
1.7 茜素红染色将BMSCs按2×105/孔铺于24孔板中,分为3组,分别向每组BMSCs中加入不含有药物、含有1‰DMSO、含10 μmol/L ITD-1的成骨诱导培养基(10%胎牛血清、100 mg/L链霉素、100 kU/L青霉素、50 mg/L维生素C、10 mmol/L β磷酸甘油二钠、0.1 μmol/L地塞米松),在37 ℃、5%CO2及饱和湿度条件下培养14 d,利用茜素红染色试剂盒进行细胞染色,镜下观察并拍照,利用Image J软件进行钙化面积比分析。
1.8 小鼠器官培养出生后1~3 d乳鼠(10只)购自重庆医科大学实验动物中心。处死后,无菌条件下解剖获得其上肢并去除多余皮肤肌肉组织,在成骨诱导培养基中加入DMSO或ITD-1进行培养至12 d,每组重复进行5次独立实验,将所得组织进行骨密度测定。
1.9 免疫荧光观察4%多聚甲醛中固定细胞10 min后洗涤,0.25%TritonX-100通透样品10 min,山羊血清封闭30 min,加入稀释后一抗4 ℃过夜孵育,PBS洗涤后加入二抗室温避光孵育1 h,洗涤后加入DAPI,再次洗涤后显微镜下观察并拍照,利用Image J软件进行阳性细胞百分比分析。
1.10 统计学分析采用SPSS 22.0统计软件,数据以x ± s表示。采用单因素方差分析比较多组间差异,SNK检验比较两组间差异。检验水准:α=0.05。
2 结果 2.1 ITD-1对BMSCs增殖和凋亡的影响利用1‰DMSO、10 μmol/L ITD-1对原代BMSCs作用24 h后,采用流式细胞仪检测细胞凋亡情况,结果显示(图 1A、B):ITD-1浓度为10 μmol/L时,对细胞凋亡不造成影响;同时经DMSO、ITD-1处理1、12、24、48 h后,利用CCK-8试剂盒进行细胞增殖检测,结果显示(图 1C、D):与空白组相比,DMSO(1‰)对细胞增殖不造成影响,而与DMSO组相比,ITD-1组对BMSCs具有显著的增殖抑制作用(P < 0.05)。表明10 μmol/L ITD-1没有对细胞产生毒性作用,未见细胞死亡,同时证明当ITD-1抑制BMSCs中TGFBR2后,将导致BMSCs增殖活性降低。

|
| A:流式细胞仪检测细胞凋亡水平;B:细胞凋亡率定量分析;C:CCK-8试剂盒检测BMSCs增殖变化;D:处理24 h后BMSCs数量a: P < 0.05,与DMSO组比较 图 1 ITD-1对BMSCs增殖和凋亡的影响 |
2.2 ITD-1降低BMSCs的ALP活性及成骨矿化
ALP染色结果显示(图 2A):ITD-1组ALP染色相较于DMSO组颜色更浅。利用DMSO或ITD-1持续处理BMSCs 7 d后,加入成骨诱导培养基继续培养至14 d,进行茜素红染色,结果显示(图 2B):ITD-1组钙盐结节较DMSO组、空白组显著降低(钙化面积比:0.015±0.009 vs 0.173±0.059、0.200±0.036,P < 0.05)。提示在ITD-1的作用下,BMSCs早期成骨分化和晚期钙盐结节生成均被抑制。

|
| A:ALP染色检测BMSCs成骨分化;B:茜素红染色检测BMSCs矿盐结节 图 2 ITD-1对成骨分化及矿盐沉积的影响 |
2.3 ITD-1显著降低成骨标志物表达
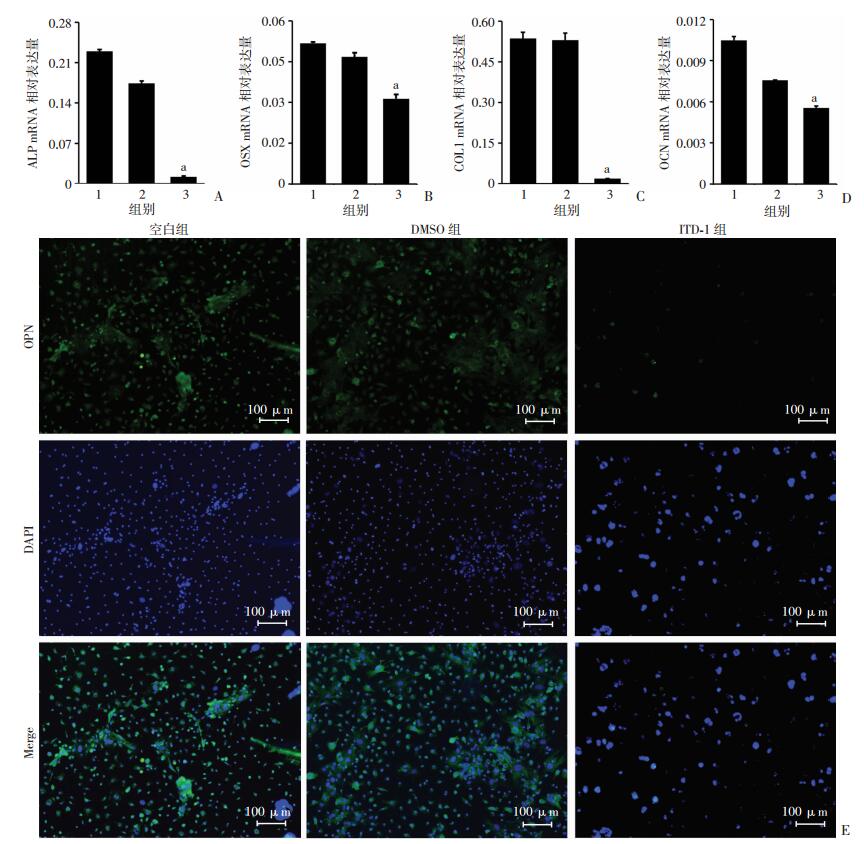
qPCR检测各组细胞成骨标志物ALP、OSX、OCN、COL1,结果显示(图 3A~D):与DMSO组比较,ITD-1组成骨标志物的相对表达量都显著降低(P < 0.01)。免疫荧光结果同样显示(图 3E):ITD-1组较DMSO组、空白组OPN的表达显著降低[OPN阳性细胞百分比:(0.487±0.274)% vs (22.334±5.641)%、(24.103± 7.348)%,P < 0.01]。该结果与ALP染色、茜素红染色结果一致,进一步证明在ITD-1的作用下,BMSCs成骨分化过程被显著抑制。
|
| A~D:qPCR检测各组细胞ALP、OSX、COL1、OCN mRNA表达1:空白组;2: DMSO组;3: ITD-1组;E:免疫荧光检测OPN表达绿色荧光为细胞内OPN 图 3 ITD-1对BMSCs成骨相关标志物mRNA表达及OPN表达的影响 |
2.4 ITD-1对体外小鼠器官培养骨密度的影响
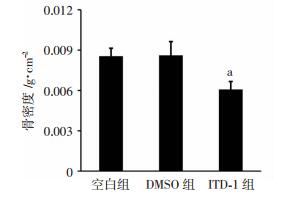
肱骨骨密度测定结果显示(图 4):DMSO组与空白组骨密度没有差异,而ITD-1组相较于DMSO组,肱骨骨密度显著降低(P < 0.05)。进一步说明利用ITD-1抑制BMSCs中TGFBR2后能够显著降低体外培养胎鼠肱骨骨组织的骨密度。
|
| a:P < 0.05,与DMSO组比较 图 4 ITD-1对小鼠肱骨骨密度的影响 |
2.5 ITD-1显著增强BMSCs促进血管生成的能力
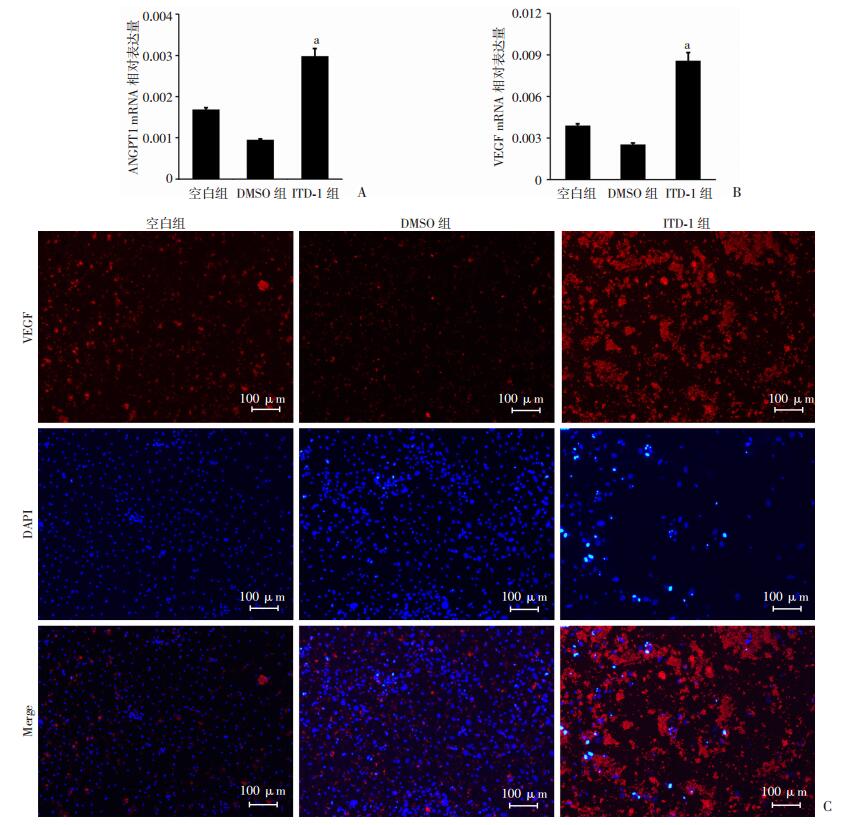
提取各组细胞RNA进行qPCR,检测成血管相关标志物的表达。发现ITD-1组相较于DMSO组成血管标志物VEGF(P < 0.01)、ANGPT1(P < 0.01)的相对表达量均显著增高(图 5A、B),进一步进行VEGF的免疫荧光染色显示:ITD-1组较DMSO组、空白组VEGF的表达显著增多[VEGF阳性细胞百分比:(18.530±4.405)% vs (2.460±1.088)%、(2.010±0.907)%,P < 0.05, 图 5C]。提示利用ITD-1抑制BMSCs中TGFBR2后能够显著增强BMSCs血管生成能力。
|
| A、B:qPCR检测ANGPT1、VEGF mRNA表达;C:免疫荧光检测VEGF表达红色荧光为细胞内VEGF 图 5 ITD-1对BMSCs成血管相关标志物mRNA表达及VEGF表达的影响 |
3 讨论
骨作为人体内代谢旺盛的器官,其代谢主要由成骨细胞和破骨细胞相互作用保持动态平衡,协调骨组织代谢,前者执行骨形成功能,而后者执行骨吸收功能。骨组织通过破骨细胞产生的旧骨重吸收作用和成骨细胞产生的新骨形成作用保证了骨量的动态稳定,该过程被称为骨重塑[14]。在骨重塑过程如果发生紊乱,将引起一系列与代谢相关的骨病,例如骨质疏松症或骨折不愈合。近来研究显示:多种因子,包括bFGF、TGF-β、血小板衍生因子(PDGF)、骨形态发生蛋白(BMPs)在内的细胞因子、激素和生长因子等,在骨重塑过程中,发挥着关键作用。TGF-β参与从干细胞募集到终末分化再到骨形成和骨吸收等过程调节骨稳态。TGF-β通过调节成骨和重吸收相关细胞的活性及感应物理负荷,维持骨骼稳态[15]。在骨骼和许多其他组织中,TGF-β的作用是非线性的,这样TGF-β信号增加和减少都会产生骨质疏松表型[16]。因此,TGF-β信号在骨中产生这种明显矛盾现象的机制仍待进一步探究,以明确其在骨发育和重塑过程中所扮演的角色。
骨是高度血管化的组织。骨骼脉管结构在骨骼发育、骨再生和重塑阶段起着至关重要的作用[17]。氧气或营养物质通过血管送达骨骼系统,代谢废物也通过血管去除,同时各种激素及生长因子也经血管递送至骨骼系统,以维持骨中细胞存活[18]。血管和骨中细胞之间的相互作用异常,将导致多种骨骼疾病的发展,如颅面畸形或特发性骨坏死[19]。
TGF-β作为血管内皮调节剂的作用机制尚不清楚[20]。TGF-β经典途径为TGF-β结合其受体并诱导Smad2/3的磷酸化,但也可以通过非经典信号通路激活其他信号传导,包括有丝分裂原活化蛋白激酶(MAPK)、JNK和p38α[9]。TGF-β激活的TAK1对于TGF-β诱导的JNK和p38α激活是必需的,TAK1缺陷的胚胎存在血管缺陷[12]。p38α和JNK的信号传导也与内皮细胞增殖和凋亡有关,还与血管生成调节因子如VEGF产生有关[12]。然而,TGF-β激活的Smad经典信号通路和MAPK信号传导对BMSCs转化为内皮样细胞的贡献以及这是否影响血管生成,尚不清楚。因此,本研究通过特异性TGFBR2的小分子抑制剂研究抑制TGF-β经典及非经典信号通路的情况下,其成血管分化的影响。
本研究利用小分子药物ITD-1抑制BMSCs中TGF-β信号,通过ALP染色、茜素红染色、成骨成血管相关标志物的mRNA相对表达量测定、小鼠器官体外培养实验以及成骨相关标志物OPN和成血管相关标志物VEGF的免疫荧光染色发现:在不影响细胞凋亡的情况下,ITD-1导致BMSCs增殖速率显著降低,同时明显抑制其成骨分化,而成血管相关实验表明ITD-1能够显著增强BMSCs的成血管能力。
综上所述,小分子药物ITD-1抑制BMSCs中TGFBR2后,BMSCs的成骨分化显著降低而血管形成能力显著增强,但是其在成骨、成血管分化中产生作用的确切机制还需要深入研究。根据前期结果,该现象可能的机制为TGF-β信号经典通路的抑制导致了成骨分化降低,而非经典信号通路的抑制则导致了血管形成增强,敲除非经典通路中p38能够促进血管生成[12],但是经典通路与非经典通路在成血管和成骨之间的相互作用仍然需要做进一步的探究。本研究下一步拟通过RNA-Seq技术从基因表达的角度深入研究,确定产生该现象的机制。TGF-β信号作为目前已知的最复杂的细胞生长因子,在成骨、成血管分化中的作用众说纷纭,深入研究TGF-β信号中的关键受体TGFBR2在成骨、成血管分化中的作用,有助于揭示TGF-β在成骨成血管分化中的作用机制,为临床骨科TGFBR2的小分子抑制剂的应用提供方向。
| [1] |
MAJIDINIA M, SADEGHPOUR A, YOUSEFI B. The roles of signaling pathways in bone repair and regeneration[J]. J Cell Physiol, 2018, 233(4): 2937-2948. DOI:10.1002/jcp.26042 |
| [2] |
LIU Z P, YUAN X, FERNANDES G, et al. The combination of nano-calcium sulfate/platelet rich plasma gel scaffold with BMP2 gene-modified mesenchymal stem cells promotes bone regeneration in rat critical-sizedcalvarial defects[J]. Stem Cell Res Ther, 2017, 8(1): 122. DOI:10.1186/s13287-017-0574-6 |
| [3] |
POLYMERI A, GIANNOBILE W V, KAIGLER D. Bone marrow stromal stem cells in tissue engineering and regenerative medicine[J]. Horm Et Metab, 2016, 48(11): 700-713. DOI:10.1055/s-0042-118458 |
| [4] |
CHU W X, GAN Y K, ZHUANG Y F, et al. Mesenchymal stem cells and porous β-tricalcium phosphate composites prepared through stem cell screen-enrich-combine(-biomaterials) circulating system for the repair of critical size bone defects in goat tibia[J]. Stem Cell Res Ther, 2018, 9(1): 157. DOI:10.1186/s13287-018-0906-1 |
| [5] |
KUSUMBE A P, RAMASAMY S K, ADAMS R H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone[J]. Nature, 2014, 507(7492): 323-328. DOI:10.1038/nature13145 |
| [6] |
FELBER K, ELKS P M, LECCA M, et al. Expression ofosterix is regulated by FGF and wnt/β-catenin signalling during osteoblast differentiation[J]. PLoS ONE, 2015, 10(12): e0144982. DOI:10.1371/journal.pone.0144982 |
| [7] |
SHANG W K, ADZIKA G K, LI Y J, et al. Molecular mechanisms of circular RNAs, transforming growth factor-β, and long noncoding RNAs in hepatocellular carcinoma[J]. Cancer Med, 2019, 8(15): 6684-6699. DOI:10.1002/cam4.2553 |
| [8] |
MAJIDINIA M, SADEGHPOUR A, YOUSEFI B. The roles of signaling pathways in bone repair and regeneration[J]. J Cell Physiol, 2018, 233(4): 2937-2948. DOI:10.1002/jcp.26042 |
| [9] |
ZHANG Y G. Non-smad signaling pathways of the TGF-β family[J]. Cold Spring Harb Perspect Biol, 2017, 9(2): a022129. DOI:10.1101/cshperspect.a022129 |
| [10] |
PETERS S B, WANG Y, SERRA R. TGFBR2 is required in osterix expressing cells for postnatal skeletal development[J]. Bone, 2017, 97: 54-64. DOI:10.1016/j.bone.2016.12.017 |
| [11] |
EHNERT S, HEUBERGER E, LINNEMANN C, et al. TGF-β1-dependent downregulation of HDAC9 inhibits maturation of human osteoblasts[J]. J Funct Morphol Kinesiol, 2017, 2(4): 41. DOI:10.3390/jfmk2040041 |
| [12] |
BATLLE R, ANDRÉS E, GONZALEZ L, et al. Regulation of tumor angiogenesis and mesenchymal-endothelial transition by p38α through TGF-β and JNK signaling[J]. Nat Commun, 2019, 10(1): 3071. DOI:10.1038/s41467-019-10946-y |
| [13] |
WILLEMS E, CABRAL-TEIXEIRA J, SCHADE D, et al. Small molecule-mediated TGF-β type Ⅱ receptor degradation promotescardiomyogenesis in embryonic stem cells[J]. Cell Stem Cell, 2012, 11(2): 242-252. DOI:10.1016/j.stem.2012.04.025 |
| [14] |
SIDDIQUI J A, PARTRIDGE N C. Physiological bone remodeling: systemic regulation and growth factor involvement[J]. Physiology (Bethesda), 2016, 31(3): 233-245. DOI:10.1152/physiol.00061.2014 |
| [15] |
WU M R, CHEN G Q, LI Y P. TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease[J]. Bone Res, 2016, 4: 16009. DOI:10.1038/boneres.2016.9 |
| [16] |
DOLE N S, MAZUR C M, ACEVEDO C, et al. Osteocyte-intrinsic TGF-β signaling regulates bone quality throughperilacunar/canalicular remodeling[J]. Cell Rep, 2017, 21(9): 2585-2596. DOI:10.1016/j.celrep.2017.10.115 |
| [17] |
HUANG B, WANG W H, LI Q C, et al. Osteoblasts secrete Cxcl9 to regulate angiogenesis in bone[J]. Nat Commun, 2016, 7: 13885. DOI:10.1038/ncomms13885 |
| [18] |
NIEDŹWIEDZKI T, FILIPOWSKA J. Bone remodeling in the context of cellular and systemic regulation: the role of osteocytes and the nervous system[J]. J Mol Endocrinol, 2015, 55(2): R23-R36. DOI:10.1530/JME-15-0067 |
| [19] |
FILIPOWSKA J, TOMASZEWSKI K A, NIEDŹWIEDZKI Ł, et al. The role of vasculature in bone development, regeneration and proper systemic functioning[J]. Angiogenesis, 2017, 20(3): 291-302. DOI:10.1007/s10456-017-9541-1 |
| [20] |
KUMAR P, NAUMANN U, AIGNER L, et al. Impaired TGF-β induced growth inhibition contributes to the increased proliferation rate of neural stem cells harboring mutant p53[J]. Am J Cancer Res, 2015, 5(11): 3436-3445. |



