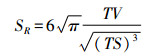组织因子(tissue factor, TF)是一种分子量为47×103启动外源性凝血途径的单链跨膜糖蛋白。研究表明,TF不仅参与机体内的凝血级联反应,还在多种实体肿瘤的发生、发展及侵袭、转移过程中发挥重要作用。TF不但可以造成肿瘤细胞的休眠逃逸和基因改变,引起肿瘤细胞的大量增殖,而且其高表达引起的凝血系统改变也被认为是肿瘤发生的始动因素之一[1-2]。TF的过表达常常预示着肿瘤的高度恶性和较差的预后,而TF被抑制后肿瘤生长被抑制、血管生成减少[3]。在胶质瘤中,TF表达量与胶质瘤的恶性程度及肿瘤分级相关[4],使得抗TF治疗成为胶质瘤治疗的新靶点。胶质母细胞瘤(glioblastoma, GBM)是恶性程度最高的胶质瘤,极高的血管生成活性是其预后极差的主要原因之一[5]。TF的表达水平对GBM的预后及抗血管生成治疗效果具有重要的影响[6]。因此,评价GBM患者TF表达水平对其治疗方式选择及预后评价具有重要的临床意义。
目前,对于TF的检测主要基于肿瘤组织常规免疫组化染色,其取材过程有创且不能实时有效地反映TF的动态变化,取材误差常常是影响其准确性的关键因素。磁共振成像(magnetic resonance imaging, MRI)、核素标记抗体活性位点的正电子发射计算机断层显像(positron emission computed tomography, PET-CT)等已经被证实可用于多种影响肿瘤预后的分子检测(如IDH、HIF-1α、Ki67、VEGF等)[7-9]。然而,靶向TF的PET-CT成像方式常用于术前TF表达水平的检测,对于术后复发病例的敏感度低于MRI[10],此外,PET-CT检查费用高,不利于常规应用于TF的临床动态活体监测。动态对比增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging, DCE-MRI)虽然被报道可用于TF的动态监测[11],但也面临影像标记物相对单一、易受个体差异与成像条件影响的问题,其敏感度与特异性也有待进一步研究。
多模态磁共振成像已广泛应用于GBM患者的诊断及鉴别诊断,动态磁敏感增强磁共振成像(dynamic susceptibility contrast magnetic resonance imaging,DSC-MRI)和动态对比增强磁共振成像(DCE-MRI)能够很好地实时反映肿瘤内部微血管密度、通透性及血流灌注[12]。本研究通过对60例GBM患者进行术前常规及灌注磁共振成像以及对术后标本进行免疫组化染色定量研究,探讨多种磁共振参数与TF表达量的相关性,获得鉴别TF高表达和低表达GBM的各影像学参数的最佳阈值及其敏感度和特异性。从而进一步探讨磁共振成像参数在活体动态过程中评价TF表达水平的应用价值,为GBM患者疗效评估和预后判断提供重要的影像资料。
1 资料与方法 1.1 病例资料收集本院2014年8月至2018年11月期间初诊为GBM的患者,患者术前均进行头颅MRI扫描(常规MRI、DCE、DSC)及术后病理检查,术后标本根据WHO 2016年CNS肿瘤分类行病理分级。纳入标准:①患者行MRI检查前未接受任何治疗;②签署检查患者知情同意书;③行手术治疗;④术后病理结果确认为胶质母细胞瘤(GBM,WHOⅣ级);⑤无高血压、糖尿病以及心、肝、肾障碍等其他基础疾病。排除标准:①不能耐受MRI扫描过程者;②对比剂过敏者;③孕期妇女;④颅内有其他肿瘤患者。经筛选共纳入患者60例,年龄9~81 (50.6±15.4)岁,男性39例,女性21例。本研究通过本院伦理委员会机构审查和批准(医研伦审2014第9号)。
1.2 磁共振图像采集及处理扫描采用Siemens Verio 3.0T磁共振及8通道线圈。常规MRI扫描序列包括T1WI:TR=1 770 ms, TE=20 ms;T2WI:TR=4 660 ms, TE=110 ms;FLAIR:TR=8 602 ms,TE=126 ms,激励次数(NEX)=1,矩阵320×320,层厚5 mm。使用钆对比剂进行增强扫描。
DSC灌注扫描参数如下:TR=1 500 ms, TE(GR)= 30 ms, TE(SE)=100 ms,FOV=24 cm×24 cm,翻转角:90°,矩阵:64×64,NEX=1,层数:7,每层面采集50帧图像,在第2帧时经肘前静脉按照0.2~0.3 mmol/kg团注Gd-DTPA,流速3 mL/s,再注入等量生理盐水冲洗导管。
DCE灌注扫描参数如下:T1-vibe序列(分别采用翻转角2°与15°, TR=5.08 ms,TE=1.74 ms,FOV=26 cm×26 cm,矩阵:138×192,层厚:5 mm)扫描2组T1WI图像;T1-twist序列(翻转角采用12°,TR=4.82 ms,TE=1.88 ms,FOV=26 cm×26 cm,矩阵:138×192),共进行75次采集,时间间隔5.3 s。在第6次采集时,以4 mL/s的速率按照0.1 mmol/kg经肘静脉注入钆喷酸双葡甲胺。进行DCE和DSC两种灌注扫描时,两者之间间隔24 h以上。
1.3 图像后处理 1.3.1 常规MRI图像处理由2名5年以上工作经验的放射科医师采用3D slicer4.8.1软件结合GBM患者常规T1、T2以及增强后图像,对所有GBM显示层面肿瘤的强化、坏死、水肿区域分别进行图像分割,将各个层面的图像信息,经3D重建后分别得到GBM强化、坏死、水肿的体积和表面积参数, 并计算得到肿瘤坏死比(坏死体积/肿瘤体积)及表面规律性(SR)。其计算公式如下,其中TV为肿瘤总体积,TS为肿瘤总表面积[13]。
1.3.2 功能磁共振图像处理由3名5年以上工作经验的放射科医师在Siemens Syngo工作站上对DSC图像进行处理并绘制伪彩图,选取多个层面,采用热点法选取多个ROI,ROI面积为25~40 mm2 ,每个患者绘制3~4个ROI,分别测量灌注效果最为显著区域的脑血容量(cerebral blood volume, CBV)、脑血流量(cerebral blood flow, CBF)值,测量过程中,ROI应避开囊变、坏死和出血区域,同时取病灶相应对侧正常脑白质相应CBF、CBV值作为参考基准,肿瘤区与正常脑白质区的比值即为各个肿瘤区域ROI的相对脑血容量(relative cerebral blood volume, rCBV)、相对脑血流量(relative cerebral blood flow, rCBF),并计算得到rCBV及rCBF平均值。在Omni Kinetics工作站上对DCE图像进行计算处理并得到伪彩图,以颈内动脉为动脉输入函数(AIF),获得脑组织时间/信号强度曲线,得到与T1WI图像相应的容量转移常数(volume transfer constant, Ktrans)图,采用热点法在Ktrans最显著区域放置多个ROI,ROI应避开囊变、坏死和出血区域,最后计算得到Ktrans平均值。
1.4 免疫组化检测 1.4.1 免疫组化染色运用免疫组化法判定患者GBM中TF的表达情况。采用Anti-Tissue Factor ab211016抗体(Abcam, 英国),按照1:100比例稀释,将60例GBM患者的石蜡组织制备成4 μm厚的切片(每个患者2张切片),切片中要求包含肿瘤组织大于25%,60 ℃烘烤2 h,采用二甲苯脱蜡,EDTA(pH=8.0)高温抗原修复,5%山羊血清孵育,一抗4 ℃过夜,二抗(Alexa Fluor 488,碧云天,中国)进行处理后,DAB显色,苏木精复染,脱水、固定,镜下观察TF的表达情况[14]。
1.4.2 组织切片判读采用Olympus BX41荧光显微镜,Cell Sens Standard显微图像软件对切片进行阅片判读及信息采集。切片均由2名资深病理学人员采用双盲法判读,在高倍镜下(×200)观察并进行拍照。GBM细胞TF阳性染色表现为细胞质呈棕色或棕黑色着色,其余分子阳性部位均位于内皮细胞胞质和胞核。利用Image-Pro Plus6软件对阳性染色区域进行分割并计算阳性区域分光密度值(integrated option density, IOD)及阳性区域面积[15]。统计视野中阳性染色细胞数量和细胞总数,计算阳性细胞百分比,TF阳性细胞数<50%纳入低表达组(<10%为阴性,10%~<50%为弱阳性),阳性细胞数≥50%纳入高表达组[3]。
1.5 统计学分析采用SPSS 25.0统计软件进行数据处理,Ktrans、rCBV、rCBF正态性检验采用Kolmogorov-Smimow法检验,方差齐性检验用Levene法。各参数值以x±s表示。对Ktrans、rCBV、rCBF、肿瘤强化区域体积、坏死区域体积、水肿区域体积及肿瘤强化区域表面积、坏死区域表面积、水肿区域表面积与TF免疫组化结果平均分光光密度值MOD(mean option density, MOD=IOD/area)进行Pearson和Spearman相关分析。采用受试者工作曲线(ROC)检验与TF表达相关的影像学参数曲线下面积获取阈值及灵敏度、特异性;Logistic回归分析参数间联合概率,并测算其曲线下面积,取得阈值及其灵敏度、特异性。
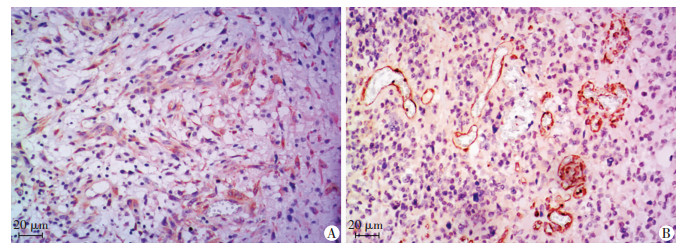
2 结果 2.1 免疫组化结果免疫组化结果显示(图 1),TF主要分布于细胞质内,在肿瘤血管周边表达量较高。分光光度法发现其单位面积内分光光密度值为:0.25~0.55。
|
| A:TF在胶质母细胞瘤内主要分布于胞质内,胞膜和胞核少量分布;B:TF在血管周边呈现出高表达特征 图 1 免疫组化观察TF在GBM内的分布 (S-P) |
2.2 磁共振成像参数与TF的相关性分析 2.2.1 常规磁共振成像参数与TF的相关性
60例GBM患者的肿瘤瘤体体积为4.2~125.4 cm3,其中肿瘤强化区域体积为0.5~121.4 cm3,坏死比0~0.9,肿瘤周边水肿体积2.5~199.5 cm3。Spearman相关分析结果显示:坏死比与TF表达量呈正相关(r=0.665,P < 0.01);肿瘤强化区域体积(r=-0.124, P=0.345)、肿瘤周边水肿区域体积(r=0.119, P=0.365)和表面规律性(r=-0.045, P=0.732)与TF表达量没有相关性。
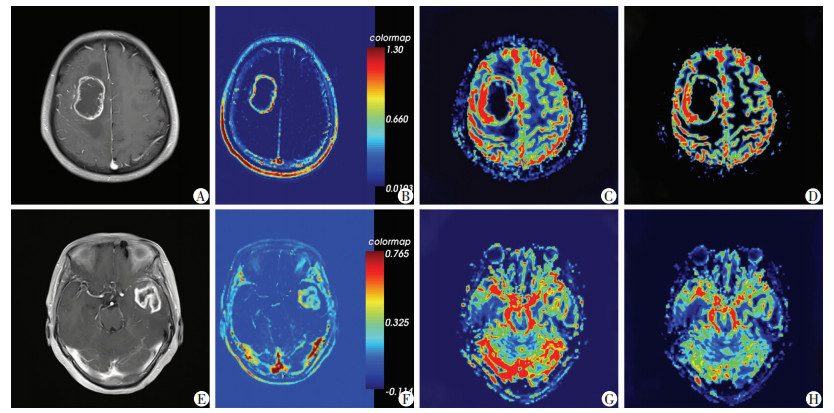
2.2.2 功能磁共振成像参数与TF的相关性60例GBM患者中有40例采集DCE-MRI图像,Ktrans值范围为0.13~4.89,中位值0.46。Spearman相关分析结果显示,GBM的Ktrans值与TF表达量呈明显的正相关(r=0.631, P < 0.001)。60例GBM患者中有39例采集DSC-MRI图像,rCBV值范围为3.31~11.48,rCBF值范围为2.27~19.12。相关分析结果显示,GBM的rCBV值与TF表达量呈正相关(Pearson相关系数r=0.661,P < 0.001);rCBF值与TF表达量呈正相关(Spearman相关系数r=0.619,P=0.001)。见表 1。TF高表达患者磁共振图像显示出更高的恶性特征,具有更高的坏死比和Ktrans,灌注成像表现出高灌注特征。见图 2。
| 参数 | 分布范围 | r值 | P值 |
| 坏死比 | 0.00~0.91 | 0.665 | <0.001 |
| 表面规律性 | 0.20~0.49 | -0.045 | 0.732 |
| 强化区域体积/cm3 | 0.54~121.44 | -0.124 | 0.345 |
| 水肿区域体积/cm3 | 2.54~199.51 | 0.119 | 0.365 |
| Ktrans | 0.13~4.89 | 0.631 | <0.001 |
| rCBV | 3.31~11.48 | 0.661 | <0.001 |
| rCBF | 2.27~19.12 | 0.619 | 0.001 |
|
| A~D:分别为TF高表达患者肿瘤MRI的坏死比及Ktrans、CBV、CBF信号;E~H:分别为TF低表达患者肿瘤MRI的坏死比及Ktrans、CBV、CBF信号 图 2 GBM患者TF高表达与低表达的MRI特征 |
2.3 ROC曲线分析磁共振成像参数反映TF的表达
根据免疫组化阳性细胞率将患者分为TF高表达组(阳性细胞率≥50%)和低表达组(阳性细胞率<50%),对与TF表达量相关的各影像学参数进行分析,结果显示TF高表达组的坏死比、Ktrans、rCBV、rCBF均显著高于低表达组(P < 0.001,P=0.008,P=0.002,P=0.002)。ROC曲线分析结果显示各参数能够很好地反映TF在GBM表达量(P≤0.001,表 2)。Logistic二元回归分析得到两参数联合预测概率,并利用预测概率做ROC分析。结果显示,坏死比与Ktrans,坏死比与rCBV,坏死比与rCBF联合预测均能更好地反映GBM内TF表达量(AUC=0.982,P < 0.001;AUC=0.939,P < 0.001;AUC=0.971,P < 0.001)。
| 参数 | 曲线下面积 | 阈值 | 敏感度 | 特异性 | P值 |
| 坏死比 | 0.869 | 0.204 | 84.6% | 67.6% | <0.001 |
| Ktrans | 0.854 | 0.575 | 81.3% | 83.3% | <0.001 |
| rCBV | 0.804 | 5.314 | 94.4% | 57.1% | 0.001 |
| rCBF | 0.907 | 5.146 | 88.9% | 85.7% | <0.001 |
| 坏死比联合Ktrans | 0.982 | 0.197 | 100.0% | 87.5% | <0.001 |
| 坏死比联合rCBV | 0.939 | 0.381 | 88.9% | 90.5% | <0.001 |
| 坏死比联合rCBF | 0.971 | 0.254 | 94.4% | 85.7% | <0.001 |
3 讨论
胶质母细胞瘤是成年人最常见的颅内原发性恶性肿瘤,根据WHO 2016年CNS肿瘤分类标准,GBM在所有胶质瘤中肿瘤侵袭性最强、血管生成能力最显著、预后最差。目前,GBM的治疗主要依靠手术切除及术后联合替莫唑胺标准放化疗[16],但疗效甚微。抗血管生成治疗成为上述两种治疗方式之外重要的辅助治疗方式,但越来越多的临床实践发现在GBM抗血管生成治疗过程中,患者常常呈现出不同的敏感性。造成这一现象的主要原因是肾小球样血管(glomeruloid vascular proliferation,GVP)的形成,且GVP的形成与TF的高表达相关[17]。研究证实90%的GBM患者中表达TF,而在Ⅰ级和Ⅱ级胶质瘤中其表达率仅为10%[2]。TF可以通过TF-FVⅡa-PAR2(凝血酶激活蛋白酶活化受体)通路诱导VEGF生成[18], 激活血管内皮细胞导致肿瘤血管尤其是畸形血管的生成[19]。这些病理生理过程能够提升GBM的侵袭力及生长速度,导致肿瘤局部区域缺氧环境的产生,而缺氧环境会造成TF表达上调,循环促使GBM的快速进展。本研究通过免疫组化发现TF主要分布在细胞胞质内,且在肿瘤血管周边表达量较高,证实了TF与GBM肿瘤血管生成密切相关。目前,TF已成为GBM治疗的新靶点,抗TF药物的应用能够降低GBM肿瘤细胞的侵袭性,抑制肿瘤的生长和血管生成[20-23]。因此,利用快速、无创实时动态的检测方法评估GBM患者TF的表达水平对其治疗方式选择、病情进展及疗效评价具有重要意义。
磁共振成像是临床颅内肿瘤首选的诊断检查方法,但众多研究发现即便是相同病理级别的胶质瘤,其影像学表现也各不相同,甚至具有较大差异。这是因为胶质瘤内部存在明显的异质性,这一特点在GBM中更为明显,而GBM磁共振表现的差异性,说明GBM的影像特征表现可以在一定程度上反映其内在的病理学差异。WHO 2016年CNS肿瘤分类标准首次将分子表达以及基因检测纳入到胶质瘤分级标准中,体现出特征性分子对胶质瘤病理生理特点的重要性。已有研究证实检测特征性分子的表达对GBM的新型靶向治疗、预后评估等具有重要的临床及科学意义。但目前针对GBM特征分子表达的检测属有创检测,过程繁琐且多在手术后进行,因而GBM术前无创的分子表达检测对GBM的治疗方式选择、病情进展评估、预后监测等具有重要意义。磁共振成像作为一种无创、简便、快捷的影像学检查方法,能活体动态反映GBM大小、形态和代谢变化,是一种理想的反映GBM内分子表达的技术手段[24-26]。
常规的磁共振成像可以全面准确地显示GBM的病变位置、病灶范围、周围侵犯等重要的解剖结构信息,因此成为颅内病变检查的普选手段,结合造影剂增强检查,MRI可以更加清晰、准确地显示GBM内部的结构组成成分。本研究通过3D重建分析发现,GBM的坏死比与其TF表达量呈正相关(r=0.665,P < 0.001),AUC=0.869,说明通过检测GBM的坏死比可以较为准确地反映TF的表达量,其阈值为0.204(0.846,0.676),我们可以较容易地得到TF的高低表达情况。在病理层面进一步证实,TF高表达的GBM内呈现高凝状态,肿瘤中心出现坏死区域,也进一步验证了坏死比反映TF表达的准确性。本研究结果表明,通过最基础的影像特征即可反映TF表达。
与常规磁共振扫描相比,功能磁共振成像能够在更深层次的病理生理层面反映GBM的分子特性,具有更重要的临床应用意义。由于TF的表达与GBM的肿瘤新生血管具有密切的联系,因此监测GBM的血管相关影像学指标,对反映TF表达具有重要意义。DSC-MRI的参数能很好地反映肿瘤局部微血管密度及血流量。本研究发现在TF高表达的GBM中往往呈现出更高的rCBV及rCBF值,二者具有较高的判定TF表达的能力(AUC=0.804,0.907),尤其是rCBF,具有很好的敏感度与特异性。同时由于GBM新生血管结构常不完整,呈现出高通透性,DCE-MRI的Ktrans参数能够很好地反映血管通透性。本研究证实Ktrans和TF表达量间存在着较好的相关性,对于TF表达量的评价同样具有较好的作用(AUC=0.854),与CHEN等[27]的结果相一致。
目前,多模态磁共振成像已常规用于GBM患者的诊断、放化疗辅助成像、疗效的评估和预后判断。本研究参数来源于这些目前最常用的磁共振成像序列。单一的参数虽具有一定判别TF表达高低的能力,但多参数联合运用的优势明显,能够极大的提高检出率和准确性。本研究结果显示,坏死比分别与Ktrans、rCBV、rCBF联合运用将极大地提高其对TF表达水平的检测能力(AUC=0.982、0.939、0.971),且各联合成像参数具有非常好的敏感度与特异性。
本研究结果表明,常规MRI影像特征和磁共振功能成像参数都可以很好地反映患者体内的TF表达,尤其是常规磁共振成像参数与灌注成像联合运用可达到更好的效果,为患者的治疗和术后监测及生存期预测提供重要的辅助,同时也为临床检测其他GBM特征分子提供了新的思路。但本研究存在病例量较少、特征分子较单一、多种参数联合运用还不够深入等不足,将会在后续研究中进一步完善。
| [1] |
MAGNUS N, GARNIER D, MEEHAN B, et al. Tissue factor expression provokes escape from tumor dormancy and leads to genomic alterations[J]. Proc Natl Acad Sci USA, 2014, 111(9): 3544-3549. DOI:10.1073/pnas.1314118111 |
| [2] |
ANDREASEN E B, NIELSEN O L, TRANHOLM M, et al. Expression of tissue factor in canine mammary tumours and correlation with grade, stage and markers of haemostasis and inflammation[J]. Vet Comp Oncol, 2016, 14(2): 191-201. DOI:10.1111/vco.12089 |
| [3] |
GARNIER D, MILSOM C, MAGNUS N, et al. Role of the tissue factor pathway in the biology of tumor initiating cells[J]. Thromb Res, 2010, 125(Suppl 2): S44-S50. DOI:10.1016/S0049-3848(10)70012-8 |
| [4] |
HAMADA K, KURATSU J, SAITOH Y, et al. Expression of tissue factor correlates with grade of malignancy in human glioma[J]. Cancer, 1996, 77(9): 1877-1883. DOI:10.1002/(SICI)1097-0142(19960501)77:9<1877:AID-CNCR18>3.0.CO;2-X |
| [5] |
AMERATUNGA M, PAVLAKIS N, WHEELER H, et al. Anti-angiogenic therapy for high-grade glioma[J]. Cochrane Database Syst Rev, 2018, 11: CD008218. DOI:10.1002/14651858.CD008218.pub4 |
| [6] |
ZHU S J, KISIEL W, LU Y J, et al. Visualizing cancer and response to therapy in vivo using Cy5.5-labeled factor VⅡa and anti-tissue factor antibody[J]. J Drug Target, 2015, 23(3): 257-265. DOI:10.3109/1061186X.2014.988217 |
| [7] |
SUH C H, KIM H S, JUNG S C, et al. Imaging prediction of isocitrate dehydrogenase (IDH) mutation in patients with glioma: a systemic review and meta-analysis[J]. Eur Radiol, 2019, 29(2): 745-758. DOI:10.1007/s00330-018-5608-7 |
| [8] |
MA T, YANG S L, JING H Y, et al. Apparent diffusion coefficients in prostate cancer: correlation with molecular markers Ki-67, HIF-1α and VEGF[J]. NMR Biomed, 2018, 31(3): e3884. DOI:10.1002/nbm.3884 |
| [9] |
TAKASHIMA H, TSUJI A B, SAGA T, et al. Molecular imaging using an anti-human tissue factor monoclonal antibody in an orthotopic glioma xenograft model[J]. Sci Rep, 2017, 7(1): 12341. DOI:10.1038/s41598-017-12563-5 |
| [10] |
何志明, 谢雪梅, 张紫寅, 等. 增强MRI和18F-FDG PET-CT对胶质瘤术后复发病灶诊断价值的比较[J]. 检验医学与临床, 2014, 11(1): 3-5. HE Z M, XIE X M, ZHANG Z Y, et al. Comparison of enhanced MRI and 18F-FDG PET-CT in the diagnosis of recurrent lesions after glioma surgery[J]. Lab Med Clin, 2014, 11(1): 3-5. DOI:10.3969/j.issn.1672-9455.2014.01.002 |
| [11] |
CHEN X, XIE T, FANG J Q, et al. Dynamic MR imaging for functional vascularization depends on tissue factor signaling in glioblastoma[J]. Cancer Biol Ther, 2018, 19(5): 416-426. DOI:10.1080/15384047.2018.1423924 |
| [12] |
BARAJAS R F Jr, CHA S. Benefits of dynamic susceptibility- weighted contrast-enhanced perfusion MRI for glioma diagnosis and therapy[J]. CNS Oncol, 2014, 3(6): 407-419. DOI:10.2217/cns.14.44 |
| [13] |
PÉREZ-BETETA J, MOLINA-GARCÍA D, ORTIZ-ALHAMBRA J A, et al. Tumor surface regularity at MR imaging predicts survival and response to surgery in patients with glioblastoma[J]. Radiology, 2018, 288(1): 218-225. DOI:10.1148/radiol.2018171051 |
| [14] |
CALLANDER N S, VARKI N, RAO L V. Immunohistochemical identification of tissue factor in solid tumors[J]. Cancer, 1992, 70(5): 1194-1201. DOI:10.1002/1097-0142(19920901)70:5<1194:aid-cncr2820700528>3.0.co;2-e |
| [15] |
JIANG Z X, TAN G Z, SHI Z R, et al. Galectin-3 expression in benign and malignant skin diseases with epidermal hyperplasia[J]. Am J Dermatopathol, 2017, 39(10): 738-741. DOI:10.1097/DAD.0000000000000781 |
| [16] |
PUDUVALLI V K, HOANG N. Chemotherapy of high-grade astrocytomas in adults[J]. Prog Neurol Surg, 2018, 31: 116-144. DOI:10.1159/000467374 |
| [17] |
RIBATTI D, DJONOV V. Intussusceptive microvascular growth in tumors[J]. Cancer Lett, 2012, 316(2): 126-131. DOI:10.1016/j.canlet.2011.10.040 |
| [18] |
GUAN M, JIN J, SU B, et al. Tissue factor expression and angiogenesis in human glioma[J]. Clin Biochem, 2002, 35(4): 321-325. DOI:10.1016/s0009-9120(02)00312-0 |
| [19] |
GIANNARELLI C, ALIQUE M, RODRIGUEZ D T, et al. Alternatively spliced tissue factor promotes plaque angiogenesis through the activation of hypoxia-inducible factor-1α and vascular endothelial growth factor signaling[J]. Circulation, 2014, 130(15): 1274-1286. DOI:10.1161/CIRCULATIONAHA.114.006614 |
| [20] |
SVENSSON K J, KUCHARZEWSKA P, CHRISTIANSON H C, et al. Hypoxia triggers a proangiogenic pathway involving cancer cell microvesicles and PAR-2-mediated heparin-binding EGF signaling in endothelial cells[J]. Proc Natl Acad Sci USA, 2011, 108(32): 13147-13152. DOI:10.1073/pnas.1104261108 |
| [21] |
CARNEIRO-LOBO T C, KONIG S, MACHADO D E, et al. Ixolaris, a tissue factor inhibitor, blocks primary tumor growth and angiogenesis in a glioblastoma model[J]. J Thromb Haemost, 2009, 7(11): 1855-1864. DOI:10.1111/j.1538-7836.2009.03553.x |
| [22] |
BREIJ E C, DE GOEIJ B E, VERPLOEGEN S, et al. An antibody-drug conjugate that targets tissue factor exhibits potent therapeutic activity against a broad range of solid tumors[J]. Cancer Res, 2014, 74(4): 1214-1226. DOI:10.1158/0008-5472.CAN-13-2440 |
| [23] |
HARTER P N, DVTZMANN S, DROTT U, et al. Anti-tissue factor (TF9-10H10) treatment reduces tumor cell invasiveness in a novel migratory glioma model[J]. Neuropathology, 2013, 33(5): 515-525. DOI:10.1111/neup.12018 |
| [24] |
ARTZI M, BLUMENTHAL D T, BOKSTEIN F, et al. Classification of tumor area using combined DCE and DSC MRI in patients with glioblastoma[J]. J Neurooncol, 2015, 121(2): 349-357. DOI:10.1007/s11060-014-1639-3 |
| [25] |
林建煌, 周杰钦, 江佳舒, 等. 胶质母细胞瘤的影像学表现与病理学对照分析[J]. 实用医学影像杂志, 2018, 19(6): 51-53. LIN J H, ZHOU J Q, JIANG J S, et al. Comparative analysis of the imaging features and pathology of glioblastoma[J]. J Appl Med Imaging, 2018, 19(6): 51-53. DOI:10.16106/j.cnki.cn14-1281/r.2018.06.017 |
| [26] |
GROSSMANN P, GUTMAN D A, DUNN W D Jr, et al. Imaging-genomics reveals driving pathways of MRI derived volumetric tumor phenotype features in glioblastoma[J]. BMC Cancer, 2016, 16: 611. DOI:10.1186/s12885-016-2659-5 |
| [27] |
CHEN X, XIE T, FANG J Q, et al. Quantitative in vivo imaging of tissue factor expression in glioma using dynamic contrast-enhanced MRI derived parameters[J]. Eur J Radiol, 2017, 93: 236-242. DOI:10.1016/j.ejrad.2017.06.006 |