2. 300011 天津,天津市疾病预防控制中心;
3. 300220 天津,第983医院第一派驻门诊部
2. Tianjin Center for Disease Control and Prevention, Tianjin, 300011, First Outpatient Department;
3. No.983 Hospital of PLA, Tianjin, 300220, China
我国是世界上高原地区面积最大、海拔最高、居住人口最多的国家。高原低氧容易导致肠道蠕动减弱、直肠肌肉无力、消化功能受损,对高原地区的经济、军事等方面带来不利影响。柑橘橘络富含柑橘多糖和黄酮,前期研究显示[1],橘络提取物能够改善小鼠的肠道功能,一般认为可能与橘络提取物中的大分子多糖有关。而橘络中同时含有大量的黄酮类物质,已经证实黄酮类物质具有抗氧化、抗血栓、抗肿瘤、抗菌消炎、抗病毒和排毒、体能代谢等具有多方位的调节作用[2-4]。然而橘络黄酮对缺氧机体肠道功能的调控未见报道,本研究主要探讨橘络黄酮提取物对缺氧肠道平滑肌细胞(intestinal smooth muscle cells, ISMCs)的保护作用,初步探讨橘络黄酮提取物保护缺氧肠道平滑肌细胞的线粒体机制,为开发食源性抗缺氧物质提供实验依据。
1 材料与方法 1.1 实验仪器与试剂流式细胞仪:Attune NxT流式细胞仪,美国Thermofisher公司。TR3抗体和细胞色素c氧化酶Ⅳ(Cox Ⅳ)抗体购自美国abcam公司,JC-1线粒体膜电位检测试剂盒购自北京雷根生物技术公司,Annexin V-FITC细胞凋亡检测试剂盒和Caspase 3/8活性检测试剂盒购自上海碧云天生物技术公司,二抗购自天津三箭生物技术公司,β-actin抗体购自美国santa cruz公司。An-nexinV/PI凋亡试剂盒购于BENDER公司;RPMI-1640培养液、蛋白浓度测定试剂盒、胰蛋白酶购于杭州四季青生物材料研究所;胎牛血清购自GIBCO公司;细胞培养瓶、细胞培养皿、96孔及6孔培养板购于Corning公司。
1.2 细胞培养与实验设计和分组人肠道平滑肌细胞(human intestinal smooth muscle cells, HISMCs)购自Sciencell公司(Cat 2910),在平滑肌细胞培养基(美国Sciencell公司,Cat 1101)中培养,辅以10%胎牛血清(CAT 0010,CISCENELL公司,美国),1%平滑肌细胞生长补充剂(Cat 0010,Sciencell公司),和1%青霉素/链霉素溶液(CAT 0503,CISCENELL公司,美国)。正常组细胞培养在95%空气和5%二氧化碳的37 ℃细胞培养箱中。缺氧组细胞分别培养在(1%O2、5%CO2、94%N2)、(3%O2、5%CO2、92%N2)、(5%O2、5%CO2、90%N2)环境6 h。在研究缺氧时间对细胞影响的实验中,缺氧组(1%O2、5%CO2、94%N2)细胞在37 ℃细胞培养箱中不同时间(0、3、6、9 h)。总黄酮提取物干预细胞的浓度分别为300 μg/mL和600 μg/mL干预6 h。过表达TR3拮抗橘络黄酮对缺氧HISMCs细胞的保护作用部分,细胞分为对照组、缺氧组(1%O2)、缺氧+橘络酮干预组(1%O2+600 μg/mL橘络酮)、缺氧+橘络酮干预+TR3高表达组(1%O2+600 μg/mL橘络酮+TR3高表达) 。
1.3 实验方法 1.3.1 橘络黄酮类物质的提取与定量按照文献[6-7]方法,以1 :60投料比,加入80%的乙醇,超声萃取仪超声1.5 h后过滤,共3次。滤液经旋转蒸发仪蒸发浓缩得其浸膏,采用紫外分光光度计法测定总黄酮含量为23%。黄酮粗提物倒入装有大孔树脂的玻璃层析柱中,浸泡12 h后,用60%乙醇进行洗脱,收集洗脱液,旋转蒸发仪进行旋蒸。以芦丁含量x(mg)为横坐标,以吸光值y D(510)为纵坐标,绘制标准曲线。样品中黄酮含量的测定依照标准曲线进行定量,测得总黄酮含量为52%。
1.3.2 Western blot检测TR3的表达用胰酶消化收集细胞后,差速离心法提取细胞线粒体 。分别在全细胞和线粒体中加入RIPA裂解液冰上处理后,离心,收集上清,-80℃保存备用。采用BCA法检测蛋白总量后,取适量进行SDS-PAGE电泳,然后进行转膜,脱脂奶粉封闭1 h后,孵育相应的一、二抗体进行Western Blot检测,观察TR3在细胞内和线粒体内的表达。
1.3.3 线粒体膜电位(mitochondrial membrane potential)检测细胞线粒体膜电位检测采用流式细胞仪检测,使用JC-1线粒体膜电位检测试剂盒,细胞按照试剂盒说明书进行处理后上机检测。
1.3.4 caspase活性和细胞凋亡率检测采用上海碧云天生物技术公司生产的caspase活性检测试剂盒检测细胞中caspase活性。各组细胞收集后用PBS缓冲液洗3次后,裂解,离心后上清用BCA法定量蛋白浓度,然后按照试剂盒说明书进行活性检测。细胞凋亡检测采用上海碧云天生物技术公司生产的Annexin V-FITC细胞凋亡检测试剂盒和流式细胞仪检测。细胞消化后按照产品说明书进行细胞的处理并上机检测。
1.4 统计学分析采用SPSS 23.0统计软件分析,计量资料数据结果以x±s表示,两组间比较采用t检验,两组以上的组间差异采用单因素方差分析进行检验,然后采用TUKEY HSD检验进行两两比较,分析数据差异显著性。
2 结果 2.1 缺氧对HISMCs线粒体凋亡通路的影响分别给予HISMCs 5%O2、3%O2、1%O2缺氧条件培养6 h后,HISMCs的线粒体膜电位水平逐渐下降(图 1A),细胞内的caspase-3和caspase-8的酶活性逐渐升高(图 1B),与此同时细胞的凋亡率也逐渐升高(P < 0.05,图 1C)。给予HISMCs 1%O2干预不同时间(3、6、9 h),结果也显示随着缺氧时间的延长,HISMCs线粒体凋亡通路活化水平逐渐增加,并呈现显著的剂量效应关系(图 1D -F)。
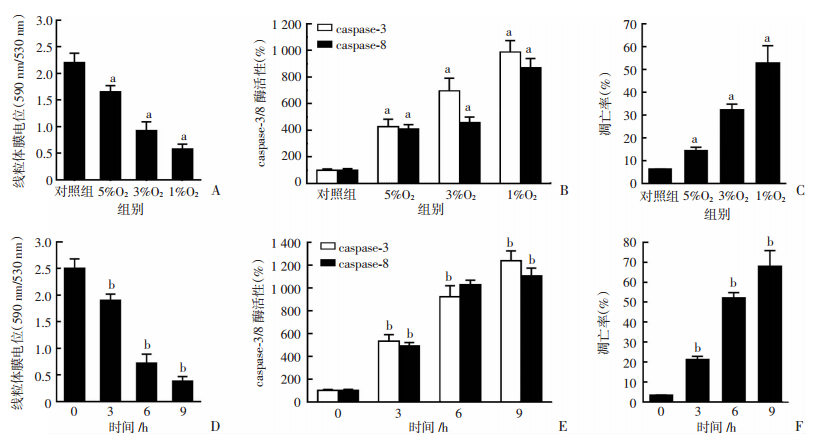
|
| A:不同程度缺氧对线粒体膜电位的影响;B:不同程度缺氧对细胞caspase3/8酶活性的影响;C:不同程度缺氧对细胞凋亡率的影响;D:1%O2干预不同时间对线粒体膜电位的影响;E:1%O2干预不同时间对细胞caspase3/8酶活性的影响;F:1%O2干预不同时间对细胞凋亡率的影响;a:P < 0.05,与对照组比较; b: P < 0.05,与0 h比较 图 1 缺氧导致HISMCs细胞线粒体凋亡通路启动(n=6, x±s) |
2.2 橘络黄酮对缺氧HISMCs的保护作用
为了探讨橘络黄酮对缺氧HISMCs的保护作用,给予1% O2处理HISMCs不同浓度的橘络黄酮(300 μg/mL、600 μg/mL)干预6 h,结果显示橘络黄酮可显著抑制缺氧所致的HISMCs线粒体膜电位下降(图 2A),阻断缺氧所致的caspase-3/8活化(图 2B),降低缺氧所致HISMCs的凋亡水平(P < 0.05, 图 2C )。
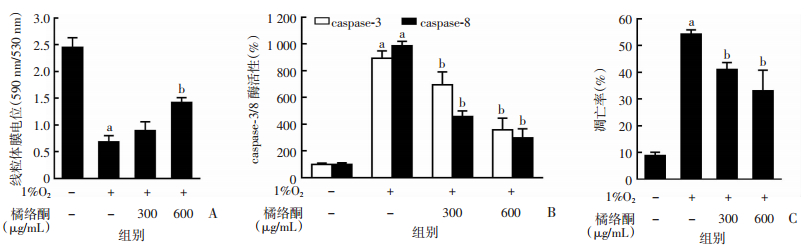
|
| A:不同浓度橘络酮干预对缺氧细胞线粒体膜电位的影响;B:不同浓度橘络酮干预对缺氧细胞caspase3/8酶活性的影响;C:不同浓度橘络酮干预对缺氧细胞凋亡率的影响;a:P < 0.05,与对照组(1%O2-,橘络酮-)比较;b:P < 0.05,与1%O2干预组比较 图 2 橘络黄酮保护缺氧HISMCs线粒体功能(n=6,x±s) |
2.3 缺氧导致HISMCs中TR3向线粒体聚集
线粒体TR3水平的升高是多种因素导致细胞线粒体凋亡通路启动的重要途径之一。本研究为了探讨缺氧启动线粒体凋亡通路的机制,检测了缺氧HISMCs中TR3表达水平及其在线粒体中含量的变化规律,结果显示缺氧导致细胞线粒体TR3含量显著增加(P < 0.05, 图 3)。这说明TR3的线粒体移位可能是缺氧所致HISMCs凋亡的关键。
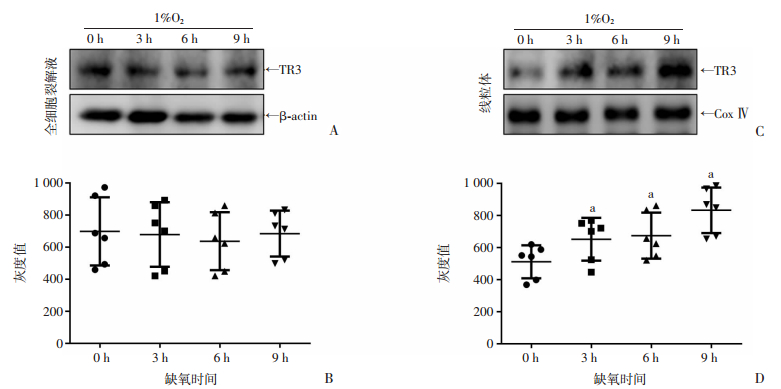
|
| A、C:Western Blot检测结果;B、D:分别为定量分析结果;a:P < 0.05,与0 h比较 图 3 缺氧诱导HISMCs线粒体TR3含量增加(n=6,x±s) |
2.4 橘络黄酮抑制缺氧HISMCs中的TR3向线粒体聚集
橘络黄酮干预6 h后,缺氧HISMCs中线粒体TR3含量较单纯缺氧组细胞线粒体中显著下降(P < 0.05),提示橘络黄酮可能通过调控TR3的线粒体聚集发挥其细胞保护作用(图 4)。

|
| A:Western Blot检测结果;B:为定量分析结果;a:P < 0.05,与对照组(1%O2-,橘络酮-)比较;b:P < 0.05,与1% O2干预组比较 图 4 橘络黄酮抑制缺氧所致的HISMCs线粒体TR3含量的增加(n=6,x±s) |
2.5 过表达TR3拮抗橘络黄酮对缺氧HISMCs的保护作用
为了进一步探讨TR3在橘络黄酮保护缺氧HISMCs线粒体功能过程中的作用,采用TR3过表达载体在HISMCs中过表达TR3(图 5A)。结果显示,过表达TR3可显著抑制橘络黄酮(600 μg/mL)对缺氧HISMCs线粒体膜电位的保护作用(P < 0.05, 图 5C),拮抗橘络黄酮对caspase-3/8活性的调控作用(图 5D),并逆转橘络黄酮降低缺氧HISMCs凋亡率的效应(图 5E)。这提示TR3是橘络黄酮保护缺氧HISMCs的关键靶点。
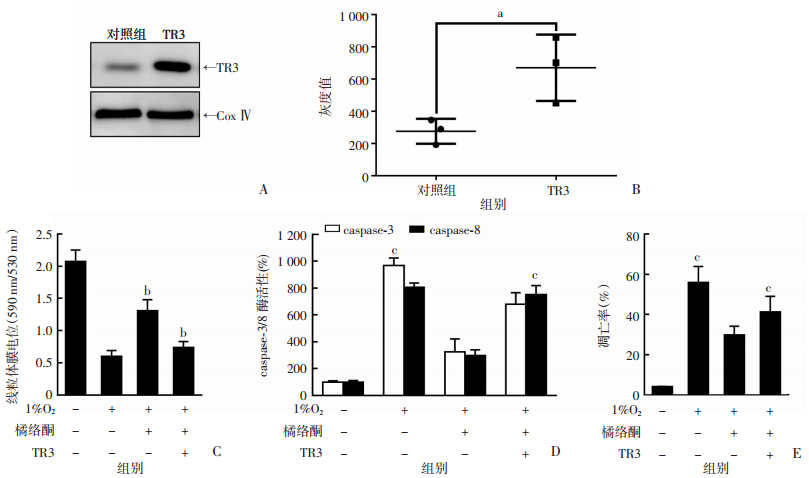
|
| A: Western Blot检测结果;B:定量分析结果;C:橘络酮对1%O2处理细胞线粒体膜电位的影响;D:橘络酮对1%O2处理细胞caspase3/8酶活性的影响;E:橘络酮对1%O2处理细胞凋亡率的影响;a:P < 0.05,与对照组比较;b:P < 0.05,与1% O2+橘络酮干预组比较;c:P < 0.05,与空白对照组(1%O2-,橘络酮-)比较 图 5 过表达TR3拮抗橘络黄酮对缺氧HISMCs细胞的保护作用(n=6, x±s) |
3 讨论
高原缺氧严重影响人员健康,降低军事作业能力[9]。2018版的急性高原病(acute mountain sickness,AMS)最近诊断标准中,去除了睡眠障碍并突出了消化系统症状的重要性[10]。但是目前对于缺氧所致消化系统障碍的研究较少。胃肠道的运动功能减弱被认为是高原缺氧所致消化系统症状的重要原因之一,而正常的平滑肌细胞功能是胃肠道运动能力的基础。因此,本研究采用肠道平滑肌细胞系作为研究对象,探讨缺氧对肠道平滑肌细胞影响作用及其机制。我们的研究结果显示,缺氧可导致HISMCs以线粒体凋亡通路启动为特征的细胞凋亡,并具有明显的剂量效应关系(图 1)。我们的这一研究结果进一步证实了缺氧可能导致肠道平滑肌细胞线粒体功能受损,继而影响肠道的运动功能。细胞缺氧伴随着大量的自由基产生,天然黄酮类化合物被认为是一种极强的抗氧化剂,可有效清除体内的氧自由基[11]。橘络提取物含有大量的黄酮[1],被研究证实对肠道功能具有重要的调控作用,尽管这种作用被认为与橘络提取物中的大分子多糖有关,但橘络黄酮毫无疑问也发挥了重要作用,为了对橘络黄酮与缺氧肠道运动相关细胞功能之间的关系进行深入研究,我们采用了离体细胞学实验。结果显示,橘络黄酮可有效保护HISMCs免受缺氧损伤的影响。这一研究结果提供了橘络黄酮保护缺氧肠平滑肌细胞的直接证据。
我们的研究结果同时显示,缺氧导致TR3在线粒体局部的聚集效应,并与线粒体凋亡通路的启动密切相关。橘络黄酮可明显抑制缺氧HISMCs中TR3向线粒体的聚集。TR3是一种孤儿受体,属于核受体超家族的成员之一[12]。TR3作为一种重要的转录因子,能够在表皮生长因子(EGF)、神经生长因子(NGF)等多种生长因子或佛波脂、视黄醇、细胞内Ca2+超载等因素诱导下,在细胞质内的表达迅速增加,并进入核内,调节下游基因的表达,参与多种细胞生命活动[13]。有研究发现,在凋亡诱导剂作用下,人前列腺癌细胞(LNCaP)等肿瘤细胞中TR3并不在核内行使核转录因子的功能,而是从细胞核输出并移位至线粒体膜,诱导细胞色素c(cytochrome c,Cyt c)的释放,导致细胞凋亡;阻抑TR3的核输出,Cty c不再从线粒体内释放,细胞凋亡率也显著下降[14]。这表明TR3移位线粒体对细胞凋亡的线粒体机制具有重要调控作用,其作用位点可能在于调控线粒体外膜的通透性,进而导致Cty c的释放。我们的前期研究也发现,应激条件下的心肌细胞凋亡过程中,TR3由细胞核向线粒体转移,并启动相应的凋亡通路。在本研究结果显示,细胞中过表达TR3可拮抗橘络黄酮对缺氧HISMCs细胞的保护效应。这些研究结果表明TR3是橘络黄酮发挥缺氧保护效应的一个重要靶点之一。缺氧条件下,肠道平滑肌细胞TR3的线粒体移位导致线粒体功能障碍和细胞损伤可能是肠道功能下降的重要原因。
综上,本研究提示橘络黄酮可抑制缺氧所致HISMCs凋亡。线粒体凋亡通路的启动是缺氧导致HISMCs凋亡的重要原因之一,橘络黄酮可有效抑制缺氧所致的线粒体膜电位下降所激发的下游caspase-3/8酶活性活化。核转录因子TR3作为线粒体凋亡通路的重要调控因子,通常在应激刺激下向线粒体聚集并启动线粒体凋亡通路,本研究发现其在缺氧所致HISMCs凋亡过程中也发挥了重要的作用。我们的研究结果显示,橘络黄酮可抑制缺氧HISMCs中TR3的线粒体移位,并保护线粒体功能免受损伤,继而减少缺氧所致的细胞凋亡,随后的TR3过表达实验也进一步证实了这一结论。本研究证实了橘络黄酮对缺氧细胞具有保护作用,并揭示了一种黄酮类物质抑制细胞凋亡的新途径。
| [1] |
王亚雯, 辛中豪, 蒲玲玲, 等. 柑橘橘络提取物通便作用的实验研究[J]. 中国食物与营养, 2017, 23(5): 73-76. WANG Y W, XIN Z H, PU L L, et al. Experimental study on facilitating bowel movement by citrus net extract[J]. Food Nutr China, 2017, 23(5): 73-76. |
| [2] |
刘金萌, 刘全日, 韩静, 等. 富含黄酮类物质果蔬汁对大鼠肝脏中氧化损伤相关Ⅱ相代谢酶基因mRNA表达的影响[J]. 中国食品卫生杂志, 2014, 26(5): 409-413. LIU J M, LIU Q R, HAN J, et al. Effect of flavonoids-rich fruit and vegetable juice on the mRNA expression of oxidative damage related phaseⅡenzyme gene in rat liver tissue[J]. Chin J Food Hyg, 2014, 26(5): 409-413. DOI:10.13590/j.cjfh.2014.05.001 |
| [3] |
刘美玲, 曹波, 刘玉冰, 等. 红砂(Reaumuria soongorica)黄酮类物质代谢及其抗氧化活性对UV-B辐射的响应[J]. 中国沙漠, 2014, 34(2): 426-432. LIU M L, CAO B, LIU Y B, et al. Responses of the flavonoid pathway and antioxidant ability to UV-B radiation stress in Reaumuria soongorica[J]. J Desert Res, 2014, 34(2): 426-432. |
| [4] |
陆明旸, 张岭, 王茵. 高尿酸血症的发病机制以及黄酮类膳食对其干预作用[J]. 中国预防医学杂志, 2012, 13(8): 632-634. LU M Y, ZHANG L, WANG Y. Pathogenesis of hyperuricemia and intervention of flavonoid diet[J]. Chin Prev Med, 2012, 13(8): 632-634. DOI:10.16506/j.1009-6639.2012.08.023 |
| [5] |
DAI L N, YAN J K, XIAO Y T, et al. Butyrate stimulates the growth of human intestinal smooth muscle cells by activation of yes-associated protein[J]. J Cell Physiol, 2018, 233(4): 3119-3128. DOI:10.1002/jcp.26149 |
| [6] |
李继伟, 任璇, 周绍庆, 等. 柑橘皮黄酮石灰水提取工艺及果胶去除效果的研究[J]. 食品研究与开发, 2019, 40(10): 101-104. LI J W, REN X, ZHOU S Q, et al. Study on flavonoids extraction process from Citrus peels by lime water method and the efficiency of pectin removing in the process[J]. Food Res Dev, 2019, 40(10): 101-104. |
| [7] |
乔魏, 荆新鑫, 李明, 等. 基于网络药理学的昆仑雪菊总黄酮对食管癌细胞的抗瘤作用[J]. 新疆医科大学学报, 2019, 42(9): 1216-1222. QIAO W, JING X X, LI M, et al. Anti-tumor effect of Kunlun Chrysanthemum flavonoids on esophageal cancer cells based on network pharmacology[J]. J Xinjiang Med Univ, 2019, 42(9): 1216-1222. |
| [8] |
WANG X X, FENG H, ZHAN R, et al. Phosphorylated nerve growth factor-induced clone B (NGFI-B) translocates from the nucleus to mitochondria of stressed rat cardiomyocytes and induces apoptosis[J]. Stress, 2012, 15(5): 545-553. DOI:10.3109/10253890.2011.644603 |
| [9] |
罗勇军, 马四清. 急性高原反应发病的危险因素相关研究进展[J]. 第三军医大学学报, 2019, 41(8): 723-728. LUO Y J, MA S Q. Advances in research of risk factors for acute high-altitude sickness[J]. J Third Mil Med Univ, 2019, 41(8): 723-728. DOI:10.16016/j.1000-5404.201812013 |
| [10] |
ROACH R C, HACKETT P H, OELZ O, et al. The 2018 Lake Louise acute mountain sickness score[J]. High Alt Med Biol, 2018, 19(1): 4-6. DOI:10.1089/ham.2017.0164 |
| [11] |
SARI E, BERCZYNSKI P, KLADNA A, et al. Synthesis and in vitro antioxidant activity study of some novel substituted piperazinyl flavone compounds[J]. Med Chem, 2018, 14(4): 372-386. DOI:10.2174/1573406414666171204105000 |
| [12] |
WOHLKOENIG C, LEITHNER K, OLSCHEWSKI A, et al. TR3 is involved in hypoxia-induced apoptosis resistance in lung cancer cells downstream of HIF-1α[J]. Lung Cancer, 2017, 111: 15-22. DOI:10.1016/j.lungcan.2017.06.013 |
| [13] |
CHEN H Z, WEN Q, WANG W J, et al. The orphan nuclear receptor TR3/Nur77 regulates ER stress and induces apoptosis via interaction with TRAPγ[J]. Int J Biochem Cell Biol, 2013, 45(8): 1600-1609. DOI:10.1016/j.biocel.2013.04.026 |
| [14] |
MU X M, CHANG C. TR3 orphan nuclear receptor mediates apoptosis through up-regulating E2F1 in human prostate cancer LNCaP cells[J]. J Biol Chem, 2003, 278(44): 42840-42845. DOI:10.1074/jbc.m305594200 |



