以往的研究表明高原地区低压、低氧、寒冷等多种环境因素对于机体的生理功能具有显著影响,其中低氧是影响人类生命活动的主要因素,而高原环境对雌性生殖系统影响的研究较少,本研究通过模拟海拔6 000 m低压低氧环境,建立低氧诱导大鼠生理周期紊乱模型,拟从氧化-抗氧化角度,初步揭示低氧暴露对雌性大鼠生殖功能的影响,为探索低氧暴露环境下女性生殖功能损伤防护提供理论依据。
1 材料与方法 1.1 实验动物及主要试剂、仪器SPF级健康雌性SD大鼠,体质量210~230 g(军事医学科学院实验动物中心提供)。清洁级动物房,恒温(25±1)℃,恒湿(50±5)%,光-暗周期12 h。动物低压氧舱,台式高速冷冻离心机(Eppendorf 5810R),多功能读板仪(Molecular Devices M5)。GSH-Px、SOD、MDA测定试剂盒(南京建成生物工程公司)。
1.2 实验分组及方法 1.2.1 动物实验动物适应性喂养5d后,按照体质量分为正常对照组和低氧暴露组,每组11只,各组均自由摄食饮水,实验周期为4周。低氧暴露组每天进行8 h的模拟高度为6 000 m的暴露,过程如下:以1 000 m/min的速度由海平面高度上升至5 000 m,停留3 min;再以500 m/min速度上升至6 000 m,停留8 h;此后再以500 m/min速度下降至5 000 m,停留3 min,再以1 000 m/min的速度下降至海平面高度[1]。实验结束后,10%水合氯醛麻醉,腹主动脉取血,分离血清,剥离组织迅速置于液氮保存。
1.2.2 摄食量和体质量记录每日记录动物的摄食量,观察动物精神状态、活动及饮水等情况,每周称量2次体质量。
1.2.3 脏器系数测定称取大鼠体质量、心脏、肝脏、脾脏、肺脏、肾脏、胸腺、垂体、肾上腺、卵巢和子宫质量,计算脏器系数。
脏器系数=脏器质量(mg)/体质量(g)
1.2.4 动情周期观察每天上午8:00-9:00、下午19:00-20:00进行阴道脱落细胞涂片检查,根据阴道脱落细胞的形态学变化确定大鼠的动情周期。固定大鼠,暴露阴道后,用移液枪吸取100 μL无菌生理盐水,打入雌性大鼠阴道内部并来回抽吸两次,均匀平铺到载玻片中央,自然风干,95%乙醇固定15 min,室温下自然晾干,进行HE染色15 min,蒸馏水冲洗干净后镜检。按照参考文献[2-3]中大鼠性周期阴道涂片的细胞变化特点来划分大鼠性周期的各个阶段:①动情前期:图片可见大量有核上皮细胞、少量角化上皮细胞;②动情期:图片可见满视野角化上皮细胞、少量有核上皮细胞;③动情后期:图片可见有核上皮细胞、角化上皮细胞及白细胞;④动情间期:图片可见大量白细胞和少量黏液。
1.2.5 血清性激素水平测定血清雌二醇(estradiol, E2)、孕酮(P)、促卵泡生成素(follicle-stimulating hormone, FSH)、促黄体生成素(LH)、催乳素(prolactin, Prl)、睾酮(testosterone, T)的水平采用RIA进行测定。按照说明书上的程序进行加样操作,在放免仪上测定各管沉淀的放射性计数(count per minute, cpm),最后通过标准曲线计算出各个血清激素水平。
1.2.6 血清抗氧化水平测定血清GSH-Px、SOD活性和MDA含量测定,分别采用DTNB法、羟胺法和TBA法检测,按照试剂盒操作说明,通过标准曲线计算出血清抗氧化水平。
1.3 统计学分析采用SPSS 21.0统计软件进行统计分析,所有实验数据均以
正常对照组雌性大鼠摄食量稳定,维持20 g左右水平,低氧暴露组雌性大鼠摄食量在第1周出现了下降趋势,且与正常对照组相比具有显著差异(P < 0.05),第2周之后与正常对照组相比无显著性差异(P>0.05,表 1)。
| 组别 | 第1周 | 第2周 | 第3周 | 第4周 |
| 正常对照组 | 20.07±0.82 | 21.27±1.05 | 19.03±1.09 | 20.31±0.79a |
| 低氧暴露组 | 16.96±0.79a | 19.84±1.39 | 19.23±1.17 | 19.56±1.03 |
| a:P<0.01,与正常对照组比较 | ||||
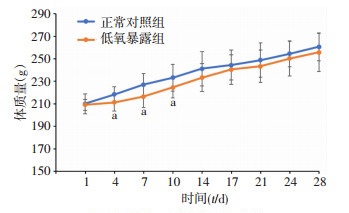
实验期间,各组动物均无咬伤现象,毛色光泽。体质量随喂养天数延长而增加。低氧暴露组雌性大鼠体质量在低氧暴露前10 d较对照组增长缓慢,具有统计学差异(P < 0.05),低氧暴露两周之后体质量增加与正常对照组变化一致,无显著差异(P>0.05,图 1)。
|
|
a:P < 0.05,与正常对照组比较
图 1
大鼠体质量增长情况( |
2.2 脏器系数变化
对各组大鼠的脏器系数进行分析,研究结果显示,低氧暴露组雌性大鼠肝脏、肺脏和脾脏系数较正常对照组显著增加(P < 0.05),低氧暴露组雌性大鼠胸腺系数较正常对照组显著下降(P < 0.05)。但低氧暴露组雌性大鼠心脏、肾脏、下丘脑、垂体、子宫与卵巢的脏器系数与正常对照组比较均无显著差异(P>0.05,表 2)。
| 脏器 | 正常对照组(mg/g) | 低氧暴露组(mg/g) |
| 心脏 | 3.72±0.30 | 3.89±0.37 |
| 肝脏 | 34.53±2.56 | 37.02±2.73a |
| 脾脏 | 2.12±0.28 | 2.36±0.29a |
| 肺脏 | 4.88±0.42 | 5.57±0.75a |
| 肾脏 | 7.25±0.49 | 7.22±0.45 |
| 胸腺 | 1.99±0.23 | 1.78±0.26a |
| 下丘脑 | 0.201±0.041 | 0.21±0.067 |
| 垂体 | 0.062±0.009 | 0.053±0.015 |
| 子宫 | 2.15±0.69 | 2.07±0.55 |
| 卵巢 | 0.062±0.009 | 0.053±0.015 |
| a:P < 0.05,与正常对照组比较 | ||
2.3 生理周期的变化
通过对雌性大鼠阴道脱落细胞学观察到的细胞类型来判断动情周期的不同阶段(动情前期、动情期、动情后期和动情间期)。①动情前期:镜下可见大量椭圆形有核上皮细胞和少量角化上皮细胞(图 2A);②动情期:镜下可见大量外形不规则的角化上皮细胞,多成堆积状互相连成一片、呈落雪状,间有少量有核上皮细胞(图 2B);③动情后期:镜下可见有核上皮细胞、不规则角化上皮细胞及白细胞,且比例相当(图 2C);④动情间期:镜下可见大量白细胞及少量有核上皮细胞黏液(图 2D)。

|
| A:动情前期; B:动情期; C:动情后期; D:动情间期 图 2 大鼠各生理周期阴道脱落细胞形态(LM ×200) |
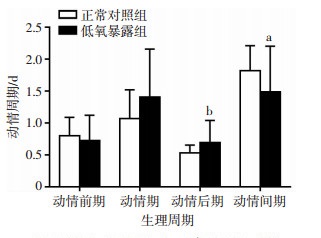
正常的动情周期一般持续4~5 d,与正常对照组相比,低氧暴露组的大鼠动情周期出现了显著性的变化,表现为动情期和动情后期显著延长(P < 0.01),动情间期显著缩短(P < 0.05),两组的动情前期无显著性差异(图 3)。
|
|
a:P < 0.05,b:P < 0.01,与正常对照组比较
图 3
低氧暴露对雌性大鼠的生理周期变化(n=11, |
2.4 性激素水平
对雌性大鼠血清的性激素水平进行分析,结果显示,与正常对照组相比,低氧暴露组雌性大鼠血清P及LH水平显著降低(P < 0.05),低氧暴露组雌性大鼠血清E2、FSH、PRL、T水平与正常对照组虽有下降趋势,但无统计学意义(表 3)。
| 组别 | 正常对照组 | 低氧暴露组 |
| 雌二醇(pg/mL) | 11.02±1.82 | 10.37±2.79 |
| 孕酮(ng/mL) | 4.21±1.91 | 2.59±0.93a |
| 促卵泡生成素(mIU/mL) | 3.09±1.05 | 2.91±0.94 |
| 促黄体生成素(mIU/mL) | 8.60±1.62 | 6.71±1.27a |
| 催乳素(mIU/mL) | 112.98±41.35 | 83.16±25.09 |
| 睾酮(ng/mL) | 0.097±0.041 | 0.085±0.043 |
| a:P < 0.05,与正常对照组比较 | ||
2.5 血清GSH-Px、SOD酶活性
与正常对照组[(86.71±3.72)U/mL]相比,低氧暴露组[(78.33±8.14)U/mL]大鼠血清SOD酶活性显著降低(P < 0.05);同时,低氧暴露组[(230.76±17.89)U/mL]大鼠血清GSH-Px酶活性与正常对照组[(251.43±19.38)U/mL]相比也显著降低(P < 0.05),表明低氧暴露可显著影响雌性大鼠的机体抗氧化能力。
2.6 血清MDA含量与正常对照组[(7.07±1.05)nmol/L]相比,低氧暴露组[11.14±2.40)nmol/L]雌性大鼠血清MDA量显著升高(P < 0.01),表明低氧暴露可显著影响雌性大鼠机体的氧化水平。
3 讨论大量研究表明高原低氧环境对机体的各个器官和系统有着不同程度的损害,低氧暴露能够在神经内分泌水平、细胞水平、基因水平等多个环节引发机体产生一系列复杂的连锁反应。以往研究主要关注了低氧暴露对雄性动物的调控作用,高原低氧对雌性生理功能的研究目前尚缺乏,本研究主要围绕模拟间断低氧暴露状态下雌性大鼠动情周期以及机体氧化与抗氧化水平评价了间断低氧暴露对雌性大鼠生理功能的影响。
雌性哺乳动物的动情周期一般分为4个阶段:动情前期(proestrus)、动情期(estrus)、动情后期(metestrus)和动情间期(diestrus) [3]。在雌性的非妊娠期间,动情状态呈周期性变化,卵子的形成和性激素的分泌也呈周期性波动,雌性大鼠的动情周期常被作为体内激素水平变化以及生殖器官如卵巢和子宫病理生理状态的重要标志物[4]。已有研究发现动情周期会影响雌性动物的行为和情绪等[5-7]。本研究发现间断低氧暴露可显著导致雌性大鼠动情期、动情后期及动情间期的紊乱。而正常的生理周期不仅受到卵巢的调节,中枢神经系统、内分泌免疫系统以及机体的生理状态等对于生理周期调节也有重要作用。研究结果发现低氧暴露组雌性大鼠肝脏系数、肺脏系数较正常对照组显著增加,已有研究显示小鼠在低氧状态下肝脏与肺组织中低氧诱导因子表达水平升高[8],参与了缺氧诱导适应性调节[8-9],但长时间低氧暴露可能会造成脏器实质性损伤,间断低氧暴露导致雌性大鼠肝脏、肺脏系数异常引起的肝肺功能改变是否是低氧暴露导致雌性大鼠动情周期紊乱的重要原因仍需进一步探讨。此外,本研究观察了低氧暴露对重要免疫器官脾脏与胸腺的影响,结果发现,低氧诱导组大鼠脾脏指数显著升高、胸腺指数显著降低,这与田云梅等[10]研究的低氧暴露后雄性大鼠机体免疫功能紊乱的结果相一致,这也提示低氧暴露导致的免疫功能异常可能是雌性大鼠生理周期紊乱的重要原因之一。
下丘脑-垂体-卵巢轴是由下丘脑-垂体以及卵巢构成的一个完整而协调的神经内分泌系统,并受大脑皮层的控制,参与调节子宫内膜的周期性变化。本研究结果显示间断低氧暴露对雌性大鼠的下丘脑、垂体、子宫与卵巢系数无显著性影响。但生殖周期的形成是性类固醇激素通过作用于脑和垂体正负反馈机制调节了LH和FSH的分泌而产生的。下丘脑-垂体调节并释放促性腺激素调节卵巢中E2和P的合成,这些性激素的水平随着卵泡发育与排卵的发生,发生周期性的改变,对于子宫内膜的周期性变化和生理周期的循环非常重要[11]。有文献报道,阴道上皮细胞受生殖激素水平的影响,在动情前期FSH水平的升高刺激了E2和P水平的升高,E2水平升高继而诱发了动情期LH的激增,在动情后期P浓度逐渐增加,形成第二个高峰,而动情间期以E2水平的升高为特征。性激素分泌水平的异常可导致生理周期紊乱的发生[12]。李素芝等[13]研究表明进驻高原低氧环境一个月后,女性P、E2的含量较平原对照组显著降低,一年后P、E2含量略有回升但仍显著低于对照组,说明低氧环境下,机体为适应低氧环境产生的适应性变化导致性激素发生了变化。在本研究中我们观察到间断低氧暴露可以显著导致雌性大鼠血清P及LH水平的下降,这提示间断低氧暴露导致的下丘脑-垂体-卵巢轴的神经内分泌紊乱可能是低氧暴露导致雌性大鼠动情周期紊乱的重要原因。
有研究报道高原低氧暴露能够导致机体活性氧族(reactive oxygen species, ROS)代谢紊乱,氧化应激反应增强[14]。高原低氧环境下机体氧自由基代谢紊乱、抗氧化系统受到破坏是机体损伤的重要原因。已有研究报道低氧诱发的氧化应激在雄性慢性生殖功能损伤的发生发展过程中起着非常重要的作用[15]。LIM等[16]研究发现氧化应激影响卵巢的内分泌功能,参与窦卵泡的凋亡,影响卵母细胞的质量。氧化应激导致的卵巢分泌功能改变可能会导致生理周期紊乱的发生。而低氧暴露对雌性动物氧化与抗氧化水平的影响尚未见报道。GSH-Px、SOD活性以及MDA含量是衡量机体氧化与抗氧化能力的常规指标。在本研究中,低氧暴露组雌性大鼠抗氧化酶GSH-Px、SOD的活性较正常对照组显著降低,而脂质过氧化反应的终产物MDA的水平较正常对照组显著升高,表明低氧暴露雌性大鼠在模拟间断低氧暴露条件下机体自由基含量增多,脂质过氧化反应增强,抗氧化能力减弱。机体氧化与抗氧化能力失衡可能是低氧暴露导致雌性大鼠生理功能异常的重要原因之一。
本研究结果表明了低氧暴露可显著导致雌性大鼠动情周期紊乱,肝脏、肺脏、免疫器官的改变以及性激素水平的紊乱可能是低氧暴露致雌性大鼠生理周期紊乱的重要原因,并进一步证实了间断低氧暴露导致机体氧化与抗氧化能力失衡是导致雌性大鼠生理功能紊乱的重要诱因。这项研究为高海拔环境雌性机体生理功能紊乱的机制研究奠定了基础,而关于低氧暴露下雌性动物生理周期紊乱调控机制及防护措施仍需深入研究。
| [1] |
王宇平, 郭长江, 杨继军, 等. 急性低氧暴露小鼠外周血代谢组变化分析[J]. 中国应用生理学杂志, 2009, 25(2): 177-180. WANG Y P, GUO C J, YANG J J, et al. Effects of acute hypoxia on plasma metabolome in mice[J]. Chin J Appl Physiol, 2009, 25(2): 177-180. DOI:10.13459/j.cnki.cjap.2009.02.016 |
| [2] |
XU T, LI X, YANG L, et al. Impact of cold exposure on the reproductive function in female rats[J]. Biomed Res Int, 2018, 2018: 3674906. DOI:10.1155/2018/3674906 |
| [3] |
印丹丹, 封瑞, 任丽菲, 等. 阴道涂片法鉴定大鼠生理周期的应用评价[J]. 解剖科学进展, 2014, 20(4): 360-363. YIN D D, FENG R, REN L F, et al. Evaluation of rat physiological cycle by vaginal smear assay[J]. Prog Anat Sci, 2014, 20(4): 360-363. DOI:10.16695/j.cnki.1006-2947.2014.04.015 |
| [4] |
MONDAL M, SARKAR K, NATH P P, et al. Monosodium glutamate suppresses the female reproductive function by impairing the functions of ovary and uterus in rat[J]. Environ Toxicol, 2018, 33(2): 198-208. DOI:10.1002/tox.22508 |
| [5] |
BARRETO-CORDERO L, MARCELA RIOS-CARRILLO J, Roldan G l, et al. Cyclic changes and actions of progesterone and allopregnanolone on cognition and hippocampal basal (stratum Oriens) dendritic spines of female rats[J]. Behav Brain Res, 2020, 379: 112355. DOI:10.1016/j.bbr.2019.112355 |
| [6] |
CHOLERIS E, CLIPPERTON-ALLEN A E, GRAY D G, et al. Differential effects of dopamine receptor D1-type and D2-type antagonists and phase of the estrous cycle on social learning of food preferences, feeding, and social interactions in mice[J]. Neuropsychopharmacology, 2011, 36(8): 1689-1702. DOI:10.1038/npp.2011.50 |
| [7] |
PARIS J J, FRYE C A. Estrous cycle, pregnancy, and parity enhance performance of rats in object recognition or object placement tasks[J]. Reproduction, 2008, 136(1): 105-115. DOI:10.1530/rep-07-0512 |
| [8] |
PASCHETTA E, BELCI P, ALISI A, et al. OSAS-related inflammatory mechanisms of liver injury in nonalcoholic fatty liver disease[J]. Mediat Inflamm, 2015, 2015: 1-10. DOI:10.1155/2015/815721 |
| [9] |
SEMENZA G L. Hypoxia-inducible factors in physiology and medicine[J]. Cell, 2012, 148(3): 399-408. DOI:10.1016/j.cell.2012.01.021 |
| [10] |
田云梅, 聂鸿靖, 刘嘉瀛, 等. 高原低氧免疫损伤及其干预措施的研究[J]. 中国应用生理学杂志, 2010, 26(4): 404-410. TIAN Y M, NIE H J, LIU J Y, et al. Study of hypoxia-induced immune injury and its intervention measure[J]. Chin J Appl Physiol, 2010, 26(4): 404-410. DOI:10.13459/j.cnki.cjap.2010.04.011 |
| [11] |
SELLIX M T, MENAKER M. Circadian clocks in the ovary[J]. Trends Endocrinol Metab, 2010, 21(10): 628-636. DOI:10.1016/j.tem.2010.06.002 |
| [12] |
LI S, DAVIS B. Evaluating rodent vaginal and uterine histology in toxicity studies[J]. Birth Defect Res B, 2007, 80(3): 246-252. DOI:10.1002/bdrb.20120 |
| [13] |
李素芝, 蔡志祥, 王洪斌, 等. 高原低氧对女性孕酮、雌二醇的影响[J]. 放射免疫学杂志, 2006, 19(1): 30-31. LI S Z, CAI Z X, WANG H B, et al. Effect of hypoxia(3 658 m) on serum levels of progestrone(P) and estradiol(E2) in women[J]. J Radioimmunol, 2006, 19(1): 30-31. DOI:10.3969/j.issn.1008-9810.2006.01.016 |
| [14] |
SIQUES P, BRITO J, PENA E. Reactive oxygen species and pulmonary vasculature during hypobaric hypoxia[J]. Front Physiol, 2018, 9: 865. DOI:10.3389/fphys.2018.00865 |
| [15] |
ZEPEDA A B, FIGUEROA C A, CALAF G M, et al. Male reproductive system and antioxidants in oxidative stress induced by hypobaric hypoxia[J]. Andrologia, 2014, 46(1): 1-8. DOI:10.1111/and.12039 |
| [16] |
LIM J, NAKAMURA B N, MOHAR I, et al. Glutamate cysteine ligase modifier subunit (gclm) null mice have increased ovarian oxidative stress and accelerated age-related ovarian failure[J]. Endocrinology, 2015, 156(9): 3329-3343. DOI:10.1210/en.2015-1206 |



