2. 400042 重庆,重庆市公安局渝北区分局
2. Yubei Public Security Station of Chongqing Public Security Bureau, Chongqing, 400042, China
间质性肺疾病(interstitial lung disease,ILD),又称间质性肺炎(interstitial pneumonias, IP),常以全肺弥漫性、局限性炎症和(或)纤维化或累及肺间质为其主要特征。根据病因是否清楚将ILD分为已知病因ILD和原因不明ILD,后者又被统称为特发性间质性肺炎(idiopathic interstitial pneumonias,IIPs)[1]。虽然ILD可发生在任何年龄段的儿童身上,但婴幼儿ILD更常见[2]。作为受肺发育不完善和肺损伤影响不均衡的特殊人群,近年来婴幼儿中的ILD受到越来越多的关注。急性间质性肺炎(acute interstitial pneumonia,AIP)是IIPs的主要亚型之一,其发病年龄范围广,无性别差异,与吸烟无关[3-4]。不同于其他类型的间质性肺炎,AIP的病理组织学特征为弥漫性肺泡损伤(diffuse alveolar damage, DAD)。这一表现与急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的组织学模式难以区分。但由于其病因不明这一特点,遂与病因明确的ARDS区别开来[5]。儿童AIP起病急,进展迅速,病程短,临床表现不典型,其病因及发病机制目前尚不清楚[6],但普遍认为病原微生物感染在ILD发病机制中发挥着作用[7]。研究表明腺病毒及肺炎支原体感染将增强DAD损害或直接造成肺DAD改变[8]。儿童肺部感染中,以呼吸道合胞病毒(respiratory syncytial virus, RSV)、腺病毒(adenovirus, ADV)、肺炎支原体(mycoplasma pneumoniae, MP)、流感病毒(influenza virus)、肺炎衣原体(chlamydia pneumonia, CMP)等多见,其中以RSV及ADV感染最常见[9-10]。结合AIP临床和病理表现,考虑到婴幼儿受吸烟、药物、环境污染等外界影响因素少,我们初步推断其致病原因可能为病原微生物感染。本研究直接利用儿童AIP肺组织鉴定儿童AIP肺组织中的病原体特异性蛋白,以筛选或确诊儿童AIP可能的致病病原体。
1 资料与方法 1.1 研究对象及分组收集并回顾性分析2002年1月至2018年10月重庆医科大学法医学教研室(重庆法医验伤所)患儿尸体检验资料。3位病理学专家参照2002年AST/ERS与2013年AST/ERS[10-12]发表的IIPs分类及诊断标准的多学科共识,从所有患儿中筛选出95例IIPs患儿进行病理亚型分类,设置AIP组和对照组。查阅患儿的临床资料,并向其父母进行问卷调查,设置纳入、排除标准:①年龄<14周岁;②未暴露于吸烟环境中(包括孕妇孕期无吸烟或被动吸烟史,患儿产后未被动暴露于吸烟环境中);③未接触过有毒物质、未暴露于有毒有害气体环境中;④无激素类(如皮质类固醇类)药物用药史;未接受过免疫抑制剂治疗;⑤肺部无机械性损伤。AIP的诊断需结合临床-影像-病理学诊断标准[11-13]进行,与病因明确的ARDS做出区分。对照组患儿需明确未患肺部疾病,且意外死亡这一过程(如车祸、高坠)未造成其肺部机械性损伤。本研究经重庆医科大学医学研究伦理委员会审批通过(2018年12月),资料取得监护人同意并签署知情同意书。按照纳入、排除标准,AIP组纳入20例诊断为AIP;对照组纳入13例意外死亡患儿。
1.2 主要试剂羊抗呼吸道合胞病毒抗体(ab20745)、兔抗柯萨奇腺病毒受体抗体(ab153740)、小鼠抗甲型流感病毒抗体(ab66191)、羊抗乙型流感病毒抗体(ab119969)、兔抗TLR2抗体(ab108998)、小鼠抗衣原体抗体(ab155876)购于英国Abcam公司。SABC(羊IgG、鼠IgG、兔IgG)试剂盒购于武汉博士德生物工程有限公司。
1.3 方法 1.3.1 HE染色与免疫组化病例均按照中华人民共和国安全行业标准GA/T147-1996《法医学尸体解剖》和GA/T 148-1996《法医病理学检材的提取固定、包装及送检方法》进行尸体解剖及取材:双肺经10%福尔马林溶液固定7 d左右,每叶肺于靠近肺膜和肺门处各取材1块,如发现异常或存在病变部位则加取该部位组织。每块组织大小约1 cm×1 cm×0.3 cm放入包埋盒内,流水冲洗12 h,后制成肺组织蜡块。肺组织切片厚度3 μm,56 ℃恒温烤片1 h后脱蜡水化,热诱导抗原修复15 min后漂洗,封闭过氧化物酶10 min后漂洗,滴加封闭液(5%BSA)于37 ℃温箱静置30 min。取出后按照所需检测病毒抗原滴加配比好的一抗,切片放于湿盒中于4℃冰箱里静置12~16 h过夜,取出后复温滴加相应二抗,切片放于湿盒中37 ℃温箱30 min,漂洗后滴加SABC放于湿盒中37 ℃温箱静置30 min。取出后滴加配比好的DAB显色剂进行染色,染色过程中于显微镜下观察染色情况并调整染色时长,及时终止染色。染色结束后进行分化、返蓝,脱水、透明,封片。
1.3.2 免疫组化结果判定每例标本均设置阴性对照,实验组完全按照上述操作,阴性对照组则不加入一抗。肺组织标本由3位病理学老师独立阅片,可疑阳性组加做实验。细胞质内棕黄色细颗粒状沉积判断为阳性。
1.4 统计学分析采用SPSS 21.0统计学软件进行分析。计数资料以率或百分比表示,采用秩和检验与χ2检验,检验水准α=0.05。
2 结果 2.1 一般情况AIP组样本20例,其中男性12例,女性8例,中位年龄1.92(0~11.57)岁;病程3.95±3.22 d,体温(37.49±1.13)℃。对照组样本13例,其中男性5例,女性8例,中位年龄3.5(0~14)岁。2组患儿性别、年龄构成比差异无统计学意义(P>0.05)。
2.2 AIP组临床表现20例AIP病例,19例有临床记录,其临床表现见表 1。
| 特征 | 例(%) |
| 临床表现 | 19 (95.00) |
| 呼吸系统a、消化系统b表现伴发热 | 7 (36.84) |
| 呼吸系统表现 | 5 (26.32) |
| 呼吸系统表现伴发热 | 4 (21.1) |
| 呼吸系统、消化系统表现 | 2 (10.53) |
| 消化系统表现 | 1 (5.26) |
| 临床诊断 | 16 (80.00) |
| 上呼吸道感染 | 6 (37.50) |
| 肺炎 | 4 (25.00) |
| 重症手足口病 | 2 (12.50) |
| 急性支气管炎 | 1 (6.25) |
| 颅内感染 | 1 (6.25) |
| 猝死 | 1 (6.25) |
| 新生儿黄疸 | 1 (6.25) |
| 影像学检查 | 2 (10.00) |
| 双肺纹理增多紊乱 | 2 (100.00) |
| 部分肺部感染 | 2 (100.00) |
| a:呼吸系统表现,如咳嗽、流涕、呼吸困难、强直、发绀或肺鸣音;b:消化系统表现,如呕吐、腹泻或腹痛 | |
2.3 AIP患儿血常规指标
AIP组有7例患儿查血常规:白细胞计数增高和降低各2例;中性粒细胞百分比增高2例,降低2例;2例淋巴细胞百分比增高,3例C反应蛋白计数升高;其余指标均在正常值范围;见表 2。
| 样本 | WBCa/L-1 | NEUTb/% | LYc/% | MONOd/% | CRPCe/mg·L-1 | EOSf/% | BASOg/% |
| 1 | 14.96×109↑ | 62.80 | 29.20 | - | 18.0↑ | - | - |
| 2 | 10.30×109 | 70.70↑ | 23.50 | - | - | - | - |
| 3 | 11.62×109 | 40.40↓ | 56.20↑ | - | 5.0 | - | - |
| 4 | 12.98×109↓ | 42.50↓ | 43.90↑ | 8.70 | 1.0 | 4.30 | 0.60 |
| 5 | 9.25×109↓ | 46.90↓ | 34.30 | 15.10 | - | 3.20 | - |
| 6 | 8.08×109 | 61.80 | 31.10 | - | 36.36↑ | - | - |
| 7 | ↑ | ↑ | - | - | ↑ | - | - |
| a: WBC=白细胞计数;b: NEUT=中性粒细胞百分比;c: LY=淋巴细胞百分比;d: MONO=单核细胞百分比;e: CRPC=C反应蛋白计数;f: EOS=嗜酸性粒细胞百分比;g: BASO=嗜碱性粒细胞百分比 | |||||||
2.4 AIP组患儿病理表现
大体观,20例AIP组肺标本均存在肺质地异常(质韧或实变)和部分区域颜色异常。镜下观,肺泡上皮细胞受损、肺间质水肿和肺泡腔水肿、出血,95%患儿出现了肺泡壁炎性细胞浸润,85%患儿肺泡壁增厚和炎细胞浸润,8名(40%)患儿肺泡腔透明膜形成。见图 1。
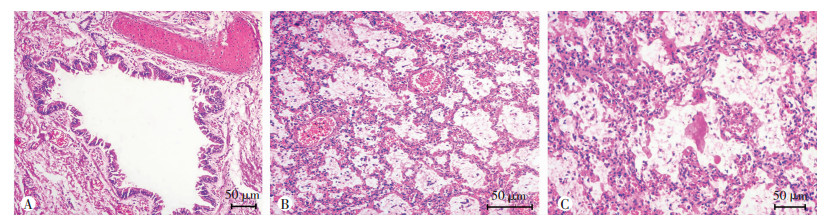
|
| A:气管黏膜上皮细胞受损;B:间质成纤维细胞增生及淋巴细胞浸润;C:肺泡壁水肿、淋巴细胞浸润及肺泡腔渗出物,透明膜形成 图 1 HE染色观察AIP组肺组织病理学表现 |
2.5 病毒抗体检测结果
RSV抗体在肺泡上皮细胞、肺泡内巨噬细胞及细支气管黏膜上皮细胞呈阳性(图 2);CAV抗体在肺泡上皮细胞呈阳性,细支气管黏膜上皮细胞呈强阳性(图 2)。
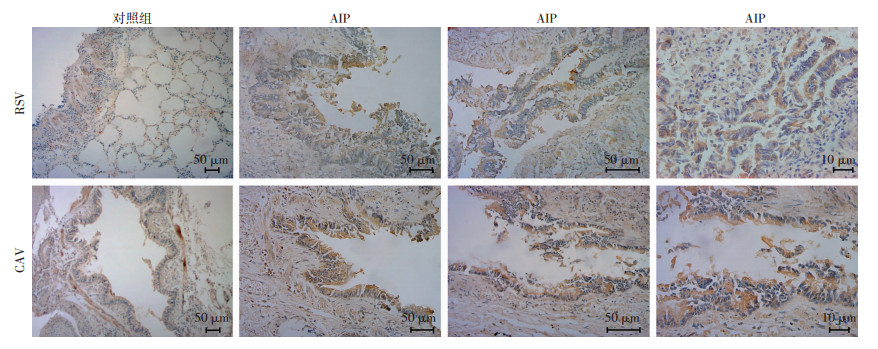
|
| 图 2 免疫组化观察RSV和CAV抗体染色结果 |
AIP组(20例)中抗体阳性结果:RSV 10例,CAV 7例,A型流感病毒1例,B型流感病毒2例,TLR2 2例,CMP 1例;对照组(13例)中RSV 1例,CAV 2例,A型流感病毒1例,B型流感病毒1例,TLR2 2例,未检出CMP;见图 3。两组实验样本中,RSV抗体检出阳性率比较差异有统计学意义(P<0.05),其余抗体阳性检出率无统计学意义(P>0.05)。

|
| 每一列代表一个独立样本,绿色表示病原体抗体阳性表达 图 3 两组病原体抗体阳性结果 |
3 讨论
自1935年首次引入AIP一词以来,关于儿童AIP的病例报告非常少,尽管在临床上AIP是一种罕见诊断,但作为一种疾病,其背后仍可能代表着相当大的儿童群体。AIP患儿发病前1~2周出现类似流感样上呼吸道感染的前驱症状,如咳嗽和发烧[14]。随着病情进展出现呼吸困难、喘息及紫绀等症状及体征,而后迅速发展为呼吸衰竭[5]。儿童AIP与成人AIP相似,无明显性别差异,与吸烟无关,无肺病史,无确切患病危险因素[3-4],疾病主要影响年龄为50~55岁,男性和女性患病率大致相同[3],没有已知的危险因素[15]。在我们的病例中,患者临床病程与之前的研究大致相同:起初病情较轻,而后突然加重。然而本研究发现儿童AIP发病比例男性略高于女性。这可能与本研究纳入样本量略少有关,需进一步研究。
尽管不同组织学领域的病变程度可能存在差异,但DAD仍然是AIP的主要病理特征。其病理变化过程可分为两期:急性期以渗出性改变为主,表现为肺间质水肿和炎细胞浸润,肺泡内水肿渗出,透明膜在此阶段出现;增生期表现为Ⅱ型肺泡细胞明显增生,肺间隔内成纤维细胞增生,但透明膜数量减少[11-13, 16-17]。本组患儿肺组织均出现肺泡上皮细胞受损、肺间质水肿和肺泡腔水肿液及出血,肺泡壁及肺泡腔炎细胞浸润,部分患儿肺泡腔透明膜形成或肺泡壁纤维组织增生,这些组织学表现提示上述病变处于AIP渗出期或增殖期。
肺活检(surgical lung biopsy,SLB)标本是诊断AIP的直接证据,但SLB标本的获取存在很多问题。虽然支气管穿刺活检有助于AIP诊断,但该方法的敏感性、特异性、活检质量、数量及活检位置等均不甚理想且操作风险高[18-19],患儿迅速恶化的病情也使得活检开展困难。在另一项关于ILD患儿的研究中,SLB的特异性诊断率为53%。这一研究数据表明SLB特异性不理想,且对于2岁以下[20]的患儿诊断率更低,故其在婴幼儿中的应用极其少见。此外,就活检损伤而言,其风险可能大于确诊疾病本身所带来的益处,结合婴幼儿自身整体状况,风险大、并发症多、术后预后差都是SLB难以开展的原因(尽管具体机制尚不清楚,但有研究表明SLB的损伤会造成DAD发生[21])。本研究通过尸体检验方式收集了较丰富儿童AIP肺组织标本,与临床肺活检相比取材更全面,且无临床风险。
儿童肺部感染中,以RSV、ADV、流感病毒、肺炎支原体、肺炎衣原体等感染多见,其中又以RSV和ADV感染最为常见。本研究对以上病原体抗体进行了免疫组化检测,AIP组检出RSV抗体阳性10例,与对照组中仅检出1例RSV抗体阳性相比,差异具有统计学意义。RSV属副粘病毒科肺炎病毒属的单链负股RNA病毒,是引起婴幼儿下呼吸道感染最主要和常见的病原体,其发病机制与诸多因素相关,一方面RSV感染会直接造成气道黏膜损伤,另一方面RSV可以作为变应原诱导机体免疫应答, 使机体在清除RSV的同时又造成免疫损伤[22]。AIP组中CAV抗体阳性7例,尽管在AIP组中CAV抗体检出率较高,但其与对照组CAV抗体阳性检出率之间差异无统计学意义,故认为儿童AIP的发生与CAV感染无关。AIP组中检测出1例A型流感病毒、2例B型流感病毒抗体,故考虑儿童AIP发生与A、B型流感病毒感染无关。AIP组中其余病原体如TLR2和CMP检出率均低,共检出3例阳性表达,且这3例中有2例存在RSV感染。AIP组中有4例6种病毒抗体均呈阴性表达,需进一步寻找病因。故就这一结果而言,儿童AIP以RSV感染为主,提示儿童AIP与病毒感染如RSV感染有关。
因受病例及疾病模型限制,且存在误诊、未就诊、缺少相关检验等情况,AIP病因与发病机制的相关研究一直很难开展。目前国内、外主要以治疗和预后研究为主,且多为病例报道。而即便是经过了强化治疗,AIP的预后仍很差,超过60%患者在患病后6个月内死亡[23]。我们目前对AIP的了解主要是基于零散研究和少量案例报告。实际上,儿科诊断和治疗采用的大多数策略都来自于成人患者研究提供的信息。总的来说,肺科医生已经达成共识,即早期诊断、抗病毒治疗可能提高治愈率或生存率。然而,从成人研究中获得的信息是否可以应用于儿童的内部环境还有待确定。本研究AIP组尽管RSV抗体阳性表达,但仍存在阴性结果且对照组部分肺组织中也有致病病原体抗体表达,提示儿童AIP病因的复杂性,尚需进一步扩大样本或进行动物实验明确。
| [1] |
GOLDMAN L, SCHAFER A I. Goldman's cecil medicine[M]. 25th ed. Philadelphia: Elsevier Saunders, 2018: 575-583.
|
| [2] |
DETERDING R R. Infants and young children with children's interstitial lung disease[J]. Pediatr Allergy Immunol Pulmonol, 2010, 23(1): 25-31. DOI:10.1089/ped.2010.0011 |
| [3] |
BRUMINHENT J, YASSIR S, PIPPIM J. Acute interstitial pneumonia (hamman-rich syndrome) as a cause of idiopathic acute respiratory distress syndrome[J]. Case Rep Med, 2011, 2011: 628743. DOI:10.1155/2011/628743 |
| [4] |
VOURLEKIS J S, BROWN K K, COOL C D, et al. Acute interstitial pneumonitis. Case series and review of the literature[J]. Medicine (Baltimore), 2000, 79(6): 369-378. DOI:10.1097/00005792-200011000-00003 |
| [5] |
MUKHOPADHYAY S, PARAMBIL J G. Acute interstitial pneumonia (AIP): relationship to Hamman-Rich syndrome, diffuse alveolar damage (DAD), and acute respiratory distress syndrome (ARDS)[J]. Semin Respir Crit Care Med, 2012, 33(5): 476-485. DOI:10.1055/s-0032-1325158 |
| [6] |
CLEMENT A, ERS TASK FORCE. Task force on chronic interstitial lung disease in immunocompetent children[J]. Eur Respir J, 2004, 24(4): 686-697. DOI:10.1183/09031936.04.00089803 |
| [7] |
SALISBURY M L, HAN M K, DICKSON R P, et al. Microbiome in interstitial lung disease: from pathogenesis to treatment target[J]. Curr Opin Pulm Med, 2017, 23(5): 404-410. DOI:10.1097/MCP.0000000000000399 |
| [8] |
FINBERG R W, KURT-JONES E A. Tolls: you pay them on the way in and on the way out![J]. J Infect Dis, 2007, 196(4): 497-498. DOI:10.1086/519694 |
| [9] |
TAKEUCHI O, AKIRA S. Recognition of viruses by innate immunity[J]. Immunol Rev, 2007, 220(1): 214-224. DOI:10.1111/j.1600-065x.2007.00562.x |
| [10] |
KASPER DL, FAUCI AS, HAUSER S, et al. Harrison's principles of internal medicine[M]. 20th ed. New York: McGraw-Hill Education, 2018: 2369-2375.
|
| [11] |
American thoracic society/European respiratory society. International multidisciplinary consensus classification of the idiopathic interstitial pneumonias[J]. Am J Respir Crit Care Med, 2002, 165(2): 277-304. DOI:10.1164/ajrccm.165.2.ats01 |
| [12] |
TRAVIS W D, COSTABEL U, HANSELL D M, et al. An official American thoracic society/European respiratory society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias[J]. Am J Respir Crit Care Med, 2013, 188(6): 733-748. DOI:10.1164/rccm.201308-1483ST |
| [13] |
SVERZELLATI N, LYNCH D A, HANSELL D M, et al. American thoracic society-European respiratory society classification of the idiopathic interstitial pneumonias: advances in knowledge since 2002[J]. Radiographics, 2015, 35(7): 1849-1871. DOI:10.1148/rg.2015140334 |
| [14] |
MASTAN A, MURUGESU N, HASNAIN A, et al. Hamman-rich syndrome[J]. Respir Med Case Rep, 2018, 23: 13-17. DOI:10.1016/j.rmcr.2017.10.008 |
| [15] |
DALPIAZ G, MAFFESSANTI M. Diffuse lung diseases[M]//Geriatric Imaging. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013: 365-388. DOI: 10.1007/978-3-642-35579-0_16.
|
| [16] |
MANDAL R V, MARK E J, KRADIN R L. Organizing pneumonia and pulmonary lymphatic architecture in diffuse alveolar damage[J]. Hum Pathol, 2008, 39(8): 1234-1238. DOI:10.1016/j.humpath.2008.01.002 |
| [17] |
TABAJ G C, FERNANDEZ C F, SABBAGH E, et al. Histopathology of the idiopathic interstitial pneumonias (ⅡP): A review[J]. Respirology, 2015, 20(6): 873-883. DOI:10.1111/resp.12551 |
| [18] |
TANIGUCHI H, KONDOH Y. Acute and subacute idiopathic interstitial pneumonias[J]. Respirology, 2016, 21(5): 810-820. DOI:10.1111/resp.12786 |
| [19] |
ARCADU A, MOUA T. Bronchoscopy assessment of acute respiratory failure in interstitial lung disease[J]. Respirology, 2017, 22(2): 352-359. DOI:10.1111/resp.12909 |
| [20] |
FAN L L, KOZINETZ C A, WOJTCZAK H A, et al. Diagnostic value of transbronchial, thoracoscopic, and open lung biopsy in immunocompetent children with chronic interstitial lung disease[J]. J Pediatr, 1997, 131(4): 565-569. DOI:10.1016/s0022-3476(97)70063-5 |
| [21] |
KAARTEENAHO R. The current position of surgical lung biopsy in the diagnosis of idiopathic pulmonary fibrosis[J]. Respir Res, 2013, 14: 43. DOI:10.1186/1465-9921-14-43 |
| [22] |
林立, 李昌崇. 呼吸道合胞病毒感染发病机制[J]. 中华儿科杂志, 2006, 44(9): 673-675. LIN L, LI C C. Respiratory syncytial virus infection pathogenesis[J]. Chin J Pediatr, 2006, 44(9): 673-675. DOI:10.3760/j.issn:0578-1310.2006.09.010 |
| [23] |
BOUROS D, NICHOLSON A C, POLYCHRONOPOULOS V, et al. Acute interstitial pneumonia[J]. Eur Respir J, 2000, 15(2): 412. DOI:10.1034/j.1399-3003.2000.15b31.x |



