巢蛋白(nestin)是一种Ⅵ型中间丝蛋白,首次被发现在多能神经干细胞(neural stem cells,NSCs)中,与NSCs的自我更新关系密切[1]。尽管Nestin已经广泛应用于神经系统各个区域中NSCs的标记与部分肿瘤的病理检查,但对于其具体功能与作用机制的研究尚不完善,其中的部分原因是神经细胞体外长期培养与基因干预具有相当难度。近年的研究表明除神经细胞与部分肿瘤外,Nestin在皮肤、心脏、胰腺、肾脏及血管内皮中均有表达[2],尤其大鼠中Nestin阳性的心室成纤维细胞在心肌受损后明显增高,参与组织损伤后的瘢痕形成[3]。不论是原代还是建株成纤维细胞的传代培养方法已经成熟,且成纤维细胞具有转化成为神经干细胞的潜能[4],因此成纤维细胞可以作为良好的载体研究Nestin的功能。
Nestin的分子量较大(240×103),具有N端较短,C端长的特殊结构[5],构建其过表达病毒载体,难以保证病毒的得率与滴度,而常规过表达克隆载体又存在筛选周期长且由于插入基因组DNA位置的随机性所导致目的蛋白表达不稳定的问题,需要采用更加方便、稳定的过表达技术应用于本实验。协同激活介导因子(synergistic activation mediator, SAM)技术[6]是在规律成簇间隔短回文序列/CRISPR相关蛋白9 (clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins 9, CRISPR/Cas9)基因敲除基础上发展起来的过表达内源基因的新技术,其优势在于能够激活分子量较大的内源蛋白高效表达,可以控制一个启动子支配的各种转录本表达,由于细胞可以容纳多个小向导RNA(single guide RNA,sgRNA),所以在一个细胞内可同时调控多种蛋白的表达,有利于研究蛋白间的相互作用。
本研究利用CRISPR/SAM技术构建了内源性过表达Nestin质粒系统,并利用其调控成纤维细胞NIH3T3中内源性Nestin的表达,初步研究了Nestin的过表达对NIH3T3细胞增殖、迁移及TGF-β1诱导下细胞胶原蛋白表达与MAPK信号传导通路激活的影响。
1 材料与方法 1.1 材料NIH3T3,293T细胞(购自中国科学院细胞库);SAM系统:lentiSAMv2、lentiMPHv2质粒自Addgene引进;病毒包装Δ8.9(Packaging plasmid)及VSVG(Envelope plasmid)质粒由实验室保存;Stbl3感受态细菌(购自博迈德公司);PEG6000(购自BIOSHARP);氯喹(购自Sigma公司);DPBS(购自BI);BsmBI(购自Biolabs);T4 DNA Ligase(购自Promega);TRIzol (购自北京鼎国公司);HiScript©ⅡRT SuperMix逆转录试剂盒(R222-01,购于Vazyme);AceQ© qPCR SYBR试剂盒(Q111-03/02,购于Vazyme);MTS试剂(购自Promega);TGF-β1(购自novoprotein);Nestin抗体(ab11306,Abcam);PCNA抗体(10205-2-AP,武汉三鹰);MAPK抗体(201246-4F3,成都正能);Phospho-MAPK抗体(301245,成都正能);α-Tubulin抗体(66031-1-1g,武汉三鹰);β-Actin抗体(66009-1-1g,武汉三鹰);CollagenⅢ抗体(22734-1-AP,武汉三鹰);CollagenⅠ抗体(66761-1-1g,武汉三鹰);Alexa Fluor 488标记山羊抗小鼠IgG(SA0006-1,武汉三鹰)。
1.2 方法 1.2.1 LV-sgRNA-MS2-P65-HSF1-Neo质粒构建首先利用哈佛大学Zhang Lab网上设计软件(网址:http://sam.genome-engineering.org/),获得7条sgRNA序列,根据文献[7]获得小鼠Nestin靶基因上游调控序列及转录起始位点(Transcriptional Start Site,TSS)相关信息,分别选择距TSS 34、77 bp与150 bp的3段sgRNA序列(序列信息见表 1),加上BsmBⅠ位点切割后产生的互补粘端后,合成寡核苷酸(表 2),经退火处理形成双链DNA。SAM系统采用哈佛大学Zhang Lab lentiSAMv2/ lentiMPHv2双质粒系统[8](来自哈佛大学Feng Zhang博士,Addgene plasmid # 75112与# 89308)。通过BsmBⅠ酶切、回收与连接,将退火sgRNA片段连入lentiSAMv2载体。经转化、菌落PCR、测序,获得序列正确的表达sgRNA的慢病毒质粒(图 1)。
| 基因名 | 基因库编码 | 转录起始位点 | 引导序列 |
| Nes | NM_016701 | 150 | ATCAAATTGTAGCCTCGCCC |
| Nes | NM_016701 | 77 | CTCTAAAGGGTTAAGGCCTA |
| Nes | NM_016701 | 34 | GTATTCATACTCCCGCCGGC |
| 编号 | 接头 | sgRNA序列 | 接头 | |
| Nes #1 | 正义链 | CACCg | ATCAAATTGTAGCCTCGCCC | c |
| 反义链 | aaac | GGGCGAGGCTACAATTTGAT | ||
| Nes #2 | 正义链 | CACCg | CTCTAAAGGGTTAAGGCCTA | c |
| 反义链 | aaac | TAGGCCTTAACCCTTTAGAG | ||
| Nes #3 | 正义链 | CACCg | GTATTCATACTCCCGCCGGC | c |
| 反义链 | aaac | GCCGGCGGGAGTATGAATAC |
1.2.2 病毒的包装、浓缩与滴度检测
过表达病毒的包装、纯化及滴度测定主要按照文献[9]的方法进行:以293T细胞作为包装细胞;辅助质粒采用Δ8.9(Packaging plasmid)及VSVG(Envelope plasmid),按照Envelope质粒:Packaging质粒:Transfer质粒(μg)= 1 :2 :3的比例混合质粒,利用磷酸钙法进行转染,收集培养48 h后上清液,过滤后以PEG6000进行病毒的浓缩。采用293T细胞进行药筛实验对病毒滴度进行检测,通过记录抗性药物处理24 h后活细胞数量,利用公式:病毒滴度=活细胞数/病毒原液量,计算病毒的滴度。
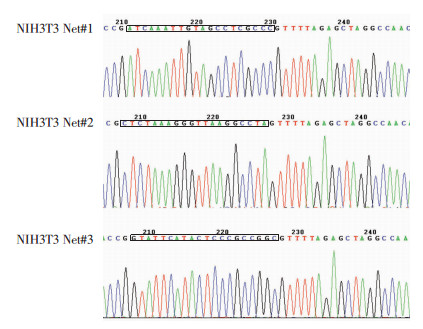
|
| 图 1 内源性过表达Nestin LV-sgRNA-MS2-P65-HSF1-Neo质粒构测序 |
1.2.3 内源性过表达Nestin细胞株构建与细胞培养
NIH3T3细胞在10%灭活小牛血清,1% NEAA,1%抗生素,88% DEME高糖,37 ℃、5% CO2环境中培养。NIH3T3细胞加入LentiMPH病毒感染24 h,以含200 μg/mL潮霉素(hygromycin)培养基连续筛选2周,获稳定细胞后,将细胞分为4组,分别用Nes-sgRNA #1、Nes-sgRNA #2、Nes-sgRNA #3和对照病毒(Nes-sgRNA con)进行感染,利用含10 μg/mL杀稻瘟菌素(blasticidin)和200 μg/mL潮霉素培养基连续筛选1周,获得Nes-sgRNA con、#1、#2、#3稳定细胞株。
1.2.4 总RNA提取和qPCR使用TRIzol提取细胞总RNA,通过NanoDropTM分光光度计定量RNA后,利用HiScript©Ⅱ RT SuperMix逆转录试剂盒制备cDNA,以AceQ© qPCR SYBR试剂盒进行各种目的基因的检测检测。qPCR引物:Nestin上游5′-CCCTGAAGTCGAGGAGCTG-3′;下游5′-CTGCACCTCTAAG-CGA-3′。Collagen Ⅲ上游5′-CTGTAACATGGAAACTGGGGAAA-3′;下游5′-CCATAGCTGAACTGAAAACCA-CC-3′。mβ-actin上游5′-GGCTGTATTCCCCTCCATCG-3′;下游5′-CCAGTTGGTAACAATGCCATGT-3′。PCR程序如下:95 ℃预变性5 min,循环反应95 ℃ 10 s,60 ℃ 30 s,40个循环,融解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。以mβ-actin为内参,使用2-ΔΔCt方法计算相对表达量。所有实验至少进行3次。
1.2.5 Western blot检测建株细胞采用无血清培养液饥饿过夜后,采用含/不含5 ng/mL TGF-β1完全培养基进行刺激,于冰上以RIPA裂解液分别提取各组0、2、4、8、12 h与24 h细胞总蛋白,采用SDS-PAGE法分离蛋白,并转移至0.45 μm PVDF膜,室温下5%脱脂牛奶封闭2 h。然后一抗4 ℃过夜。二抗室温孵育2 h。采用ECL底物发光法获取结果。并使用β-actin抗体与α-Tubulin抗体为内参对照。通过image Lab软件定量蛋白质条带的灰度值。
1.2.6 免疫荧光染色Nes-sgRNA con、#1、#3细胞接种于爬片上,经/不经5 ng/mL TGF-β1刺激24 h后,以4%多聚甲醛固定15 min,0.5% TritonX-100通透20 min,10%山羊血清封闭2 h,一抗4 ℃过夜,二抗及DAPI染色2 h,封片后以荧光显微镜拍照获取结果。
1.2.7 MTS细胞增殖检测Nestin-sgRNA con、#1、#2、#3细胞株分别接种于96孔板中,每组设置3个复孔,每孔加入100 μL培养基,37 ℃、5% CO2环境中培养。于接种后24、48、72、96、120、144 h向每孔中加入MTS试剂20 μL,重新置于37 ℃、5% CO2孵箱中继续培养2 h后,使用酶标仪测定各孔细胞的光吸收值,设置检测波长为450 nm。
1.2.8 细胞划痕实验Nes-sgRNA con、#1、#2、#3细胞接种于24孔板。培养24 h后,用200 μL移液管尖在每孔底部中间划一窄线。分别在划痕12、24 h后置细胞培养板于固定位置拍照观察拍照,测量细胞向致伤区迁移的相对迁移距离,根据原始致伤区距离利用ImageJ软件计算伤口愈合面积。
1.3 统计学分析采用SPSS 22.0统计软件,数据以x±s表示,采用配对样本t检验,检验水准:α=0.05。
2 结果 2.1 病毒包装及高效内源性过表达NestinNIH3T3细胞的鉴定qPCR检测所构建细胞的Nestin的表达水平,解链曲线(图 2A)证实反应特异性高,qPCR检测结果显示,Nes-sgRNA #1、#2、#3和对照组con的mRNA相对表达水平为(20.30±6.025)、(1.858±0.634)、(29.20± 4.201)、(1.033±0.152),差异具有统计学意义(P < 0.05), 其中#1和#3表达量最高(与对照组con相比,P < 0.01)(图 2B)。Western blot检测结果显示,Nes-sgRNA #1、#2、#3、对照组con的蛋白相对表达水平为(0.540±0.045)、(0.036±0.008)、(0.469±0.030)、(0.024±0.008),差异具有统计学意义(P < 0.05)(图 2C、D)。与qPCR结果相似,Nes-sgRNA#1和#3细胞Nestin相对表达量最高(与对照组con相比,P < 0.01),后续实验选择#1和#3细胞继续进行。免疫荧光IF验证了Nes-sgRNA #1和#3调控Nestin的表达模式,结果显示细胞模型中Nestin的表达模式与对照一致,Nestin蛋白在细胞质表达,形成轻微弯曲的纤维,以放射状形式从核周发散出去。免疫荧光也证实,与对照相比Nes-sgRNA#1和#3细胞中Nestin表达更多(图 2E)。
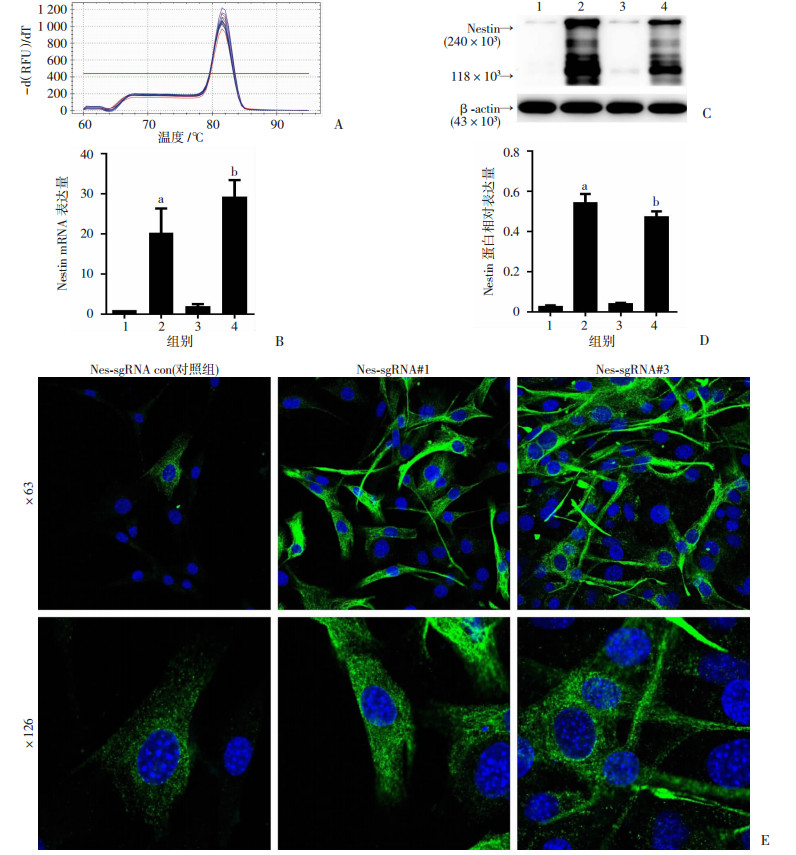
|
| A:Nestin的PCR解链曲线;B:qPCR检测Nestin mRNA相对表达量结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;3:Nes-sgRNA #2;4:Nes-sgRNA #3;a、b:P < 0.01,与对照组相比;C、D:Western blot检测Nestin蛋白表达及半定量分析结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;3:Nes-sgRNA #2;4:Nes-sgRNA #3;a、b:P < 0.01, 与对照相比;E:免疫荧光染色验证内源性过表达Nestin模式 图 2 qPCR、Western blot、免疫荧光染色检测构建的细胞模型中Nestin的表达 |
2.2 内源性过表达Nestin对NIH3T3细胞增殖的影响
MTS检测Nes-sgRNAcon(对照组)、#1、#3组细胞在450nm时的光吸收度值,绘制细胞增殖曲线。结果显示,Nes-sgRNA #1和#3组细胞增殖活力相对于对照组明显增高,差异具有统计学意义(P < 0.05)说明Nestin内源性过表达后促进了细胞增殖(图 3A)。Western blot检测结果显示,Nes-sgRNA #1、#3、对照组con的PCNA蛋白相对表达水平为(0.944±0.050)、(1.237±0.073)、(0.670±0.054),差异具有统计学意义(P < 0.05)。与增殖曲线结果相似,Nestin内源性过表达后促进了#1、#3组细胞增殖。(与对照组相比P < 0.05,图 3B、C)。
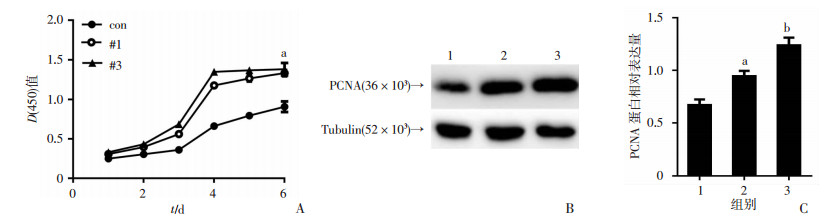
|
| A:细胞生长曲线 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;3:Nes-sgRNA #3;a:P < 0.05,与对照组相比;B、C:Western blot检测三种细胞PCNA表达及半定量分析结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;3:Nes-sgRNA #3;a、b:P < 0.05,与对照组相比 图 3 内源性过表达Nestin对NIH3T3细胞增殖的影响 |
2.3 内源性过表达Nestin对NIH3T3细胞迁移的影响
细胞划痕实验检测内源性过表达Nestin后成纤维细胞的侧向迁移能力,结果显示,与对照组相比,过表达内源性Nestin后成纤维细胞的迁移能力明显增强,结果表明,12 h的时候,#1和#3组细胞中内源性过表达Nestin后,迁移能力更好(P < 0.01,图 4)。

|
| 图 4 划痕实验检验NIH3T3细胞内源性过表达Nestin后对迁移的影响 |
2.4 内源性过表达Nestin对NIH3T3细胞胶原蛋白及相关信号传导通路的影响
胶原蛋白是成纤维细胞分化的重要标志物,qPCR结果显示,Nes-sgRNA #1和对照组con的胶原蛋白Ⅲ (Collagen Ⅲ)mRNA相对表达水平为(0.595±0.040)、(1.050±0.095),差异具有统计学意义(P < 0.01),内源性Nestin的过表达将导致Collagen Ⅲ表达明显下调(图 5A)。TGF-β1能促进成纤维细胞的分化,免疫荧光结果显示,与对照组相比,内源性过表达Nestin后成纤维细胞经TGF-β1刺激后CollagenⅢ(图 5B)。不同时相点Western blot检测的结果也证实,Nestin的过表达导致TGF-β1诱导CollagenⅢ的表达受到抑制,但CollagenⅠ变化不明显(图 5C)。由于MAPK通路的激活与成纤维细胞的分化关系密切,为了进一步明确Nestin的过表达对TGF-β1诱导下MAPK相关信号传导通路的影响,我们检测了MAPK通路相关分子ERK、JNK、P38激活的情况,结果显示:在未刺激状态下过表达内源性Nestin细胞内ERK1/2的磷酸化程度就低于对照组,而总ERK1/2表达差异无统计学意义。经TGF-β1刺激后对照组在2、4、8 h几个时相点ERK1/2的磷酸化明显上调,而过表达内源性Nestin的细胞尽管ERK1/2的磷酸化也有所上升,但磷酸化的程度明显不如对照组,提示Nestin的过表达会抑制ERK1/2的磷酸化激活(图 6A)。同样,TGF-β1所诱导的JNK磷酸化也明显受到抑制(图 6B),但P38的激活未发现明显差异(图 6C),说明Nestin的过表达会抑制MAPK信号传导通路中ERK与JNK的激活,对P38通路影响不大。
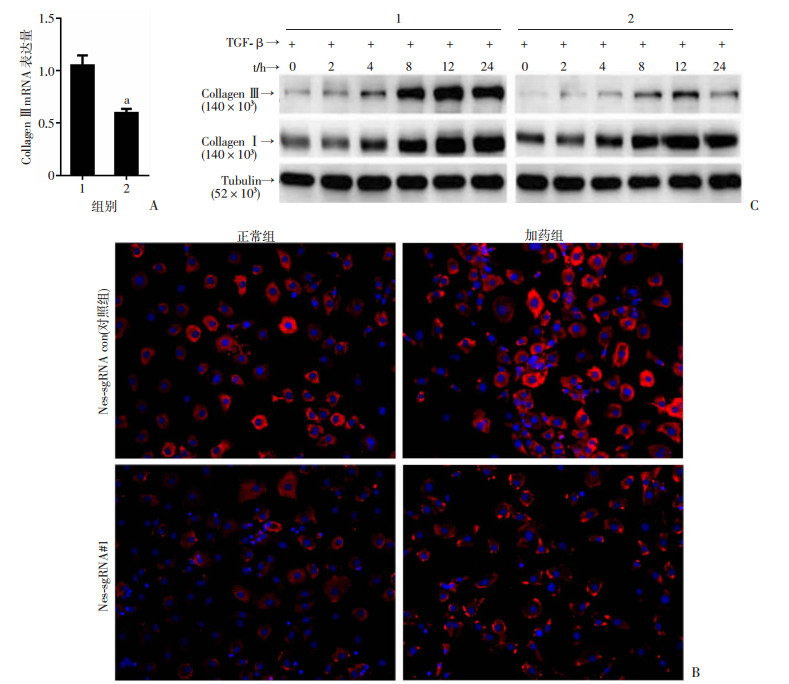
|
| A:qPCR检测CollagenⅢ表达结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;a:P < 0.01, 与对照组相比;B:免疫荧光染色实验,检测TGF-β1刺激两种细胞后的CollagenⅢ表达情况(DAPI/CollⅢ);C:Western blot检测TGF-β1(5ng/ml)不同时间点刺激两种细胞后Collagen Ⅲ、CollagenⅠ表达结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1 图 5 内源性过表达Nestin对NIH3T3细胞胶原蛋白的影响 |
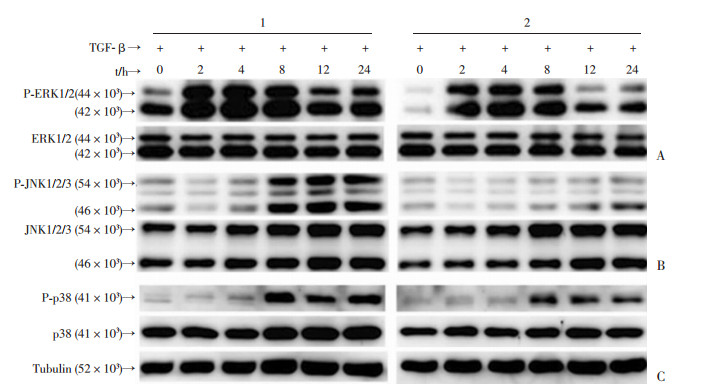
|
| A: Western blot检测磷酸化和全长ERK表达结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;B:Western blot检测磷酸化和全长JNK蛋白表达结果 1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1;C:Western blot检测磷酸化和全长P38蛋白表达结果1:对照组(Nes-sgRNA con);2:Nes-sgRNA #1 图 6 内源性过表达Nestin对NIH3T3细胞相关信号传导通路的影响 |
3 讨论
本实验采用CRISPR SAM技术成功构建了内源性过表达NestinNIH3T3细胞模型。与传统的过表达技术相比,SAM技术的是在dCas9 (Cas9酶突变后形成的dCas9序列,其编码的蛋白只具有结合基因组和sgRNA的能力,不能切割DNA)作用下,细胞内形成“基因组DNA-dCas9-sgRNA-MS2 binding site-MS2- P65-HSF1”复合体。当sgRNA设计为特定基因转录起始位点时,此超级复合体定位于转录起始位点,P65、HSF1募集大量转录因子,启动转录,从而激活转录起始位点后面的基因表达。本实验我们利用该方法在极大提高NIH3T3内源性Nestin表达的同时,节省了Nestin基因克隆及真核表达载体构建的时间,克服了由于外源性Nestin片段插入位置的随机性所致目的基因表达不稳定,也节省了筛选稳定细胞克隆的时间。另一方面我们也应当看到,由于本技术是人为利用P65、HSF1招募转录因子实现目的基因的过表达,并不适合应用于靶基因本身的调控表达研究,且P65、HSF1本身对细胞的影响也应在实验设计时予以考虑。
Nestin作为一种中间丝蛋白,其表达与功能最早在神经系统中被发现与研究。正常情况下Nestin在神经系统中的表达具有严格的时空顺序,与神经细胞分化成负相关,为神经干细胞的自我更新所需[10],与细胞骨架形成、细胞信号转导、细胞器发生、细胞新陈代谢等有关[11]。近年的发现证实Nestin在机体其他组织(如胰岛、骨骼肌、睾丸、心脏等)中也存在广泛的表达[12],在这些研究中,大部分的结果证实Nestin与细胞的增殖及迁移正相关[13]。我们建立模型的研究结果提示作用Nestin对于NIH3T3细胞的与上述研究的结论一致,也能够促进成纤维细胞的增殖与迁移。有研究证实Nestin阳性细胞参与移植皮肤或愈合伤口的修复及血管生成[14],但这些Nestin阳性细胞的性质及种类并未得到准确的鉴定。由于成纤维细胞在不同程度的细胞变性、坏死和组织缺陷以及骨创伤的修复中均发挥着十分重要的作用,我们认为Nestin阳性成纤维细胞可能是参与伤口修复的重要细胞。
胶原蛋白的表达是成纤维细胞分化与发挥功能的重要标志物。我们研究发现Nestin的过表达能够抑制成纤维细胞Ⅲ型胶原蛋白(CollagenⅢ)的表达,说明Nestin能够发挥抑制成纤维细胞分化的功能。另一方面,瘢痕组织的产生是组织修复的必然产物,而以过度的纤维化和胶原蛋白的沉积为特征的病理性瘢痕组织(增生性瘢痕和瘢痕疙瘩),是人类真皮组织所特有的一种纤维代谢性疾病。研究已经证实,瘢痕疙瘩的形成过程中,以Ⅰ型胶原(CollagenⅠ)增加为主,而增生性瘢痕Ⅰ、Ⅲ型胶原均明显增加。我们的研究结果提示Nestin可能会参与瘢痕形成的不同病理过程,在后期实验中需要应用临床样品进行进一步的验证。我们前期证实NIH3T3细胞中存在一定程度的Nestin表达,通过与Gli3的相互作用参与SHH通路调控[15],但关于Nestin对成纤维细胞其他信号传导通路,尤其是瘢痕生成相关的信号传导通路影响的研究还较少见到。已知多种信号传导通路如Wnt、Notch、AKT/mTOR及MAKP与组织修复及病理性瘢痕组织的发生密切相关,而TGF-β1作为公认的致纤维化因子,是目前已知的与胶原代谢和瘢痕形成关系最为密切的细胞因子,能够诱导成纤维细胞分化,促进胶原蛋白的合成[16]。TGF-β1在病理性瘢痕形成过程中能够激活MAPK通路,抑制MAPK的激活能够抑制瘢痕疙瘩成纤维细胞的增殖以及胶原合成[17-18]。MAPK可分为4个亚族:ERK、p38、JNK和ERK5,一般认为ERK参与细胞的增殖分化的调控。JNK家族参与细胞对辐射、渗透压、温度变化等应激反应。p38介导炎症、凋亡等。我们的研究证实Nestin的表达能够降低TGF-β1的转化作用,它主要影响TGF-β1诱导下MAPK中ERK与JNK通路的激活,提示Nestin可能主要参与成纤维细胞增殖与应激反应过程,可能具有促进组织修复,抑制病理性瘢痕生成作用。上述推论需要利用所建立的模型进一步证实。
综上所述,我们利用SAM技术成功建立了Nestin过表达系统,该系统稳定可靠,在此基础上我们验证了成纤维细胞中内源性Nestin的过表达会对细胞生物学性状及信号传导通路产生影响。本研究对后期进一步明确Nestin在成纤维细胞与神经干细胞的功能,尤其所影响的具体信号传导通路及相互作用分子的研究奠定了基础。
| [1] |
PARK D, XIANG A P, MAO FF, et al. Nestin is required for the proper self-renewal of neural stem cells[J]. Stem Cells, 2010, 28(12): 2162-2171. DOI:10.1002/stem.541 |
| [2] |
BERNAL A, ARRANZ L. Nestin-expressing progenitor cells: function, identity and therapeutic implications[J]. Cell Mol Life Sci, 2018, 75(12): 2177-2195. DOI:10.1007/s00018-018-2794-z |
| [3] |
CALDERONE A. The biological role ofnestin(+)-cells in physiological and pathological cardiovascular remodeling[J]. Front Cell Dev Biol, 2018, 6: 15. DOI:10.3389/fcell.2018.00015 |
| [4] |
TANG Y W, XIONG S M, YU P, et al. Direct conversion of mouse fibroblasts into neural stem cells by chemical cocktail requires stepwise activation of growth factors and Nup210[J]. Cell Rep, 2018, 24(5): 1355-1362.e3. DOI:10.1016/j.celrep.2018.06.116 |
| [5] |
MICHALCZYK K, ZIMAN M. Nestin structure and predicted function in cellular cytoskeletal organisation[J]. Histol Histopathol, 2005, 20(2): 665-671. DOI:10.14670/HH-20.665 |
| [6] |
JOUNG J, KONERMANN S, GOOTENBERG J S, et al. Genome-scale CRISPR-Cas9 knockout and transcriptional activation screening[J]. Nat Protoc, 2017, 12(4): 828-863. DOI:10.1038/nprot.2017.016 |
| [7] |
CHENG L P, JIN Z G, LIU L, et al. Characterization and promoter analysis of the mousenestin gene[J]. FEBS Lett, 2004, 565(1/2/3): 195-202. DOI:10.1016/j.febslet.2004.03.097 |
| [8] |
KONERMANN S, BRIGHAM M D, TREVINO A E, et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex[J]. Nature, 2015, 517(7536): 583-588. DOI:10.1038/nature14136 |
| [9] |
KUTNER R H, ZHANG X Y, REISER J. Production, concentration and titration ofpseudotyped HIV-1-based lentiviral vectors[J]. Nat Protoc, 2009, 4(4): 495-505. DOI:10.1038/nprot.2009.22 |
| [10] |
DI C G, XIANG A P, JIA L, et al. Involvement of extracellular factors in maintaining self-renewal of neural stem cell bynestin[J]. Neuroreport, 2014, 25(10): 782-787. DOI:10.1097/WNR.0000000000000177 |
| [11] |
NOWAK A, DZIEGIEL P. Implications ofnestin in breast cancer pathogenesis (Review)[J]. Int J Oncol, 2018, 53(2): 477-487. DOI:10.3892/ijo.2018.4441 |
| [12] |
HERTIG V, MATOS-NIEVES A, GARG V, et al. Nestin expression is dynamically regulated in cardiomyocytes during embryogenesis[J]. J Cell Physiol, 2018, 233(4): 3218-3229. DOI:10.1002/jcp.26165 |
| [13] |
WANG J, CAI J, HUANG Y, et al. Nestin regulates proliferation and invasion of gastrointestinal stromal tumor cells by altering mitochondrial dynamics[J]. Oncogene, 2016, 35(24): 3139-3150. DOI:10.1038/onc.2015.370 |
| [14] |
AKI R, AMOH Y, LI L N, et al. Nestin-expressing interfollicular blood vessel network contributes to skin transplant survival and wound healing[J]. J Cell Biochem, 2010, 110(1): 80-86. DOI:10.1002/jcb.22512 |
| [15] |
LI P, LEE E H, DU F, et al. Nestin mediates hedgehog pathway tumorigenesis[J]. Cancer Res, 2016, 76(18): 5573-5583. DOI:10.1158/0008-5472.CAN-16-1547 |
| [16] |
COENTRO J Q, PUGLIESE E, HANLEY G, et al. Current and upcoming therapies to modulate skin scarring and fibrosis[J]. Adv Drug Deliv Rev, 2018, S0169-S409X(18)30207-2. DOI:10.1016/j.addr.2018.08.009 |
| [17] |
LIANG C J, YEN Y H, HUNG L Y, et al. Thalidomide inhibitsfibronectin production in TGF-β1-treated normal and keloid fibroblasts via inhibition of the p38/Smad3 pathway[J]. Biochem Pharmacol, 2013, 85(11): 1594-1602. DOI:10.1016/j.bcp.2013.02.038 |
| [18] |
HE T, BAI X Z, YANG LL, et al. Loureirin B inhibits hypertrophic scar formation via inhibition of the TGF-β1-ERK/JNK pathway[J]. Cell Physiol Biochem, 2015, 37(2): 666-676. DOI:10.1159/000430385 |



