2. 儿科学重庆市重点实验室
2. Chongqing Key Laboratory of Pediatrics, Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
Ⅱ型肺泡上皮细胞(alveolar epithelium cell Ⅱ, AECⅡs)是肺泡上皮的重要组成部分,与Ⅰ型肺泡上皮细胞(alveolar epithelial cell Ⅰ, AECⅠs)一同构成肺泡,占肺泡上皮细胞总数的14%~16%[1]。肺表面活性物质(pulmonary surfactant, PS)是存在于肺泡表面被覆的气液分子层表面的一种脂蛋白,由Ⅱ型细胞分泌,有降低肺泡的表面张力、保证肺泡的顺应性等作用,包含4种蛋白:表面活性物质相关蛋白A(surfactant-associated protein A, SFTPA)、表面活性物质相关蛋白B(surfactant-associated protein B, SFTPB)、表面活性物质相关蛋白C(surfactant-associated protein C, SFTPC)和表面活性物质相关蛋白D(surfactant-associated protein D, SFTPD)。其中,SFTPC是仅在AECⅡs表达的活性蛋白[2],首先在AECⅡs胞质内的板层小体中合成肺表面活性物质蛋白C前体蛋白(prosurfactant protein C, pro SP-C),pro SP-C经过多次酶解成为具有生理活性的SFTPC[3-4]。因此pro SP-C和SFTPC通常被认为是AECⅡs的标志物,pro SP-C和SFTPC的表达水平在一定程度上反映AECⅡs的数量及功能。AECⅡs可以促进肺泡巨噬细胞趋化、T淋巴细胞分化及表达Toll样受体,参与机体免疫调节[2-3]。在慢性阻塞性肺病、急性呼吸窘迫综合征、肺水肿等肺疾病中,支气管肺泡灌洗液中SFTPC水平减少,由此可见,AECⅡs与许多肺部疾病的发病和病理过程息息相关,研究AECⅡs在肺内的数量及功能的改变对于许多相关肺疾病的预防与治疗都具有重要的意义。
染色质重构复合物核心催化亚基(Brahma-related gene 1,Brg1)是定位于人类19p13.2染色体,在小鼠体内位于9A3,是表观遗传学ATP依赖的多亚基组成的染色质重塑复合物(chromatin-remodeling complex, SWI/SNF)的核心成分之一,其主要作用是利用ATP水解产生能量从而实现染色体重组[4]。有研究表明,Brg1可以明显降低MCF7细胞系的DNA合成和CyclinD1的表达水平[5],而本课题组前期研究发现在16HBE细胞系中敲低Brg1可以增加该细胞的增殖迁移能力,同时在哮喘小鼠肺泡Ⅱ型上皮细胞上特异性敲除Brg1可对上皮细胞的增殖和分化起着十分重要的作用[6-7]。但目前仍没有Brg1对AECⅡs影响的相关研究,因此本研究旨在探讨Brg1对AECⅡs数量和功能的影响及可能机制,为治疗某些肺部疾病如支气管哮喘、肺纤维化、急性肺损伤等提供新的思路和方向。
1 材料与方法 1.1 实验动物SPF级雌性C57BL/6小鼠,6~8周龄,购自重庆医科大学实验动物中心。Brg1fl/fl小鼠为在C57BL/6小鼠背景上条件性敲除Ⅱ型肺泡上皮细胞上Brg1基因的纯合子小鼠。敲除鼠获得和基因型鉴定方法:将两种转基因小鼠Brg1fl/fl和SP-C-rtTA/(tetO)7-Cre在SPF级饲养环境中进行交配,于生后大约7 d剪指甲提取DNA,qPCR及PCR检测小鼠基因型。将得到的纯合子小鼠喂养母乳至3周后给予2%多西环素水7 d,诱导(tetO)7-Cre重组酶活性从而靶向剪切AECⅡs上Brg1基因,Western blot检测Brg1表达水平。
1.2 主要试剂小鼠DNA提取试剂配制方法如下。①缓冲液A:0.5 moL/L EDTA(pH 8.0) 100 μL加10 moL/L NaOH 625 μL,加双蒸水定容至250 mL,混匀后室温储存;②缓冲液B:40 mmoL/L Tribase 100 mL(pH 3.0)。其余试剂:pro SP-C兔抗小鼠单克隆抗体(Abcam,ab40879),SFTPC兔抗小鼠单克隆抗体(Abcam,ab211326),兔抗人Brg1单克隆抗体(Santa cruz),SFTPA兔抗小鼠多克隆抗体(Bioss,bs-10265R),SFTPD兔抗小鼠多克隆抗体(Bioss,bs-21617R),兔抗小鼠CyclinD1多克隆抗体(bioss,bs-20597R),兔抗PI3K(Proteintech),兔抗p-PI3K(CST),兔抗AKT(Proteintech),兔抗p-AKT(CST),山羊抗兔Alexa-Fluor 488荧光二抗,PE标记的山羊抗兔IgG流式抗体,Ⅰ型胶原酶COLLAGENASEⅠ(Sigma c0130),兔超敏二步法免疫组化检测试剂盒(中杉金桥生物技术);全蛋白试剂提取盒(南京凯基生物科技),BCA法蛋白定量试剂盒(百泰克生物技术);DNA Marker、SYBR Premix ExTaqTM(TaKaRa公司)。PCR引物由上海生工生物工程合成:序列如下Brg1L5 5′-TCTCATGCACAGAGGTCCTG-3′,Brg1R276 5′-TAGCCCCTTGAAAGTGATCC-3′,oIMR1084 5′-GCGGTCTGGCAGTAAAAACTATC-3′,oIMR1085 5′-GTGAAACAGCATTGCTGTCACTT-3′,oIMR7338 5′-CTAGGCCACAGAATTGAAAGATCT-3′,oIMR7339 5′-GTAGGTGGAAATTCTAGCATCATCC-3′,oIMR8744 5′-CAAATGTTGCTTGTCTGGTG-3′,oIMR8745 5′-GTCAGTCGAGTGCACAGTTT-3′,oIMR8746 5′-CGCTGTGGGGCATTTTACTTTAG-3′,oIMR8747 5′-CATGTCCAGATCGAAATCGTC-3′。
1.3 肺组织中SFTPC免疫组化染色肺组织脱水石蜡包埋块制作成4 μm组织切片,脱蜡入水,一抗(兔抗小鼠SFTPC的单克隆抗体1:500)4 ℃孵育过夜,采用组化试剂盒孵育山羊抗兔二抗,DAB染色,苏木精复染,中性树脂封片,每只小鼠肺组织选取5个肺泡区(×400),计数SFTPC阳性的细胞数,应用GraphPad Prism 5.0软件分析各组阳性细胞数。
1.4 肺组织中SFTPC免疫荧光染色肺组织脱水石蜡包埋块,制作4 μm组织切片,脱蜡入水,一抗(兔抗小鼠SFTPC的单克隆抗体1:200)4 ℃孵育过夜,将二抗以1:500稀释并于室温避光孵育60 min。将DAPI染色液常温避光孵育30 min进行细胞核染色, 清洗后, 封片, 干燥后采集成像。
1.5 流式细胞术检测肺组织中pro SP-C阳性细胞数取小鼠肺组织,用0.2% Ⅰ型胶原酶(1640配置)1~2 mL 37 ℃消化15 min,于200目筛网上反复剪碎,1640培养基冲洗,制成单细胞悬液, 2 500 r/min 4 ℃离心5 min, 1 mL PBS洗涤2遍,4%多聚甲醛室温固定15 min,直接加入1 mL PBS终止固定,2 500 r/min 4 ℃离心5 min,0.5%Triton X-100室温破膜20 min后直接加入1 mL PBS终止后离心。弃上清加入50 μL大鼠血清封闭20 min,再加入1 μL pro SP-C抗体每管,室温孵育1.5 h,1 mL PBS洗涤后离心,弃上清,加入2 μL PE标记的山羊抗兔IgG流式抗体(二抗)。室温避光孵育30 min,1 mL PBS洗涤2遍,离心后200 μL PBS重悬上机。
1.6 Western blot检测各组小鼠肺组织中EGFR、p-EGFR、PI3K、p-PI3K、AKT、p-AKT、NF-κB p65及CyclinD1蛋白的表达用全蛋白试剂提取盒提取40 mg各组小鼠肺组织的总蛋白,按BCA蛋白定量试剂盒说明书测定蛋白浓度。取100 μg总蛋白上样,10% SDS-PAGE电泳后转移至PVDF膜(美国Millipore公司),封闭后分别加入相应一抗(Brg1 1:200,SFTPC 1:1 000,pro SP-C 1:1 000,SFTPA 1:1 000,SFTPD 1:1 000,CyclinD1 1:1 000,EGFR 1:1 000,p-EGFR 1:1 000,PI3K 1:1 000,p-PI3K 1:1 000,AKT 1:500,p-AKT 1:500,NF-κB 1:500,内参:兔抗小鼠β-actin单克隆抗体1:1 000),4 ℃孵育过夜,漂洗后分别加入相应二抗(辣根过化物酶标记的山羊抗兔1:5 000稀释),室温孵育1 h,TBST洗膜后滴加ECL显色剂用荧光化学发光凝胶成像系统进行化学发光、照相,用Image J软件对条带进行定量分析。
1.7 统计学分析采用GraphPad Prism 5.0软件和SPSS 11.5软件进行分析。各组比较采用t检验。检验水准α=0.05。
2 结果 2.1 Brg1fl/fl小鼠的鉴定为鉴定合笼小鼠子代的基因型,运用了qPCR、PCR扩增、琼脂糖凝胶电泳同时鉴定了SPC-rt TA、Brg1和(tetO)7-Cre基因。SPC-rt TA判断方式为:阴性溶解峰在(80±1)℃,阳性小鼠溶解峰(90±1)℃ (图 1A);Brg1基因型判定方式为:Brg1fl/fl纯合扩增条带在260 bp, Brg1fl/-杂合扩增条带同时有260 bp和160 bp两个条带(图 1B);Cre判断方式(图 1C、D):引物(tetO)7-Cre7338/7339是内参,鉴定所提DNA是否可用,条带为300 bp且亮的为可用;引物(tetO)7-Cre1084/1085用于鉴定Cre是否为阳性,阳性扩增带在100 bp,条带亮,无杂带。只有同时满足Brg1为纯合、(tetO)7-Cre和SPC-rtTA同时阳性的小鼠才为纯合子,即为Brg1fl/fl小鼠。Western blot检测结果显示Brg1在Brg1fl/fl小鼠肺组织匀浆中的表达明显低于WT小鼠(图 1E、F, P < 0.01),提示已成功构建在肺组织中条件性敲低Brg1的小鼠模型。
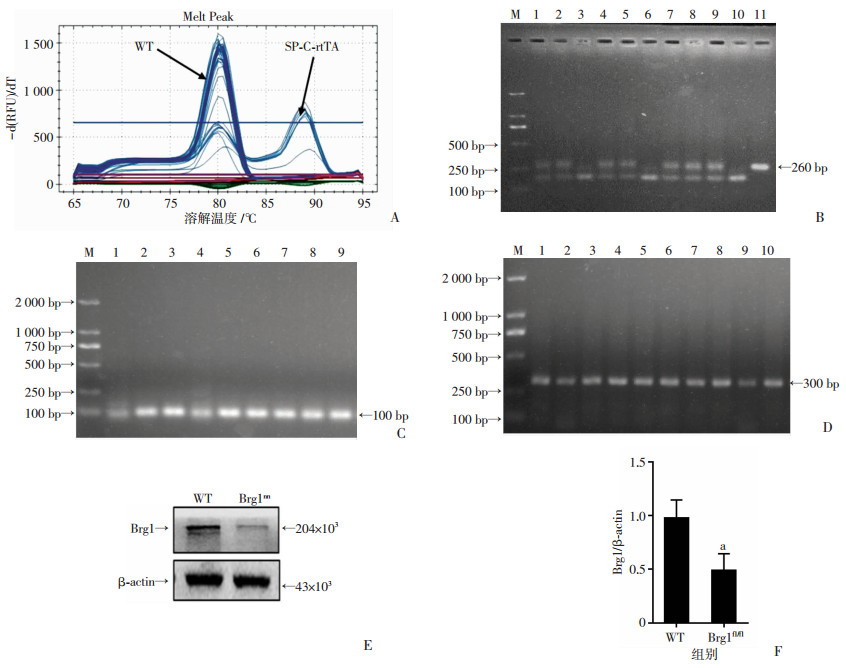
|
| A:qPCR示SP-C-rtTA鉴定结果;B:PCR示Brg1fl/fl基因鉴定结果;C、D: (tetO)7-Cre鉴定结果;E、F:Western blot检测WT组和Brg1fl/fl组中Brg1蛋白质表达水平 M:标准;1~11:分别代表小鼠编号;a: P < 0.01, 与WT组相比 图 1 Brg1转基因小鼠子代基因型鉴定结果 |
2.2 敲除Brg1对小鼠AECⅡs数量的影响 2.2.1 免疫组化和免疫荧光测定肺组织中SFTPC阳性的细胞数量
肺组织石蜡切片抗SFTPC免疫组化(图 2A、B)及免疫荧光(图 2C)检测肺泡SFTPC阳性细胞数。结果显示Brg1fl/fl组小鼠肺泡SFTPC阳性(箭头所指细胞)细胞数明显高于WT组(P < 0.01,图 2)。
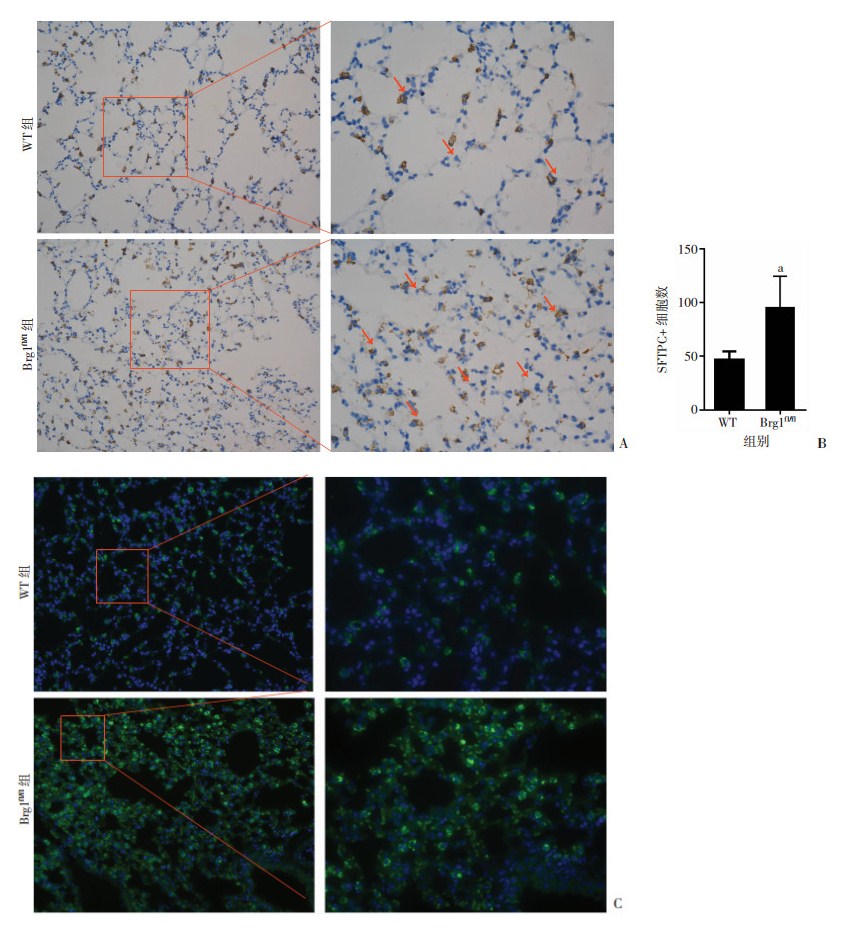
|
| A:抗SFTPC免疫组化检测WT组和Brg1fl/fl组小鼠肺组织中SFTPC阳性的细胞数;B:免疫组化SFTPC阳性细胞统计分析 a: P < 0.01, 与WT组相比;C:抗SFTPC免疫荧光检测WT组和Brg1fl/fl组肺组织中SFTPC阳性的细胞数 图 2 WT组和Brg1fl/fl组小鼠肺组织SFTPC免疫组化及免疫荧光 |
2.2.2 流式细胞术测定pro SP-C阳性的细胞数量
与WT组比较, Brg1fl/fl组小鼠肺组织中pro SP-C阳性的细胞比例显著升高(P < 0.05,图 3)。

|
| A:WT组;B:Brg1fl/fl组 图 3 两组小鼠肺组织中pro SP-C阳性细胞水平 |
2.3 敲除Brg1对小鼠AECⅡs分泌的功能的影响 2.3.1 敲除Brg1促进肺组织匀浆中SFTPC和pro SP-C的表达
Western blot检测结果显示,Brg1fl/fl组小鼠肺组织匀浆中AECⅡs标记性分子pro SP-C、SFTPC的表达显著高于WT组(P < 0.05,图 4)。

|
| A-D:Western blot检测WT组和Brg1fl/fl组肺组织中pro SP-C与SFTPC的表达水平及其统计分析 a: P < 0.05, 与WT相比 图 4 Western blot检测两组pro SP-C和SFTPC蛋白表达水平 |
2.3.2 敲除Brg1促进AECⅡs功能性蛋白SFTPA和SFTPD的分泌
进一步研究表明,Brg1fl/fl组小鼠肺组织匀浆中AECⅡs分泌的其他功能性蛋白SFTPA、SFTPD的表达水平也显著高于WT组(P < 0.01,图 5),表明特异性敲除AECⅡs中的Brg1可以显著促进小鼠AECⅡs功能性蛋白SFTPA和SFTPD分泌增加。

|
| A~D:Western blot检测WT组和Brg1fl/fl组肺组织中SFTPA和SFTPD的表达水平及其统计分析 a: P < 0.01, 与WT相比 图 5 WT组和Brg1fl/fl组小鼠肺组织中SFTPA及SFTPD蛋白质水平 |
2.4 敲除Brg1促进EGFR/PI3K/AKT信号通路的激活及相关蛋白的表达
与对照组相比,Brg1fl/fl组p-EGFR/EGFR、p-PI3K/PI3K、p-AKT/AKT的表达明显上调,差异均有统计学意义(P < 0.05,图 6A、B)。同时其下游分子NF-κB p65及CyclinD1的表达也显著升高(P < 0.01, 图 6C、D)。

|
| A、B:Western blot检测WT组和Brg1fl/fl组肺组织中EGFR、p-EGFR、PI3K、p-PI3K、AKT、p-AKT的表达水平及p-EGFR/EGFR、p-PI3K/PI3K、p-AKT/AKT比值的其统计分析;C-F:WT组和Brg1fl/fl组中肺组织中NF-κB p65、CyclinD1的表达水平及其统计分析 a: P < 0.05, b: P < 0.01, 与WT组相比 图 6 Western blot检测WT组和Brg1fl/fl组中EGFR、p-EGFR、PI3K、p-PI3K、AKT、p-AKT、NF-κB p65及CyclinD1蛋白质表达水平 |
3 讨论
染色质重塑复合物核心催化亚基Brg1是一种磷酸化核蛋白,其主要的作用是通过ATP水解产生能量重排核小体位置和组蛋白-DNA相互作用调节基因转录,从而促进靶基因的转录激活或抑制。在人非小细胞肺癌的细胞中,Brg1缺失会改变其细胞的形态,增加其成瘤潜能[8]。研究表明,Brg1结合磷酸化的视网膜母细胞瘤蛋白(phosphorylated retinoblastoma protein, pRB蛋白)形成复合物抑制E2F转录因子的释放,下调细胞周期蛋白E、细胞周期蛋白A的表达,从而干扰成纤维细胞的增殖[9-10]。提示Brg1在促进细胞增殖、调控细胞周期中发挥重要作用[11-12]。本实验结果显示特异性敲除AECⅡs的Brg1可以促使AECⅡs数量的增加,可能与Brg1参与AECⅡs的增殖有关。除此之外,文献[5]报道Brg1可以占据内源性细胞周期蛋白D1的AP-1位点,通过向CyclinD1启动子区募集辅阻遏物(HDAC1、HP1、Suv39h1)来抑制CyclinD1的表达,这与本实验中敲除Brg1发现CyclinD1的表达增多一致。
多种信号通路参与细胞的增殖调控,其中EGFR/PI3K/AKT信号通路是哺乳动物中广泛存在的经典信号通路, 在介导细胞分化、增殖、自噬、凋亡中发挥重要作用[13]。研究表明, 表皮生长因子(epidermal growth factor, EGF)在表皮细胞、成纤维细胞和上皮细胞等细胞的增殖中起着重要的作用[14],表皮生长因子受体(epidermal growth factor receptor, EGFR)是一种酪氨酸激酶受体,是由胞内、胞外、跨膜结构域组成的糖蛋白,EGF与EGFR结合后通过其胞内结构域的自磷酸化促进受体二聚体激活,进而启动磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/AKT信号通路[15]。AKT,也称为蛋白激酶B(PKB),是一种丝氨酸/苏氨酸特异性蛋白激酶,在大脑、心脏、肺和皮肤等多种人体组织中细胞生长和增殖的正常调节中起着关键作用。文献[16]报道,在胰腺癌细胞中,Brg1可参与调控PI3K/AKT信号通路的磷酸化调控PI3K/AKT信号通路的激活,从而影响胰腺癌细胞的生长;同时,AKT通过Ser473位点的磷酸化被证实可以通过激活转录因子核因子NF-κB,促进其表达增多并从胞质转移至细胞核,上调CyclinD1的表达来促进细胞增殖[17-18]。另外,Brg1也可以调控AKT上Ser473位点的磷酸化直接促进CyclinD1的表达,从而促进前列腺癌细胞的生长[19]。CyclinD1是调控细胞周期G1期到S期关卡点最关键的蛋白,可通过结合并激活细胞周期相关激酶(如CDK4、CDK6),促进细胞周期运行,其过度表达可缩短G1期加快细胞周期进程,促进细胞增殖[20]。这与本研究实验结果相符,说明敲除Brg1可以激活EGFR/PI3K/AKT信号通路,引起下游NF-κB p65增多,从而促进CyclinD1蛋白的表达,促进AECⅡs的增殖,但是Brg1的具体作用机制暂不清楚,需进一步探讨。
综上,特异性敲除C57BL/6小鼠Ⅱ型肺泡上皮细胞中的Brg1可促使AECⅡs数量和分泌功能的增加,其可能机制是与敲除Brg1促进EGFR/PI3K/AKT/NF-κB信号通路激活,且促进增殖相关的周期蛋白CyclinD1表达相关。肺组织中AECⅡs数量和功能的增加,可以使肺部能够及时修复损伤,防止外界病原侵入,同时,其分泌的SFTPC、SFTPA、SFTPD蛋白明显增多可以改善肺部的顺应性及发挥免疫调节作用,为研究和治疗肺纤维化、哮喘、急性肺损伤等呼吸系统的疾病提供了新的靶点和方向,但其具体机制还有待进一步的研究。
| [1] |
LIANG J R, ZHANG Y L, XIE T, et al. Hyaluronan and TLR4 promote surfactant-protein-C-positive alveolar progenitor cell renewal and prevent severe pulmonary fibrosis in mice[J]. Nat Med, 2016, 22(11): 1285-1293. DOI:10.1038/nm.4192 |
| [2] |
XIA Y, FENG S, LIU Z, et al. Rhodium (Ⅰ)‐catalyzed sequential C (sp) C (sp3) and C (sp3)C (sp3) bond formation through migratory carbene insertion[J]. Angew Chem Int Edit, 2015, 54(27): 7891-7894. DOI:10.1002/anie.201503140 |
| [3] |
ROLDAN N, NYHOLM T K M, SLOTTE J P, et al. Effect of lung surfactant protein SP-C and SP-C-promoted membrane fragmentation on cholesterol dynamics[J]. Biophys J, 2016, 111(8): 1703-1713. DOI:10.1016/j.bpj.2016.09.016 |
| [4] |
CHIGNALIA A Z, VOGEL S M, REYNOLDS A B, et al. P120-catenin expressed in alveolar type Ⅱ cells is essential for the regulation of lung innate immune response[J]. Am J Pathol, 2015, 185(5): 1251-1263. DOI:10.1016/j.ajpath.2015.01.022 |
| [5] |
RAO M, CASIMIRO M C, LISANTI M P, et al. Inhibition of cyclin D1 gene transcription by Brg-1[J]. Cell Cycle, 2008, 7(5): 647-655. DOI:10.4161/cc.7.5.5446 |
| [6] |
WANG T, ZOU W, NIU C, et al. Brg1 inhibits E-cadherin expression in lung epithelial cells and disrupts epithelial integrity[J]. J Mol Med (Berl), 2017, 95(10): 1117-1126. DOI:10.1007/s00109-017-1576-7 |
| [7] |
蔡霜, 邹文静, 王婷, 等. Brg1通过STAT6促进哮喘气道黏液高分泌[J]. 南方医科大学学报, 2018, 38(1): 42-47. CAI S, ZOU W J, WANG T, et al. Brahma-related gene 1 promotes airway mucus hypersecretion via STAT6 in asthmatic mice[J]. J South Med Univ, 2018, 38(1): 42-47. |
| [8] |
ORVIS T, HEPPERLA A, WALTER V, et al. BRG1/SMARCA4 inactivation promotes non-small cell lung cancer aggressiveness by altering chromatin organization[J]. Cancer Res, 2014, 74(22): 6486-6498. DOI:10.1158/0008-5472.can-14-0061 |
| [9] |
DUNAIEF J L, STROBER B E, GUHA S, et al. The retinoblastoma protein and BRG1 form a complex and cooperate to induce cell cycle arrest[J]. Cell, 1994, 79(1): 119-130. DOI:10.1016/0092-8674(94)90405-7 |
| [10] |
STROBECK M W, KNUDSEN K E, FRIBOURG A F, et al. BRG-1 is required for RB-mediated cell cycle arrest[J]. Proc Natl Acad Sci USA, 2000, 97(14): 7748-7753. DOI:10.1073/pnas.97.14.7748 |
| [11] |
WONG A K, SHANAHAN F, CHEN Y, et al. BRG1, a component of the SWI-SNF complex, is mutated in multiple human tumor cell lines[J]. Cancer Res, 2000, 60(21): 6171-6177. |
| [12] |
HARGREAVES D C, CRABTREE G R. ATP-dependent chromatin remodeling: genetics, genomics and mechanisms[J]. Cell Res, 2011, 21(3): 396-420. DOI:10.1038/cr.2011.32 |
| [13] |
MAYER I A, ARTEAGA C L. The PI3K/AKT pathway as a target for cancer treatment[J]. Annu Rev Med, 2016, 67: 11-28. DOI:10.1146/annurev-med-062913-051343 |
| [14] |
MCGRATH M H. Peptide growth factors and wound healing[J]. Clin Plast Surg, 1990, 17(3): 421-432. |
| [15] |
BAZLEY L A, GULLICK W J. The epidermal growth factor receptor family[J]. Endocr-Relat Cancer, 2005, 12(Suppl 1): S17-S27. DOI:10.1677/erc.1.01032 |
| [16] |
JUBIERRE L, SORIANO A, PLANELLS-FERRER L, et al. BRG1/SMARCA4 is essential for neuroblastoma cell viability through modulation of cell death and survival pathways[J]. Oncogene, 2016, 35(39): 5179-5190. DOI:10.1038/onc.2016.50 |
| [17] |
SONG G, OUYANG G L, BAO S D. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59-71. DOI:10.1111/j.1582-4934.2005.tb00337.x |
| [18] |
SCHENCK A, GOTO-SILVA L, COLLINET C, et al. The endosomal protein Appl1 mediates akt substrate specificity and cell survival in vertebrate development[J]. Cell, 2008, 133(3): 486-497. DOI:10.1016/j.cell.2008.02.044 |
| [19] |
LV D J, SONG X L, HUANG B, et al. HMGB1 promotes prostate cancer development and metastasis by interacting with brahma-related gene 1 and activating the Akt signaling pathway[J]. Theranostics, 2019, 9(18): 5166. DOI:10.7150/thno.33972 |
| [20] |
SANTO L, SIU K T, RAJE N. Targeting cyclin-dependent kinases and cell cycle progression in human cancers[J]. Semin Oncol, 2015, 42(6): 788-800. DOI:10.1053/j.seminoncol.2015.09.024 |



