2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:全军临床病理学研究所,西南癌症中心
2. Institute of Clinical Pathology, Southwest Cancer Center, First Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400038, China
上皮性卵巢癌(epithelial ovarian cancer,EOC)的死亡率位于女性生殖系统3大恶性肿瘤的首位。由于其发病隐匿,70%的患者就诊时即为晚期并伴有远处转移[1]。一线治疗后缓解的患者中,有55%~75%在2年内复发,并且复发后缺乏有效的治疗手段[2]。因此,寻找有效的生物标志物并研究其在卵巢癌发展中的作用,对卵巢癌的预防、早期诊断和设计新的治疗策略具有重要意义。叶酸受体α是FOLR1(folate receptor 1)基因的编码产物,表达于多种上皮源性肿瘤的细胞膜上,属于叶酸受体(FR)的一种。研究表明,FR的表达受细胞的生长速度调节,细胞增殖速率下降则FR的表达增加[3],但是FOLR1在卵巢癌中高表达的机制仍不清楚,其在卵巢癌发生、发展中的作用存在争议[4]。间皮素(mesothelin,MSLN)是一种40×103的蛋白质,通过糖基磷脂酰肌醇附着在细胞膜上,在肺癌、间皮瘤、卵巢癌、胰腺癌和乳腺癌等各种实体瘤中高表达[5],既往研究认为间皮素与细胞粘附有关,有报道称间皮素与CA125共同作用促进了卵巢癌的转移[6]。DAINTY等[7]通过q-PCR的方法检测FOLR1与MSLN共表达于子宫内膜癌中(P=0.014),其蛋白表达阳性率分别为23/48(48%)和17/54(32%)。但目前关于FOLR1与MSLN在EOC发病中相互作用以及联合检测两者来判断EOC患者的预后研究尚少见报道,故本研究对FOLR1与MSLN在EOC中表达及临床意义进行探索, 旨在为卵巢癌的诊断、治疗和预后判断提供新的思路。
1 材料与方法 1.1 生物信息学分析 1.1.1 GEO(Gene Expression Omnibus)、TCGA(Cancer Genome Atlas)数据库下载FOLR1和MSLN基因表达谱下载EOC数据集(Ovarian Cancer TCGA, Provisional; GSE6008; GSE66957; GSE49997)(www.cbioportal.org;www.ncbi.nlm.nih.gov/gds/)的表达谱(数据通过log2标准化)和临床病理参数。
1.1.2 FOLR1和MSLN在EOC与正常组织的表达差异以及与分期的关系获取GSE6008(n=103)、GSE66957(n=69)数据集中EOC和正常卵巢组织基因表达谱信息;利用R语言进行基因ID转换,并绘制表达差异图;利用TCGA(n=256)、GSE49997(n=194)数据集进一步分析FOLR1和MSLN在EOC中的分期差异。
1.1.3 Kaplan-Meier生存曲线分析整理TCGA中包含总体生存期(overall survival, OS)和无病生存期(disease-free survival, DFS)EOC患者的临床病理信息;按照是否发生终点事件(复发/进展或死亡)分为无事件组和事件组,以1-特异度为横坐标,灵敏度为纵坐标绘制ROC曲线,以最大约登值(灵敏度+特异度-1)为cut-off值,以此为临界值判断mRNA高表达和低表达患者。同时,为了研究FORL1和MSLN在EOC总体生存期上可能存在的交互影响,通过TCGA数据库对这两个基因进行mRNA水平的亚组生存分析,利用约登指数最大值对应的表达量作为Cut-off值。
1.2 材料 1.2.1 组织标本收集2018年4月至2019年7月陆军军医大学第一附属医院生物样本库经病理学检查证实的石蜡包埋组织标本146例,其中正常卵巢组织标本30例、交界性卵巢肿瘤组织标本11例及EOC组织标本105例。105例EOC患者中,年龄28~79岁,平均51岁,其中≤50者48例(45.71%),>50岁者57例(54.29%),浆液性卵巢癌73例(69.5%),黏液性卵巢癌11例(10.5%),透明细胞癌10例(9.5%),子宫内膜样癌11例(10.5%);高分化卵巢癌12例(11.4%),中低分化卵巢癌93例(88.6%);按国际妇产科联盟2009年FIGO(Federation International of Gynecology and Obstetrics)分期,Ⅰ~Ⅱ期25例(23.8%),Ⅲ~Ⅳ期80例(76.2%);无淋巴结转移73例(69.5%),有淋巴结转移32例(30.5%)。本研究经伦理委员会批准(批件号:KY201843)。
1.2.2 仪器及试剂兔抗人单克隆FOLR1抗体购自英国Abcam公司,鼠抗人多克隆MSLN抗体购自美国Invitrogen公司;光学显微镜BX40购自日本奥林巴斯公司,牛血清白蛋白(BSA)、PBS缓冲粉剂、苏木精染色液购自北京中杉金桥,二甲苯、30%过氧化氢、无水乙醇、中性树胶封片试剂购自重庆川东化工,鼠兔通用型免疫组化试剂盒(Envision法,鼠/兔)购自丹麦DAKO公司。
1.3 免疫组织化学染色、图像采集及分析① 脱蜡:组织置于60 ℃烤片90 min,按标准流程进行脱蜡。②阻断:3%过氧化氢阻断液室温放置20 min。③修复:切片浸泡于柠檬酸抗原修复液中进行热修复。④BSA封闭,37 ℃封闭45 min。⑤滴加足量FOLR1和MLSN一抗工作液(FOLR1稀释比1 :100;MSLN稀释比1 :10),4 ℃过夜。⑥PBS溶液洗涤6 min/次×3次,滴足量加鼠兔通用二抗覆盖组织,37 ℃孵育60 min。⑦弃二抗,PBS洗6 min/次×5次,DAB显色。⑧苏木素染核。⑨脱水,二甲苯透明,中性树胶进行封片。每张切片随机选取5个高倍镜视野,胞膜着色提示蛋白表达。根据染色强度将未着色、浅黄色、棕黄色、棕褐色分别计为0分、1分、2分、3分;再根据染色阳性率将无阳性细胞、1%~25%、26%~50%、51%~75%、76%~100%分别计为0分、1分、2分、3分、4分;将染色强度与染色阳性率评分的乘积作为最终分数,0~4分为蛋白表达阴性(-),>4分为蛋白表达阳性(+)。
1.4 统计学分析利用Graphpad Prism 7.0软件对样本表达量进行两独立样本t检验,数据以x±s表示,生存情况用中位生存期表示;Kaplan-Meier生存分析采用Log Rank检验。采用χ2检验或Fisher确切概率进行计数资料组间比较,检验水准:α=0.05。
2 结果 2.1 TCGA、GEO数据库分析FOLR1和MSLN在正常卵巢和EOC中表达与分期的关系利用GEO数据集GSE6008和GSE66957分析FOLR1和MSLN在正常卵巢组织和EOC组织中的表达情况,相较于正常卵巢上皮,EOC组织中FOLR1(P < 0.000 1)和MSLN(P < 0.000 1)mRNA表达水平明显增高(图 1A、B、C、D)。TCGA数据库和GSE49997分析显示中晚期(Ⅲ~Ⅳ期)患者的FOLR1和MSLN基因的表达水平明显高于早期(Ⅰ~Ⅱ期)患者(图 1E、F、G、H),提示FOLR1和MSLN可能与EOC的发生、发展有关。
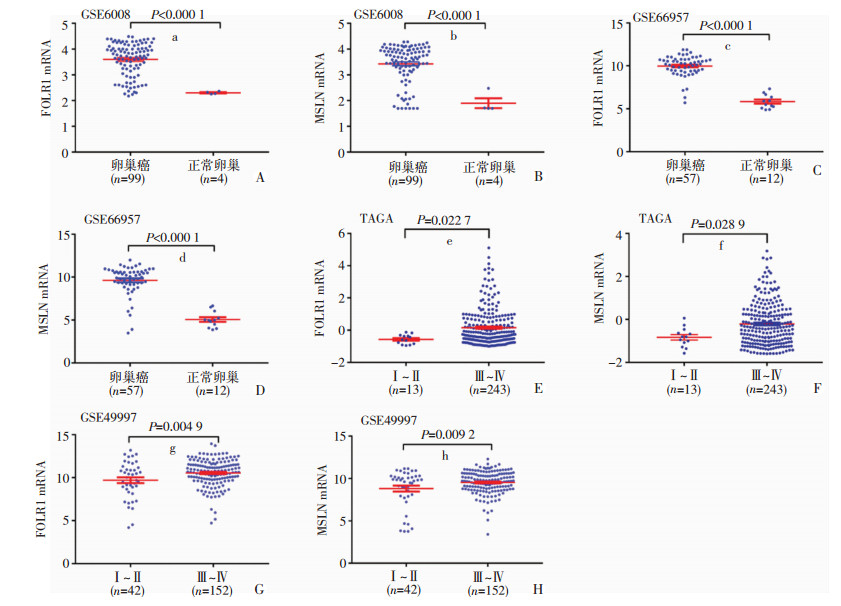
|
| A:FOLR1在EOC和正常卵巢中的表达 a:P < 0.000 1,与正常卵巢比较;B:MSLN在EOC和正常卵巢中的表达 b:P < 0.000 1,与正常卵巢比较;C:FOLR1在EOC和正常卵巢中的表达 c:P < 0.000 1,与正常卵巢比较;D:MSLN在EOC和正常卵巢中的表达 d:P < 0.000 1,与正常卵巢比较;E:FOLR1在不同分期EOC中的表达 c:P=0.022 7,与Ⅰ~Ⅱ期比较;F:MSLN在不同分期EOC中的表达 d:P=0.028 9,与Ⅰ~Ⅱ期比较; G:FOLR1在不同分期EOC中的表达 g:P=0.004 9,与Ⅰ~Ⅱ期比较;H:MSLN在不同分期EOC中的表达 h:P=0.009 2,与Ⅰ~Ⅱ期比较 图 1 利用GEO、TCGA数据库分析FOLR1和MSLN在不同组织和不同分期的EOC组织中的表达 |
2.2 FOLR1高表达患者预后好,MSLN高表达患者预后不良
以TCGA数据库(Ovarian Cancer TCGA, Provisional)中FOLR1和MSLN mRNA的表达进行生存分析。相比于FOLR1低表达患者,FOLR1高表达患者预后好(中位生存时间:51.87 vs 35.55个月,P=0.000 3;中位无病生存时间:18.89 vs 13.24个月,P=0.002,图 2A、C)。相反,MSLN水平越高,患者生存率越差(中位生存时间:47.5 vs 64.95个月,P=0.010 5;中位无病生存时间:16.1 vs 21.29个月,P=0.010 2,图 2 B、D)。
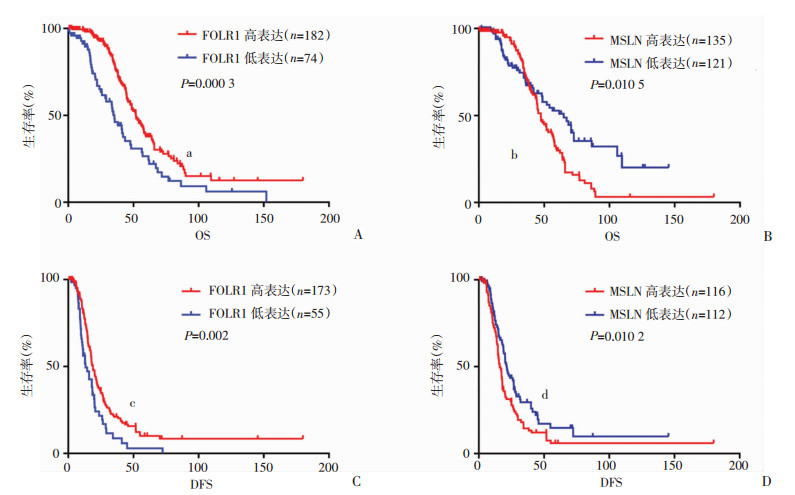
|
| A:FOLR1与EOC总体生存期相关性 a:P=0.000 3,与FOLR1低表达患者比较;B:MSLN与EOC总体生存期相关性 b:P=0.010 5,与MSLN低表达患者比较; C:FOLR1与EOC无进展生存期相关性 c:P=0.002,与FOLR1低表达患者比较;D:MSLN与EOC无进展生存期相关性 d:P=0.010 2,与MSLN低表达患者比较 图 2 基于TCGA数据库中FOLR1和MSLN表达差异的Kaplan-Meier生存曲线分析 |
2.3 FOLR1与MSLN蛋白在不同卵巢组织中的表达
对不同卵巢组织进行FOLR1与MSLN免疫组化染色,发现FOLR1和MSLN在正常卵巢组织中低表达,在交界性卵巢癌中表达升高,而在EOC组织中阳性率明显升高(图 3)。利用卡方检验对3组卵巢石蜡切片组织中FOLR1蛋白的表达进行分析,发现FOLR1蛋白表达从正常卵巢组织、交界性卵巢肿瘤组织到EOC组织呈逐渐增加,FOLR1蛋白阳性表达率为80.95%(85/105),显著高于交界性卵巢癌9.09%(1/11)及正常卵巢组织3.33%(1/30)(P < 0.001,表 1)。同样地,MSLN蛋白在正常卵巢组织、交界性卵巢肿瘤组织及EOC组织中的阳性表达率也呈逐渐升高的趋势(P < 0.001),MSLN蛋白阳性表达率为53.33%(56/105),显著高于交界性卵巢癌18.18% (2/11)及正常卵巢组织0.00%(0/30)(P < 0.001,表 1)。
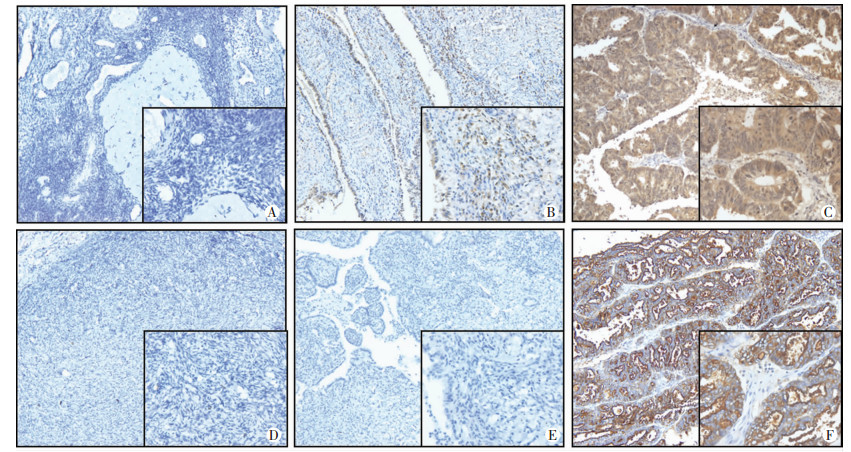
|
| A:FOLR1在正常卵巢组织中的表达;B:FOLR1在交界性卵巢肿瘤组织中的表达;C:FOLR1在EOC中的表达;D:MSLN在正常卵巢组织中的表达;E:MSLN在交界性卵巢肿瘤组织中的表达;F:MSLN在EOC中的表达;右下框(Envision ×400) 图 3 免疫组织化学检测FOLR1和MSLN在不同卵巢组织中的表达(Envision ×100) |
| 卵巢组织 | 例数 | FOLR1 | MSLN | |||||||
| 阳性 | 阴性 | 阳性率 | P值 | 阳性 | 阴性 | 阳性率 | P值 | |||
| 正常卵巢 | 30 | 1 | 29 | 3.33% | < 0.001 | 0 | 30 | 0% | < 0.001 | |
| 交界性 | 11 | 1 | 10 | 9.09% | 2 | 9 | 18.18% | |||
| 上皮性卵巢癌 | 105 | 85 | 20 | 80.95% | 56 | 49 | 53.33% | |||
2.4 FOLR1与MSLN蛋白表达与上皮性卵巢癌临床病理特征的关系
为明确FOLR1、MSLN和患者临床病理参数之间的相关性,进一步利用卡方检验分析相同视野下上皮性卵巢癌中两种蛋白表达与患者临床病理特征之间的关系,由表 2可见,FOLR1蛋白在Ⅲ~Ⅳ期卵巢癌中阳性表达率高于Ⅰ~Ⅱ期;但不同年龄、病理类型、分化程度、有无淋巴结转移患者的FOLR1蛋白表达差异无统计学意义(P>0.05)。MSLN蛋白在Ⅲ~Ⅳ期卵巢癌中阳性表达率高于Ⅰ~Ⅱ期;在有淋巴结转移的患者中阳性表达率明显高于无淋巴结转移者(P=0.000);不同组织类型间的表达有差异(P=0.008);不同年龄、分化程度患者的MSLN蛋白表达差异无统计学意义(P>0.05)。
| 临床病理参数 | FOLR1表达(n=105) | MSLN表达(n=105) | |||||
| 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | ||
| 年龄 | 0.669 | 0.582 | |||||
| ≤50 | 38(36.19%) | 10(9.52%) | 27(25.71%) | 21(20.00%) | |||
| >50 | 47(44.77%) | 10(9.52%) | 29(27.62%) | 28(26.67%) | |||
| 组织类型 | 0.904 | 0.008* | |||||
| 浆液性 | 60(57.14%) | 13(12.38%) | 47(44.76%) | 26(24.76%) | |||
| 粘液性 | 9(8.58%) | 2(1.90%) | 3(2.86%) | 8(7.62%) | |||
| 透明细胞癌 | 8(7.62%) | 2(1.90%) | 3(2.86%) | 7(6.66%) | |||
| 子宫内膜样癌 | 8(7.62%) | 3(2.86%) | 3(2.86%) | 8(7.62%) | |||
| 分化程度 | 0.289 | 0.389 | |||||
| 高分化 | 8(7.62%) | 4(3.81%) | 5(4.76%) | 7(6.67%) | |||
| 低-中分化 | 78(74.29%) | 15(14.28%) | 51(48.57%) | 42(40.00%) | |||
| FIGO分期 | 3.87×10-9* | 2.58×10-5* | |||||
| Ⅰ~Ⅱ | 11(10.48%) | 16(15.24%) | 5(4.76%) | 22(20.95%) | |||
| Ⅲ~Ⅳ | 74(70.47%) | 4(3.81%) | 51(48.57%) | 27(25.72%) | |||
| 淋巴结转移 | 0.19 | 0.000* | |||||
| 有 | 28(26.67%) | 3(2.86%) | 25(23.81%) | 6(5.72%) | |||
| 无 | 57(54.28%) | 17(16.19%) | 31(29.52%) | 43(40.95%) | |||
2.5 TCGA数据库中FOLR1与MSLN表达的亚组生存分析
为了探索FORL1和MSLN在上皮性卵巢癌总体生存期上可能存在的交互作用,通过TCGA(ovarian cancer TCGA, Provisional)数据库对这两个预后标志物进行了mRNA水平的亚组生存分析,利用约登指数最大值对应的表达量作为Cut-off值。结果显示MLFL组和MHFL组存在明显交叉,早期(< 50个月)MHFL组的预后较好,而超过50个月则生存率下降明显,但这种差异无统计学意义(P>0.05)。这可能与MHFL组晚期淋巴结转移有关。此外,MSLN低表达和FOLR1高表达的患者(MLFH)预后最好,MSLN高表达和FOLR1低表达的患者(MHFL)预后最差(中位生存期70.57 vs 25.85个月,P < 0.000 1,图 4),提示FOLR1的高表达可能有助于上皮性卵巢癌患者预后改善。
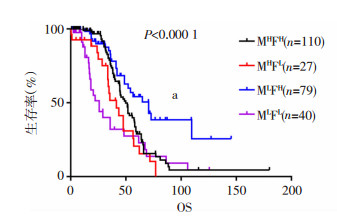
|
| a:P < 0.0001,与MHFL组比较 图 4 FOLR1和MSLN不同表达水平的亚组生存分析 |
3 讨论
叶酸受体α由FOLR1基因编码,是一种通过糖基磷脂酰肌醇偶联于细胞膜表面的单链糖蛋白,可将叶酸结合并转运到细胞中。FOLR1显著表达于许多恶性肿瘤细胞(如宫颈癌、肝癌、子宫内膜癌等)的基底膜和侧膜上。既往研究认为肿瘤细胞可通过上调FORL1增加对叶酸的摄取,促进DNA合成以保证肿瘤细胞快速增殖的需要[8]。但尚有研究表明,相较于还原型叶酸受体(reduced folate carrier, RCF),FOLR1对叶酸的亲和力较低[9],因而FOLR1所介导的叶酸摄取过程效率较低[10], 这提示FOLR1在肿瘤中高表达的作用可能并非促进叶酸的摄取来提高其增殖率。与以往的研究一致,生物信息学分析和临床样本免疫组化染色均提示FOLR1在EOC中表达高于正常卵巢组织(P < 0.001),且Ⅲ~Ⅳ期患者的表达量明显高于Ⅰ~Ⅱ期卵巢癌(P < 0.001),提示FOLR1可能参与了EOC的进展[11],进一步的生存分析结果提示FOLR1高表达有利于患者的预后,这与以往的报道不同,因为FOLR1在肿瘤发生、发展及预后中的作用尚存在许多争议[12]。
一方面,早期的研究称FOLR1高表达与卵巢癌的复发和总体生存率无关[11],也有研究表明在浆液性卵巢癌中FOLR1的高表达是无病生存期(P=0.02)和化疗反应(P=0.021)的独立不良预后因素[13]。此外,SIU等[12]的研究发现叶酸可以诱导卵巢肿瘤细胞(skov-3)的增殖、迁移和侵袭,而FOLR1的高表达与总体生存期或无病生存期无关。在另一方面,最近的一项研究表明,FOLR1的高表达增加了卵巢癌细胞对顺铂治疗的敏感性[14],这有可能与改善患者预后相关。对于以往报道的不一致,可能存在以下几点原因:①以往研究的样本量偏小,可能产生误差。②研究种族的不同也可能是报道不一致的原因之一。③这些流行病学研究结果都缺乏对机制的探索。对此,基于目前的TCGA大样本分析,结合最新报道的机制研究(FOLR1增加顺铂敏感性),我们认为FOLR1高表达是卵巢的有利预后因素,原因可能在于:FOLR1高表达的患者,化疗敏感性增加,从而预后得到改善。当然,其具体机制需要进一步研究阐明。
MSLN基因位于染色体16p13.3,含有17个外显子,编码628个氨基酸,在细胞内首先翻译为72×103前体蛋白,然后被furin蛋白酶水解剪接为两部分,羧基末端的疏水序列被糖基磷脂酰肌醇取代并偶联于细胞膜上,称为间皮素(40×103),33×103的氨基端脱落片段释放入血,称为巨核细胞增强因子(MPF)[15]。CHANG等[16]研究证明MSLN可通过MAPK/ERK和JNK通路上调MMP-7,从而增强卵巢癌细胞的侵袭能力。此外,在化疗患者中,MSLN还可以通过PI3K/AKT和MAPK/ERK信号通路诱导卵巢癌细胞对紫杉醇产生耐药[17]。与以往的研究结果一致,本研究发现从正常组织、交界性肿瘤到卵巢癌,MSLN的mRNA和蛋白的相对表达量呈逐渐上升,且MSLN高表达的患者FIGO分期晚、淋巴结转移率高[18-19]。发生淋巴结转移的EOC患者中,MSLN的表达量明显增加,这提示MSLN可能与卵巢癌的淋巴转移相关,进一步生存分析提示MSLN是卵巢癌的一个重要不良预后因素。因此,抑制MSLN的表达,可能是减缓卵巢癌侵袭和耐药的一个重要努力方向。
MSLN与FOLR1的关系以及两者对预后的影响缺乏深入研究,在子宫内膜癌差异基因的研究中,DAINTY等[7]发现FOLR1高表达的患者,MSLN的mRNA表达也显著上调(P=0.014),提示二者可能存在共表达关系。为明确卵巢癌患者中MSLN与FOLR1在总体生存期上可能存在的交互关系,我们联合MSLN与FOLR1对患者进行亚组生存分析,发现在mRNA水平MHFL组早期(< 50个月)预后较好,而超过50个月生存率则明显下降,其原因可能是由于MSLN高表达的患者晚期淋巴结转移率较高所致(表 2,P < 0.001),也有可能与这部分患者早期化疗敏感有关,但数据库中缺乏这一部分数据,因此有待未来进一步研究。此外,MSLN低表达和FOLR1高表达的患者(MLFH)预后最好,而MHFL组预后最差(中位生存期70.57 vs 25.85个月,P < 0.0001),这对卵巢癌患者生存状态具有重要预测意义。同时,根据生存分析结果:MHFH组的预后明显优于MHFL组(图 4),推测在卵巢癌发生、发展过程中,FOLR1可能部分抑制了MSLN对肿瘤细胞恶性表型的促进作用,但这种推测和其内在调控机制尚有待进一步研究和证实。
本研究不足之处在于仅探讨了mRNA水平FOLR1及MSLN对卵巢癌预后的影响,缺乏蛋白水平的预后影响、不同患者的化疗敏感性数据以及深入的机制研究。今后可进一步利用基因敲除等手段干预卵巢癌细胞系中FOLR1和MSLN的表达,明确FOLR1和MSLN之间的相互作用,以及对卵巢癌细胞生物学功能的影响。此外对患者生存、化疗耐药情况进行随访,明确FOLR1和MSLN在蛋白水平的表达与预后和化疗的关系,并结合RNA-seq等方法寻找影响FOLR1和MSLN表达的核心转录因子,以探讨卵巢癌中FOLR1和MSLN表达变化的原因。
综上所述,FOLR1高表达是上皮性卵巢癌预后的有利因素,MSLN高表达是患者预后的不良因素。通过联合检测FOLR1和MSLN两种蛋白的表达,有助于EOC患者的预后判断,两种蛋白可能共同参与了EOC的发展过程,有望作为EOC临床预后辅助预测指标。
| [1] |
TIMMERMANS M, SONKE G S, VAN DE VIJVER KK, et al. No improvement in long-term survival for epithelial ovarian cancer patients:A population-based study between 1989 and 2014 in the Netherlands[J]. Eur J Cancer, 2018, 88: 31-37. DOI:10.1016/j.ejca.2017.10.030 |
| [2] |
MORRISON J, THOMA C, GOODALL R J, et al. Epidermal growth factor receptor blockers for the treatment of ovarian cancer[J]. Cochrane Database Syst Rev, 2018, 10: CD007927. DOI:10.1002/14651858.CD007927.pub4 |
| [3] |
DOUCETTE MM, STEVENS V L. Folate receptor function is regulated in response to different cellular growth rates in cultured mammalian cells[J]. J Nutr, 2001, 131(11): 2819-2825. DOI:10.1093/jn/131.11.2819 |
| [4] |
SIU M K, KONG D S, CHAN H Y, et al. Paradoxical impact of twofolate receptors, FRα and RFC, in ovarian cancer:effect on cell proliferation, invasion and clinical outcome[J]. PLoS ONE, 2012, 7(11): e47201. DOI:10.1371/journal.pone.0047201 |
| [5] |
ZHENJIANG L, RAO M, LUO X H, et al. Mesothelin-specific immune responses predict survival of patients with brain metastasis[J]. EBioMedicine, 2017, 23: 20-24. DOI:10.1016/j.ebiom.2017.08.024 |
| [6] |
SASAKI A, AKITA K, ITO F, et al. Difference inmesothelin-binding ability of serum CA125 between patients with endometriosis and epithelial ovarian cancer[J]. Int J Cancer, 2015, 136(8): 1985-1990. DOI:10.1002/ijc.29185 |
| [7] |
DAINTY L A, RISINGER J I, MORRISON C, et al. Overexpression offolate binding protein and mesothelin are associated with uterine serous carcinoma[J]. Gynecol Oncol, 2007, 105(3): 563-570. DOI:10.1016/j.ygyno.2006.10.063 |
| [8] |
LIU Z B, JIN X, PI W, et al. Folic acid inhibits nasopharyngeal cancer cell proliferation and invasion via activation of FRα/ERK1/2/TSLC1 pathway[J]. Biosci Rep, 2017, 37(6): BSR20170772. DOI:10.1042/BSR20170772 |
| [9] |
VERGOTE I B, MARTH C, COLEMAN R L. Role of thefolate receptor in ovarian cancer treatment:evidence, mechanism, and clinical implications[J]. Cancer Metastasis Rev, 2015, 34(1): 41-52. DOI:10.1007/s10555-014-9539-8 |
| [10] |
KAMEN B A, SMITH A K. A review offolate receptor alpha cycling and 5-methyltetrahydrofolate accumulation with an emphasis on cell models in vitro[J]. Adv Drug Deliv Rev, 2004, 56(8): 1085-1097. DOI:10.1016/j.addr.2004.01.002 |
| [11] |
HEKMAN M C H, BOERMAN O C, BOS D L, et al. Improved intraoperative detection of ovarian cancer byfolate receptor alpha targeted dual-modality imaging[J]. Mol Pharm, 2017, 14(10): 3457-3463. DOI:10.1021/acs.molpharmaceut.7b00464 |
| [12] |
SIU M K, KONG D S, CHAN H Y, et al. Paradoxical impact of twofolate receptors, FRα and RFC, in ovarian cancer:effect on cell proliferation, invasion and clinical outcome[J]. PLoS ONE, 2012, 7(11): e47201. DOI:10.1371/journal.pone.0047201 |
| [13] |
CHEN Y L, CHANG M C, HUANG C Y, et al. Serous ovarian carcinoma patients with high alpha-folate receptor had reducing survival and cytotoxic chemo-response[J]. Mol Oncol, 2012, 6(3): 360-369. DOI:10.1016/j.molonc.2011.11.010 |
| [14] |
HUANG M J, ZHANG W, WANG Q, et al. FOLR1 increases sensitivity tocisplatin treatment in ovarian cancer cells[J]. J Ovarian Res, 2018, 11(1): 15. DOI:10.1186/s13048-018-0387-y |
| [15] |
PASTAN I, HASSAN R. Discovery ofmesothelin and exploiting it as a target for immunotherapy[J]. Cancer Res, 2014, 74(11): 2907-2912. DOI:10.1158/0008-5472.CAN-14-0337 |
| [16] |
CHANG M C, CHEN C A, CHEN P J, et al. Mesothelin enhances invasion of ovarian cancer by inducing MMP-7 through MAPK/ERK and JNK pathways[J]. Biochem J, 2012, 442(2): 293-302. DOI:10.1042/BJ20110282 |
| [17] |
CHANG M C, CHEN C A, HSIEH C Y, et al. Mesothelin inhibits paclitaxel-induced apoptosis through the PI3K pathway[J]. Biochem J, 2009, 424(3): 449-458. DOI:10.1042/BJ20082196 |
| [18] |
CHENG W F, HUANG C Y, CHANG M C, et al. Highmesothelin correlates with chemoresistance and poor survival in epithelial ovarian carcinoma[J]. Br J Cancer, 2009, 100(7): 1144-1153. DOI:10.1038/sj.bjc.6604964 |
| [19] |
HANAOKA T, HASEGAWA K, KATO T, et al. Correlation between tumormesothelin expression and serum mesothelin in patients with epithelial ovarian carcinoma:A potential noninvasive biomarker for mesothelin-targeted therapy[J]. Mol Diagn Ther, 2017, 21(2): 187-198. DOI:10.1007/s40291-017-0255-2 |



