2. 150040 哈尔滨, 黑龙江省中医药大学药物安全评价中心
2. Center of Drug Safety and Evaluation, Heilongjiang University of Chinese Medicine, Harbin, Heilongjiang Province, 150040, China
高脂膳食(high fatty diet, HFD)可以引起器官内活性氧(reactive oxygen species, ROS)的过量累积,会造成器官(肝脏、心脏、肾脏和肌肉等)的氧化应激性损伤[1-2]。抗氧化酶(过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧酶等)和谷胱甘肽还原酶的水平在HFD诱导的肥胖大鼠组中显著减少[3]。线粒体DNA(mitochondrial DNA, mtDNA)损伤、线粒体功能的紊乱以及氧化应激也都在HFD喂食的小鼠中发现[4]。HFD导致小鼠肌肉中mtDNA拷贝数减少和线粒体功能紊乱[5]。
莱菔硫烷(sulforaphane,SFN)是一种来源于十字花科蔬的植物化学物,它能激活核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)上调细胞抗氧化能力。SFN明显改善HFD小鼠肝脏脂肪变性、减少血清ALT和AST水平和肝脏中胆固醇、甘油三酯和游离脂肪酸的含量[6-7]。另一方面,SFN增加3T3-L1脂肪细胞线粒体中电子传递链复合物1和柠檬酸合成酶的酶活以促进线粒体功能[8],提示SFN可能提高线粒体功能。SFN是否可以上调肝细胞的抗氧化能力和线粒体功能保护肝细胞,尚不清楚。本研究采用高脂饲料喂食大鼠和混合游离脂肪酸诱导HHL-5肝细胞建立体外氧化应激模型,研究SFN对肝细胞抗氧化能力和线粒体功能的影响。
1 材料与方法 1.1 主要试剂和仪器SFN(纯度≥98%)购于美国LKT公司。SFN溶于DMSO,配制成100 mmol/L的储备液,分装于0.6 mL的EP管中,并放置与-20℃冰箱中备用。人肝细胞系HHL-5细胞为本实验室保存的细胞系。RIPA全蛋白提取试剂盒购于北京索莱宝生物技术有限公司,BCA蛋白浓度测定试剂盒,MDA试剂盒,ROS试剂盒,JC-1线粒体膜电位试剂盒购于碧云天生物技术有限公司。棕榈酸和油酸购于美国Sigma公司。血红素加氧酶-1(hemeoxygenase-1, HO-1),磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NADH dehydrogenase quinone 1, NQO1)和谷胱甘肽-S-转移酶(glutathione S-transferase, GST)抗体购于美国Santa Cruz公司。总DNA基因提取试剂盒购于哈尔滨新海基因检测有限公司。谷胱甘肽(glutathione, GSH)试剂盒和SOD试剂盒购于南京建成生物工程研究所有限公司。
油酸和棕榈酸溶于0.01 mol/L NaOH溶液分别形成20 mmol/L游离脂肪酸溶液(free fatty acid, FFA)。油酸溶液,棕榈酸溶液和10% BSA溶液以2 :1 :3混合形成10 mmol/L游离脂肪酸溶液,保存于-4 ℃冰箱。
凝胶成像仪(美国Bio-Rad)公司,超净工作台(上海Healforce公司),垂直电泳槽(北京市六一仪器厂),转膜槽(北京六一仪器厂),荧光显微镜(日本Olympus公司)。
1.2 高脂膳食大鼠模型动物实验经过黑龙江中医药大学伦理委员会批准(批准号20160324)。SPF级雄性Wistar大鼠18只(4周龄,体质量为150~200 g)购于北京维通利华实验动物技术有限公司(合格证编号SCXK(京)2016-0032)。动物在黑龙江中医药大学药物安全性评价中心SPF级动物房饲养,饲养环境为:温度为(22±2)℃,空气湿度为(55±5)%,12 h :12 h明暗交替。大鼠自由摄食和自由饮水,定期更换垫料和饮水瓶。适应性喂养2周后,大鼠分为3组(n=6),正常食物组(Con),高脂喂食组(HFD)和高脂喂食+SFN (20 mg/kg)组(SFN)。称量一定质量的SFN溶于0.5%的羧甲基纤维素钠溶液中。SFN灌胃剂量为20 mg/kg(按照体质量的1%进行灌胃),每周3次,实验进行10周。当实验结束时,动物处死前禁食12 h,处死当日,称取动物体质量,用10%水合氯醛腹腔注射麻醉,取肝脏于液氮迅速冻存后,保存于-80 ℃冰箱备用。
肝匀浆制备:取约0.5 g肝组织,加入4.5 mL预冷0.85%的生理盐水,冰上匀浆。匀浆液在12 000×g离心力下4 ℃离心30 min。收集上清液保存于-80 ℃冰箱备用。
1.3 FFA诱导HHL-5肝细胞氧化应激模型的建立HHL-5肝细胞的培养条件:F12培养基(含10% FBS、100 U/mL青霉素和100 U/mL链霉素),37 ℃、5% CO2。细胞氧化应激模型培养如下:以浓度为250 μmol/L FFA作用HHL-5肝细胞4d,诱导细胞产生脂滴。之后给予细胞10 μmol/L SFN,作用时间为2 d。
1.4 肝组织MDA含量测定取肝脏组织匀浆,通过分光光度计法测定硫代巴比妥酸反应(thiobarbituric aicd-reacting substance, TBARS)的产物含量代表MDA的含量。肝匀浆的蛋白浓度采用BCA试剂盒测定。
1.5 HE染色取新鲜肝脏组织投入福尔马林,福尔马林固定后的肝脏组织进行修整,在自动脱水机中进行梯度酒精脱水,浸蜡包埋,将蜡片组织块切成5 μm厚的薄膜,随后进行水化,染核,细胞质染色和封片。使用倒置光学显微镜观察肝脏组织的病理学变化。肝脏组织学由黑龙江中医药大学的病理学专家完成。并用Image J软件分析脂滴空泡的数量。
1.6 线粒体膜电位检测线粒体膜电位采用碧云天线粒体膜电位试剂盒(JC-1)进行测定。HHL-5细胞种于6孔板中,实验完后,加入JC-1染色工作液孵育20 min,JC-1洗涤液冲洗2次。荧光显微镜观察拍照,Image J软件分析。
1.7 ROS测定HHL-5细胞的ROS含量采用碧云天ROS检测试剂盒进行测定。HHL-5细胞种于6孔板,实验完后,加入DCFH-DA染色工作液孵育20 min,PBS洗涤后,采用荧光显微镜观察并拍照,Image J软件分析ROS含量。
1.8 GSH含量和SOD酶活测定实验结束后,将HHL-5细胞进行破碎,离心提取上清后根据GSH和SOD的试剂盒说明书进行测定,并采用BCA试剂盒测定蛋白浓度。
1.9 线粒体DNA含量测定线粒体DNA(mitochondrial DNA,mtDNA)的含量采用ABI 7300 qPCR仪器进行测定。总DNA基因组采用组织细胞DNA基因组提取试剂盒提取。18S rRNA作为内参基因,线粒体D-loop作为线粒体基因。18S rRNA引物序列:5′-3′ CATTCGAACGTCTGCCCT-ATC(上游),5′-3′ CCTGCTGCCTTCCTTGGA(下游);D-loop引物序列:5′-3′GCGTCCTTGCCCTATTACTATC(上游),5′-3′ CTTACTGGTTGTCCTCCGATTC(下游)。qPCR程序:95 ℃ 30 s,95 ℃ 5 s,58 ℃ 30 s,42个循环。根据引物的溶解曲线和扩增曲线确定引物的特异性。采用2-ΔΔCt法计算mtDNA的拷贝数。
1.10 Western blot检测采用蛋白提取试剂盒提取大鼠肝脏组织蛋白,并用BCA蛋白试剂盒测定蛋白浓度。配制10%分离胶和浓缩胶。电泳条件:浓缩胶80V 30 min,分离胶120 V 1.5 h。200 mA恒流湿转90 min。转膜完后,2%的BSA室温封闭1 h,一抗GST(1 :500)、NQO1(1 :800)、HO-1(1 :500)和GAPDH(1 :1 000)4 ℃过夜孵育。TBST洗膜3次,每次5 min,加入二抗室温孵育1 h。TBST洗膜3次,每次5 min。采用BCIP和NBT进行显色。Image J计算灰度值,各组结果与GAPDH进行比。
1.11 统计学分析数据以x±s表示。用GraphPad Prism 6进行绘图和统计学分析。符合正态分布的数据采用单因素方差(One-way ANOVA),检验水准:α=0.05。
2 结果 2.1 SFN改善大鼠肝脏组织的形态变化肝脏组织病理学结果如图 1所示,Con组中肝细胞细胞核明显、结构完整,不存在脂肪空泡现象;HFD组的肝细胞出现轮廓不规则,肝细胞中存在较多的脂肪空泡,脂肪空泡面积约占整个病理切片的视野的20%(P < 0.05),这说明大量的脂质在肝脏组织中聚集,造成了脂肪病变。SFN组的肝组织仍然存在脂肪空泡,但所占面积显著减少(P < 0.05)。
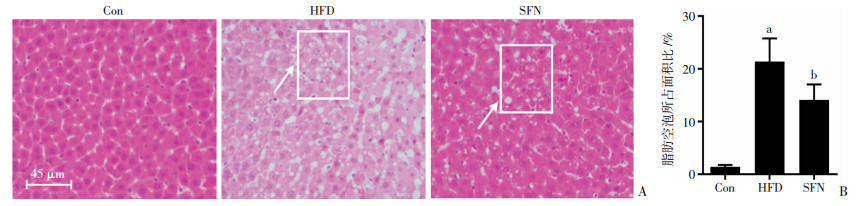
|
| A:HE染色观察结果 白色方框区域为脂肪空泡区;B:脂肪空泡所占面积比较 Con组:正常对照组;HFD组:高脂喂养组;SFN组:莱菔硫烷组;a: P < 0.05,与Con组相比;b: P < 0.05,与HFD组相比 图 1 大鼠肝脏组织病理学变化 |
2.2 SFN对大鼠肝脏MDA水平的影响
HFD组的MDA的含量显著高于Con组,约为Con的1.47倍(P < 0.05);相比于HFD,SFN显著减少大鼠肝组织的MDA含量(P < 0.05,图 2)。
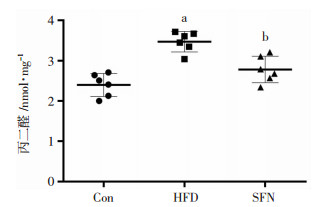
|
| Con组:正常对照组;HFD组:高脂喂养组;SFN组:莱菔硫烷组;a: P < 0.05,与Con组相比;b: P < 0.05,与HFD组相比 图 2 SFN对大鼠肝脏组织内MDA生成的影响 |
2.3 SFN提高抗氧化酶含量
Western blot检测肝脏组织中抗氧化酶GST、NQO1和HO-1的蛋白表达结果如图 3,HFD显著减少GST和NQO1的蛋白水平,分别是Con组表达量的0.63%(P < 0.05)和0.82%(P < 0.05)。SFN略下调HO-1的蛋白水平,但无统计学差异(P>0.05)。与HFD组相比,SFN显著上调大鼠肝脏中GST、NQO1和HO-1的蛋白水平(P < 0.05)。
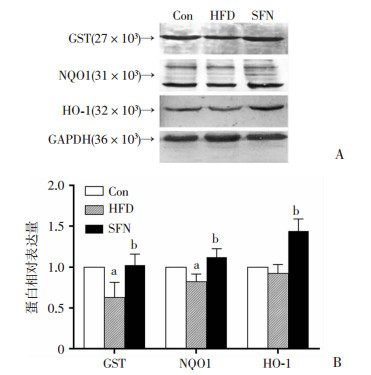
|
| A:Western blot检测;B;半定量分析 Con组:正常对照组;HFD组:高脂喂养组;SFN组:莱菔硫烷组 a: P < 0.05,与Con组相比;b: P < 0.05,与HFD组相比 图 3 SFN对大鼠肝脏组织抗氧化酶蛋白表达的影响 |
2.4 SFN减少ROS含量
HHL-5细胞中胞内ROS含量如图 4所示,Con组中存在一定量的ROS;FFA显著增加HHL-5细胞的ROS含量(6.30±1.32),约为对照组(1.00±0.00)的6.3倍(P < 0.05)。相比FFA组,SFN显著减少HHL-5细胞的ROS含量(3.60±0.63)(P < 0.05)。
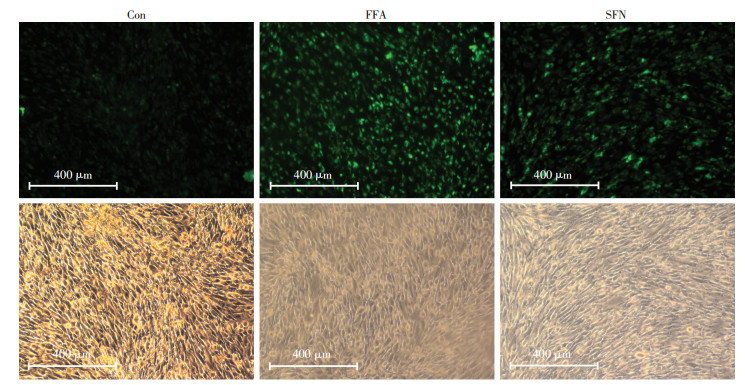
|
| Con组:正常对照组;FFA组:游离脂肪酸组;SFN组:莱菔硫烷组;a: P < 0.05,与Con组相比;b: P < 0.05,与FFA组相比 图 4 SFN对FFA诱发肝细胞ROS积累的抑制作用 |
2.5 SFN提高HHL-5肝细胞的抗氧化能力
如图 5所示,FFA明显减少HHL-5细胞中GSH和SOD的水平,分别是Con组的56%(P < 0.05)和64%(P < 0.05)。SFN显著增加HHL-5细胞中GSH的含量(P < 0.05)和SOD(P < 0.05)的酶活。结果提示,SFN可以明显改善FFA诱导的氧化应激水平。
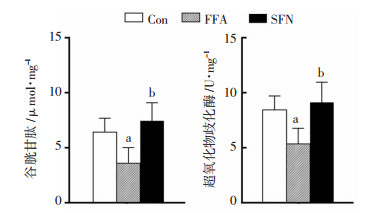
|
| Con组:正常对照组;FFA组:游离脂肪酸组;SFN组:莱菔硫烷组;GSH:谷胱甘肽;SOD:超氧化歧化酶;a: P < 0.05,与Con组相比;b: P < 0.05,与FFA组相比 图 5 SFN提高HHL-5肝细胞中GSH和SOD的水平 |
2.6 SFN恢复线粒体膜电位
过多的ROS会攻击线粒体的内外膜并最终破坏线粒体的膜完整性,导致线粒体膜电位降低。JC-1是用于检测线粒体膜电位的荧光探针,当线粒体膜电位较高时,JC-1在线粒体的基质中聚集形成聚合物,产生红色荧光,当线粒体膜电位较低时,JC-1不能存在线粒体的基质中,此时JC-1属于单体,产生绿色荧光。因此通过荧光颜色的变化来显示线粒体膜电位的变化。如图 6所示,与Con组(3.06±0.65)相比,FFA明显地降低HHL-5细胞的线粒体膜电位(0.55±0.14)(P < 0.05);SFN恢复线粒体膜电位(1.64±0.42)(P < 0.05)。

|
| Con组:正常对照组;FFA组:游离脂肪酸组;SFN组:莱菔硫烷组;a: P < 0.05,与Con组相比;b: P < 0.05,与FFA组相比 图 6 SFN对HHL-5肝细胞线粒体膜电位影响的荧光观察 |
2.7 SFN对mtDNA拷贝数的影响
本研究采用实时定量PCR测定HHL-5肝细胞的mtDNA拷贝数。FFA组的mtDNA水平(0.71±0.08)显著低于Con组(1.00±0.00)(P < 0.05),而SFN提高HHL-5细胞中mtDNA的含量(1.20±0.19)(P < 0.05)。
3 讨论氧化应激是由于ROS的平衡稳态遭到破坏以及细胞内抗氧化物的耗竭导致,进而导致组织损伤。肝脏是ROS产生的主要场所之一,同时也极易受到ROS攻击。本研究表明FFA显著诱导HHL-5肝细胞产生ROS。此外,HFD组的抗氧化酶GST和NQO1含量显著减少(P < 0.05),并且FFA组中GSH和SOD显著减少(P < 0.05),说明HFD或FFA可诱导氧化应激。MDA是一种强毒性的脂质过氧化产物,可加重氧化应激。SFN能显著减少MDA的水平,可能由于SFN改善了HFD的脂类代谢,或者是SFN提高了抗氧化能力。CHEN等[9]研究表明SFN可减少由HFD导致小鼠肝脏脂肪空泡,本研究的HE染色结果与其一致,说明SFN减少肝脏脂质堆积。另一方面,SFN通过激活Nrf2途径提高细胞的抗氧化能力(HO-1,NQO1、GST、GSH和SOD)[10],防止肝脏氧化应激损伤。一项采用多酚提取物干预HFD小鼠的实验发现,多酚提取物并没有增加抗氧化酶如SOD1、GSH-Px和SOD2的活性,但是其肝脏组织中MDA含量则明显减少[11]。该结果提示多酚抑制脂质过氧化的机制可能是由于多酚直接中和ROS的结果。与多酚抗氧化物的机制不同,SFN属于间接抗氧化物,它通过激活Nrf2途径,上调抗氧化酶的表达而发挥间接抗氧化作用。SFN通过激活Nrf2途径,诱导HHL-5细胞的硫氧还蛋白还原酶表达,进而增强机体抗氧化防御系统机能[12]。由此可知,SFN通过提高细胞抗氧化能力有效抑制高脂饮食诱导的小鼠肝组织氧化应激水平。
GSH缺少可导致线粒体脂肪酸氧化水平的下降,反之,GSH含量增多可恢复脂肪酸氧化水平[13]。此外,线粒体抗氧化能力的减弱可导致线粒体损伤(线粒体膜电位的破坏,呼吸链复合物的酶活力下降,ATP产量减少)[14-15]。可见机体抗氧化对维持线粒体功能完整性有着重要作用。SFN(20 mg/kg)处理HFD大鼠后,肝脏中抗氧化酶(GST,NQO1和HO-1)的表达显著增多(P < 0.05)。此外,SFN显著减少HHL-5肝细胞中ROS含量,提高GSH和SOD的水平以及线粒体膜电位。这提示SFN对线粒体膜电位具有保护作用。类似地,骨骼肌和心脏组织中,线粒体功能的下降能够导致甘油三酯的聚集[16],这是由于线粒体功能的受损导致脂肪酸代谢受阻。ARRUDA等[17]报道HFD可导致小鼠肝脏中mtDNA的拷贝数减少。本研究发现mtDNA的拷贝数在FFA组中减少,并且SFN增加HHL-5细胞中的mtDNA的拷贝数。已报道Nrf2可诱导线粒体生物合成基因NRF1(Nuclear Respiratory Factor 1)的转录[18],进而促进mtDNA合成。SFN不仅增加3T3-L1脂肪细胞的线粒体数量,而且提高柠檬酸合成酶和线粒体复合物1的酶活,以及增加NRF1和解偶联蛋白1(Uncoupling protein 1)的蛋白表达[8]。由此可见,SFN增加线粒体功能并不是仅仅通过抗氧化途径,深入揭示SFN保护线粒体功能的机制将有助于SFN的功能开发和应用。
课题组前期研究发现,SFN通过抑制高脂所致的肝细胞内质网应激,降低内质网应激元件XBP1及PERK的表达,抑制甘油三酯合成酶及脂肪酸合成酶的表达,最终抑制脂类的异常蓄积[19]。本研究则进一步发现,SFN通过诱导抗氧化酶表达,修复线粒体功能及增加线粒体拷贝数,对高脂所致的肝脏氧化损伤发挥保护作用。这些发现将进一步肯定SFN在预防和改善NAFLD中的有益作用,为SFN防治NAFLD中的应用提供理论基础。
| [1] |
NOEMAN S A, HAMOODA H E, BAALASH A A. Biochemical study of oxidative stress markers in the liver, kidney and heart of high fat diet induced obesity in rats[J]. Diabetol Metab Syndr, 2011, 3(1): 17. DOI:10.1186/1758-5996-3-17 |
| [2] |
HE H J, WANG G Y, GAO Y, et al. Curcumin attenuates Nrf2 signaling defect, oxidative stress in muscle and glucose intolerance in high fat diet-fed mice[J]. World J Diabetes, 2012, 3(5): 94-104. DOI:10.4239/wjd.v3.i5.94 |
| [3] |
CARMIEL-HAGGAI M, CEDERBAUM A I, NIETO N. A high-fat diet leads to the progression of non-alcoholic fatty liver disease in obese rats[J]. FASEB J, 2005, 19(1): 136-138. DOI:10.1096/fj.04-2291fje |
| [4] |
YUZEFOVYCH L V, MUSIYENKO S I, WILSON G L, et al. Mitochondrial DNA damage and dysfunction, and oxidative stress are associated with endoplasmic reticulum stress, protein degradation and apoptosis in high fat diet-induced insulin resistance mice[J]. PLoS ONE, 2013, 8(1): e54059. DOI:10.1371/journal.pone.0054059 |
| [5] |
CHOI J W, OHN J H, JUNG H S, et al. Carnitine induces autophagy and restores high-fat diet-induced mitochondrial dysfunction[J]. Metab Clin Exp, 2018, 78: 43-51. DOI:10.1016/j.metabol.2017.09.005 |
| [6] |
CHEN Y J, MYRACLE A D, WALLIG M A, et al. Dietary broccoli protects against fatty liver development but not against progression of liver cancer in mice pretreated with diethylnitrosamine[J]. J Funct Foods, 2016, 24: 57-62. DOI:10.1016/j.jff.2016.03.028 |
| [7] |
YANG G, LEE H E, LEE J Y. A pharmacological inhibitor of NLRP3 inflammasome prevents non-alcoholic fatty liver disease in a mouse model induced by high fat diet[J]. Sci Rep, 2016, 6: 24399. DOI:10.1038/srep24399 |
| [8] |
ZHANG H Q, CHEN S Y, WANG A S, et al. Sulforaphane induces adipocyte Browning and promotes glucose and lipid utilization[J]. Mol Nutr Food Res, 2016, 60(10): 2185-2197. DOI:10.1002/mnfr.201500915 |
| [9] |
CHEN Y J, WALLIG M A, JEFFERY E H. Dietary broccoli lessens development of fatty liver and liver cancer in mice given diethylnitrosamine and fed a Western or control diet[J]. J Nutr, 2016, 146(3): 542-550. DOI:10.3945/jn.115.228148 |
| [10] |
HAYES J D, DINKOVA-KOSTOVA A T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism[J]. Trends Biochem Sci, 2014, 39(4): 199-218. DOI:10.1016/j.tibs.2014.02.002 |
| [11] |
ANHÊ F F, NACHBAR R T, VARIN T V, et al. A polyphenol-rich cranberry extract reverses insulin resistance and hepatic steatosis independently of body weight loss[J]. Mol Metab, 2017, 6(12): 1563-1573. DOI:10.1016/j.molmet.2017.10.003 |
| [12] |
李丹, 暴永平, 吴坤. 莱菔硫烷诱导人肝细胞硫氧还蛋白还原酶表达[J]. 中国公共卫生, 2009, 25(2): 189-191. LI D, BAO Y P, WU K. Induction of TR1 by sulforaphane in human immortalized hepatocytes[J]. Chin J Public Health, 2009, 25(2): 189-191. DOI:10.3321/j.issn:1001-0580.2009.02.032 |
| [13] |
NGUYEN D, SAMSON S L, REDDY V T, et al. Impaired mitochondrial fatty acid oxidation and insulin resistance in aging: novel protective role of glutathione[J]. Aging Cell, 2013, 12(3): 415-425. DOI:10.1111/acel.12073 |
| [14] |
PIAO C S, GAO S, LEE G H, et al. Sulforaphane protects ischemic injury of hearts through antioxidant pathway and mitochondrial K(ATP) channels[J]. Pharmacol Res, 2010, 61(4): 342-348. DOI:10.1016/j.phrs.2009.11.009 |
| [15] |
GRECO T, SHAFER J, FISKUM G. Sulforaphane inhibits mitochondrial permeability transition and oxidative stress[J]. Free Radic Biol Med, 2011, 51(12): 2164-2171. DOI:10.1016/j.freeradbiomed.2011.09.017 |
| [16] |
PETERSEN K F, BEFROY D, DUFOUR S, et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance[J]. Science, 2003, 300(5622): 1140-1142. DOI:10.1126/science.1082889 |
| [17] |
ARRUDA A P, PERS B M, PARLAKGVL G, et al. Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity[J]. Nat Med, 2014, 20(12): 1427-1435. DOI:10.1038/nm.3735 |
| [18] |
PIANTADOSI C A, CARRAWAY M S, BABIKER A, et al. Heme oxygenase-1 regulates cardiac mitochondrial biogenesis via Nrf2-mediated transcriptional control of nuclear respiratory factor-1[J]. Circ Res, 2008, 103(11): 1232-1240. DOI:10.1161/01.RES.0000338597.71702.ad |
| [19] |
TIAN S C, LI B L, LEI P, et al. Sulforaphane improves abnormal lipid metabolism via both ERS-dependent XBP1/ACC & SCD1 and ERS-independent SREBP/FAS pathways[J]. Mol Nutr Food Res, 2018, 62(6): e1700737. DOI:10.1002/mnfr.201700737 |



