2. 226001 江苏 南通,南通大学附属医院烧伤整形科
2. Department of Burns and Plastic Surgery, Affiliated Hospital of Nantong University, Nantong, Jiangsu Province, 226001, China
伤口愈合是一个循序渐进的过程,通常在组织损伤后立即发生,但往往会导致瘢痕[1]。理想的瘢痕薄而平,几乎看不见,被称为表浅性瘢痕[2]。严重创伤或在标准手术时缝合伤口不当会导致的非典型凸起瘢痕,称为增生性瘢痕(hypertrophic scar, HS)[3]。HS无论从机体的外观还是功能方面都给患者带来心理和生理上的痛苦,严重者甚至影响患者自信心,使其产生自卑心理。因此,无论在烧创伤科、整形科还是皮肤科,HS都是临床上高度关注的焦点。目前,临床上治疗HS通常选择手术切除,类固醇注射和放疗[4]; 然而,临床上治疗HS的金标准还尚不明确。有研究报道,非编码RNA和生长因子与HS的形成有关[5-6]。micro RNAs是一种由20~22个核苷酸组成的单链非编码RNA,通过与靶基因mRNA的3’-UTR结合,调控基因的表达。先前的研究表明,microRNA-26a(miR-26a)可能在正常组织的生长和发育以及肿瘤和非肿瘤疾病的发病机制中发挥关键作用[7-9]。有研究表明HS形成的特征是致密纤维组织的过度生长[10],然而基因Smad2(mothers against decapentaplegic homolog 2)又是转化生长因子β(TGF-β)的重要家族成员之一。但miR-26和Smad2在HS中作用并不了解。本研究分析HS组织和正常皮肤(normal skin,NS)组织中miR-26a的差异表达情况,分析两者的相关性,并通过双荧光素酶报告系统验证了重组蛋白Smad2是miR-26a的靶基因,从而证明miR-26a可能是治疗HS的新型潜在治疗靶点。
1 资料与方法 1.1 研究对象选取2013年2月至2018年12月南通大学附属医院收治的20例患者(年龄18~59岁; 女性13例,男性7例),取瘢痕切除术或自体皮移植术后的活检组织,其中切除的瘢痕组织为HS组,瘢痕旁正常组织为NS组。患者均经临床和病理诊断确诊。纳入标准:必须有局部瘢痕且无全身性疾病,在手术前3个月未曾接受激素药物,放射治疗或注射其他形式的药物。入组标本取下后均立即储存在液氮中。本研究经南通大学附属医院伦理委员会批准(审查批号:2019-L014)且患者均获得书面知情同意书。
1.2 主要材料、试剂与仪器人胚胎皮肤成纤维细胞(CCC-ESF-1)和人HS成纤维细胞(hHSF)购自美国弗吉尼亚州马纳萨斯典型培养物保藏中心。其他试剂:RPMI1640培养基、胎牛血清、TRIzol试剂(美国赛默飞世尔科技公司),逆转录试剂盒、RT-qPCR试剂盒(日本TaKaRa公司),Lipofectamine 2000 (美国Invitrogen公司),双荧光素酶检测试剂盒(美国Promega公司),RNeasy Micro Kit微量RNA提取试剂盒(德国QI-AGEN公司),抗兔IgG辣根过氧化物酶偶联的二抗(目录号7074,1 :1 000;上海CST公司),兔抗鼠PTEN抗体、兔抗鼠PI3K抗体(自美国Santa Cruz公司),pMD18-T载体(日本TaKaRa公司),pmiR-RB-ReportTM质粒(广州瑞博生物有限公司),miR-26a、PTEN、PI3K、β-actin引物序列由上海吉玛公司合成(表 1)。
| 基因 | 引物序列(5′-3′) | 片段大小/bp |
| Smad2 | 正向CGTCCATCTTGCCATTCACG | 171 |
| 反向CTCAAGCTCATCTAATCGTCCTG | ||
| ColⅠ | 正向CCCTGAGTGGAAGAGTGGAG | 152 |
| 反向GAGGCGTGAGGTCTTCTGTG | ||
| ColⅢ | 正向GGAGCTGGCTACTTCTCGC | 150 |
| 反向GGGAACATCCTCCTTCAACAG | ||
| miR-26A | 正向CAAGUAAUCCAGGAUAGG | 149 |
| 反向GGCCAACCGCGAGAAGATGTTTTTTTTT | ||
| U6 | 正向GGAGCGAGATCCCTCCAAAAT | 146 |
| 反向GGCTGTTGTCATACTTCTCATGG | ||
| GAPDH | 正向CTTTGGTATCGTGGAAGGACTC | 135 |
| 反向GTAGAGGCAGGGATGATGTTCT |
1.3 方法 1.3.1 细胞培养与基因转染
将CCC-ESF-1细胞与hHSF细胞置于含10%胎牛血清和1%青霉素-链霉素溶液的RPMI1640培养基中培养,至细胞密度达到80%以上时接种到6孔板(每孔5×104个细胞)中,并在含有37 ℃、5%CO2的湿润培养箱中培养约24 h。将50 nmol/L miR-26a模拟物(5′-TTCAAGTAATCCAGGATAGGCT-3′),50 nmol/L miR-26a抑制剂(5′-AGCCTATCCTGGATTACTTGAA-3′),50 nmol/L寡核苷酸随机序列对照(NC,上海基因药物有限公司),Smad2-质粒(Smad2-p),对照质粒(ctrl-p),Smad2-小干扰RNA(Smad2-siRNA)和对照小干扰RNA(ctrl-s),按照Lipofectamine2000说明书进行转染,转入hHSF细胞中。转染的细胞在含有5%CO2的空气中37℃孵育48 h后,将细胞进行以下实验。
1.3.2 qRT-PCR检测HS中miR-26a的表达使用TRIzol试剂从CCC-ESF-1,hHSF细胞及HS、NS组织中提取总RNA,根据miScript逆转录试剂盒说明书将其转录为cDNA,所需反应条件如下:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min并保持在4 ℃。以mi R-26a引物为模板用RT-qPCR扩增,条件为:95 ℃变性5 min,95 ℃变性15 s,60 ℃退火30 s,再继续延伸30 s,共40个循环。使用2-ΔΔCq检测分析miR-26a的表达,正常化为U6表达。
1.3.3 mi R-26a转染与双荧光素酶报告系统检测①双荧光素酶报告系统检测:为了证实直接靶标结合,将Smad2的野生型(WT-Smad2)和突变型(MUT-Smad2)3′-UTR克隆到报告基因监测系统pmiR-RB-ReportTM质粒载体中。再次按照Lipofectamine 2000说明书进行转染,将100 ng WT-Smad2或100 ng MUT-Smad2、50 nmol/L miR-26a、50 nmol/L miR-26a随机对照序列(50 nmol/L; miR-C)载体转染到hHSF细胞中。48 h后,根据双荧光素酶检测试剂盒说明书,最后的荧光素酶活性以海肾荧光素酶的荧光值与萤火虫萤光素酶的荧光值之比表示.②Western blot检测:将hHSF细胞分别用miR-26a模拟物,miR-26a抑制剂转染48 h,提取细胞总蛋白, 加入100 μL蛋白酶抑制剂,BCA蛋白浓度测定试剂盒测定总蛋白质浓度。将等量的蛋白质用SDS-PAGE电泳缓冲液分离,再用转膜液将分离出的蛋白转至PVDF膜上,用含Tween-205%脱脂牛奶封闭PVDF膜,室温1.5 h。探讨抗Smad2抗体,胶原蛋白ColⅠ、Col Ⅲ、Bcl-2、Bax的表达,用Tris-缓冲盐水/ Tween-20洗涤3次后,加入抗兔IgG辣根过氧化物酶偶联的二抗(1 :1 000)孵育,显色剂显色,使用WinMDI 2.5版软件分析数据。
1.4 统计学分析采用SPSS 17.0统计软件。计量资料以x±s表示。两组间比较用两独立样本t检验,3组间比较用单因素方差分析,在方差分析有意义的基础上,进行Tukey检验或Student’s -t检验。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 miR-26a在患者HS组织以及hHSF细胞中的低表达与NS组织相比,HS组织中miR-26a的表达显著降低(P < 0.01,图 1A)。与CCC-ESF-1细胞相比,hHSFs细胞中miR-26a表达显著降低(P < 0.01,图 1B)。用miR-26a模拟物、miR-26a抑制剂以及NC转染至hHSF细胞中,RT-qPCR检测每个细胞系的转染效率,结果显示miR-26a过表达后miR-26a表达量明显高于对照组,miR-26a抑制后miR-26a表达量明显低于对照组(P < 0.01,图 1C)。提示miR-26a在HS组织和hHSF中下调。
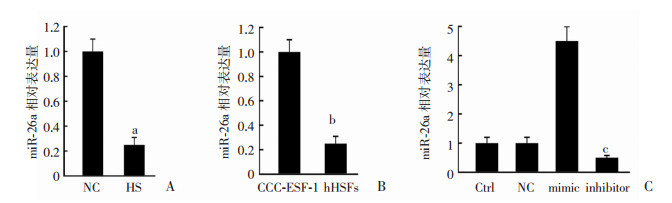
|
| A:qRT-PCR检测HS组织中miR-26a mRNA表达; B:qRT-PCR检测在hHSFs细胞中miR-26a mRNA表达;C:qRT-PCR检测在hHSFs细胞中miR-26a过表达和抑制后miR-26a表达 a:P < 0.01,与NS对照组比较;b:P < 0.01,与CCC-ESF-1对照组比较;c:P < 0.01,与NC、Ctrl对照组比较 图 1 miR-26a在患者HS组织以及hHSF细胞中的表达 |
2.2 miR-26a直接靶向Smad2
Targetscan软件预测miR-26a的靶向基因,结果发现:Smad2是为miR-26a潜在的靶基因(图 2A)。Smad2 3'-UTR在相当多的物种中形成了假定的结合位点。为了验证结合位点,进行双荧光素酶报告基因检测,结果表明:在hHSF细胞转染WT-Smad2后分别再转染miR-26a和miR-C,miR-26a组荧光素酶活性明显低于对照组(P < 0.05);而共转染MUT-Smad2后,miR-26a组荧光素酶活性和对照组没有明显差异(图 2B)。使用RT-qPCR检测HS组织和hHSF细胞中Smad2的表达,结果表明:与NS组相比,Smad2表达在HS组织显著上调(图 2C),与CCC-ESF-1细胞相比,Smad2表达在hHSF细胞中也显著上调(图 2D)。转染miR-26a-模拟物的hHSF细胞中Smad2蛋白表达显著下调,而在用miR-26a抑制剂转染的细胞中Smad2蛋白表达显著上调(图 2E)。在用miR-26a模拟物转染后,发现hHSF细胞中Smad2 mRNA的表达降低,而在miR-26a抑制剂后Smad2水平显著增高(图 2F)。
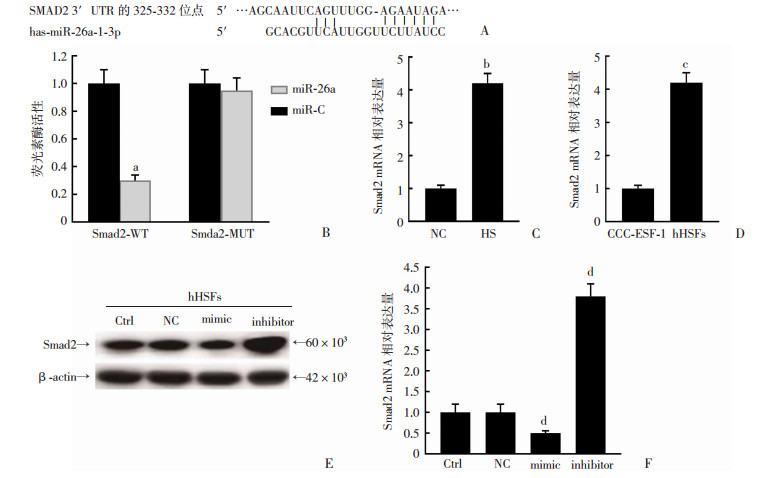
|
| A:Target scan软件预测miR-26a的靶向基因;B:荧光素酶报告基因检测在hHSF细胞中分别共转染WT-Smad2、miR-26a和WT-Smad2、miR-C及分别共转染MUT-Smad2、miR-26a和MUT-Smad2、miR-C后荧光素酶活性;C: HS和NS组织中Smad2 mRNA表达; D: CCC-ESF-1和hHSFs细胞中Smad2 mRNA表达;E:在hHSFs细胞中过表达和干扰miR-26a后Smad2蛋白表达; F:在hHSFs细胞中过表达和干扰miR-26a后Smad2 mRNA表达 a:P < 0.01,与Smad2-MUT对照组比较;b:P < 0.01,与NS对照组比较;c:P < 0.01,与CCC-ESF-1对照组比较;d:P < 0.01,与NC对照组比较 图 2 miR-26a结合在Smad2启动子区并调节其活性 |
2.3 miR-26a对hHSF细胞中Col Ⅰ和Col Ⅲ表达的影响
为了进一步研究miR-26a的分子机制,通过Western blot和实时RT-qPCR检测用miR-26a模拟物或miR-26a抑制剂转染的hHSF细胞后ColⅠ和Col Ⅲ的表达。结果显示:转染miR-26a模拟物后ColⅠ和Col Ⅲ蛋白质和mRNA表达降低,而转染miR-26a抑制剂后ColⅠ和Col Ⅲ蛋白质和mRNA表达增高(P < 0.05,图 3)。提示:miR-26a抑制hHSF细胞的细胞外基质沉积。
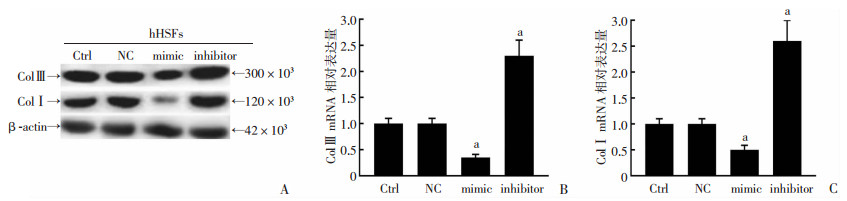
|
| A:Western blot检测在hHSFs细胞中过表达和干扰miR-26a后ColⅠ和Col Ⅲ蛋白;B. RT-PCR检测在hHSFs细胞中过表达和干扰miR-26a后ColⅢ mRNA表达; C:RT-PCR检测在hHSFs细胞中过表达和干扰miR-26a后ColⅠmRNA表达 a:P < 0.01,与NC对照组比较 图 3 miR-26a调节hHSF细胞中ColⅠ和ColⅢ表达 |
2.4 Smad2对hHSFs细胞中Col Ⅰ和Col Ⅲ表达的影响
为了确定Smad2的调节是否影响HS形成,用Smad2-质粒和Smad2-siRNA转染hHSF细胞。结果显示:过表达Smad2的hHSFs细胞中ColⅠ和Col Ⅲ蛋白表达升高;敲低Smad2的hHSFs细胞中ColⅠ和Col Ⅲ蛋白表达降低(图 4A)。同时,Smad2的hHSFs细胞ColⅠ和Col Ⅲ mRNA表达也升高; 敲低Smad2的hHSFs细胞ColⅠ和Col Ⅲ mRNA表达也降低(图 4B~D)。
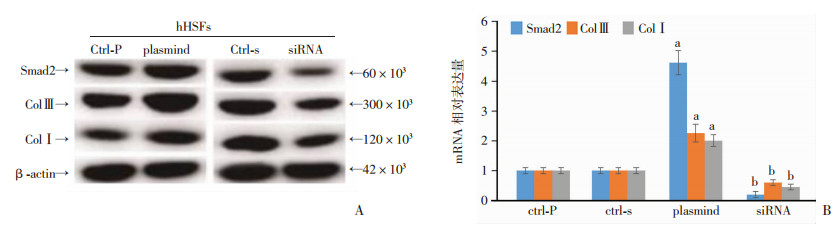
|
| A:Western blot检测在hHSFs细胞中过表达和敲低Smad2后ColⅠ和ColⅢ蛋白表达;B半定量分析结果 a:P < 0.01,与Ctrl-p对照组比较;b:P < 0.01,与Ctrl-s对照组比较 图 4 Smad2调节hHSFs细胞中ColⅠ和ColⅢ的表达 |
3 讨论
HS是由于皮肤严重受热或创伤性损伤时致密的纤维组织过度生长引起的。目前已有许多研究证实细胞因子(肿瘤坏死因子α、转化生长因子β、血管内皮生长因子等)、细胞(中性粒细胞、成纤维细胞、肌成纤维细胞、肥大细胞等)、细胞外基质(Extracellular mechanism,ECM)(胶原的代谢与排列失常、糖胺聚糖的改变等)等成分的相互作用在HS形成中起着重要作用[11-12],但对于细胞因子是否调节并影响HS的形成并不是很清楚。
近年来,micro RNA的生物学功能研究引起广泛关注。microRNA的异常表达可能有助于皮肤纤维化疾病的治疗[13]。研究报道miR-26a可能在正常组织的生长和发育以及非肿瘤性疾病和肿瘤的发病机制中发挥关键作用[14-16]。最近的1项研究发现miR-26a在青光眼滤过手术后过滤瘢痕形成中发挥了重要作用[14]。然而,并未有研究说明miR-26a在HS中的作用及进一步的研究。本研究通过检测miR-26a在HS及hHSF细胞的表达结果发现:与配对的NS组织相比,在HS组织中的miR-26a表达水平显著降低,并且在hHSF细胞中miR-26a表达水平显著也降低。那么, HS组织中miR-26a的异常表达是怎么被调控的呢?本研究选取hHSF细胞珠做接下来的实验。研究表明Smad2是真核生物中的一种保守蛋白质,含有3种亚型,TGF-β1-Smad2 / 3信号通路是从细胞质转移到细胞核并调节基质蛋白的产生(包括纤维连接蛋白和胶原),可以调节靶基因转录以及ECM的合成和降解[18-19]。而TGF-β1是最重要的成纤维细胞形成细胞因子,并且在细胞分化、增殖和凋亡中起作用[20-21]。创伤后,TGF-β1首先从血小板释放到损伤部位,然后发生成纤维细胞、单核细胞、嗜中性粒细胞和其他细胞的剂量依赖性趋化性[22-23]。这说明Smad2可能在HS形成中起着重要作用。那么Smad2是否与miR-26a相互作用,影响HS的形成呢?本研究结果提示:Smad2是miR-26a的靶基因,Smad2的表达在HS组织和hHSFs中均表达上调。另外,在用miR-26a模拟物转染的hHSF细胞中Smad2显著降低;然而,在用miR-26a抑制剂转染的hHSF细胞内Smad2显著升高;这些结果说明在HS中miR-26a的低表达使其对Smad2的表达抑制作用降低,导致瘢痕形成过程加强。此外,本研究也表明miR-26a模拟物和抑制剂分别转染hHSF细胞降低和增加ColⅠ和ColⅢ表达,Smad2过表达和沉默分别促进和抑制ColⅠ和ColⅢ的表达。进一步确定了miR-26a和Smad2在HS形成中的作用。接下来可以通过观察上调或下调miR-26a后ECM相关蛋白表达水平的变化,了解miR-26a靶向Smad2对ECM相关蛋白表达水平的调节情况。
本研究提供了证据证明miR-26a是治疗增生性瘢痕的潜在新型替代治疗靶标,同时也为HS的临床治疗提供了理论依据。但本研究未在活体动物模型上进一步验证miR-26a在HS中的作用及敲除miR-26a对HS的影响,有待今后进一步进行深入研究。
| [1] |
TYACK Z F, PEGG S, ZIVIANI J. Postburn dyspigmentation:its assessment, management, and relationship to scarring:a review of the literature[J]. J Burn Care Rehabil, 1997, 18(5): 435-440. DOI:10.1097/00004630-199709000-00012 |
| [2] |
DAS S, BAKER A B. Biomaterials andnanotherapeutics for enhancing skin wound healing[J]. Front Bioeng Biotechnol, 2016, 4: 82. DOI:10.3389/fbioe.2016.00082 |
| [3] |
GAUGLITZ GG, KORTING H C, PAVICIC T, et al. Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies[J]. Mol Med, 2011, 17(1/2): 113-125. DOI:10.2119/molmed.2009.00153 |
| [4] |
ZUCCARO J, ZIOLKOWSKI N, FISH J. A systematic review of the effectiveness of laser therapy for hypertrophic burn scars[J]. Clin Plast Surg, 2017, 44(4): 767-779. DOI:10.1016/j.cps.2017.05.008 |
| [5] |
KASHIYAMA K, MITSUTAKE N, MATSUSE M, et al. MiR-196a downregulation increases the expression of type Ⅰ and Ⅲ collagens in keloid fibroblasts[J]. J Invest Dermatol, 2012, 132(6): 1597-1604. DOI:10.1038/jid.2012.22 |
| [6] |
LI P, HE Q Y, LUO C Q. Overexpression of miR-200b inhibits the cell proliferation and promotes apoptosis of human hypertrophic scar fibroblastsin vitro[J]. J Dermatol, 2014, 41(10): 903-911. DOI:10.1111/1346-8138.12600 |
| [7] |
ZHAO S J, YE X D, XIAO L, et al. MiR-26a inhibits prostate cancer progression by repression of Wnt5a[J]. Tumour Biol, 2014, 35(10): 9725-9733. DOI:10.1007/s13277-014-2206-4 |
| [8] |
SHEN W J, SONG M, LIU J, et al. MiR-26a promotes ovarian cancer proliferation and tumorigenesis[J]. PLoS ONE, 2014, 9(1): e86871. DOI:10.1371/journal.pone.0086871 |
| [9] |
QIAN H, YANG C, YANG Y X. MicroRNA-26a inhibits the growth and invasiveness of malignant melanoma and directly targets onMITF gene[J]. Cell Death Discov, 2017, 3: 17028. DOI:10.1038/cddiscovery.2017.28 |
| [10] |
WOLFRAM D, TZANKOV A, PVLZL P, et al. Hypertrophic scars and keloids:A review of their pathophysiology, risk factors, and therapeutic management[J]. Dermatol Surg, 2009, 35(2): 171-181. DOI:10.1111/j.1524-4725.2008.34406.x |
| [11] |
GAO J, LIU Q G. The role of miR-26 in tumors and normal tissues (Review)[J]. Oncol Lett, 2011, 2(6): 1019-1023. DOI:10.3892/ol.2011.413 |
| [12] |
ZHANG B, LIU XX, HE J R, et al. Pathologically decreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J]. Carcinogenesis, 2011, 32(1): 2-9. DOI:10.1093/carcin/bgq209 |
| [13] |
BABALOLA O, MAMALIS A, LEV-TOV H, et al. The role of microRNAs in skin fibrosis[J]. Arch Dermatol Res, 2013, 305(9): 763-776. DOI:10.1007/s00403-013-1410-1 |
| [14] |
WANG W H, DENG A J, HE S G. A key role of microRNA-26a in the scar formation after glaucoma filtration surgery[J]. Artif Cells Nanomed Biotechnol, 2018, 46(4): 831-837. DOI:10.1080/21691401.2017.1345926 |
| [15] |
HAO R, CHEN L, WU J W, et al. Structure of Drosophila mad MH2 domain[J]. Acta Cryst Sect F, 2008, 64(11): 986-990. DOI:10.1107/s1744309108033034 |
| [16] |
Moustakas A, Souchelnytskyi S, Heldin C H. Smad regulation in TGF-beta signal transduction[J]. J Cell Sci, 2001, 114(24): 4359-4369. DOI:10.1152/ajpgi.00208.2007 |
| [17] |
FROESE A R, SHIMBORI C, BELLAYE P, et al. Stretch-induced activation of transforming growth factor-β1in pulmonary fibrosis[J]. Am J Respir Crit Care Med, 2016, 194(1): 84-96. DOI:10.1164/rccm.201508-1638oc |
| [18] |
CAO S, XIAO L, RAO J N, et al. Inhibition of Smurf2 translation by miR-322/503 modulates TGF-β/Smad2 signaling and intestinal epithelial homeostasis[J]. Mol Biol Cell, 2014, 25(8): 1234-1243. DOI:10.1091/mbc.E13-09-0560 |
| [19] |
YIN K, YIN W J, WANG Y H, et al. MiR-206 suppresses epithelial mesenchymal transition by targeting TGF-β signaling in estrogen receptor positive breast cancer cells[J]. Oncotarget, 2016, 7(17): 24537-24548. DOI:10.18632/oncotarget.8233 |
| [20] |
ZUO J, CHEN Z Y, ZHONG X C, et al. FBP1 is highly expressed in human hypertrophic scars and increases fibroblast proliferation, apoptosis, and collagen expression[J]. Connect Tissue Res, 2018, 59(2): 120-128. DOI:10.1080/03008207.2017.1311327 |
| [21] |
LI J, CHEN L, CAO C Y, et al. The long non-coding RNA LncRNA8975-1 is upregulated in hypertrophic scar fibroblasts and controls collagen expression[J]. Cell Physiol Biochem, 2016, 40(1/2): 326-334. DOI:10.1159/000452548 |
| [22] |
ZHOU R P, ZHANG Q, ZHANG Y, et al. Aberrant miR-21 and miR-200b expression and its pro-fibrotic potential in hypertrophic scars[J]. Exp Cell Res, 2015, 339(2): 360-366. DOI:10.1016/j.yexcr.2015.10.018 |
| [23] |
FAN C, DONG Y, XIE Y, et al. Shikonin reduces TGF-β1-induced collagen production and contraction in hypertrophic scar-derived human skin fibroblasts[J]. Int J Mol Med, 2015, 36(4): 985-991. DOI:10.3892/ijmm.2015.2299 |



