2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院神经内科
2. Department of Neurology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
帕金森病(Parkinson’s disease, PD)是一种神经变性疾病,其发病率约为15/10万[1]。便秘是PD最常见的非运动症状,约70%的PD患者存在不同程度的便秘[2],被认为是PD的危险因素之一[3-4]。不仅便秘,腹泻也被报道为PD的潜在前驱症状,临床上同样常见。PD患者的肠道功能障碍集中表现为便秘、腹泻以及便秘-腹泻交替3种类型,这样的表现被认为是肠易激综合征(irritable bowel syndrome, IBS)样症状。关于PD患者中IBS样症状的发病率,据有限文献报道在17%~24.3%,远高于正常对照组[5-6],台湾的1项临床研究显示IBS与台湾人口罹患PD的风险增加有关[7]。关于PD患者IBS样症状的病因仍不确定,临床用药不规范,疗效也不确切。目前的证据表明“肠道菌群失调”,即肠道环境的变化导致肠道微生物群的变化,是IBS的重要病因之一[8],IBS患者的肠道微生物群的构成与健康人明显不同[9]。最近的研究集中显示PD患者普遍存在肠道菌群失调状态[10],并且值得关注的是,有IBS样症状的PD患者肠道菌群失调更加显著,肠道菌群检测发现他们的普雷沃氏菌属丰度明显降低[11]。
粪菌移植(fecal microbiota transplantation,FMT)作为一种古老的治疗方法近年来重新被临床关注。它是一种将健康供者的粪便所含肠道菌群送入患者消化道的技术,旨在恢复患者健康的肠道菌群。大量研究显示FMT治疗IBS安全有效[12]。基于国内外研究结果,我们认为FMT治疗可能会改善PD患者肠道菌群失调状态,并且对患者IBS样症状有积极作用。本研究旨在对伴有IBS样症状的PD患者进行FMT治疗,并观察其安全性和有效性。
1 资料与方法 1.1 一般资料选择2019年3-7月在陆军军医大学第一附属医院就诊的H-Y 1~3级伴有IBS样症状的30例PD患者,其中男性16例,女性14例,年龄(59.9±7.48)岁,体质量指数(BMI)为(22.55±2.36)kg/m2,治疗前便秘患者26例,腹泻患者4例(表 1)。
| 临床特征 | 患者情况 |
| 性别(男/女, 例) | 16/14 |
| 年龄/岁(x±s) | 59.90±7.48 |
| 身高/cm(x±s) | 162.70±7.43 |
| 体质量/kg(x±s) | 59.77±7.94 |
| BMI/kg·m-2(x±s) | 22.55±2.36 |
| 发病时间/年(x±s) | 5.70±4.11 |
| 确诊时间/年(x±s) | 4.40±4.28 |
| 泻药使用史(有/无)(例) | 13/17 |
| 便秘患者每周排便次数(x±s) | 1.31±0.67 |
| 腹泻患者每周排便次数(x±s) | 18.00±1.87 |
| 便秘患者大便性状评分(x±s) | 1.88±1.09 |
| 腹泻患者大便性状评分(x±s) | 5.75±0.43 |
| IBS样症状腹痛评分(x±s) | 2.40±0.49 |
| IBS-SSS评分(x±s) | 137.83±67.86 |
| IBS-QOL评分(x±s) | 21.47±14.59 |
| GSRS评分(x±s) | 7.70±2.72 |
| IBS样症状类型[例(%)] | |
| 功能性便秘 | 22(73.33) |
| 功能性腹泻 | 3(10.00) |
| IBS-腹泻型 | 1(3.33) |
| IBS-便秘型 | 4(13.33) |
1.2 观察指标
所有患者在试验开始后接受口服“肠菌胶囊”的FMT治疗,连续3次(1、2、3周),每周1次,期间治疗PD口服药物保持不变。受试者于实验开始后2、3、4、8周进行访视,观察记录IBS样症状量表评分变化,并检测其治疗前和每次FMT后的血常规、肝肾功;此外,要求患者每天用日记形式记录大便性状、大便次数以及治疗的副作用。主要指标是有效性指标,即IBS样症状量表的变化值,次要指标是安全性指标及相关不良反应的记录。
本研究经大坪医院伦理委员会批准。临床试验(ClinicalTrials.gov)注册编码为ChiCTR1900021405(http://www.chictr.org.cn/showproj.aspx?proj=36172)。本研究是根据良好临床实践的要求和赫尔辛基修订宣言进行的。所有参与者均提供书面知情同意,在口头和书面同意后参与研究。参与者可以根据自己的要求在任何时间点停止。
1.3 纳入、排除标准纳入标准:①男性或女性,年龄30~85岁;②符合《很可能的帕金森病H-Y1~3级的诊断标准2016》,诊断为早期帕金森病且伴有便秘和/或腹泻症状的患者;③具有正常沟通能力;④签署知情同意,同意参加本项研究。
排除标准:①并发其他严重的心、肝、肾、呼吸、消化、血液、内分泌系统疾病;②合并有肠道的二重感染,如艰难梭菌感染、肠出血性大肠杆菌、沙门氏菌、志贺氏菌、弯曲杆菌、鼠疫和巨细胞病毒等;③合并各种急性感染者、肿瘤、严重心律失常、精神系统疾患、药物或酒精成瘾者;④妊娠或者哺乳期妇女;⑤近4周内有应用过抗生素或微生态制剂者;⑥对于本研究所用“肠菌胶囊”有过敏或有禁忌证者;⑦入组时或入组前3个月内正在进行其他相关帕金森病的临床研究者;⑧既往有脑缺血、脑出血等疾病;⑨疑诊帕金森叠加综合征或继发性帕金森综合征患者;⑩已知有胃肠道器质性疾病的患者。
1.4 供体要求粪菌胶囊的供体要求[13] ①50岁以下、具有良好的饮食习惯及生活方式的健康成年人;②无任何已知的传染病;③最近3个月内未使用抗菌药物以及其他导致肠道微生态紊乱的药物;④无胃肠道肿瘤、息肉等消化系疾病;⑤无免疫系统疾病史;⑥未使用任何免疫抑制剂;⑦无IBD、慢性便秘和IBS病史;⑧无恶性肿瘤病史;⑨最近6个月内未到地方流行性腹泻地区旅行;B10当前未进行任何抗肿瘤相关的药物和其他治疗;B11当前无消化系统症状,无其他相关危险因素,如静脉内药物滥用(吸毒)、高危性行为和犯罪史等。
1.5 研究设计和随访 1.5.1 “肠菌胶囊”制备称取100 g大便,加500 mL生理盐水,搅拌器搅拌混匀。将搅拌好的液体倒入0.4 mm、0.2 mm、0.1 mm,筛子逐层过滤,将过滤后的液体分装入离心瓶中,离心(3 000 r/min,15 min)。配制6%海藻糖,将离心后的上清倒掉,然后将配制好的海藻糖倒入离心瓶中,用磁力搅拌器搅拌混匀。最后将液体倒入离心管中,密封,-80 ℃冷冻,2 h后再将冷冻好的菌液从-80 ℃冰箱中拿出,将其放入真空冷冻干燥机中冻干。最后,将冻干后的粉末装到胶囊中,胶囊放入-80 ℃冰箱中保存。
1.5.2 “肠菌胶囊”服用方法及伴随用药整个FMT疗程为3周,前3周每周进行1次FMT,即每次清晨空腹温开水送服“肠菌胶囊”16粒(一共相当于50 g大便的菌量),并要求间隔1 h以上进食。疗效观察期为入组后第1~8周,每周进行1次门诊随访;入组开始至随访结束,要求患者停用其他治疗便秘或影响胃肠动力的药物,但若患者连续4 d以上不排便,可应急使用开塞露纳肛以辅助排便。为了得到准确的基线信息,第1次治疗前后48 h不能应急用药。同时向患者进行健康宣教,倡导合理的饮食,正确的运动及排便习惯,说明焦虑和抑郁对身体产生的不良影响,增强患者应对疾病的能力。在治疗和随访期间,建议所有患者参与健康的生活方式,如饮食、锻炼和生活习惯。
1.6 治疗有效性与安全性评定 1.6.1 有效性指标① 每周排便次数:治疗前后每周排便次数变化;便秘症状的临床治愈率:每周排便次数>3次患者所占比例;便秘症状的临床改善率:临床症状未达到治愈水平,但较治疗前明显改善的患者比例。②Bristol粪便性状评分:记录患者的粪便性状。③笑脸疼痛评分表评估腹痛:0分,无痛;1~3分,轻度疼痛(睡眠不受影响);4~6分,中度疼痛(睡眠受影响);7~10分,重度疼痛(严重影响睡眠)。④IBS-QOL专用量表:量表经过汉化,由焦虑不安、行为障碍、躯体意念、挑食、健康忧虑、社会反应、性行为、人际关系8个领域的34个条目组成,每个条目分为5个等级,分别赋值1~5分,分值越高说明生活质量越差。⑤IBS疾病严重程度(IBS-SSS)评分:以问卷进行测量,包括5项,总分0~500分。问题1,腹痛的严重程度,问题2,腹痛的频率,问题3,腹胀的严重程度,问题4,对排便习惯的不满,问题5,对生活质量的干扰。⑥GSRS(胃肠道症状)量表:包括患者便秘、腹胀、腹痛、流涎、恶心、吞咽困难、大便费力、大便不尽等8项指标,每项分4个等级,分别赋值0~3分,分值越高说明患者胃肠道症状越重。
1.6.2 安全性指标依据FMT治疗前和每次FMT治疗后血常规、肝肾功检验指标变化和随访期间相关不良反应进行评价。
1.7 统计学分析使用SPSS 25.0统计软件,计数资料用率表示,计量数据用x±s表示,治疗前后各时间点比较采用单因素方差分析。检验水准:α=0.05。
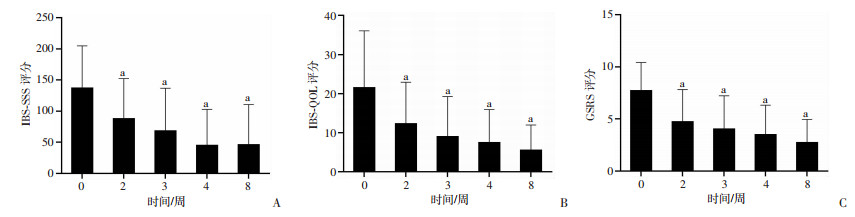
2 结果 2.1 有效性评价FMT治疗后26例便秘型患者排便次数明显增加,Bristol粪便性状评分明显升高;相反,4例腹泻型患者排便次数明显减少,Bristol粪便性状评分明显降低(图 1)。随访期间疗效显著,第4周效果最佳,第8周随访结束时,共21例便秘患者获得临床治愈,22例便秘患者获得临床改善(表 2)。30例患者的IBS-SSS评分、IBS-QOL评分、GSRS评分与治疗前相比明显降低(P < 0.05,图 2),至第8周随访结束,共21例患者IBS-SSS评分降低>50分。

|
| A、B:分别为便秘型患者排便次数、粪便性状评分(n=26);C、D:腹泻型患者排便次数、粪便性状评分(n=4) a:P < 0.05,与FMT前(即0周)比较 图 1 便秘和腹泻型PD患者FMT前后腹泻、便秘症状及相关量表评分的比较 |
| 临床治愈 | 临床改善 | ||||||||
| 2周 | 3周 | 4周 | 8周 | 2周 | 3周 | 4周 | 8周 | ||
| 便秘型 | 19(73.08) | 21(80.77) | 23(88.46) | 21(80.77) | 20(76.92) | 22(84.62) | 23(88.46) | 22(84.62) | |
|
| A:IBS-SSS评分; B:IBS-QOL评分; C:GSRS评分 a:P < 0.05,与FMT前(0周)比较 图 2 30例患者FMT前后IBS-SSS评分、IBS-QOL评分和GSRS评分比较 |
2.2 安全性评价结果
血液生化指标结果显示:除1例女性患者在第1次FMT治疗4 d后因上呼吸道感染白细胞轻度升高,经口服阿莫西林胶囊治疗3 d后恢复正常,其余29例患者在接受FMT治疗前后血常规、肝、肾功能指标未发生明显变化,直至随访8周结束;临床表现:仅1例女性患者在第1次服用“肠菌胶囊”后出现轻度恶心,无呕吐,未进行医疗干预,第2天患者自行缓解,其余29例患者至随访第8周时,无任何不良反应。
3 讨论早在2003年BRAAK等[14]通过人类病理学分析假定α-synuclein(α-syn)可从肠道通过迷走神经传递至大脑,2019年发表在Neuron上的文献用小鼠模型证实了以上假说[15]。紧接着,Nature上1项最新研究表明,肠道感染可以在缺乏与人类疾病相关基因的小鼠模型中导致类似PD的病理学改变和症状,并且这种症状可以通过左旋多巴暂时逆转[16]。近年来越来越多的研究资料提示PD与肠道菌群失调有关。临床病例对照研究也发现PD患者普遍存在肠道菌群失调的状态[17]。神经退行性疾病的特点是异常聚集的α-syn。现有研究结果显示,肠道菌群失调可能导致α-syn的错误折叠,通过脑-肠轴影响包括中枢神经、自主神经及肠道周围神经在内的各级神经功能[18],并与PD患者运动症状和非运动症状密切相关。近年来学术界提出了“脑-肠-微生物群轴”这个概念,越来越多的研究开始关注脑功能和肠道微生物群之间的双向信息交流。因此,探究肠道菌群失调对PD的影响以及改善肠道菌群对PD的治疗是从新的角度认识PD的发病机制和治疗策略,并为其临床防治提供新思路。
在PD中便秘与肠神经系统中的α-syn积聚和神经退行性变有关,伴有局部炎症、氧化应激和肠通透性增加[19]。这些病理生理变化甚至可以在PD运动症状出现前数年至数十年就可以观察到。诊断为IBS的患者PD的发病风险明显升高[20]。科学家们对PD患者的肠道菌群失调与肠道功能障碍之间的关系进行了深入研究,发现PD患者的IBS样症状属于自主神经功能紊乱导致的肠道功能失调的表现,既与脑-肠轴密切相关,又有肠道菌群失调的证据。
肠菌移植是将健康人粪便中的功能菌群移植到患者胃肠道内,重建具有正常功能的肠道菌群,从而实现肠道及肠道外疾病的治疗。本研究采用口服“肠菌胶囊”的方式进行FMT治疗,避免了侵入性的治疗方式,大大降低了FMT治疗方式上造成的不良事件发生率,并提高了患者依从性。
本研究纳入PD患者这一特殊人群,针对其IBS样症状进行FMT治疗,并通过自身前后对照数据统计分析结果显示FMT治疗后PD患者的腹痛、腹泻、便秘等IBS样症状,差异有统计学意义。FMT治疗既可以缓解患者的腹泻症状又可以发挥治疗便秘的作用,这种双向调节的作用与既往发表文献结果相符,但其机制尚未形成一致定论。IBS患者粪便微生物群的组成与健康对照组差异有统计学意义,但参与IBS发展的确切细菌种类仍有待确定[21-24]。总的来说,IBS的菌群特点是放线菌、双歧杆菌和乳酸菌减少,拟杆菌门、厚壁菌门和变形杆菌门增加[25-26]。肠道菌群失调可能会对肠道分泌和蠕动产生负面影响,甚至导致IBS[27]。研究显示功能性便秘和肠易激综合征便秘型(irritable bowel syndrome-constipation, IBS-C)患者的肠道菌群的失调可影响短链脂肪酸生成,使胰高血糖素样肽生成减少,进而抑制肠道传输功能[28]。另外,1篇纳入1 277例患者的Meta分析显示:甲烷呼气试验阳性与便秘密切相关[29],而呼出的甲烷含量与产甲烷菌在粪便中的比例呈正相关。5-HT与5-HT4受体结合可促进肠道蠕动,临床研究表明IBS-C患者与功能性便秘患者的双歧杆菌属丰度降低,伴随有直肠黏膜中5-HT水平明显降低,这可能是导致结肠传输时间延长的原因之一[30]。另一方面,肠易激综合征腹泻型(irritable bowel syndrome-diarrhea, IBS-D)中,包括大肠杆菌在内的变形杆菌增多与炎症增加有关[25]。其他研究表明,IBS-D患者肠道菌群中拟杆菌门和瘤胃球菌属显著增加[25, 31]。瘤胃球菌种类的增加可能导致黏液层的降解,进而导引起链球菌种类的浸润,从而导致低度炎症[25]。这些肠道微生物群的改变,特别是瘤胃球菌、变形杆菌和志贺菌或大肠杆菌的增加,可能是IBS-D低级别炎症的机制之一。低度炎症和异常肠内分泌细胞在肠易激综合征的病理生理过程中起着重要作用。FMT治疗患者IBS-D症状可能与其对局部免疫细胞、肠内分泌细胞和肠神经系统的影响有关[32],肠道菌群将未消化的短链碳水化合物和膳食纤维发酵,产生了包括短链脂肪酸在内的副产物,而这些脂肪酸作用于局部免疫细胞、肠内分泌细胞和肠道神经系统,抑制低级别炎症反应,恢复肠内分泌细胞密度。已有研究证实,FMT可恢肠道内分泌细胞的密度,FMT治疗可恢复IBS患者肠嗜铬细胞、神经g3细胞密度[33]。综合以上文献,推测FMT治疗后患者肠道菌群重塑可改变患者肠道微环境,引起一系列细菌代谢产物的改变,从而影响肠道神经内分泌系统,进而改善患者的IBS样症状。
本研究的不足之处:首先,本研究为单中心、自身前后对照研究,且样本量较小,随访时间较短,仅是对FMT治疗PD患者IBS样症状的初步探索。其次,现有少数文献报道益生菌治疗可降低PD患者的帕金森病联合评分标准(unified parkinson’s disease rating sacle, UDPRS)评分,改善其运动症状,并可改善患者焦虑、抑郁等情绪,本研究中对PD患者的运动障碍、认知功能以及情绪方面的改变进行了同步观察,以上数据仍在进一步随访中,有待下一步统计分析和论证。最后,我们的研究进行了肠道菌群的干预治疗,但并未对治疗前后的肠道菌群进行测序和分析,也未进行肠道菌群代谢产物的定量检测,因此机制方面有待深入。
综上,PD作为老年人发病率仅次于阿尔茨海默症的第2大神经变性疾病,其病因不明且临床表现复杂,PD相关的胃肠道功能紊乱的临床表现和发病机制与肠道菌群失调密切相关。本研究初步探索了FMT方法治疗PD患者IBS样症状的安全性与有效性,结果显示疗效显著并且安全可靠,为进一步探索FMT治疗PD的机制研究及临床防治PD的新疗法打下基础。
| [1] |
KALIA L V, LANG A E. Parkinson's disease[J]. Lancet, 2015, 386(9996): 896-912. DOI:10.1016/s0140-6736(14)61393-3 |
| [2] |
FASANO A, VISANJI N P, LIU L W, et al. Gastrointestinal dysfunction in Parkinson's disease[J]. Lancet Neurol, 2015, 14(6): 625-639. DOI:10.1016/S1474-4422(15)00007-1 |
| [3] |
NOYCE A J, BESTWICK J P, SILVEIRA-MORIYAMA L, et al. Meta-analysis of early nonmotor features and risk factors for Parkinson disease[J]. Ann Neurol, 2012, 72(6): 893-901. DOI:10.1002/ana.23687 |
| [4] |
STIRPE P, HOFFMAN M, BADIALI D, et al. Constipation:an emerging risk factor for Parkinson's disease?[J]. Eur J Neurol, 2016, 23(11): 1606-1613. DOI:10.1111/ene.13082 |
| [5] |
MISHIMA T, FUKAE J, FUJIOKA S, et al. The prevalence of constipation and irritable bowel syndrome in Parkinson's disease patients according to Rome Ⅲ diagnostic criteria[J]. J Parkinsons Dis, 2017, 7(2): 353-357. DOI:10.3233/JPD-160982 |
| [6] |
MERTSALMI T H, AHO V T E, PEREIRA P A B, et al. More than constipation-bowel symptoms in Parkinson's disease and their connection to gut microbiota[J]. Eur J Neurol, 2017, 24(11): 1375-1383. DOI:10.1111/ene.13398 |
| [7] |
LAI S W, LIAO K F, LIN C L, et al. Irritable bowel syndrome correlates with increased risk of Parkinson's disease in Taiwan[J]. Eur J Epidemiol, 2014, 29(1): 57-62. DOI:10.1007/s10654-014-9878-3 |
| [8] |
BARBARA G, FEINLE-BISSET C, GHOSHAL U C, et al. The intestinal microenvironment and functional gastrointestinal disorders[J]. Gastroenterology, 2016, S0016-S5085(16): 00219-5. DOI:10.1053/j.gastro.2016.02.028 |
| [9] |
PINN D M, ARONIADIS O C, BRANDT L J. Is fecal Microbiota transplantation (FMT) an effective treatment for patients with functional gastrointestinal disorders (FGID)?[J]. Neurogastroenterol Motil, 2015, 27(1): 19-29. DOI:10.1111/nmo.12479 |
| [10] |
KESHAVARZIAN A, GREEN S J, ENGEN P A, et al. Colonic bacterial composition in Parkinson's disease[J]. Mov Disord, 2015, 30(10): 1351-1360. DOI:10.1002/mds.26307 |
| [11] |
MERTSALMI T H, AHO V T E, PEREIRA P A B, et al. More than constipation-bowel symptoms in Parkinson's disease and their connection to gut Microbiota[J]. Eur J Neurol, 2017, 24(11): 1375-1383. DOI:10.1111/ene.13398 |
| [12] |
KUROKAWA S, KISHIMOTO T, MIZUNO S, et al. The effect of fecal microbiota transplantation on psychiatric symptoms among patients with irritable bowel syndrome, functional diarrhea and functional constipation:An open-label observational study[J]. J Affect Disord, 2018, 235: 506-512. DOI:10.1016/j.jad.2018.04.038 |
| [13] |
CAMMAROTA G, IANIRO G, TILG H, et al. European consensus conference on faecal microbiota transplantation in clinical practice[J]. Gut, 2017, 66(4): 569-580. DOI:10.1136/gutjnl-2016-313017 |
| [14] |
BRAAK H, DEL TREDICI K, RVB U, et al. Staging of brain pathology related to sporadic Parkinson's disease[J]. Neurobiol Aging, 2003, 24(2): 197-211. DOI:10.1016/s0197-4580(02)00065-9 |
| [15] |
KIM S, KWON S, KAM T, et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease[J]. Neuron, 2019, 103(4): 627-641.e7. DOI:10.1016/j.neuron.2019.05.035 |
| [16] |
MATHEOUD D, CANNON T, VOISIN A, et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1-/- mice[J]. Nature, 2019, 571(7766): 565-569. DOI:10.1038/s41586-019-1405-y |
| [17] |
SUN M F, SHEN Y Q. Dysbiosis of gut microbiota and microbial metabolites in Parkinson's disease[J]. Ageing Res Rev, 2018, 45: 53-61. DOI:10.1016/j.arr.2018.04.004 |
| [18] |
SAMPSON T R, DEBELIUS J W, THRON T, et al. Gut Microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease[J]. Cell, 2016, 167(6): 1469-1480.e12. DOI:10.1016/j.cell.2016.11.018 |
| [19] |
FORSYTH C B, SHANNON K M, KORDOWER J H, et al. Increased intestinal permeability correlates with sigmoid mucosa alpha-synuclein staining and endotoxin exposure markers in early Parkinson's disease[J]. PLoS ONE, 2011, 6(12): e28032. DOI:10.1371/journal.pone.0028032 |
| [20] |
LAI S W, LIAO K F, LIN C L, et al. Irritable bowel syndrome correlates with increased risk of Parkinson's disease in Taiwan[J]. Eur J Epidemiol, 2014, 29(1): 57-62. DOI:10.1007/s10654-014-9878-3 |
| [21] |
SUNDIN J, ÖHMAN L, SIMRÉN M. Understanding the gut Microbiota in inflammatory and functional gastrointestinal diseases[J]. Psychosom Med, 2017, 79(8): 857-867. DOI:10.1097/PSY.0000000000000470 |
| [22] |
RAJILIC' -STOJANOVIC ' M, JONKERS D M, SALONEN A, et al. Intestinal Microbiota and diet in IBS:causes, consequences, or epiphenomena?[J]. Am J Gastroenterol, 2015, 110(2): 278-287. DOI:10.1038/ajg.2014.427 |
| [23] |
ÖHMAN L, TÖRNBLOM H, SIMRÉN M. Crosstalk at the mucosal border:importance of the gut microenvironment in IBS[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(1): 36-49. DOI:10.1038/nrgastro.2014.200 |
| [24] |
HUANG H L, CHEN H T, LUO Q L, et al. Relief of irritable bowel syndrome by fecal Microbiota transplantation is associated with changes in diversity and composition of the gut Microbiota[J]. J Dig Dis, 2019, 20(8): 401-408. DOI:10.1111/1751-2980.12756 |
| [25] |
BENNET S M, OHMAN L, SIMREN M. Gut Microbiota as potential orchestrators of irritable bowel syndrome[J]. Gut Liver, 2015, 9(3): 318-331. DOI:10.5009/gnl14344 |
| [26] |
CHANG C, LIN H. Dysbiosis in gastrointestinal disorders[J]. Best Pract Res Clin Gastroenterol, 2016, 30(1): 3-15. DOI:10.1016/j.bpg.2016.02.001 |
| [27] |
HOLVOET T, JOOSSENS M, WANG J, et al. Assessment of faecal microbial transfer in irritable bowel syndrome with severe bloating[J]. Gut, 2017, 66(5): 980-982. DOI:10.1136/gutjnl-2016-312513 |
| [28] |
WICHMANN A, ALLAHYAR A, GREINER T U, et al. Microbial modulation of energy availability in the colon regulates intestinal transit[J]. Cell Host Microbe, 2013, 14(5): 582-590. DOI:10.1016/j.chom.2013.09.012 |
| [29] |
KUNKEL D, BASSERI R J, MAKHANI M D, et al. Methane on breath testing is associated with constipation:a systematic review and meta-analysis[J]. Dig Dis Sci, 2011, 56(6): 1612-1618. DOI:10.1007/s10620-011-1590-5 |
| [30] |
JAHNG J, JUNG I S, CHOI E J, et al. The effects of methane and hydrogen gases produced by enteric Bacteria on ileal motility and colonic transit time[J]. Neurogastroenterol Motil, 2012, 24(2): 185-190. DOI:10.1111/j.1365-2982.2011.01819.x |
| [31] |
JALANKA-TUOVINEN J, SALOJÄRVI J, SALONEN A, et al. Faecal Microbiota composition and host-microbe cross-talk following gastroenteritis and in postinfectious irritable bowel syndrome[J]. Gut, 2014, 63(11): 1737-1745. DOI:10.1136/gutjnl-2013-305994 |
| [32] |
HOLZER P, FARZI A. Neuropeptides and the microbiota-gut-brain axis[M]//Advances in experimental medicine and biology. New York: Springer, 2014: 195-219. DOI: 10.1007/978-1-4939-0897-4_9.
|
| [33] |
VANHOUTVIN S A, TROOST F J, KILKENS T O, et al. The effects of butyrate enemas on visceral perception in healthy volunteers[J]. Neurogastroenterol Motil, 2009, 21(9): 952-e76. DOI:10.1111/j.1365-2982.2009.01324.x |



