2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院全军烧伤研究所,创伤、烧伤与复合伤国家重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院骨科,全军矫形外科中心
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Burns, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Orthopedics, Center of Plastic Surgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是一种既可引起医院流行感染又可导致社区散发感染的重要病原菌[1]。金葡菌可产生大量的穿孔毒素(pore-forming toxins, PFTs)溶解细胞。γ-溶血素(γ-hemolysin)是葡萄球菌产生的一种双组分穿孔毒素,类似杀白细胞素,主要作用于人类和其他哺乳动物的血细胞等,从而在金葡菌的致病、免疫逃逸等方面发挥重要作用[2-3]。
附属调节系统(accessory gene regulator, Agr)是金葡菌中非常重要的双组分调节系统,控制着多种毒力因子的表达。RNAⅢ是金葡菌Agr群体感应调控系统的组成成分,也是Agr系统关键的效应分子[4]。在主要的毒力因子中,α-溶血素、杀白细胞素、肠毒素、脂酶都受到RNAⅢ的直接调控,而γ-溶血素是否受到RNAⅢ的调控尚不明确。
为研究RNAⅢ的敲除是否会影响γ-溶血素的表达,我们利用同源重组技术构建了Newman RNAⅢ敲除株,RT-PCR表明RNAⅢ敲除株的γ-溶血素A亚基和BC亚基转录均降低,进一步对Newman野生株及RNAⅢ敲除株培养上清的蛋白进行Western blot比较分析,发现RNAⅢ的敲除可导致γ-溶血素蛋白表达水平显著降低, 提示RNAⅢ可调控γ-溶血素蛋白的表达,也为进一步研究RNAⅢ调控γ-溶血素的表达具体机制提供了研究基础。
1 材料与方法 1.1 实验材料金葡菌RN4220为限制性内切酶缺陷菌株,可接受并修饰来自大肠埃希菌的穿梭质粒,由中国科学技术大学孙宝林教授惠赠。质粒pBT2为温度敏感型穿梭质粒,具有氨苄和氯霉素抗性。金葡菌Newman购自中国菌种保藏中心。
1.2 主要试剂和实验仪器氯霉素(chloramphenicol,Chl)和氨苄(ampicillin,Amp)、溶葡萄球菌素购自上海生工生物工程技术服务有限公司;PrimeSTAR高保真聚合酶、限制性内切酶、DNA连接酶购自TaKaRa公司;琼脂糖凝胶回收试剂盒、质粒抽提试剂盒购自Promega公司;胰蛋白胨大豆肉汤培养基(tryptone soya broth,TSB)、胰蛋白胨、酵母提取物等购自英国Oxiod公司。
1.3 实验方法 1.3.1 引物设计根据GenBank中金葡菌Newman基因组序列利用Primer Premier 5.0软件设计RNAⅢ基因上下游片段引物(引物RNAⅢ-上游-正向和RNAⅢ-上游-反向用于扩增RNAⅢ上游片段, 片段长度852 bp; RNAⅢ-下游-正向和RNAⅢ-下游-反向用于扩增下游片段,片段长度1 002 bp)。为克隆需要,分别在引物序列中引入不同的酶切位点。并依据RNAⅢ-基因上下游片段的外侧序列设计引物RNAⅢ-外侧-正向和RNAⅢ-外侧-反向,用于RNAⅢ敲除株的鉴定。根据Newman基因组中γ-溶血素基因ABC亚基序列设计实时荧光定量PCR引物,所设计的引物均交由重庆百诺合一生物科技有限公司合成。各引物具体序列详见表 1。
| 引物名称 | 序列 | 用途 |
| RNAⅢ-上游-正向 | 5′-CGGAAGCTTAGTCGATATCGTAGCTGG-3′ | 扩增RNAⅢ上游序列 |
| RNAⅢ-上游-反向 | 5′-AAACGTCGACTATGGTCGTGAGCC-3′ | |
| RNAⅢ-下游-正向 | 5′-ACGCGTCGACCAACTATTTTCCATC-3′ | 扩增RNAⅢ下游序列 |
| RNAⅢ-下游-反向 | 5′-CGCGAATTCATTCCACCTACTATCACAC-3′ | |
| RNAⅢ-外侧-正向 | 5′-GTTTTTCATTTATTAAACATTTAGCTGAAAAATATAA-3′ | 鉴定RNAⅢ是否敲除成功 |
| RNAⅢ-外侧-反向 | 5′-TGGTATTGTAAACATTAATATCATTTGAGTTAATAC-3′ | |
| γA-正向 | 5′-GCTTTCACTCCCCATTTAACACC-3′ | 检测Hemolysin γA转录水平 |
| γA-反向 | 5′-CCATCAATCGGAGGCAGTGG-3′ | |
| γB-正向 | 5′-TTGCGCTATGAAGTTTTGGC-3′ | 检测Hemolysin γBC转录水平 |
| γB-反向 | 5′-CGAGATAGCTTCCACCCAACAT-3′ | |
| 16S-正向 | 5′-CGACAACCATGCACCACCTG-3′ | 扩增内参基因16s rRNA |
| 16S-反向 | 5′-TGACGTCATCCCCACCTTCC-3′ |
1.3.2 RNAⅢ/Newman敲除株的构建
分别扩增RNAⅢ左臂同源片段及右臂同源片段,经限制性内切酶酶切后克隆插入质粒pBT2,构建基因敲除载体(pBT2∷RNAⅢ)。然后电穿孔转化限制系统缺陷型金葡菌RN4220,涂布于氯霉素平板进行筛选。将经过RN4220修饰后的阳性菌株质粒,电转化Newman感受态,置于30 ℃孵箱培养。过夜培养经酶切鉴定的阳性Newman菌株,次日以1:100比例接种于TSB氯霉素抗性培养基中,42 ℃过夜培养,过夜菌划平板于42 ℃孵箱培养。挑单菌落过夜纯培养后提取基因组,PCR扩增筛选含有整合质粒的单交换菌株,于25 ℃无抗TSB液体培养基连续诱导培养3轮,划平板于37 ℃孵箱培养。挑单菌落分别接种无抗TSB和氯霉素抗性TSB平板,37 ℃培养,挑取在无抗培养基上生长而在氯霉素抗性TSB平板上不生长的菌落于无抗TSB中培养后提取基因组,PCR及测序筛选鉴定双交换敲除株。
1.3.3 实时荧光定量PCR分别挑取Newman野生株、△RNAⅢ/Newman敲除株单菌落,接种于2 mL TSB液体培养基中,37 ℃振荡培养过夜。次日将过夜菌按1 :100比例转种2 mL新鲜TSB液体培养基,37 ℃振摇培养至对数生长期抽提细菌总RNA:将菌液离心集菌后,重悬于100 μL TE缓冲液(含3 mg/mL溶菌酶和10 μL 1 mg/mL溶葡萄球菌素),37 ℃作用0.5 h破坏细菌细胞壁,而后用1 mL Tripure试剂(Roche公司)进行细菌总RNA抽提(参照试剂说明书进行),并以DnaseⅠ(Promega公司)处理去除RNA中细菌基因组污染。而后取细菌总RNA取500 ng,用primescript RT Reagent Kit(TaKaRa公司)分别进行cDNA逆转录(参照试剂盒说明书进行)。cDNA样本经100倍稀释后取2 μL作为模板,用SYBR Premix Ex TaqTM Ⅱ (Tli RNaseH plus)试剂(TaKaRa公司)对Newman野生株及△RNAⅢ/Newman敲除株γ-溶血素A亚基、B亚基以及C亚基基因转录水平进行定量RT-PCR分析比对(所用引物详见表 1)。RT-PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 20 s,40 cycles。
1.3.4 野生株和敲除株上清蛋白SDS-PAGE分析及Wernter blot检测分别挑取Newman野生株、△RNAⅢ/Newman敲除株单菌落,接种于2 mL TSB液体培养基中,37 ℃振荡培养过夜。次日将过夜菌按1 :100比例转种2 mL新鲜TSB液体培养基,37 ℃振摇培养16 h,取1 mL菌液用TCA-丙酮蛋白浓缩法浓缩沉淀上清蛋白。蛋白样品加入上样buffer,5 min煮沸处理后,进行SDS-PAGE分析。取出电泳后的SDS-PAGE凝胶,放入转膜缓冲液中,平衡10 min。剪取适宜大小的PVDF膜,放入甲醇中浸泡1 min中后,与滤纸一起,放入转膜缓冲液中平衡10 min。将电泳槽中夹板取出打开,将海绵层,滤纸,凝胶,PVDF膜,滤纸,海绵,依次按顺序叠加好,将夹板对应好正负极放入电泳槽中,加入转膜缓冲液,15 V转膜30 min。转膜结束后,切断电源,取出PVDF膜。将PVDF膜放入封闭液中过夜封闭,而后将PVDF膜放入PBST缓冲液中,置于水平振荡器震荡洗涤5 min。按1 :2 500比例稀释一抗(用PBST稀释),室温下震荡孵育1 h,然后用PBST震荡洗PVDF膜5次,每次5 min。按1 :2 500比例稀释二抗(PBST稀释),室温孵育30 min,然后用PBST震荡洗PVDF膜5次,每次5 min。最后将显影剂与曝光液按1 :1混合,均匀铺于PVDF膜表面,放入曝光仪曝光。
2 结果 2.1 RNAⅢ同源左右臂扩增及重组质粒构建以金葡菌Newman为模板,分别扩增RNAⅢ基因同源左右臂,得到片段大小为852 bp的上游片段,1 002 bp的下游片段。分别将上下游片段先后经酶切位点克隆至pBT2中,构建敲除质粒pBT2∷ΔRNAⅢ(图 1),转化大肠杆菌经双酶切和三酶切验证正确(图 1),证实目的片段插入成功,重组质粒命名为pBT2∷ΔRNAⅢ。
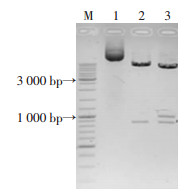
|
| M:DNA分子量标准; 1:重组质粒;2:重组质粒双酶切验证;3:重组质粒三酶切验证 图 1 pBT2∷ΔRNAⅢ重组质粒构建 |
2.2 △RNAⅢ/Newman敲除株的筛选与鉴定
将鉴定正确的pBT2∷ΔRNAⅢ质粒先后电转RN4220及Newman感受态。利用质粒温度敏感性特征进行敲除株的筛选,并对获得的阳性重组菌株进行PCR鉴定。结果显示:敲除株采用RNAⅢ-外侧-正向以及RNAⅢ-外侧-反向引物对扩增所得PCR产物约2 000 bp(图 2泳道1),较Newman野生株相应扩增产物(约2 500 bp,见图 2泳道2)短500 bp(RNAⅢ长度),提示RNAⅢ基因已从Newman基因组中成功敲除。将敲除株RNAⅢ-外侧-正向以及RNAⅢ-外侧-反向引物对PCR扩增产物送测序,测序结果证实RNAⅢ被敲掉,△RNAⅢ/Newman敲除株构建成功。
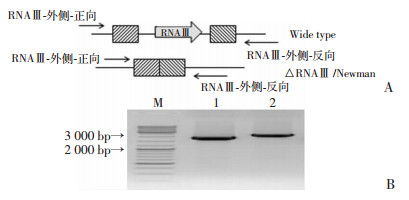
|
| A:PCR鉴定△RNAⅢ/Newman敲除株示意图;B:PCR电泳鉴定敲除株;M: DNA分子量标准;1:△RNAⅢ/Newman敲除株;2:Newman野生株 图 2 △RNAⅢ/Newman敲除株的PCR鉴定 |
2.3 △RNAⅢ/Newman敲除株γ-溶血素转录水平分析
培养Newman野生株及RNAⅢ敲除株,于对数生长期收集菌液,离心集菌后提取细菌总RNA,逆转录生成cDNA,采用实时荧光定量PCR技术对γ-溶血素亚基hlgA、hlgBC基因的转录水平进行分析。结果表明RNAⅢ敲除后,hlgA、hlgBC(hlg2)的表达均显著下调(P < 0.01,图 3),证明RNAⅢ可以正调控γ-溶血素的转录。
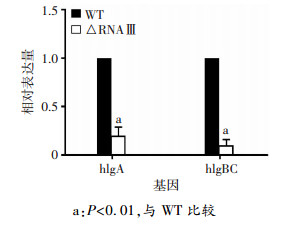
|
| a:P < 0.01,与WT比较 图 3 Newman野生株及RNAⅢ敲除株γ-溶血素基因转录水平分析 |
2.4 △RNAⅢ/Newman敲除株培养上清蛋白分析
过夜培养Newman野生株及RNAⅢ敲除株,次日按1 :100转种新鲜培养基,16 h后回收菌液,离心收集培养上清,TCA法沉淀上清蛋白,而后经12% SDS-PAGE电泳,考马斯亮蓝染色。结果显示:与Newman野生株相比,RNAⅢ的敲除可导致多种蛋白表达量明显降低, 也可导致部分蛋白表达量上升(图 4)。为进一步明确RNAⅢ对γ-溶血素的表达调控作用,将γ-溶血素免疫兔子制备hlgC多克隆抗体。Werstern blot检测RNAⅢ敲除株γ-溶血素的表达水平。Werstern blot结果显示,相对于野生株,RNAⅢ敲除株γ-溶血素蛋白表达水平(32×103处条带)明显下调(图 4),和转录水平的结果一致。
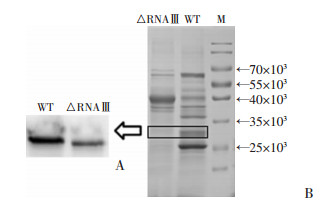
|
| M:蛋白分子量标准;WT:Newman野生株;△RNAⅢ:△RNAⅢ/Newman敲除株;A:Werstern blot检测结果;B:1 mL上清蛋白的SDS-PAGE电泳结果 图 4 Newman野生株及RNAⅢ敲除株蛋白表达分析 |
3 讨论
金葡菌可以分泌多种β桶状结构的毒素,包括α-溶血素(α-HL),γ-溶血素(γ-HL), 杀白细胞素(LUK)以及PVL来裂解细胞。其中,γ-溶血素基因座(hlg)含有3个开放阅读框,包含3个基因(hlgA、hlgC、hlgB)。hlgA由1个开放读码框组成;hlgC、hlgB为共转录基因(hlg2),因此γ-溶血素由两种组合方式(A+B,C+B)[5], 其中hlgB(F组分)绑定目标细胞的磷脂酰胆碱,S组分绑定到宿主细胞膜,导致细胞裂解[6-7]。当γ-溶血素的每种水溶性组分低聚合成后,由4种F组分和4种S组分交替排列形成预孔结合至细胞表面,成熟的异源八聚体形成跨膜β-桶孔后穿过质膜导致宿主细胞裂解[8]。临床分离的菌株99%会产生γ-溶血素[9]。γ-溶血素主要是通过破坏红细胞,有助于发挥免疫逃逸功能。有研究表明老鼠感染野生型金黄色葡萄球菌后,相对于hlg敲除株, 小鼠炎症巨噬细胞CCR2的比例明显下降。在人血液中培养USA300, 发现hlgA、hlgB、hlgC基因的转录水平显著升高。进一步敲除hlg后小鼠菌血症模型的存活率升高[10-11]。
以往的研究表明Sae二元调控系统参与了γ-溶血素的表达调控[12]。本实验结果也提示Agr系统的效应分子RNAⅢ可以调控γ-溶血素的表达。Agr系统是金葡菌中重要的二元调控系统,控制100多种毒力基因的表达。包括两个相反的转录单元RNAⅡ和RNAⅢ,分别由P2和P3启动子转录。其中Agr直接和PSM的启动子结合,激活PSM毒素基因的合成[13]。RNAⅢ是Agr的关键效应分子。在转录和翻译水平调控许多毒素、酶以及表面蛋白的表达。在金葡菌高表达的毒力因子中,α-溶素、杀白细胞素、肠毒素、脂酶都受到RNAⅢ的直接调控,而γ-溶素是否受到RNAⅢ的调控尚不明确。
我们采用基因重组的方法对金葡菌Newman的RNAⅢ基因进行敲除,并检测了其对金葡菌γ溶血素表达调控的影响。结果显示,RNAⅢ对金葡菌γ-溶血素的表达具有正调控作用。虽然RNAⅢ对γ-溶血素调控的具体机制不清楚,但RNAⅢ作为效应分子,可通过直接的碱基配对方式正调控或负调控多种毒力因子的表达。如RNAⅢ可通过3′-端茎环结构与多个靶mRNAs核糖体结合位点的结合从而阻止翻译的开始。通过这种机制,RNAⅢ抑制主要表面蛋白的合成,例如蛋白A、凝固酶、SBI和纤维蛋白原结合蛋白(SA1000)[14-15];亦可通过其5′-端茎环结构与靶基因mRNA的结合促进其表达,如RNAⅢ 5′-端茎环结构与α-溶血素mRNA的结合促进α-溶血素表达[14]。除此之外,RNAⅢ也可通过同样的机制,抑制Rot/mgrA基因的翻译、编码,间接激活许多外毒素的转录[16]。γ-溶血素也属于β桶状结构的毒素,因此,我们推测RNAⅢ对γ-溶血素基因的表达调控极有可能是通过与hlgA、hlgBC亚基的一个或多个mRNA配对结合的方式激活γ-溶血素的转录来发挥作用的。当然,这样的推测还尚需要后续的实验研究予以验证。
深入研究RNAⅢ对γ-溶血素地具体调控机制既能够促进人们对γ-溶血素在金葡菌致病中重要作用的认识,又有可能阐明一种新的受RNAⅢ调控的金葡菌的毒力因子,有望为临床致病性金葡菌感染的防治提供新的思路及候选靶标。本研究通过成功构建金葡菌Newman RNAⅢ敲除株,观察到敲除株产生的上清蛋白数量及表达量显著降低,转录水平及翻译水平观察到RNAⅢ敲除株中γ-溶血素显著降低。本研究构建的敲除株与初步验证的结论为进一步深入研究RNAⅢ调控γ-溶血素的具体分子机制奠定了基础。
| [1] |
KONG E F, JOHNSON J K, JABRA-RIZK M A. Community- associated methicillin-resistant Staphylococcus aureus: an enemy amidst us[J]. PLoS Pathog, 2016, 12(10): e1005837. DOI:10.1371/journal.ppat.1005837 |
| [2] |
YAMASHITA K, KAWAI, TANAKA Y, et al. Crystal structure of the octameric pore of staphylococcal γ-hemolysin reveals the β-barrel pore formation mechanism by two components[J]. Proc Natl Acad Sci USA, 2011, 108(42): 17314-17319. DOI:10.1073/pnas.1110402108 |
| [3] |
ZIMMERMANN-MEISSE G, PRÉVOST G, JOVER E. Above and beyond C5a receptor targeting by staphylococcal leucotoxins: retrograde transport of panton-valentine leucocidin and γ-hemolysin[J]. Toxins (Basel), 2017, 9(1): E41. DOI:10.3390/toxins9010041 |
| [4] |
BRONESKY D, WU Z F, MARZI S, et al. Staphylococcus aureus RNAⅢ and its regulon link quorum sensing, stress responses, metabolic adaptation, and regulation of virulence gene expression[J]. Annu Rev Microbiol, 2016, 70: 299-316. DOI:10.1146/annurev-micro-102215-095708 |
| [5] |
OLIVEIRA D, BORGES A, SIMÕES M. Staphylococcus aureus toxins and their molecular activity in infectious diseases[J]. Toxins (Basel), 2018, 10(6): E252. DOI:10.3390/toxins10060252 |
| [6] |
TOMITA N, ABE K, KAMIO Y, et al. Cluster-forming property correlated with hemolytic activity by staphylococcal γ-hemolysin transmembrane pores[J]. FEBS Lett, 2011, 585(21): 3452-3456. DOI:10.1016/j.febslet.2011.09.041 |
| [7] |
DUMONT A L, YOONG P, DAY C J, et al. Staphylococcus aureus LukAB cytotoxin kills human neutrophils by targeting the CD11b subunit of the integrin Mac-1[J]. Proc Natl Acad Sci USA, 2013, 110(26): 10794-10799. DOI:10.1073/pnas.1305121110 |
| [8] |
SPAAN A N, HENRY T, VAN ROOIJEN W J M, et al. The staphylococcal toxin panton-valentine leukocidin targets human C5a receptors[J]. Cell Host Microbe, 2013, 13(5): 584-594. DOI:10.1016/j.chom.2013.04.006 |
| [9] |
PREVOST G, COUPPIE P, PREVOST P, et al. Epidemiological data on Staphylococcus aureus strains producing synergohymenotropic toxins[J]. J Med Microbiol, 1995, 42(4): 237-245. DOI:10.1099/00222615-42-4-237 |
| [10] |
SPAAN A N, VRIELING M, WALLET P, et al. The staphylococcal toxins γ-haemolysin AB and CB differentially target phagocytes by employing specific chemokine receptors[J]. Nat Commun, 2014, 5: 5438. DOI:10.1038/ncomms6438 |
| [11] |
MALACHOWA N, WHITNEY A R, KOBAYASHI S D, et al. Global changes in Staphylococcus aureus gene expression in human blood[J]. PLoS ONE, 2011, 6(4): e18617. DOI:10.1371/journal.pone.0018617 |
| [12] |
YAMAZAKI K, KATO F, KAMIO Y, et al. Expression of gamma-hemolysin regulated by sae in Staphylococcus aureus strain Smith 5R[J]. FEMS Microbiol Lett, 2006, 259(2): 174-180. DOI:10.1111/j.1574-6968.2006.00236.x |
| [13] |
XU T, WANG X Y, CUI P, et al. The agr quorum sensing system represses persister formation through regulation of phenol soluble modulins in Staphylococcus aureus[J]. Front Microbiol, 2017, 8: 2189. DOI:10.3389/fmicb.2017.02189 |
| [14] |
VANDERPOOL C K, BALASUBRAMANIAN D, LLOYD C R. Dual-function RNA regulators in Bacteria[J]. Biochimie, 2011, 93(11): 1943-1949. DOI:10.1016/j.biochi.2011.07.016 |
| [15] |
LIU Y, MU C H, YING X M, et al. RNAⅢ activates map expression by forming an RNA-RNA complex in Staphylococcus aureus[J]. FEBS Lett, 2011, 585(6): 899-905. DOI:10.1016/j.febslet.2011.02.021 |
| [16] |
GUPTA R K, LUONG T T, LEE C Y. RNAⅢ of the Staphylococcus aureus agr system activates global regulator MgrA by stabilizing mRNA[J]. Proc Natl Acad Sci USA, 2015, 112(45): 14036-14041. DOI:10.1073/pnas.1509251112 |



