2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院全军肝胆外科研究所
2. Institute of Hepatobiliary Surgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肝细胞肝癌(hepatocellular carcinoma,HCC)是一种常见的消化道恶性肿瘤,其死亡率高居恶性肿瘤第3位[1]。我国每年死于肝癌的人数约38.3万,占全球肝癌死亡人数的51%[2],严重威胁我国人民健康。近几十年来,尽管HCC在手术治疗、放化疗以及分子靶向治疗等方面取得了很大进展,但由于高侵袭性、高转移性及高复发等特性,HCC患者预后差的现状仍未发生根本改变[3]。因此,探讨肝癌侵袭转移的机制,寻找有效的诊断分子标志物和治疗靶点成为目前HCC研究的重要方向。
长链非编码RNA (lncRNA)是转录本长度大于200个核苷酸而不具备蛋白质编码功能的RNA分子[4],其可以RNA的形式参与X染色体沉默、基因组印记、染色质修饰、转录干扰、转录激活和核内运输等多种生物学活动[5]。研究表明,lncRNA在肿瘤侵袭转移中发挥重要的调控作用[6],如ATB[7]、HOTAIR[8]和MVIH[9]可促进HCC的侵袭转移,而H19[10]可抑制HCC的侵袭转移。本研究前期通过生物信息学分析,筛选到1条可能对肝癌发生、发展起重要作用的lncRNA LINC02163(Ensembl ID: ENSG00000251026)。DONG等[11]研究指出,LINC02163在胃癌中发挥致癌基因的作用。但是,LINC02163在肝癌中的表达及其作用国内外尚少见相关报道。因此,本研究旨在探讨LINC02163在肝癌组织及细胞系中的表达情况,分析其与临床病理参数之间的关系,及其对肝癌细胞迁移、侵袭能力的影响。
1 材料与方法 1.1 材料与试剂 1.1.1 细胞系人肝癌细胞系HuH-7、HCCLM3、MHCC-97H、SNU-182、SMMC-7721以及人正常肝细胞系L02均购自中国科学院上海生命科学研究院干细胞库。
1.1.2 组织标本收集2017年10月至2019年5月陆军军医大学第一附属医院HCC患者手术切除标本60例。其中男性49例,女性11例;年龄24~74岁,中位年龄53岁。入选标准:患者术前未进行放化疗、射频消融治疗,术后标本经病理组织学检查证实为HCC。排除标准:其他类型肝肿瘤。临床病理参数包括:患者的性别、年龄、肝硬化、AFP表达水平、肿瘤直径、数目、病理分级、TNM分期和微血管侵犯(MVI)情况。对照组标本来自于同一患者的癌旁组织,距离手术切缘至少2 cm,且术后病理检查未发现癌细胞。所收集的新鲜标本于离体30 min内收集,立即冷冻于液氮中,并放置于-80 ℃超低温冰箱中保存。本研究经陆军军医大学伦理委员会批准实施,标本检测在所有研究对象签署知情同意书后进行。
1.1.3 试剂RPMI1640培养基、DMEM培养基购自Gibco公司,胎牛血清(FBS)购自杭州四季青生物有限技术公司,0.25%胰酶购自HyClone公司,TRIzol、LipofectamineTM 2000转染试剂购自Invitrogen公司,逆转录试剂盒、荧光定量试剂盒均购自TaKaRa公司,Matrigel基质胶购自Corning公司,结晶紫溶液购自碧云天公司,siRNA购自上海吉玛公司,引物由上海生工公司合成。
1.2 方法 1.2.1 细胞培养肝癌细胞系HuH-7、HCCLM3、MHCC-97H及正常肝细胞系L02复苏后置于含10%胎牛血清的DMEM培养基,SMMC-7721、SNU-182置于含10%胎牛血清的RPMI1640培养基,在37 ℃、5%CO2培养箱中培养,细胞贴壁生长,隔天换液,3~5 d胰酶消化传代。
1.2.2 细胞转染取对数生长期肝癌细胞,用0.25%胰酶消化,调整细胞至一定浓度,接种于6孔板。待其密度为50%~70%时用5 μL LipofectamineTM 2000分别转染5 μL LINC02163 siRNA-18(si-18)和5 μL LINC02163 siRNA-151(si-151)至干扰组肝癌细胞中。si-18序列正义链:5′-GCAGAAACGUGUUGUAUUUTT-3′;反义链:5′-AAAUACAACACGUUUCUGCTT-3′。si-151序列正义链:5′-GCAACCAGUAGCAAAUUAUTT-3′;反义链:5′-AUAAUUUGCUACUGGUUGCTT-3′。阴性对照组加入与实验组等量的LipofectamineTM 2000和siRNA-NC(si-NC)。si-NC序列正义链:5′-UUCUCCGAACGUGUCACGUTT-3′;反义链:5′-ACGUGACACGUUCGGAGAATT-3′。将细胞分为3组,分别是干扰组(si-18)、干扰组(si-151)及阴性对照组(si-NC)。转染后培养箱中常规培养,6 h后换成含双抗培养基,48 h后收集3组细胞进行qRT-PCR检测转染效率等后续实验。
1.2.3 组织和细胞总RNA提取采用TRIzol法提取RNA的具体步骤为:从液氮中取出肝癌组织,用无RNA酶的刀片切下50 mg左右标本,加1 mL TRIzol,用组织研磨仪破碎,加入200 μL氯仿,颠倒混匀,冰上放置15 min后,4 ℃下12 000 r/min离心15 min,取400 μL上清液至无RNA酶的EP管中,加400 μL异丙醇沉淀,然后加入适量DEPC水溶解。细胞总RNA的提取参考文献[12]报道的方法。对获得的总RNA采用分光光度仪检测浓度和纯度,并检查总RNA完整性。
1.2.4 逆转录和实时荧光定量PCR取1 μg总RNA按TaKaRa公司的逆转录试剂盒说明书进行逆转录反应得到cDNA,-20 ℃保存。以cDNA为模板进行qRT-PCR合成扩增目的基因,以β-actin作为内参基因。反应体系25 μL,包括cDNA模板1 μL,上下游引物各1 μL,TB Green Premix Ex Taq Ⅱ 12.5 μL,DEPC水9.5 μL。反应条件为95 ℃预变性30 s; 95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环。LINC02163上游引物:5′-TGATGCTGTTGTGTCCAGAATTG-3′;LINC02163下游引物:5′-CACTAGGGTCCGCAGCTTTA-3′;β-actin上游引物:5′-CCACGAAACTACCTTCAACTCC-3′;β-actin下游引物:5′-GTGATCTCCTTCTGCATCCTGT-3′。采用相对定量法,测定目的基因、内参基因的PCR产物的Ct值,代入公式(即ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组),以2-ΔΔCt计算LINC02163的相对表达量。所有反应设3个复孔,实验重复3次。
1.2.5 Transwell小室细胞侵袭实验实验分组同细胞转染实验。将Matrigel基质胶与预冷的无血清培养基按1 :8比例稀释。取60 μL稀释的基质胶均匀铺于Transwell上室内,于37 ℃培养箱中放置60 min。取3组细胞,加入胰酶消化,无血清的培养基制成8× 105/mL的细胞悬液,每个Transwell上室中加入100 μL细胞悬液,下室内加入550 μL含10%胎牛血清的培养基(注意避免气泡产生)。培养24 h后取出Transwell上室,用棉签擦去上室内部未穿过PC膜的细胞。无水甲醇固定30 min,0.1%结晶紫溶液染色15 min。倒置显微镜下(×200)随机选取5个视野拍照,计数染色的穿膜细胞数。每组细胞设3个复孔,实验重复3次。
1.2.6 Transwell小室细胞迁移实验将Matrigel基质胶包被的小室换成不含基质胶的小室,其余步骤同侵袭实验。
1.3 统计学分析应用SPSS 20.0统计软件进行数据分析。计量资料若服从正态分布,两组间比较采用t检验;若非正态分布,配对样本采用Wilcoxon符号秩检验,两独立样本采用Mann-Whitney U检验。计数资料比较采用χ2检验。检验水准:α=0.05。
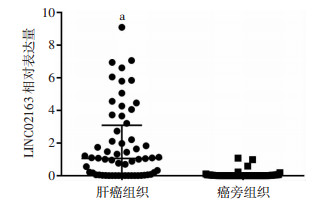
2 结果 2.1 LINC02163在肝癌组织中的表达经qRT-PCR检测肝癌以及其配对癌旁组织标本中LINC02163的表达,结果表明:与配对癌旁组织相比,LINC02163在肝癌组织中的表达明显升高,差异有统计学意义(P < 0.001,图 1)。
|
| a:P < 0.001,与癌旁组织比较 图 1 LINC02163在肝癌组织与癌旁组织中表达的比较 |
2.2 LINC02163的表达与HCC患者临床病理参数之间的关系
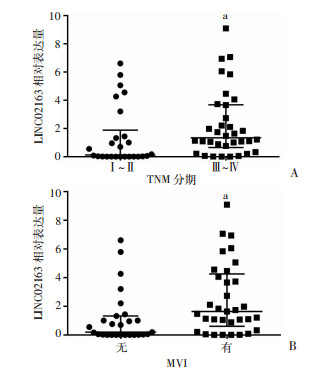
为了验证LINC02163在肝癌发生、发展过程中的作用,进一步分析LINC02163与肝癌临床病理参数之间的关系。将纳入研究的60例病例按照HCC组织的LINC02163相对表达量依次排序,并按中位数方法分为高表达组及低表达组各30例。用χ2检验分别验证两组间临床一般情况及病理参数差异有无统计学意义。结果显示,LINC02163的表达水平与性别、年龄、肝硬化、AFP表达水平、肿瘤直径、数目、病理分级等无明显相关性,而与肿瘤TNM分期和微血管侵犯(MVI)有显著的关联(P < 0.01,表 1)。相比临床早期或无微血管侵犯的患者,LINC02163的表达在临床晚期(Ⅲ~Ⅳ期)或有微血管侵犯患者中明显升高(P < 0.01,图 2)。
| 参数 | 总例数 | LINC02163表达 | χ2值 | P值 | |
| 低(n=30) | 高(n=30) | ||||
| 年龄/岁 | 0.077 | 0.781 | |||
| >55 | 19 | 9 | 10 | ||
| ≤55 | 41 | 21 | 20 | ||
| 性别 | 0.111 | 0.739 | |||
| 男性 | 49 | 24 | 25 | ||
| 女性 | 11 | 6 | 5 | ||
| 肝硬化 | 1.200 | 0.273 | |||
| 有 | 40 | 18 | 22 | ||
| 无 | 20 | 12 | 8 | ||
| APF/ng·mL-1 | 0.071 | 0.791 | |||
| >20 | 37 | 19 | 18 | ||
| ≤20 | 23 | 11 | 12 | ||
| 肿瘤直径/cm | 0.271 | 0.602 | |||
| >5 | 26 | 12 | 14 | ||
| ≤5 | 34 | 18 | 16 | ||
| 肿瘤数目 | 0.373 | 0.542 | |||
| 单发 | 46 | 24 | 22 | ||
| 多发 | 14 | 6 | 8 | ||
| 病理分级 | 3.354 | 0.067 | |||
| 高/中分化 | 46 | 26 | 20 | ||
| 低分化 | 14 | 4 | 10 | ||
| TNM分期 | 6.787 | 0.009 | |||
| Ⅰ~Ⅱ期 | 26 | 18 | 8 | ||
| Ⅲ~Ⅳ期 | 34 | 12 | 22 | ||
| 微血管侵犯(MVI) | 11.38 | 0.001 | |||
| 有 | 33 | 10 | 23 | ||
| 无 | 27 | 20 | 7 | ||
|
| A:TNM分期 a:P < 0.01,与TNMⅠ~Ⅱ比较;B:MVI a:P < 0.01,与无微血管侵犯比较 图 2 肝癌组织中LINC02163表达与TNM分期及MVI之间关联分析 |
2.3 LINC02163在肝癌细胞系中的表达
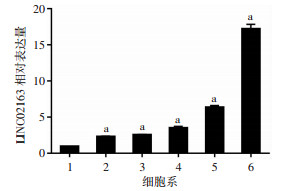
采用qRT-PCR检测了LINC02163在肝癌细胞系及人正常肝细胞系L02中的表达情况,结果显示,与L02相比,LINC02163在HuH-7、HCCLM3、MHCC-97H、SNU-182和SMMC-7721细胞系的表达量均上调;在HuH-7和HCCLM3细胞系中相对高表达,而在SMMC-7721细胞系中相对低表达(P < 0.001,图 3)。基于以上结果,我们选择HuH-7、HCCLM3细胞系为后续敲低实验研究对象,继而研究LINC02163对肝癌细胞系生物学功能的影响。
|
| 1:L02;2:SMMC-7721;3:SNU-182;4:MHCC-97H;5:HCCLM3;6:HuH-7 a: P < 0.001,与L02比较 图 3 LINC02163在肝癌细胞系中的表达 |
2.4 用RNA干扰技术可抑制LINC02163在肝癌细胞中的表达
将si-18、si-151、si-NC分别转染HuH-7、HCCLM3细胞系干扰LINC02163的表达48 h后,用qRT-PCR检测干扰效率。结果显示,与转染了si-NC的对照组相比,转染了si-18、si-151的实验组细胞HuH-7、HCCLM3中LINC02163的相对表达量明显低于si-NC对照组(P < 0.01,图 4),提示抑制表达成功,该两条siRNA可用于后续实验对LINC02163的敲低。

|
| A:HuH-7;B:HCCLM3 a: P < 0.01,与NC组比较 图 4 siRNA转染48 h后qRT-PCR检测HuH-7、HCCLM3细胞中LINC02163的表达 |
2.5 敲低LINC02163表达对肝癌细胞迁移的影响
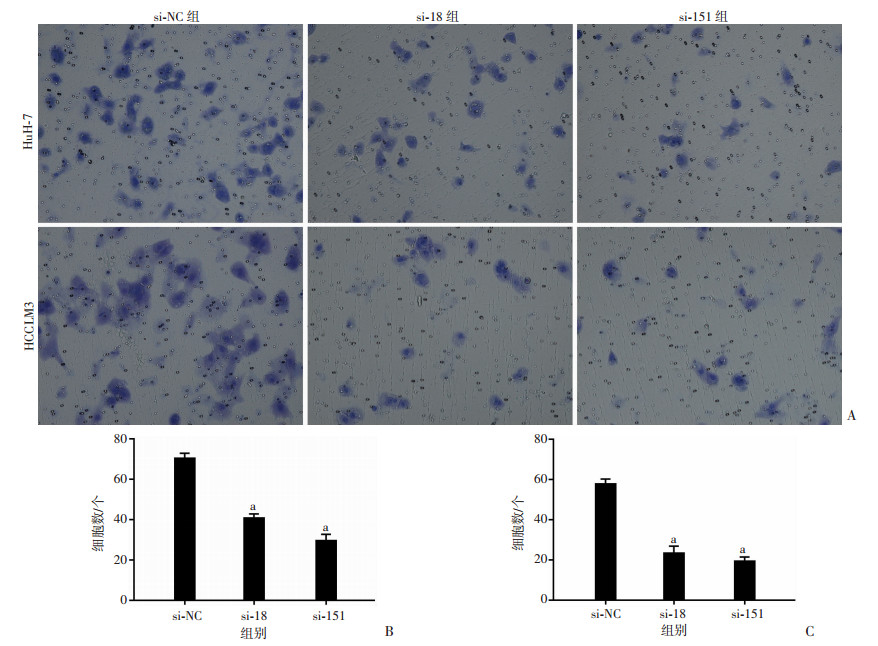
利用Transwell迁移实验检测敲低LINC02163表达对HuH-7、HCCLM3细胞迁移能力的影响,在无基质胶的条件下,观察敲低LINC02163表达的实验组与对照组穿过小室细胞的数量。该实验结果显示,HuH-7与HCCLM3实验组迁移细胞数明显少于对照组,差异有统计学意义(P < 0.01,图 5),表明敲低LINC02163表达可以显著抑制肝癌细胞的迁移能力。
|
| A:Transwell迁移实验检测结果(结晶紫×200);B: HuH-7细胞迁移细胞数;C: HCCLM3细胞迁移细胞数 a: P < 0.01,与si-NC比较 图 5 敲低LINC02163表达对肝癌细胞迁移的影响 |
2.6 敲低LINC02163表达对肝癌细胞侵袭的影响
利用Transwell侵袭实验检测敲低LINC02163表达对HuH-7、HCCLM3细胞侵袭能力的影响,在有基质胶的条件下,观察敲低LINC02163表达的实验组与对照组穿过小室细胞的数量。该实验结果显示,HuH-7与HCCLM3实验组侵袭细胞数明显少于对照组,差异有统计学意义(P < 0.01,图 6),表明敲低LINC02163表达可以显著抑制肝癌细胞的侵袭能力。
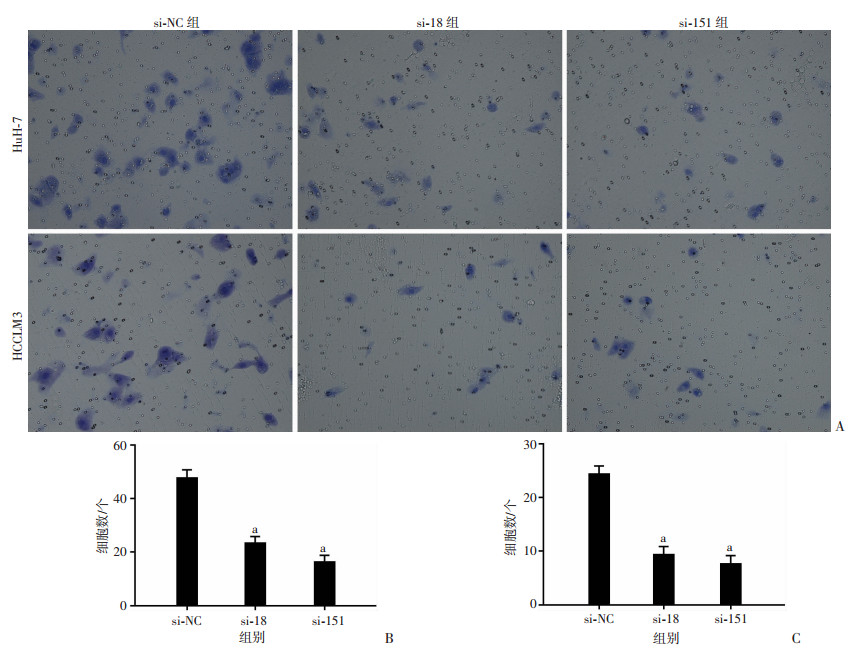
|
| A:Transwell侵袭实验检测结果(结晶紫×200);B: HuH-7细胞侵袭细胞数;C: HCCLM3细胞侵袭细胞数 a: P < 0.01,与si-NC比较 图 6 敲低LINC02163表达对肝癌细胞侵袭的影响 |
3 讨论
由于HCC发病隐匿,大多数患者被诊断时因已经浸润并发生远处转移而失去根治性手术机会,此外肝癌细胞侵袭转移能力强是导致HCC手术治疗失败和复发的重要原因[11-13]。因此,研究HCC细胞侵袭转移的分子机制,对寻找新的阻断治疗靶点以降低HCC细胞转移风险具有重要意义。LncRNA因其缺乏完整的开放阅读框,不参与蛋白质编码功能,曾被认为是基因组转录过程中产生的“噪音”和“垃圾”而不受人们重视[14]。近年越来越多的研究表明,lncRNA虽然不能编码蛋白质,但其广泛参与机体的生理与病理过程,在表观遗传水平、转录和转录后水平调控基因的表达。在肝癌的侵袭转移过程中lncRNA发挥着至关重要的作用。HOTAIR能够通过抑制RNA结合区域蛋白38 (RBM38)的表达促进肝癌细胞的迁移和侵袭[15]。MVIH可以通过下调磷酸甘油酸激酶1(PGK1)诱导血管生成,从而促进肝癌细胞转移[9]。ATB通过与miR-200家族竞争性结合上调ZEB1和ZEB2蛋白的表达,从而诱导上皮-间质转化(EMT)和肝癌侵袭[7]。H19能够通过增加组蛋白乙酰化激活miR-200家族,从而促进间质-上皮转化(MET),抑制肝癌细胞的迁移和侵袭[10]。
LINC02163是一个新近发现的基因间lncRNA分子,位于人类染色体5q21.2区域,全长316 bp,包含3个外显子。DONG等[11]研究发现LINC02163在胃癌中呈高表达,且与胃癌患者的不良预后相关。而且在体外试验中发现,下调LINC02163表达后,胃癌细胞的增殖、侵袭能力减弱。在裸鼠体内试验中,LINC02163低表达的胃癌细胞在裸鼠皮下成瘤质量显著减小,肺转移瘤数量也显著减少。进一步研究其机制发现LINC02163通过miR-593-3p/FOXK1信号轴介导了胃癌细胞的生长和转移。基于TCGA数据库分析,LINC02163在肝癌组织中亦高表达,这提示我们去探究LINC02163在临床肝癌样本和细胞系中的表达水平及其具体作用。
本研究采用qRT-PCR检测LINC02163在60例HCC组织和配对癌旁组织中的差异表达,以及5种肝癌细胞系与正常肝细胞系中的差异表达。发现与癌旁组织和正常肝细胞相比,LINC02163在肝癌组织和细胞中表达均明显升高(P < 0.001),在肝癌细胞系HuH-7和HCCLM3中的上调幅度明显,该结果提示LINC02163与肝癌发生、发展相关,可能参与了肝癌的癌变过程。进一步分析LINC02163的表达与HCC患者临床病理参数间的关系后发现,其表达水平与TNM分期、是否微血管侵犯(MVI)有关(P < 0.01),但与性别、年龄、肝硬化、AFP表达水平、肿瘤直径、数目、肝癌的分化程度等无关,高LINC02163表达患者可能有较高的TNM分期、较大的微血管侵犯(MVI)概率。已有研究[16]表明,MVI是肝癌患者术后复发及转移的高危因素。上述结果提示,LINC02163与肝癌进展密切相关,很可能参与了肝癌的侵袭转移过程。
为了进一步验证LINC02163是否参与调节肝癌细胞的迁移及侵袭过程,在体外实验中本研究选择LINC02163相对较高表达细胞系HuH-7及HCCLM3作为研究模型。我们应用siRNA技术特异性下调LINC02163表达,观察其对这两种肝癌细胞生物学功能的影响。Transwell实验结果显示,下调LINC02163表达能显著抑制HuH-7及HCCLM3细胞的体外迁移、侵袭能力(P < 0.01)。以上结果说明,在HCC中LINC02163具有调控肝癌迁移和侵袭能力,可能是一种促进肝癌侵袭转移的致癌基因,这种作用与以往LINC02163在胃癌中的研究结果相一致[11]。
综上,本研究证实LINC02163在HCC中高表达,并且与HCC的TNM分期、MVI密切相关,可能通过促进肝癌侵袭转移发挥致癌基因的作用。这表明LINC02163可能成为肝癌诊断的生物标志物和肝癌防治的新靶点。因此,在下一步的实验中我们将通过裸鼠体内实验验证这一结果,并探究LINC02163发挥促癌作用的具体信号通路,以期为阐明肝癌的分子机制及发现新的诊治方法奠定一定的理论基础。
| [1] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
WANG F S, FAN J G, ZHANG Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014, 2099-2108. DOI:10.1002/hep.27406 |
| [3] |
FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-1314. DOI:10.1016/S0140-6736(18)30010-2 |
| [4] |
SHIH J W, KUNG H J. Long non-coding RNA and tumor hypoxia: new players ushered toward an old arena[J]. J Biomed Sci, 2017, 24(1): 53. DOI:10.1186/s12929-017-0358-4 |
| [5] |
SHI X, SUN M, LIU H, et al. Long non-coding RNAs: a new frontier in the study of human diseases[J]. Cancer Lett, 2013, 339(2): 159-166. DOI:10.1016/j.canlet.2013.06.013 |
| [6] |
WEIDLE U H, BIRZELE F, KOLLMORGEN G, et al. Long non-coding RNAs and their role in metastasis[J]. Cancer Genom Proteom, 2017, 14(3): 143-160. DOI:10.21873/cgp.20027 |
| [7] |
YUAN J H, YANG F, WANG F, et al. A long noncoding RNA activated by TGF-beta promotes the invasion-metastasis cascade in hepatocellular carcinoma[J]. Cancer Cell, 2014, 25(5): 666-681. DOI:10.1016/j.ccr.2014.03.010 |
| [8] |
YANG T, HE X, CHEN A, et al. LncRNA HOTAIR contributes to the malignancy of hepatocellular carcinoma by enhancing epithelial-mesenchymal transition via sponging miR-23b-3p from ZEB1[J]. Gene, 2018, 670: 114-122. DOI:10.1016/j.gene.2018.05.061 |
| [9] |
YUAN S X, YANG F, YANG Y, et al. Long noncoding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients' poor recurrence-free survival after hepatectomy[J]. Hepatology, 2012, 56(6): 2231-2241. DOI:10.1002/hep.25895 |
| [10] |
ZHANG L, YANG F, YUAN J H, et al. Epigenetic activation of the MiR-200 family contributes to H19-mediated metastasis suppression in hepatocellular carcinoma[J]. Carcinogenesis, 2013, 34(3): 577-586. DOI:10.1093/carcin/bgs381 |
| [11] |
DONG L, HONG H, CHEN X, et al. LINC02163 regulates growth and epithelial-to-mesenchymal transition phenotype via miR-593-3p/FOXK1 axis in gastric cancer cells[J]. Artif Cells Nanomed Biotechnol, 2018, 46(sup2): 607-615. DOI:10.1080/21691401.2018.1464462 |
| [12] |
周征宇, 向颖, 袁帅, 等. 长链非编码RNA LINC00324对非小细胞肺癌细胞生物学功能的影响[J]. 第三军医大学学报, 2019, 41(4): 331-338. ZHOU Z Y, XIANG Y, YUAN S, et al. Effect of long non- coding RNA LINC00324 on biological functions of non-small cell lung cancer cells[J]. J Third Mil Med Univ, 2019, 41(4): 331-338. DOI:10.16016/j.1000-5404.201811031 |
| [13] |
OU H, LIU X, XIANG L, et al. NVM-1 predicts prognosis and contributes to growth and metastasis in hepatocellular carcinoma[J]. Am J Cancer Res, 2017, 7(3): 554-564. |
| [14] |
WANG T H, CHAN C W, FANG J Y, et al. 2-O-Methyl-magnolol upregulates the long non-coding RNA, GAS5, and enhances apoptosis in skin cancer cells[J]. Cell Death Dis, 2017, 8(3): e2638. DOI:10.1038/cddis.2017.66 |
| [15] |
DING C, CHENG S, YANG Z, et al. Long non-coding RNA HOTAIR promotes cell migration and invasion via down-regulation of RNA binding motif protein 38 in hepatocellular carcinoma cells[J]. Int J Mol Sci, 2014, 15(3): 4060-4076. DOI:10.3390/ijms15034060 |
| [16] |
刘驰, 杨启, 秦长岭. 微血管侵犯对早期肝癌肝切除术切缘选择及患者预后的影响[J]. 肝胆外科杂志, 2017, 25(5): 353-357. LIU C, YANG Q, QIN C L. The effect of microvascular invasion on the choice of resection margin of hepatectomy for early stage cancer and the prognosis ofpatients[J]. J Hepatobil Surg, 2017, 25(5): 353-357. DOI:10.3969/j.issn.1006-4761.2017.05.012 |



