细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)等炎症介质导致的炎症反应在糖尿病肾病(diabetic nephropathy,DN)发病过程中起到重要作用[1-3]。血栓调节蛋白(thrombomodulin,TM)是一种跨膜糖蛋白,主要存在于血管内皮细胞表面,TM具有抗炎作用[4],DN患者外周血可溶性TM表达下降并与肾损伤相关[5-6],提示上调TM表达有助于改善DN病变。维生素D受体等具有上调TM表达并下调炎症反应的作用[7],其虽可下调炎症反应,但并不能延缓DN进展[7]。肝X受体(liver X receptor,LXR)表现为典型的核受体结构, 包括LXRα和LXRβ, T0901317是其人工合成的配体[8-9]。我们前期细胞实验结果显示:T0901317激活的LXRα通过抑制NF-κB活性而提高TM表达,并抑制高糖条件下肾小球内皮细胞炎症介质的分泌[10];进一步针对db/db小鼠的Western blot实验结果显示:T0901317上调DN小鼠肾组织TM蛋白表达。本研究拟明确T0901317是否通过活化LXRα而减轻db/db小鼠肾损伤。以期为临床DN的发病机制和治疗提供实验依据。
1 材料与方法 1.1 实验动物和主要试剂材料8周龄雄性db/db小鼠购于南京君科生物有限责任公司,与8周龄雄性C57BL/6小鼠均饲养于四川省人民医院实验动物中心(SPF级),于20~24 ℃、12 h光暗周期并且自由进食。兔抗小鼠VCAM-1单克隆抗体(货号:sc-8304)、兔抗小鼠ICAM-1单克隆抗体(货号:sc-8439)、羊抗小鼠LXRα多克隆抗体(货号:sc-1202)和大鼠抗小鼠LXRβ单克隆抗体(货号:sc-133221)均购于美国Santa Cruz Biotechnology公司,T0901317购于美国Sigma公司,重组腺病毒Ad-TMshRNA和重组腺病毒空载体Ad-ctrlshRNA(简称Ad-ctrl)由成都帝肯科技有限公司合成并验证。
1.2 实验动物分组12周龄雄性db/db小鼠36只,应用随机数字表法进行完全随机化的分组,分为6组:生理盐水组(DN)、Ad-ctrl+DN组、Ad-TMshRNA+DN组、T0901317+DN组、Ad-TMshRNA+T0901317+DN组和Ad-ctrl+T0901317+DN组。根据前期实验,本研究选择出现了显著DN特征的12周龄雄性db/db鼠为实验对象,Ad-TM shRNA选择可明显降低肾组织TM表达的剂量为2.5×109 pfu,T0901317选择可显著提高肾组织TM表达的剂量为0.5 mg/(kg·d)。2.5×109 pfu Ad-TMshRNA和Ad-ctrl分别通过尾静脉注射到对应组的小鼠体内,1周后T0901317按剂量0.5 mg/(kg·d)灌胃对应组的小鼠且连续给药7 d,末次给药后4周以安乐死处死小鼠后收集肾组织样本,同周龄雄性野生C57BL/6小鼠给予生理盐水胃饲做正常对照组(Ctrl)。
1.3 Western blot检测肾组织LXRα、LXRβ、VCAM-1和ICAM-1表达提取各分组小鼠肾组织总蛋白,检测总蛋白浓度后, 取50 μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,将凝胶中蛋白质转移至聚偏二氟乙烯膜上。将标记好的膜转入牛奶中,封闭1 h,分别滴加一抗(LXRα抗体1 :1 000、LXRβ抗体1 :1 000、VCAM-1抗体1 :1 000、ICAM-1抗体1 :1 500、GAPDH抗体1 :10 000),4 ℃摇床孵育过夜后将膜放到各个对应的二抗(用TBST按1 :1 000比例)孵育1 h。在膜上均匀滴加曝光液并显色曝光。Western blot条带采用Image J图像分析软件分析光密度,以目的条带和GAPDH条带积分光密度值的比值代表目的蛋白的相对表达量,每个实验组重复3次。
1.4 肾小球病理损害程度的判定石蜡切片行HE、PAS等常规染色,PAS染色切片在200倍视野下进行分析,每张切片选择10个正切的肾小球,计算系膜区扩张指数(以系膜区/毛细血管襻面积比表示),取平均值作为每个标本的系膜区扩张指数[11]。
1.5 肾小管间质病理损害程度的判定根据肾小管扩张程度、肾小管萎缩程度、肾小管上皮细胞空泡变性程度、间质纤维化程度及肾间质炎症细胞浸润程度的无、轻、中、重分别计0、1、2、3分,每例样本观察10个视野,结果以每例样本的相加总和平均值表示[12]。
1.6 血肌酐检测将收集的血标本送至四川省人民医院检验科行血肌酐检测。
1.7 统计学分析采用SPSS 11.0统计软件。计量资料数据以x±s表示,正态计量资料采用单因素方差分析或t检验。检验水准:α=0.05。
2 结果 2.1 T0901317对DN小鼠肾组织LXRα和LXRβ表达的影响Western blot检测和光密度分析结果显示:DN组、Ad-ctrl+DN组和Ad-TMshRNA+DN组较野生小鼠(ctrl)组,肾组织LXRα表达下降(P < 0.05),与DN、Ad-ctrl+DN、Ad-TMshRNA+DN组比较,T0901317+DN组、Ad-TMshRNA+T0901317+DN组、Ad-ctrl+T0901317+DN组小鼠肾组织LXRα表达增加(P < 0.05,图 1A、B)。DN小鼠各分组LXRβ表达较野生鼠下降(P < 0.05),T0901317对DN小鼠肾脏组织LXRβ表达无显著影响(P>0.05,图 1A、C)。
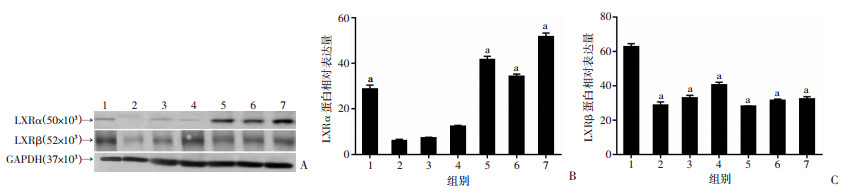
|
| 1:Ctrl组;2:DN组;3:Ad-ctrl+DN组;4:Ad-TMshRNA+DN组;5:T0901317+DN组;6:Ad-TMshRNA+T0901317+DN组;7:Ad-ctrl+T0901317+DN组;A: Western blot检测LXRα和LXRβ表达;B: LXRα蛋白相对表达量(n=6) a: P < 0.05, 与DN组、Ad-TMshRNA+DN组和Ad-ctrl组比较; C: LXRβ蛋白相对表达量(n=6) a: P < 0.05, 与Ctrl组比较 图 1 Western blot检测LXR激动剂T0901317对DN小鼠肾组织LXRα、LXRβ表达的影响 |
2.2 T0901317对DN小鼠肾组织VCAM-1和ICAM-1表达的影响
Western blot检测和光密度分析结果显示:与野生小鼠(ctrl)组比较,DN组、Ad-ctrl+DN组肾组织VCAM-1和ICAM-1表达均增加(P < 0.05),与DN组和Ad-ctrl+DN组比较,Ad-TMshRNA+DN和Ad-TMshRNA+T0901317+DN组小鼠肾组织VCAM-1、ICAM-1表达均增加(P < 0.05),而T0901317+DN组、Ad-ctrl+T0901317+DN组的小鼠肾组织VCAM-1和ICAM-1表达减少(P < 0.05),Ad-TMshRNA+DN组相比于Ad-TMshRNA+T0901317+DN组,VCAM-1和ICAM-1表达量无差异(P>0.05,图 2)。

|
| 1:Ctrl组;2:DN组;3:Ad-ctrl+DN组;4:Ad-TMshRNA+DN组;5:T0901317+DN组;6:Ad-TMshRNA+T0901317+DN组;7:Ad-ctrl+T0901317+DN组;A: Western blot检测VCAM-1和ICAM-1表达;B:VCAM-1蛋白相对表达量(n=6) a: P < 0.05, 与DN组和Ad-ctrl组比较;C:ICAM-1蛋白相对表达量(n=6) a: P < 0.05, 与DN组和Ad-ctrl组比较 图 2 Western blot检测LXR激动剂减少DN小鼠肾组织VCAM-1和ICAM-1表达 |
2.3 T0901317对DN小鼠肾组织损伤的影响
与野生小鼠(ctrl)组比较,DN组小鼠出现肾小球细胞外基质增多、系膜细胞增生、肾小管损伤(图 3)和系膜区扩张(图 4),血肌酐上升(表 1),Ad-TMshRNA沉默后DN小鼠肾小球体积增大、系膜细胞增生明显、肾小管间质炎细胞浸润、间质纤维化增加(图 3)、系膜区进一步扩张(图 4),血肌酐上升明显(表 1),与DN组和Ad-ctrl+DN组比较,Ad-TMshRNA+DN组和Ad-TMshRNA+T0901317+DN组小鼠肾小球系膜扩张指数和肾小管间质病变积分增加(P < 0.05),而T0901317+DN组、Ad-ctrl+T0901317+DN组小鼠肾组织病理损伤程度减轻,血肌酐下降(P < 0.05, 表 1)。

|
| A:DN组;B:Ad-ctrl+DN组;C:Ad-TMshRNA+DN组;D:T0901317+DN组;E:Ad-TMshRNA+T0901317+DN组;F:Ad-ctrl+T0901317+DN组 图 3 LXR激动剂T0901317改善DN小鼠肾组织损伤 (HE ×400) |

|
| A:DN组;B:Ad-ctrl+DN组;C:Ad-TMshRNA+DN组;D:T0901317+DN组;E:Ad-TMshRNA+T0901317+DN组;F:Ad-ctrl+T0901317+DN组 图 4 LXR激动剂T0901317改善DN小鼠肾组织损伤 (PAS ×400) |
| 组别 | 系膜扩张指数 | 肾小管间质病变积分 | 血肌酐/μmol·L-1 |
| Ctrl组 | 7.7±1.74ab | 2.30±0.17ab | 26.32±2.41ab |
| DN组 | 12.3±2.52 | 7.1±1.63 | 45.41±2.89 |
| Ad-ctrl+DN组 | 11.8±2.33 | 6.7±1.37 | 43.53±2.74 |
| Ad-TMshRNA+DN组 | 21.5±3.65abc | 15.7±3.43abc | 64.74±3.57abc |
| T0901317+DN组 | 9.57±2.17ab | 4.1±0.98ab | 27.38±2.50ab |
| Ad-TMshRNA+T0901317+DN组 | 18.6±3.19ab | 13.9±3.12ab | 61.86±3.27ab |
| Ad-ctrl+T0901317+DN组 | 10.4±2.69ab | 5.0±0.84ab | 29.67±2.74ab |
| a:P < 0.05,与DN组比较;b:P < 0.05,与Ad-ctrl+DN组比较;c: P>0.05, 与Ad-TMshRNA+T0901317+DN组比较 | |||
3 讨论
本研究预实验结果显示:与选取的正常野生型C57BL/6小鼠比较,12周龄db/db小鼠尿微量白蛋白明显升高,且出现肾细胞外基质增多、系膜细胞增生和肾小管损伤等典型的肾损害病理改变,故选择12周龄的db/db小鼠为实验对象, 探讨T0901317是否通过活化LXR、减少VCAM-1和ICAM-1表达而改善db/db小鼠肾损伤。以期为DN的发病机制和治疗提供实验依据。
炎症在DN发病过程中起到重要作用[1]。目前认为内源性抗炎机制包括抗炎类细胞因子、抗炎类花生酸和抗氧化剂等,此外,细胞因子抑制剂和细胞周期蛋白激酶抑制剂等也参与了炎症损伤的保护过程,而目前基于上述内源性抗炎机制的治疗并不能有效抑制DN的炎症反应和病变进展。因此,需要新的治疗策略解决上述问题。具有抗炎作用的LXR家族包括LXRα和LXRβ,LXRα多表达于肾脏、肝脏、巨噬细胞、脂肪,而LXRβ则广泛表达于机体各组织[8-9]。LXR结合于相应DNA顺式作用元件,即与RXRα(视黄醇X受体α)形成异源二聚体,而LXR激动剂T0901317可使LXR/RXRα异源二聚体空间结构改变,并使其与共抑制因子脱离,募集辅助激活因子,再通过与相应靶基因启动子上的LXR反应元件结合,激活LXR靶基因ABCA1的转录及其下游信号通路[13], 在动脉粥样硬化斑块形成、炎症、控制胆固醇流出、磷脂代谢等方面发挥作用[14]。本研究通过Western blot检测结果证实,DN组、Ad-ctrl+DN组和Ad-TMshRNA+DN组相比于野生小鼠组,肾组织LXRα和LXRβ表达下降,T0901317干预后,DN小鼠肾组织LXRα表达增加,Ad-TM shRNA沉默TM后,LXRα表达较DN对照组无明显变化,说明TM对LXRα表达无影响。DN小鼠各分组LXRβ表达较野生鼠下降,T0901317对DN小鼠肾脏组织LXRβ表达无显著影响,提示在本实验中,T0901317主要上调DN小鼠肾组织LXRα表达。
正常生理状态下,TM主要分布于血管内皮细胞表面,当内皮细胞受损伤,TM胞外段从内皮细胞脱落而释放入血[4],DN鼠肾小球内皮细胞TM表达下降并与肾损伤相关[15], 临床发现DN患者血管内皮细胞TM表达下降,尿白蛋白水平升高,说明上调内皮细胞TM表达,有助于减轻血管内皮细胞损害和肾损害,文献[16-17]报道人可溶性TM可改善抗肾小球基底膜抗体肾炎大鼠炎症反应和小鼠缺血再灌注肾损伤, 证实TM具有肾保护作用。我们前期Western blot检测结果显示:相比于野生小鼠,DN小鼠肾组织TM表达下降,T0901317促进DN小鼠肾组织TM表达,沉默TM后再给予T0901317,TM表达无增加,说明T0901317通过激活LXR而增加DN小鼠肾组织TM表达。
本研究进一步观察T0901317激活LXRα对DN小鼠肾脏炎症反应和肾病理损伤的影响,结果显示:DN小鼠相比于野生鼠,肾组织VCAM-1和ICAM-1表达均增加,肾小球系膜扩张指数和肾小管-间质病变加重,血肌酐上升,沉默TM后,DN小鼠肾组织VCAM-1和ICAM-1表达增加、肾组织病理损伤加重,血肌酐进一步升高,而T0901317干预后,DN小鼠肾组织VCAM-1和ICAM-1表达减少、肾损伤减轻,血肌酐下降,Ad-TMshRNA+DN组相比于Ad-TMshRNA+T0901317+DN组,VCAM-1和ICAM-1表达量差异均无统计学意义,提示T0901317激活LXRα可减轻肾脏炎症反应、病理损伤和血肌酐,但沉默TM后再给予T0901317激动,肾脏炎症反应、病理损伤和血肌酐无减轻,结合我们已有的实验结果,提示T0901317通过活化LXRα上调TM表达而减少VCAM-1和ICAM-1表达并改善db/db小鼠肾损伤,该结果与我们前期发现活化的LXRα通过上调TM表达而抑制高糖下肾小球内皮细胞炎症反应的作用相一致[10]。
综上,本研究发现LXR激动剂T0901317通过活化LXRα抑制肾组织ICAM-1和VCAM-1表达并改善db/db小鼠肾损伤,为通过活化LXRα减轻DN小鼠肾损伤提供了实验依据,进一步需在LXRα基因敲入或LXRα基因敲除鼠中明确LXRα调节炎症反应的具体机制。
| [1] |
KARIMI Z, KAHE F, JAMIL A, et al. Intercellular adhesion molecule-1 in diabetic patients with and without microalbuminuria[J]. Diabetes Metab Syndr, 2018, 12(3): 365-368. DOI:10.1016/j.dsx.2017.12.028 |
| [2] |
HELLEMONS M E, KERSCHBAUM J, BAKKER S J, et al. Validity of biomarkers predicting onset or progression of nephropathy in patients with Type 2 diabetes: a systematic review[J]. Diabet Med, 2012, 29(5): 567-577. DOI:10.1111/j.1464-5491.2011.03437.x |
| [3] |
NAVARRO-GONZÁLEZ J F, MORA-FERNÁNDEZ C, MUROS DE FUENTES M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol, 2011, 7(6): 327-340. DOI:10.1038/nrneph.2011.51 |
| [4] |
DROŻDŻ D, ŁATKA M, DROŻDŻ T, et al. Thrombomodulin as a new marker of endothelial dysfunction in chronic kidney disease in children[J]. Oxid Med Cell Longev, 2018, 2018: 1619293. DOI:10.1155/2018/1619293 |
| [5] |
MATSUMOTO K, YANO Y, GABAZZA E C, et al. Inverse correlation between activated protein C generation and carotid atherosclerosis in Type 2 diabetic patients[J]. Diabet Med, 2007, 24(12): 1322-1328. DOI:10.1111/j.1464-5491.2007.02289.x |
| [6] |
LI F L, YANG N S, ZHANG L L, et al. Increased expression of Toll-like receptor 2 in rat diabetic nephropathy[J]. Am J Nephrol, 2010, 32(2): 179-186. DOI:10.1159/000317023 |
| [7] |
PALOMER X, GONZÁLEZ-CLEMENTE J M, BLANCO-VACA F, et al. Role of vitamin D in the pathogenesis of type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2008, 10(3): 185-197. DOI:10.1111/j.1463-1326.2007.00710.x |
| [8] |
HIEN H T M, HA N C, THOM L T, et al. Squalene promotes cholesterol homeostasis in macrophage and hepatocyte cells via activation of liver X receptor (LXR) α and Β[J]. Biotechnol Lett, 2017, 39(8): 1101-1107. DOI:10.1007/s10529-017-2345-y |
| [9] |
FESSLER M B. The challenges and promise of targeting the liver X receptors for treatment of inflammatory disease[J]. Pharmacol Ther, 2018, 181: 1-12. DOI:10.1016/j.pharmthera.2017.07.010 |
| [10] |
DING H L, LI Y, FENG Y L, et al. LXR agonist T0901317 upregulates thrombomodulin expression in glomerular endothelial cells by inhibition of nuclear factor-κB[J]. Mol Med Rep, 2016, 13(6): 4888-4896. DOI:10.3892/mmr.2016.5138 |
| [11] |
SHANKLAND S J, SCHOLEY J W, LY H, et al. Expression of transforming growth factor-beta 1 during diabetic renal hypertrophy[J]. Kidney Int, 1994, 46(2): 430-442. DOI:10.1038/ki.1994.291 |
| [12] |
AUSTIN H A 3rd, MUENZ L R, JOYCE K M, et al. Diffuse proliferative lupus nephritis: identification of specific pathologic features affecting renal outcome[J]. Kidney Int, 1984, 25(4): 689-695. DOI:10.1038/ki.1984.75 |
| [13] |
YANG C C, ZHOU C J, LI J, et al. Quantitative proteomic study of the plasma reveals acute phase response and LXR/RXR and FXR/RXR activation in the chronic unpredictable mild stress mouse model of depression[J]. Mol Med Rep, 2018, 17(1): 93-102. DOI:10.3892/mmr.2017.7855 |
| [14] |
ENDO-UMEDA K, NAKASHIMA H, UMEDA N, et al. Dysregulation of kupffer cells/macrophages and natural killer T cells in steatohepatitis in LXRα knockout male mice[J]. Endocrinology, 2018, 159(3): 1419-1432. DOI:10.1210/en.2017-03141 |
| [15] |
ISERMANN B, VINNIKOV I A, MADHUSUDHAN T, et al. Activated protein C protects against diabetic nephropathy by inhibiting endothelial and podocyte apoptosis[J]. Nat Med, 2007, 13(11): 1349-1358. DOI:10.1038/nm1667 |
| [16] |
TACHIBANA S, IYODA M, MATSUMOTO K, et al. Recombinant human soluble thrombomodulin attenuates anti-glomerular basement membrane glomerulonephritis in Wistar-Kyoto rats through anti-inflammatory effects[J]. Nephrol Dial Transplant, 2019, 34(5): 774-782. DOI:10.1093/ndt/gfy201 |
| [17] |
OZAKI T, ANAS C, MARUYAMA S, et al. Intrarenal administration of recombinant human soluble thrombomodulin ameliorates ischaemic acute renal failure[J]. Nephrol Dial Transplant, 2008, 23(1): 110-119. DOI:10.1093/ndt/gfm563 |



