自闭症谱系障碍(autism spectrum disorder, ASD)是一种异质性神经发育障碍疾病,其特征是社会交往和沟通障碍,以及重复刻板样行为[1]。虽然ASD的确切病因目前尚不清楚,但越来越多的证据表明自闭症相关行为异常的多因素性质,如神经发生、神经免疫过程以及兴奋-抑制性神经传递的失衡[2-4]。目前全世界约有1%的儿童受到ASD的影响,并且其患病率正在不断上升。尽管ASD具有重要意义,但目前仍没有针对ASD有效的药物或行为治疗。因此,探索对于ASD有效的预防和治疗方法迫在眉睫。
海马神经发生有助于改善认知功能和调节情绪。有研究表明海马神经发生受损与一些精神疾病有关,如成瘾、抑郁、精神分裂症和ASD[5-6]。通过结构和功能磁共振成像(MRI),研究者观察到ASD患者的大脑特异性神经元生长延迟和神经元发育受限[7]。ASD患者尸检结果显示大脑海马神经发生、神经元迁移和成熟存在缺陷[8]。此外,在一些ASD模型小鼠上也观察到海马神经发生的变化,包括甲基化cpg结合蛋白2(Methyl-CpG-binding protein-2, MECP2)重复综合征小鼠和肌细胞增强因子2(myocyte enhancer factor-2, MEF2)单倍体功能不全的ASD模型小鼠[9]。此外,母体免疫激活的ASD小鼠模型也存在海马神经发生缺陷[10]。针对ASD相关行为的治疗手段也有效促进了海马神经发生[11]。综上所述,海马区异常的神经发生可能是ASD病理生理过程中的关键环节。因此,改善海马神经发生可能是一种减轻ASD患者自闭样行为的有效治疗方法。
二甲双胍是一种广泛用于糖尿病治疗的双胍类药物。研究表明二甲双胍能够跨越血脑屏障,通过改善海马神经发生预防糖尿病引起的大鼠记忆缺陷[12]。本课题组前期研究已证实生后早期二甲双胍治疗可有效改善BTBR自闭症小鼠社交缺陷和重复刻板行为[13]。此外,在阿尔茨海默症小鼠模型中,二甲双胍可治疗空间记忆损伤和海马神经元死亡,促进海马神经发生[14]。这些数据表明二甲双胍可能通过促进海马神经发生来改善ASD模型的行为缺陷。
BTBR T+Itpr3tf/J (BTBR)近交系小鼠是一种具有良好特性的ASD动物模型,通过改变C57BL/6J(C57)小鼠Disc1、Itpr3、T+ 3个基因得到。与ASD的临床症状和病理特征相似,BTBR小鼠不仅表现出缺陷的社交能力和增加的重复刻板行为,而且海马神经发生减少。在本实验中,于生后7 d(P7)至生后14 d(P14)每日1次二甲双胍腹腔注射,在P14观察对BTBR小鼠及C57小鼠海马齿状回细胞增殖、神经干细胞及新生神经元数量的影响,以期进一步探讨生后早期二甲双胍干预能否改善BTBR小鼠海马神经发生。
1 材料与方法 1.1 主要试剂二甲双胍购自美国Sigma公司;5-溴脱氧尿嘧啶核苷(5-bromo-2’-deoxyuridine,BrdU)抗体购自美国BD公司;Ki67抗体购自美国Thermo公司;Sox2抗体购自英国Abcam公司;胶原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)抗体购自美国Millipore公司;Prox1抗体购自美国Covance公司;荧光二抗购自美国Invitrogen公司。
1.2 方法 1.2.1 动物与分组BTBR小鼠购买于美国杰克逊实验室。C57孕鼠购买于陆军军医大学实验动物中心。所有动物饲养于陆军军医大学实验动物中心标准环境中,自由充分摄取食物和水。实验所用新生雄鼠由上述小鼠繁殖产生。利用随机数字表法选择每窝最多2只新生雄鼠用以实验,分为4组(n=5):C57生理盐水组(SAL)、C57药物处理组(MET)、BTBR生理盐水组(BTBR)、BTBR药物处理组(BTBRMET)。所有实验程序按照陆军军医大学批准的实验动物护理原则和伦理审批要求进行。
1.2.2 药物处理两药物处理组小鼠于生后7 d(出生当天记为P0)至生后14 d予以二甲双胍(200 mg/kg)腹腔注射,每天1次,共计8次。C57及BTBR生理盐水组予以等量的生理盐水。为评估海马齿回的细胞增殖情况,于P14予以BrdU腹腔注射(50 mg/kg),并于给药后2 h处死。
1.2.3 标本采集于P14最后1次二甲双胍注射2 h后灌注取脑,将脑组织于4%多聚甲醛(4% PFA)溶液中固定48 h后转移至30%蔗糖+4% PFA中充分脱水。收取25 μm厚度的冰冻脑组织切片,-20 ℃保存于防冻液备用。
1.2.4 免疫荧光染色选取合适的脑组织切片于0.01 mol/L PBS漂洗,后置于0.3% Triton X-100 37 ℃处理30 min。分别加入一抗:小鼠来源BrdU(1 :500);兔来源Ki67(1 :200);小鼠来源Sox2(1 :200);兔来源GFAP(1 :500);兔来源Prox1(1 :200),4 ℃孵育过夜。二抗分别为抗小鼠594、抗兔cy3、抗兔488荧光二抗(1 :500),37 ℃孵育2 h后,DAPI复染,自然晾干后荧光封片剂封片。每组各5只小鼠,每只小鼠选取相似位置的5张大脑切片。
1.3 统计学分析计量资料以x±s表示,采用SPSS 24.0统计软件,采用单因素方差分析,组间两两比较采用LSD t检验。检验水准:α=0.05。
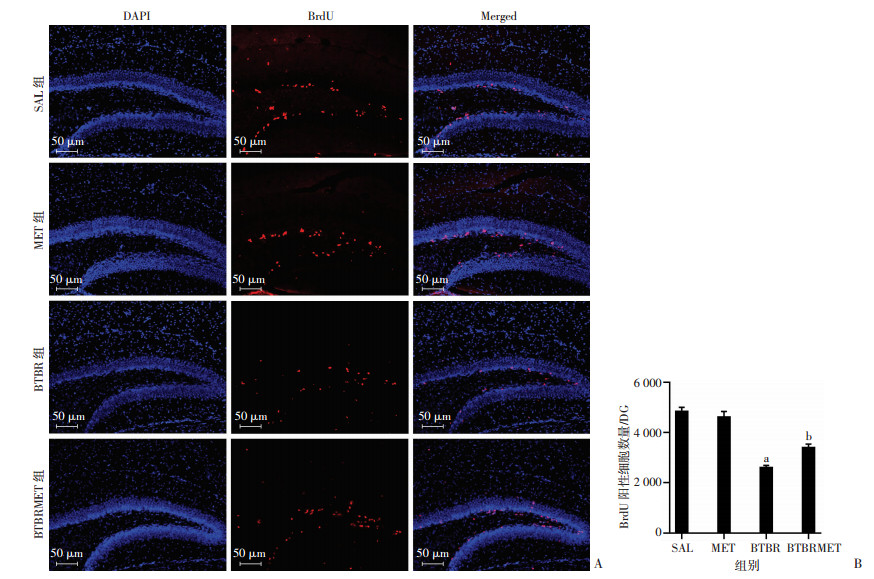
2 结果 2.1 生后早期二甲双胍治疗后BTBR小鼠海马BrdU阳性细胞数量增加BrdU作为胸腺嘧啶衍生物,可代替其在DNA合成期(S期)掺入到新合成DNA链中,用于标记增殖细胞。免疫组化结果显示:BrdU阳性细胞主要分布在海马齿状回颗粒下层。与SAL组相比,BTBR组BrdU阳性细胞数显著减少(LSD-t=9.956, P < 0.05,图 1),而MET组BrdU阳性细胞数无明显变化。BTBRMET组BrdU阳性细胞数比BTBR组明显增多(LSD-t=3.545, P < 0.05,图 1)。提示二甲双胍注射后促进BTBR海马齿状回神经细胞增殖。
|
|
A:免疫荧光染色检测各组海马齿状回细胞增殖能力;B:体视学方法统计各组海马齿状回BrdU阳性细胞数量 a:P < 0.05,与SAL组比较;b:P < 0.05,与BTBR组比较 图 1 二甲双胍处理后P14 BTBR小鼠海马齿状回BrdU阳性细胞增多 |
2.2 生后早期二甲双胍治疗后BTBR小鼠海马Ki67阳性细胞数量增加
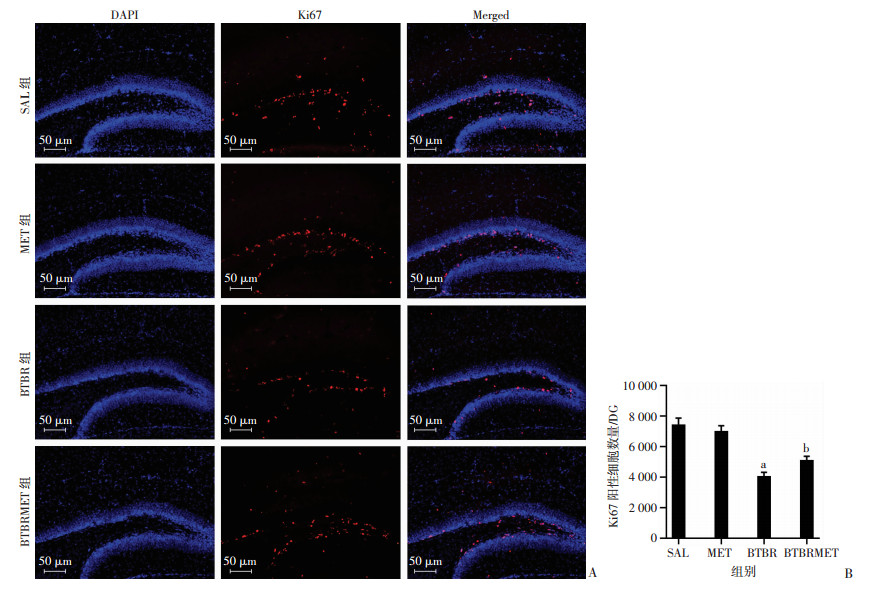
Ki67作为一种增殖细胞相关的核抗原,用以评估二甲双胍对P14 BTBR小鼠海马神经干细胞增殖的影响。经观察各组Ki67阳性细胞主要分布在海马齿状回颗粒下层。BTBR组Ki67阳性细胞与SAL组相比明显减少(LSD-t=6.929, P < 0.05,图 2),MET组相比于SAL组Ki67阳性细胞数无明显变化。BTBRMET组Ki67阳性细胞数比BTBR组明显增多,差异有统计学意义(LSD-t=2.444, P < 0.05,图 2)。这进一步证实,二甲双胍治疗有利于改善BTBR海马齿状回神经细胞增殖情况。
|
|
A:免疫荧光染色检测各组海马齿状回细胞增殖能力;B:体视学方法统计各组海马齿状回Ki67阳性细胞数量 a:P < 0.05,与SAL组比较;b:P < 0.05,与BTBR组比较 图 2 二甲双胍处理后P14 BTBR小鼠海马齿状回Ki67阳性细胞增多 |
2.3 生后早期二甲双胍治疗有利于BTBR小鼠海马神经干细胞增殖
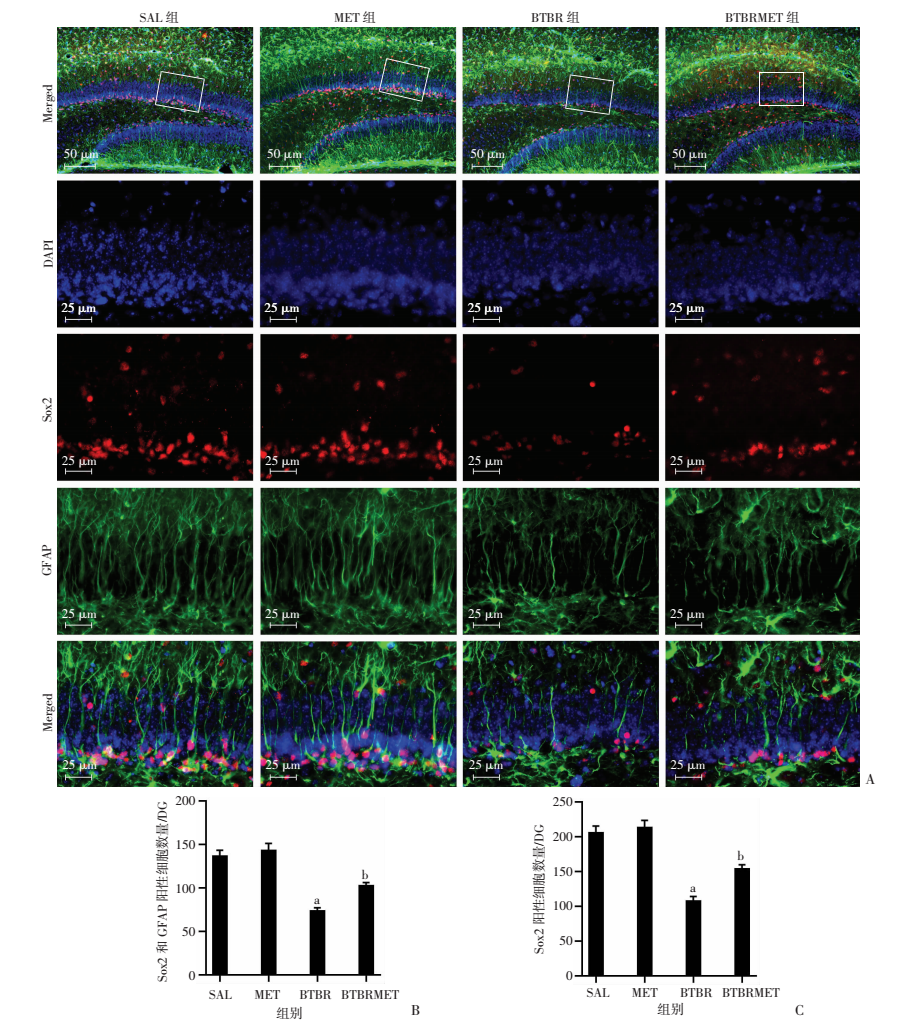
Sox2是维持干细胞所必需的一种转录因子,在干细胞和前体细胞中都有表达;Sox2和GFAP共同标记可用于检测神经干细胞,其中GFAP标记的放射状突起方向需垂直并横贯海马齿状回颗粒细胞层。与SAL组相比,BTBR组颗粒细胞层Sox2阳性的神经干细胞/早期祖细胞数显著减少(LSD-t=8.270, P < 0.05,图 3);而经MET处理后BTBR组小鼠GCL的Sox2阳性细胞数明显增多(LSD-t=3.908, P < 0.05,图 3)。SAL组和MET组比较Sox2阳性细胞数差异无统计学意义。同样,BTBRMET组Sox2和GFAP共同标记的神经干细胞数比BTBR组明显增多(LSD-t=0.412, P < 0.05,图 3),而在SAL组和MET组之间阳性细胞数差异无统计学意义。结果显示生后早期二甲双胍治疗显著增加了BTBR小鼠海马Sox2阳性细胞数量以及Sox2和GFAP共同标记的神经干细胞数量。
|
| A:免疫荧光染色检测各组海马齿状回神经干细胞分布;B:体视学方法统计各组海马齿状回Sox2和GFAP共同标记的阳性细胞数量;C:体视学方法统计各组海马齿状回Sox2阳性细胞数量 a:P < 0.05,与SAL组比较;b:P < 0.05,与BTBR组比较 图 3 二甲双胍处理后P14 BTBR小鼠海马齿状回神经干细胞增多 |
2.4 生后早期二甲双胍治疗显著增加BTBR小鼠海马颗粒细胞层新生神经细胞数量
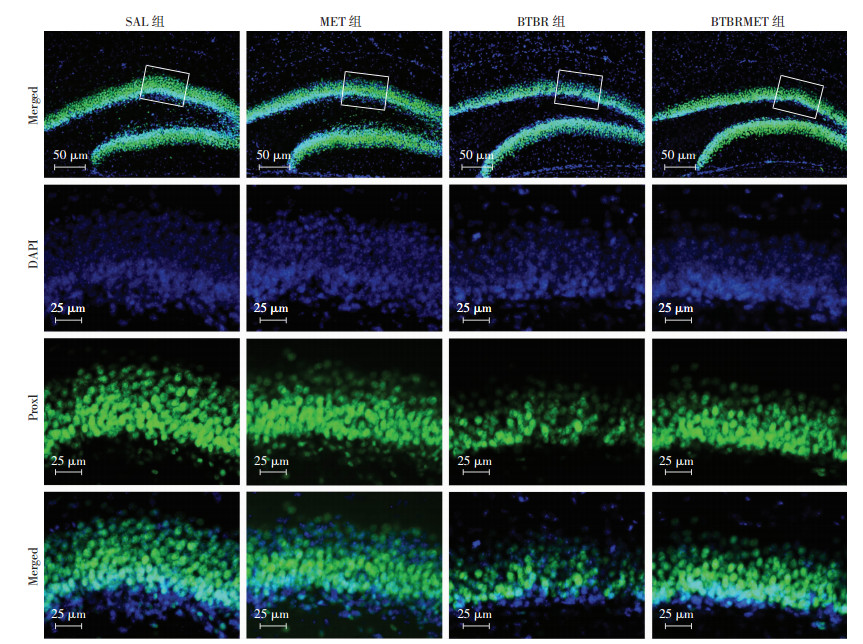
Prox1为新生神经细胞的标志,免疫荧光结果显示:各组中海马齿状回颗粒层Prox1阳性细胞,MET组与SAL组相比差异无统计学意义;而BTBR组Prox1阳性细胞数比SAL组显著减少(LSD-t=10.691,P < 0.05,图 4、5),经MET处理后BTBR小鼠Prox1阳性细胞数明显增多(LSD-t=4.338,P < 0.05,图 4、5)。
|
| 图 4 免疫荧光染色检测各组海马齿状回新生神经细胞分布 |
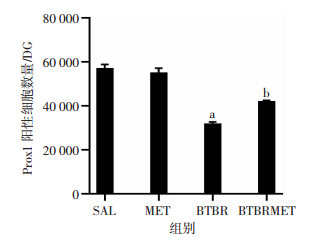
|
| a:P < 0.05,与SAL组比较;b:P < 0.05,与BTBR组比较 图 5 体视学方法统计各组海马齿状回Prox1阳性细胞数量 |
3 讨论
在过去几十年里,ASD的发病率急剧上升,现有的数据显示,自闭症儿童的家庭面临着巨大的经济压力,却没有任何有效的治疗措施。因此,迫切需要明确ASD的病因并寻找有效的治疗方法。尽管ASD的确切机制尚不清楚,但在人类和动物模型中,神经发生缺陷已被证明与该疾病相关[6]。在哺乳动物的一生中,活跃的神经发生主要发生在脑室下区和海马齿回颗粒下层[15]。这些区域的神经发生缺陷可能会对大脑功能产生重大影响。MRI证据显示,自闭症患者和健康对照组(年龄29个月至49岁)在海马齿状回区域存在明显的解剖异常[16]。此外,尸检结果显示ASD脑内神经发生、神经细胞迁移和成熟异常,这可能是导致患者症状异质性的重要原因[8]。
近年来,一些自闭症小鼠模型显示,海马的神经发生有显著变化。MECP2转基因小鼠表现出成熟神经细胞减少和成年海马异常[9]。Shank3+ /ΔC和Cntnap2-/-转基因小鼠也被发现腹侧齿回成年神经发生显著减少[17]。此外,有证据显示,BTBR和丙戊酸(valproic acid, VPA)自闭症小鼠模型的成年海马神经发生减少[18-19]。这些结果显示,海马的神经发生可能与ASD患者和动物模型的行为缺陷有关。成年海马神经发生受损不仅导致社交能力异常,还增加了重复刻板样行为[20]。我们之前的研究同样证实了成年BTBR和VPA暴露小鼠海马区BrdU和DCX标记的细胞数量显著减少,而生后早期肝脏X受体激动剂TO901317治疗可以显著挽救这些自闭症模型小鼠的神经发生缺陷[21]进而改善BTBR小鼠自闭样行为。这些结果显示,促进海马神经发生可能成为BTBR小鼠自闭样行为改善的有效靶点。
迄今为止,大多数ASD的临床前研究只检测了对成年自闭症动物模型的急性治疗效果。很少实验研究早期干预对ASD的治疗效果。脆性X综合征小鼠模型的早期社交训练可以挽救成年行为和树突棘形态的缺陷[22]。另一项临床前研究表明,维生素D治疗可以预防妊娠期母体免疫激活的ASD模型小鼠的自闭样行为[23]。我们最近的研究表明,P7~P14给予二甲双胍可以挽救成年BTBR小鼠的行为异常[13]。除此以外,生后早期肝脏X受体激动剂治疗可以显著改善成年BTBR及VPA自闭症模型小鼠的神经发生及行为缺陷[21]。以上结果显示,生后早期对自闭症小鼠给予药物干预可以导致长期效应,明显改善成年小鼠的自闭样行为,治疗效果比成年急性药物治疗更加持久且显著,提示我们更多地关注ASD的早期治疗。
二甲双胍是一种经典的双胍类糖尿病治疗药物,已有研究表明二甲双胍干预有助于促进海马成年神经发生,延缓阿尔茨海默病(AD)的神经退行性变[24];OU等[14]也进一步证明了二甲双胍可治疗AD小鼠空间记忆损伤和海马神经元死亡,促进海马神经发生。在糖尿病模型小鼠中,二甲双胍延长治疗也可促进其海马神经细胞增殖和分化[25]。本实验结果证实生后早期二甲双胍治疗可促进BTBR小鼠海马神经发生,与之前的报道一致,其潜在机制值得进一步探索。
BTBR近交系小鼠是临床前研究中常用的小鼠模型,除了表现出异常的社会交往和高水平的重复行为,同样有海马神经发生缺陷。为探讨生后早期二甲双胍对海马神经发生的治疗效果,本研究采用P7~P14二甲双胍早期干预,这与人类从妊娠最后3个月到出生后最初几年的时间大致相同,在P14对海马齿状回增殖神经元以及神经干细胞进行了检测。结果显示,生后早期二甲双胍治疗可显著增加BTBR小鼠海马齿状回BrdU、Ki67标记的增殖细胞,Sox2和GFAP共标的神经干细胞,以及Prox1标记的新生神经细胞数量。而对于神经发生正常的C57小鼠没有显著影响。由此可见,在发育关键期进行药物治疗可有效改善海马神经发生。而这也为前期实验结果显示生后早期二甲双胍改善成年BTBR小鼠行为缺陷提供了可靠依据,揭示了海马干细胞库的维持及海马结构变化对于成年行为改善的重要作用。
综上所述,生后早期二甲双胍治疗可明显改善BTBR小鼠海马神经发生,促进神经细胞增殖以及神经干细胞库的维持。这可能与二甲双胍早期治疗后成年BTBR小鼠行为改善有紧密联系,为自闭症治疗的关键时期和研究靶点提供了新思路。
| [1] |
CURRAIS A, FARROKHI C, DARGUSCH R, et al. Dietary glycemic index modulates the behavioral and biochemical abnormalities associated with autism spectrum disorder[J]. Mol Psychiatry, 2016, 21(3): 426-436. DOI:10.1038/mp.2015.64 |
| [2] |
CHRISTENSEN D L, MAENNER M J, BILDER D, et al. Prevalence and characteristics of autism spectrum disorder among children aged 4 years-early autism and developmental disabilities monitoring network, seven sites, United States, 2010, 2012, and 2014[J]. MMWR Surveill Summ, 2019, 68(2): 1-19. DOI:10.15585/mmwr.ss6802a1 |
| [3] |
CARPITA B, MUTI D, DELL'OSSO L. Oxidative stress, maternal diabetes, and autism spectrum disorders[J]. Oxid Med Cell Longev, 2018, 2018: 3717215. DOI:10.1155/2018/3717215 |
| [4] |
LEE B K, GROSS R, FRANCIS R W, et al. Birth seasonality and risk of autism spectrum disorder[J]. Eur J Epidemiol, 2019, 34(8): 785-792. DOI:10.1007/s10654-019-00506-5 |
| [5] |
CASTILLA-ORTEGA E, SERRANO A, BLANCO E, et al. A place for the hippocampus in the cocaine addiction circuit:Potential roles for adult hippocampal neurogenesis[J]. Neurosci Biobehav Rev, 2016, 66: 15-32. DOI:10.1016/j.neubiorev.2016.03.030 |
| [6] |
GILBERT J, MAN H Y. Fundamental elements in autism:from neurogenesis and neurite growth to synaptic plasticity[J]. Front Cell Neurosci, 2017, 11: 359. DOI:10.3389/fncel.2017.00359 |
| [7] |
GROEN W B, BUITELAAR J K, VAN DER GAAG R J, et al. Pervasive microstructural abnormalities in autism:a DTI study[J]. J Psychiatry Neurosci, 2011, 36(1): 32-40. DOI:10.1503/jpn.090100 |
| [8] |
WEGIEL J, KUCHNA I, NOWICKI K, et al. The neuropathology of autism:defects of neurogenesis and neuronal migration, and dysplastic changes[J]. Acta Neuropathol, 2010, 119(6): 755-770. DOI:10.1007/s00401-010-0655-4 |
| [9] |
CHEN Z F, LI X, ZHOU J J, et al. Accumulated quiescent neural stem cells in adult hippocampus of the mouse model for the MECP2 duplication syndrome[J]. Sci Rep, 2017, 7: 41701. DOI:10.1038/srep41701 |
| [10] |
LIU Y H, LAI W S, TSAY H J, et al. Effects of maternal immune activation on adult neurogenesis in the subventricular zone-olfactory bulb pathway and olfactory discrimination[J]. Schizophr Res, 2013, 151(1/2/3): 1-11. DOI:10.1016/j.schres.2013.09.007 |
| [11] |
ZHANG R Y, CAI Y L, XIAO R, et al. Human amniotic epithelial cell transplantation promotes neurogenesis and ameliorates social deficits in BTBR mice[J]. Stem Cell Res Ther, 2019, 10(1): 153. DOI:10.1186/s13287-019-1267-0 |
| [12] |
MOUSAVI S M, NIAZMAND S, HOSSEINI M, et al. Beneficial effects of teucrium polium and metformin on diabetes-induced memory impairments and brain tissue oxidative damage in rats[J]. Int J Alzheimers Dis, 2015, 2015: 493729. DOI:10.1155/2015/493729 |
| [13] |
WANG L, CAI Y L, FAN X T. Metformin administration during early postnatal life rescues autistic-like behaviors in the BTBR T+ Itpr3tf/J mouse model of autism[J]. Front Behav Neurosci, 2018, 12: 290. DOI:10.3389/fnbeh.2018.00290 |
| [14] |
OU Z R, KONG X J, SUN X D, et al. Metformin treatment prevents amyloid plaque deposition and memory impairment in APP/PS1 mice[J]. Brain Behav Immun, 2018, 69: 351-363. DOI:10.1016/j.bbi.2017.12.009 |
| [15] |
APPLE D M, SOLANO-FONSECA R, KOKOVAY E. Neurogenesis in the aging brain[J]. Biochem Pharmacol, 2017, 141: 77-85. DOI:10.1016/j.bcp.2017.06.116 |
| [16] |
GROEN W, TELUIJ M, BUITELAAR J, et al. Amygdala and Hippocampus enlargement during adolescence in autism[J]. J Am Acad Child Adolesc Psychiatry, 2010, 49(6): 552-560. DOI:10.1016/j.jaac.2009.12.023 |
| [17] |
COPE E C, BRIONES B A, BROCKETT A T, et al. Immature neurons and radial glia but not astrocytes or microglia, are altered in adult Cntnap2 and Shank3 mice, models of autism[J]. eNeuro, 2016, 3(5). DOI:10.1523/ENEURO.0196-16.2016 |
| [18] |
ZENG Q H, LONG Z M, FENG M, et al. Valproic acid stimulates hippocampal neurogenesis via activating the wnt/β-catenin signaling pathway in the APP/PS1/nestin-GFP triple transgenic mouse model of Alzheimer's disease[J]. Front Aging Neurosci, 2019, 11: 62. DOI:10.3389/fnagi.2019.00062 |
| [19] |
JULIANDI B, TANEMURA K, IGARASHI K, et al. Reduced adult hippocampal neurogenesis and cognitive impairments following prenatal treatment of the antiepileptic drug valproic acid[J]. Stem Cell Rep, 2015, 5(6): 996-1009. DOI:10.1016/j.stemcr.2015.10.012 |
| [20] |
RUSZNÁK K, CSEKÖ K, VARGA Z, et al. Long-term stress and concomitant marijuana smoke exposure affect physiology, behavior and adult hippocampal neurogenesis[J]. Front Pharmacol, 2018, 9: 786. DOI:10.3389/fphar.2018.00786 |
| [21] |
CAI Y L, ZHONG H Y, LI X, et al. The liver X receptor agonist TO901317 ameliorates behavioral deficits in two mouse models of autism[J]. Front Cell Neurosci, 2019, 13: 213. DOI:10.3389/fncel.2019.00213 |
| [22] |
ODDI D, SUBASHI E, MIDDEI S, et al. Early social enrichment rescues adult behavioral and brain abnormalities in a mouse model of fragile X syndrome[J]. Neuropsychopharmacology, 2015, 40(5): 1113-1122. DOI:10.1038/npp.2014.291 |
| [23] |
VUILLERMOT S, LUAN W, MEYER U, et al. Vitamin D treatment during pregnancy prevents autism-related phenotypes in a mouse model of maternal immune activation[J]. Mol Autism, 2017, 8: 9. DOI:10.1186/s13229-017-0125-0 |
| [24] |
AHMED S, MAHMOOD Z, JAVED A, et al. Effect of metformin on adult hippocampal neurogenesis:comparison with donepezil and links to cognition[J]. J Mol Neurosci, 2017, 62(1): 88-98. DOI:10.1007/s12031-017-0915-z |
| [25] |
TANOKASHIRA D, KURATA E, FUKUOKAYA W, et al. Metformin treatment ameliorates diabetes-associated decline in hippocampal neurogenesis and memory via phosphorylation of insulin receptor substrate 1[J]. FEBS Open Bio, 2018, 8(7): 1104-1118. DOI:10.1002/2211-5463.12436 |



