哺乳动物组织所具有的特定三维空间结构是其发挥正常生理功能的组织学基础。2009年SATO等[1]首先使用小鼠肠道干细胞培育出肠类器官(enteroid),随后类器官培养技术逐渐被运用于生物医学各个研究领域。体外培养的肠类器官具有和体内非常接近的微绒毛和肠隐窝结构,其肠隐窝内具有Lgr5+肠道干细胞,同时肠类器官中存在各种终末分化的肠上皮细胞。因此,越来越多的肠道相关研究倾向于使用肠类器官模型。不同实验室所用动物临床样本及培养方法存在较大差异[2-4]。因此,本课题组提出能否使用已有肠上皮细胞株进行肠类器官培养以增加研究结果的稳定性和可操作性。
本研究使用IEC-6[5]、CT26. WT[6]和Caco-2[7]三种肠上皮细胞株进行3D培养,比较了不同肠上皮细胞株形成肠类器官的潜能,并初步探讨了3D培养条件下Caco-2来源肠类器官中肠道干细胞相关基因、增殖细胞标记物、溶酶体分布以及电离辐射后细胞凋亡变化等特点,为今后使用肠上皮细胞株培养肠类器官进行基础和临床研究提供实验基础。
1 材料与方法 1.1 肠上皮细胞株保存及培养本课题所使用的细胞株中,IEC-6细胞(CRL-1592)和Caco-2细胞(HTB-37)购自美国模式培养物集存库(American type culture collection,ATCC)并由本实验室保存,CT26.WT细胞(CRL-2638)购自中科院上海细胞库并由本实验室保存。细胞培养时加入10%胎牛血清,同时加入1%青霉素-链霉素(碧云天公司)。
1.2 主要试剂和仪器培养IEC-6细胞所用高糖DMEM培养基,培养CT26. WT细胞所用RPMI1640培养基和培养Caco-2细胞所用MEM培养基购自HyClone公司。胎牛血清(FBS)购自以色列BI公司。3D培养所用Biocoat Matrigel (货号:356234)购自Corning公司。流式分选使用BD AriaⅢ流式细胞仪。兔抗Ki67抗体(货号:ab16667)购自Abcam公司,大鼠抗lamp1(1D4B)抗体购自DSHB公司,所用荧光二抗购自Molecular Probes公司。TUNEL试剂盒购自Roche公司。Mito-Tracker Green和LysoTracker Red购自碧云天公司。使用X-Rad 320辐照仪对培养的肠类器官进行照射。
1.3 肠类器官培养和收集方法进行类器官培养前,首先将贴壁生长至80%融合状态的细胞消化成单细胞,1 200 r/min离心后用PBS重悬细胞,并计数,按照1×105/mL调整细胞数后再次离心,加入液态Matrigel重悬细胞,按照每10 μL Matrigel中含有1×104细胞接种至96孔板,将培养板在37 ℃培养箱中放置15 min使Matrigel固化,随后加入0.1 mL完全培养基进行培养。按照所需时间点使用Corning公司的细胞回收液(货号:354253)回收Matrigel中的细胞,使用10%中性甲醛固定30 min后用于实验。
1.4 单细胞流式分选胰酶消化并收集生长状态良好的Caco-2细胞,离心并使用流式分选缓冲液(不含钙离子和镁离子的HBSS中加入1% FBS和1 μmol/L EDTA)进行重悬,调整细胞数至1×105/mL,使用40 μm孔径细胞筛过滤后进行流式分选。分选获得的Caco-2单细胞使用Matrigel进行培养,培养方法同前。
1.5 定量PCR检测收集贴壁培养(2D)和Matrigel培养(3D)的Caco-2细胞,加入RNAiso进行裂解,提取总RNA,使用NanoDrop2000测定RNA浓度与纯度。使用TaKaRa公司PrimeScriptTM RT reagent Kit with gDNA Eraser进行反转录获取cDNA。人Lgr5、Olfm4、Ki67和GAPDH基因的qPCR引物由华大基因公司合成,相应引物序列及产物大小见表 1。使用SYBR® Premix Ex TaqTM Ⅱ配制反应液,使用BioRad荧光定量PCR仪进行扩增和检测。PCR反应程序为:95 ℃预变性5 min,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40次循环。获取样本对应基因的Ct值,按照2-ΔΔCt法进行数据处理,使用GAPDH作为内参基因。
| 引物名称 | 引物序列 | 产物/bp |
| Lgr5 | 上游5′-CTCCCAGGTCTGGTGTGTTG-3′ 下游5′-GAGGTCTAGGTAGGAGGTGAAG-3′ |
149 |
| Olfm4 | 上游5′-ACTGTCCGAATTGACATCATGG-3′ 下游5′-TTCTGAGCTTCCACCAAAACTC-3′ |
135 |
| Ki67 | 上游5′-ACGCCTGGTTACTATCAAAAGG-3′ 下游5′-CAGACCCATTTACTTGTGTTGGA-3′ |
207 |
| GAPDH | 上游5′-GGAGCGAGATCCCTCCAAAAT-3′ 下游5′-GGCTGTTGTCATACTTCTCATGG-3′ |
197 |
1.6 常规染色及免疫荧光染色
固定后的肠类器官和小肠组织按照常规方法进行石蜡包埋,切片厚度为4 μm。经二甲苯和梯度酒精脱蜡至水后,使用pH=6.0枸橼酸盐缓冲液煮沸15 min进行抗原修复。使用含1% Triton X-100的抗体封闭液室温条件下封闭30 min,吸去封闭液后,滴加一抗工作液。兔抗Ki67抗体稀释比为1 :200,大鼠抗lamp1抗体稀释比为1 :500。4 ℃孵育过夜后,使用PBS清洗3次,每次5 min,洗去未结合一抗。加入AlexFluo 594标记的山羊抗兔或山羊抗大鼠荧光二抗(稀释比为1 :500),室温条件下避光孵育30 min,洗去未结合二抗并复染DAPI,使用抗荧光淬灭封片剂进行封片。
1.7 Mito-Tracker Green和LysoTracker Red标记细胞线粒体和溶酶体接种Caco-2细胞至共聚焦小皿内,生长过夜后使用完全培养基按照1 :1 000稀释Mito-Tracker Green和LysoTracker Red荧光探针,37 ℃培养箱内避光孵育30 min,使用完全培养基洗去未结合探针后加入新鲜培养基用于实验。
1.8 TUNEL染色Caco-2肠类器官分别接受5 Gy和15 Gy照射并固定制样。使用Roche公司的TUNEL染色试剂盒进行染色,具体操作按照说明书进行。
1.9 统计学分析使用Olympus BX51显微镜和Leica LSM SP5共聚焦显微镜采集明场、HE和共聚焦图像。使用Image J软件测定肠类器官直径。使用GraphPad Prism 7.0进行数据统计分析,两组间数据比较使用独立样本t检验,检验水准:α=0.05。
2 结果 2.1 不同培养条件下三种肠上皮细胞株的形态比较常规培养可见IEC-6、CT26. WT和Caco-2三种细胞株均为贴壁生长,其中IEC-6和Caco-2为鹅卵石样外观,呈上皮样细胞形态特点。CT26. WT细胞为纺锤形生长,细胞呈现极性,而非典型的上皮样外观。分别将3种细胞株接种至Matrigel中培养10 d后,可见此3种细胞均可形成细胞团,高倍镜下可见IEC-6和CT26. WT两种细胞培养所得细胞团均为结构致密的实心细胞团,未见到肠类器官所具有的空心样结构,而Caco-2细胞经Matrigel培养后可形成典型的空腔样肠类器官结构(图 1)。尝试延长IEC-6和CT26. WT细胞在3D培养体系内的培养时间,发现即使培养至21 d也仍未见到其形成肠类器官样结构。表明目前所使用的3种肠上皮细胞株中,仅Caco-2细胞可形成肠类器官。
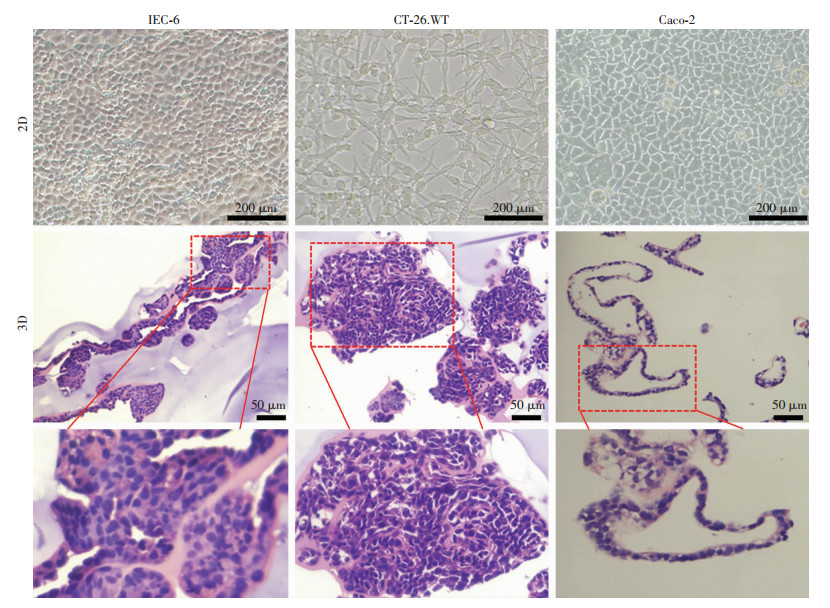
|
| 图 1 2D培养和3D培养10 d时3种肠上皮细胞株的形态对比 |
2.2 流式分选的Caco-2单细胞可形成肠类器官
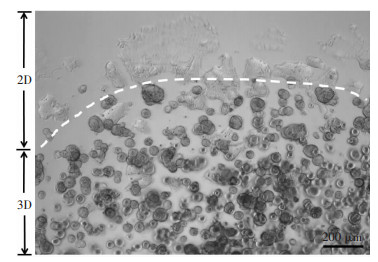
由于上述培养Caco-2来源肠类器官过程中,使用常规消化和吹打难以保证所获取的Caco-2细胞均为单细胞,进一步使用流式细胞仪分选单个Caco-2细胞并进行培养(图 2)。将Caco-2单细胞接种到Matrigel后,细胞生长迅速,接种后3 d即形成肠类器官,接种后12 d可形成明显的中空性肠类器官(图 3)。接种后3、7、12 d的肠类器官直径分别为(123.6±5.9)、(154.3±5.6)、(218.3 ± 11.4)μm(图 4)。我们发现培养时位于Matrigel边缘的Caco-2类器官在生长过程中会脱离Matrigel。这将导致其失去3D肠类器官样结构进而转变为贴壁生长状态(图 5)。证实Caco-2单细胞可在3D支持条件下形成肠类器官。
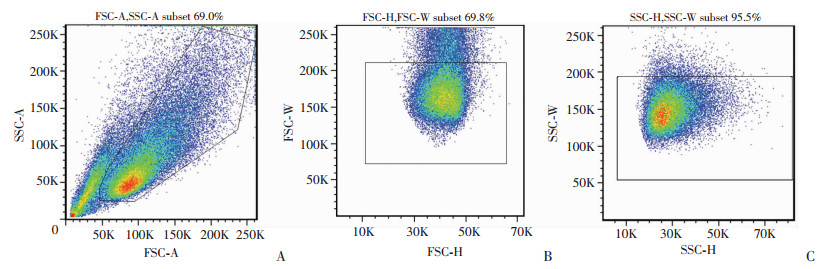
|
| A:细胞分布;B:FSC分选单细胞;C:SSC分选单细胞 图 2 流式细胞仪分选Caco-2单细胞 |
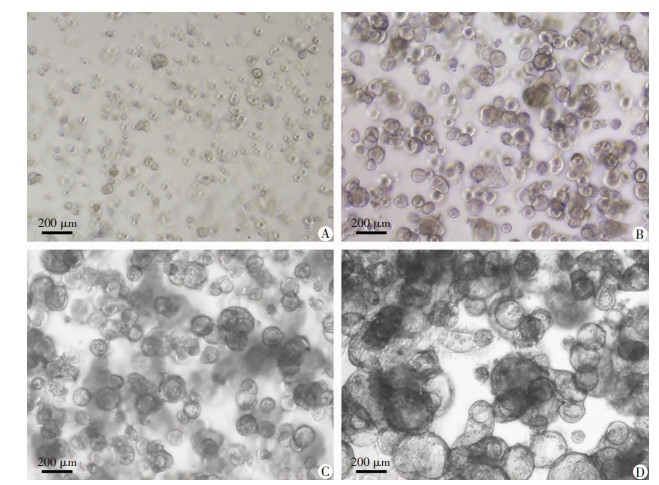
|
| A:接种1 d后细胞形态;B:接种3 d后肠类器官形态;C:接种7 d后肠类器官形态;D:接种12 d后肠类器官形态 图 3 3D条件下Caco-2单细胞形成肠类器官的动态变化 |
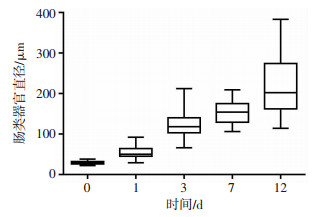
|
| 图 4 3D培养时Caco-2来源肠类器官直径的动态变化 |
|
| 图中白色虚线为孔板内Matrigel边界 图 5 培养5 d时Matrigel内外Caco-2细胞形态 |
2.3 不同培养条件下Caco-2细胞中肠道干细胞基因表达和增殖能力的比较
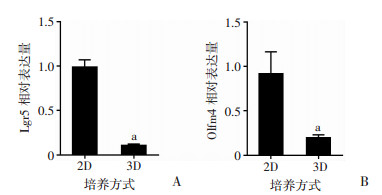
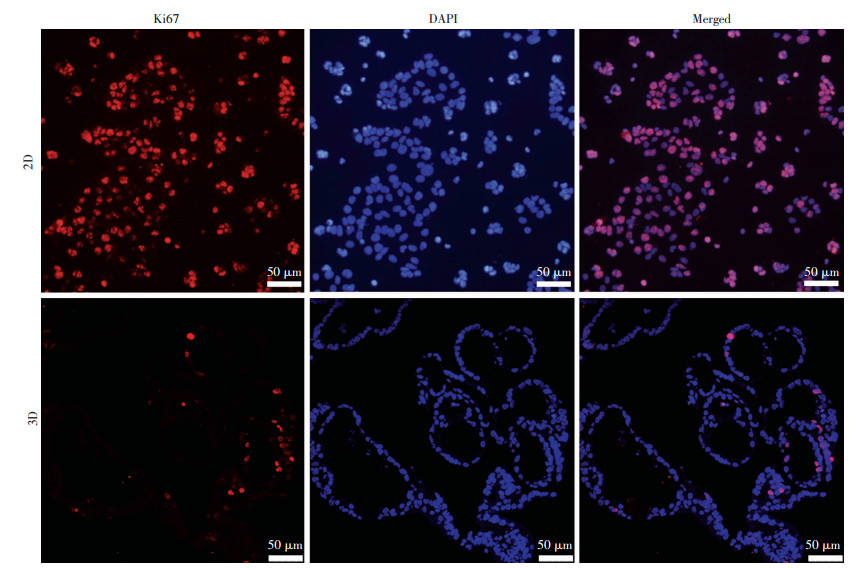
使用qPCR检测2D和3D培养7 d的Caco-2细胞中肠道干细胞标志物Lgr5和Olfm4的基因表达差异。实验结果显示,3D培养时Caco-2来源肠类器官内Lgr5基因mRNA表达水平仅为2D培养时的10%(P < 0.01),Olfm4基因的mRNA表达水平约为2D培养时的20%(P < 0.01),均显著低于贴壁培养时表达水平(图 6)。3D培养7 d时细胞增殖标志物Ki67阳性Caco-2细胞较2D培养时明显减少,定量PCR结果显示3D培养的Caco-2细胞内Ki67的mRNA水平约为对照组的46%(P < 0.05,图 7)。结果证实Caco-2细胞在3D培养时肠道干细胞相关基因表达水平和增殖能力均比贴壁培养时显著下降。
|
| A:Lgr5;B:Olfm4 a:P < 0.01,与2D培养相比较 图 6 2D和3D培养7d时Caco-2细胞中肠道干细胞基因的表达水平比较 |
|
| 图 7 免疫荧光和qPCR检测2D和3D培养7 d时Caco-2细胞内Ki67表达水平 |
2.4 2D和3D培养条件下Caco-2细胞内溶酶体分布特点比较
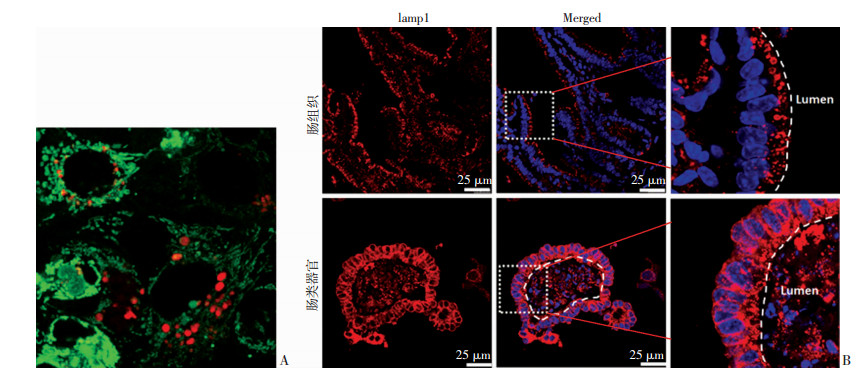
使用LysoTracker标记活细胞内溶酶体,可见贴壁生长的Caco-2细胞内溶酶体均匀分布于胞质中(图 8A)。正常肠道组织染色中lamp1阳性的溶酶体多分布于肠上皮细胞的肠腔面,而3D培养10 d所形成的Caco-2肠类器官中溶酶体也主要分布于上皮细胞的腔面,分布具有明显极性,更加类似于体内肠上皮细胞中溶酶体的分布特点(图 8B)。结果证实Caco-2肠类器官具有和体内肠上皮细胞相似的溶酶体分布特点,较2D培养更为接近在体形态。
|
| A: 2D培养中Caco-2细胞内的溶酶体(红色)和线粒体(绿色)分布;B:小鼠肠上皮细胞和3D培养时Caco-2细胞内溶酶体(红色)分布 图 8 2D和3D培养时Caco-2细胞形成的肠类器官内溶酶体分布特点 |
2.5 电离辐射可引起Caco-2肠类器官发生细胞凋亡
肠隐窝细胞对电离辐射损伤非常敏感。使用原位凋亡染色(TUNEL)检测3D培养7 d的Caco-2肠类器官在不同剂量照射后的凋亡细胞比例。从图 9可见,5 Gy和15 Gy照射后24 h Caco-2来源肠类器官可出现明显的TUNEL阳性细胞,且TUNEL阳性细胞数量随照射剂量增加而增多。因此,电离辐射能够引起Caco-2来源肠类器官出现细胞凋亡,且凋亡比例与照射剂量密切相关。
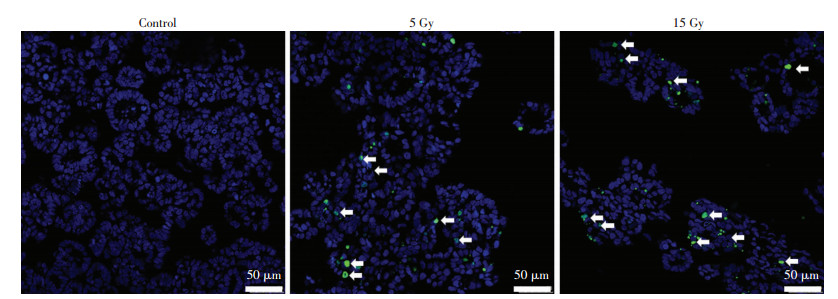
|
| 白色箭头示TUNEL阳性细胞 图 9 电离辐射诱导3D培养7 d的Caco-2肠类器官发生细胞凋亡 |
3 讨论
细胞培养是长期以来生物医学研究的重要手段,而传统细胞培养方法特别是常规贴壁培养完全不具备相应细胞在体内的三维空间结构,因此贴壁培养难以很好地模拟在体组织结构特点。自Hans Clevers实验室建立起肠类器官培养技术以来,该技术被广泛应用。近来出现的脑类器官[8]、肝类器官[9]、肾类器官[10]等类器官培养手段为体外研究特定组织和器官的三维结构、疾病发生、组织再生修复及药物评价提供了全新的体外研究模型。例如MATANO等[11]培养了正常人结肠类器官,并使用CRISPR-Cas9介导抑癌基因APC、SMAD4、TP53和癌基因KRAS、PIK3CA突变来研究结肠癌的病因,为体外研究结肠癌发病机制提供了一种全新模型。
获取肠类器官时,由于不同实验室在肠隐窝分离操作和培养过程中所用方法不尽相同,使得研究结果呈现出较大差异。此外,使用临床样本进行培养时,由于存在较大个体差异,难以保证实验结果的稳定性,所以有必要建立一种具有共同来源的肠类器官培养方法,于是我们提出是否能够利用已有的肠上皮细胞株进行3D培养来获取肠类器官。我们首先选取了目前广泛使用的3种肠上皮细胞株尝试培养肠类器官,发现只有结肠癌上皮细胞株Caco-2能够培养形成中空的肠类器官样结构。
不同细胞株形成肠类器官能力的差别主要取决于细胞自身特性。单个肠道干细胞具有体外形成类器官的能力,但本课题使用的正常肠上皮细胞IEC-6并未能培养出肠类器官,我们推测由于IEC-6胞质内有大量溶酶体且形态更加趋向于终末分化的肠上皮细胞,因此IEC-6细胞已不具备肠道干细胞特性从而导致其不能形成肠类器官。结肠癌组织分离得到的肠隐窝培养后所形成的类器官具有更强的增殖潜能[12],可形成具有更多更长隐窝凸起的肠类器官结构。因此,本实验中使用结肠癌细胞Caco-2能够培养获得肠类器官。尽管CT26. WT细胞株同样来源于结肠癌,但其为成纤维细胞样生长,已经不具备典型的肠上皮细胞特点,3D培养时其难以形成肠类器官所需的肠上皮细胞之间的紧密连接,所以该细胞株不能培养形成肠类器官。
不同的培养体系会显著影响细胞的生物学特性[13]。本研究比较了贴壁生长和3D培养下Caco-2细胞的肠道干细胞相关基因和细胞增殖标志物Ki67的表达情况。实验结果证实,3D培养条件下Caco-2细胞中肠道干细胞标志物Lgr5和Olfm4的mRNA水平较贴壁培养时降低,这一结果提示3D培养时仅少量Caco-2具有干细胞特性,与在体条件下结肠干细胞含量较少的特点更为一致。3D培养时Caco-2细胞的溶酶体分布非常接近在体肠上皮细胞溶酶体的分布特点。因此,Caco-2肠类器官在细胞组成和亚细胞器分布等方面均较贴壁培养的Caco-2细胞更加接近在体状态。电离辐射能够引起Caco-2肠类器官发生细胞凋亡,且具有剂量依赖性,所以Caco-2来源肠类器官具有和原代肠组织培养所得肠类器官相似的辐射敏感性。
由于目前尚无正常成年人来源肠上皮细胞株,本研究采用了人结肠癌细胞株Caco-2来培养肠类器官。尽管在3D培养体系中该细胞能够形成肠类器官结构,且在干细胞相关基因表达、增殖能力和亚细胞器分布等方面和正常肠上皮和肠类器官具有很高的相似性,但该细胞内终究含有许多突变基因,因此,使用Caco-2细胞培养肠类器官并进行相关评价时,还需对这一点进行充分考虑。
综上,本研究发现人结肠癌上皮细胞株Caco-2具有在3D培养体系中形成肠类器官的潜能,为后续进行胃肠道电离辐射生物学研究和抗结肠癌药物评价提供了一种新的体外研究模型。
| [1] |
SATO T, VRIES R G, SNIPPERT H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262-265. DOI:10.1038/nature07935 |
| [2] |
SCHEPERS A G, SNIPPERT H J, STANGE D E, et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas[J]. Science, 2012, 337(6095): 730-735. DOI:10.1126/science.1224676 |
| [3] |
SCHMITT M, SCHEWE M, SACCHETTI A, et al. Paneth cells respond to inflammation and contribute to tissue regeneration by acquiring stem-like features through SCF/c-kit signaling[J]. Cell Rep, 2018, 24(9): 2312-2328.e7. DOI:10.1016/j.celrep.2018.07.085 |
| [4] |
STELZNER M, HELMRATH M, DUNN J C, et al. A nomenclature for intestinal in vitro cultures[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(12): G1359-G1363. DOI:10.1152/ajpgi.00493.2011 |
| [5] |
YUAN Y H, DING D K, ZHANG N, et al. TNF-α induces autophagy through ERK1/2 pathway to regulate apoptosis in neonatal necrotizing enterocolitis model cells IEC-6[J]. Cell Cycle, 2018, 17(11): 1390-1402. DOI:10.1080/15384101.2018.1482150 |
| [6] |
XU J X, XIONG W, ZENG Z, et al. Effect of ART1 on the proliferation and migration of mouse colon carcinoma CT26 cells in vivo[J]. Mol Med Rep, 2017, 15(3): 1222-1228. DOI:10.3892/mmr.2017.6152 |
| [7] |
HIDALGO I J, RAUB T J, BORCHARDT R T. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability[J]. Gastroenterology, 1989, 96(3): 736-749. DOI:10.1016/0016-5085(89)90897-4 |
| [8] |
WANG Z, WANG S N, XU T Y, et al. Organoid technology for brain and therapeutics research[J]. CNS Neurosci Ther, 2017, 23(10): 771-778. DOI:10.1111/cns.12754 |
| [9] |
KRUITWAGEN H S, OOSTERHOFF L A, VERNOOIJ I G W H, et al. Long-term adult Feline liver organoid cultures for disease modeling of hepatic steatosis[J]. Stem Cell Rep, 2017, 8(4): 822-830. DOI:10.1016/j.stemcr.2017.02.015 |
| [10] |
MORIZANE R, BONVENTRE J V. Kidney organoids: A translational journey[J]. Trends Mol Med, 2017, 23(3): 246-263. DOI:10.1016/j.molmed.2017.01.001 |
| [11] |
MATANO M, DATE S, SHIMOKAWA M, et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids[J]. Nat Med, 2015, 21(3): 256-262. DOI:10.1038/nm.3802 |
| [12] |
MADISON B B, LIU Q, ZHONG X, et al. LIN28B promotes growth and tumorigenesis of the intestinal epithelium via Let-7[J]. Genes Dev, 2013, 27(20): 2233-2245. DOI:10.1101/gad.224659.113 |
| [13] |
SATO T, CLEVERS H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications[J]. Science, 2013, 340(6137): 1190-1194. DOI:10.1126/science.1234852 |



