血管生成素样蛋白2(angiopoietin-like protein 2,Angptl2)属于血管生成素样蛋白家族(angiopoietin-like proteins,ANGPTLs),是一种分泌性糖蛋白,在全身各个器官中都有表达。在缺氧、高压、炎症等刺激下,Angptl2表达会增高[1-2]。它在全身各种急慢性炎症中被认为是重要的炎症诱导因子[3-5]。炎症性病变在眼内也非常常见,如眼内炎、视网膜炎、葡萄膜炎等。研究表明当眼内发生炎症性病变时,Angptl2的mRNA表达也会增高,并可诱导巨噬细胞向眼内迁移,释放IL-1β、IL-6和TNF-a等促炎因子[6-7]。但Angptl2在眼内诱导炎症的机制及通路尚不完全明确。既往研究表明Angptl2诱导炎症的主要机制是通过结合单核/巨噬细胞来促进促炎症因子的释放[8-9],而视网膜中缺乏单核/巨噬细胞,Müller胶质细胞被认为是视网膜炎症因子的主要来源[10]。因此,我们推测Angptl2可能激活视网膜Müller细胞参与眼内炎症。本研究旨在证明Angptl2在眼内促进炎症的作用和机制。
1 材料与方法 1.1 材料 1.1.1 细胞提取的原代Müller细胞来自于SD新生大鼠(24 h之内),雌雄不限。
1.1.2 主要试剂Angptl2抗体(R & D systems, 美国),重组Angptl2(R & D systems, 美国),PirB一抗(R & D systems, 美国),Ad-PirB-siRNA(R & Dsystems, 美国), LPS(碧云天)。IL-1β正向引物:5′-GAGTCTGCACAGTTCCCCAA-3′,反向引物:5′-ATGTCCCGACCATTGCTGTT-3′;IL-6正向引物:5′-ACCCCAACTTCCAATGCTCT-3′,反向引物:5′-GGTTTGCCGAGTAGACCTC-3′;TNF-α正向引物:5′-AACACACGAGACGCTG-AAGT-3′,反向引物:5′-TCCAGTGAGTTCCGAAAGCC-3′(擎瑞科技)。
1.2 实验方法 1.2.1 急性眼内炎症模型的诱导SD大鼠雄性,8周龄,体质量180~200 g,由陆军军医大学大坪医院实验动物中心提供[许可证号:SCXK(渝)20020003]。实验组大鼠单眼玻璃体腔注射用PBS稀释的0.2 mg LPS(R & D,美国)[7],对照组注射同等体积的PBS,所有大鼠在LPS注射6 h后检测视网膜基因的表达。
1.2.2 Müller原代细胞培养SD大鼠(出生24 h之内)用75%乙醇消毒、处死,立即摘取眼球置于含10% FBS的DMEM培养基中,于37 ℃ CO2培养箱中孵育24 h,解剖显微镜下沿角巩膜缘剪除角膜,显微镊夹出晶状体以及玻璃体,分离出视网膜,剪碎,转移到含10% FBS的4 mL DMEM培养基中,37 ℃ CO2培养箱中孵育3~5 d后换液,7 d后传代。
1.2.3 Müller细胞纯度鉴定将Müller细胞依次用4%多聚甲醛室温固定,0.1% Triton打孔,10%山羊血清封闭,分别加入一抗(兔单克隆抗Vimentin 1 :200)以及PBS代替一抗做阴性对照,4 ℃孵育过夜。第2天,两组皆加入羊抗兔荧光二抗(1 :300),DAPI染核(1 :1 000)。荧光显微镜下每孔细胞在左上、右上、中、左下、右下等5个区域,每个区域拍一张照片,对Vimentin阳性表达细胞计数。Müller细胞纯度=Vimentin阳性细胞表达数/DAPI核染阳性细胞总数×100%。
1.2.4 细胞计数板计数观察Müller细胞的增殖以最终浓度1 μg/mL的外源性Angptl2加入Müller细胞中,培养0、6、18、24 h后,用胰酶消化Müller细胞,离心,去上清,加入200 μL DMEM轻轻吹打混匀,取20 μL滴于细胞计数板上,在计数仪上读取数值。重复3次取均值。
1.2.5 免疫荧光观察Müller细胞胶质激活以及PirB在Müller细胞中的表达将Müller细胞按照完全随机法分为实验组和对照组,实验组加入以最终浓度1 μg/mL的外源性Angptl2,对照组加入等体积PBS,37 ℃ CO2培养箱中培养24 h。4%多聚甲醛(PFA)固定,0.1% Triton穿孔,室温封闭30 min,倾去,勿洗;滴加一抗(PirB山羊抗大鼠单克隆抗体,1 :200,GFAP:抗大鼠1 :150,PBS稀释,PBS代替一抗为阴性对照组),4 ℃孵育过夜;以下步骤注意避光:PBS清洗,滴加二抗(FITC标记驴抗山羊IgG,1 :150,FITC标记的兔抗大鼠IgG,1 :150,PBS稀释),37 ℃孵育90 min,PBS清洗;抗淬灭封片剂封片;荧光显微镜下照相。
1.2.6 Western blot检测Ad-PirB-siRNA的干扰效率将Müller细胞按照完全随机法分为实验组和对照组,实验组加入Ad-PirB-siRNA腺病毒载体,对照组加入同等体积腺病毒对照Ad-C 0.5 μL,培养5 d,蛋白提取,SDS-PAGE电泳,一抗(山羊抗大鼠PirB多克隆抗体, 1 :1 000,5%脱脂奶粉稀释;小鼠抗大鼠β-actin单克隆抗体,1 :1 000,5%脱脂奶粉稀释)4 ℃摇床孵育过夜,TBST漂洗;二抗(HRP标记的驴抗山羊IgG,兔抗小鼠IgG,1 :5 000,5%脱脂奶粉稀释)室温摇床孵育2 h,TBST漂洗;PVDF膜曝光。
1.2.7 Real-time PCR检测Müller细胞中炎症因子IL-1β、IL-6、TNF-α的表达实验分为2大组,第1大组:实验组中Müller细胞加入以最终浓度1 μg/mL的外源性Angptl2,对照组中Müller细胞加同等体积PBS,37 ℃ CO2培养箱培养24 h;第2大组:Müller细胞外源性加入Angptl2后,再分别转染Ad-PirB-siRNA腺病毒载体和腺病毒对照Ad-C,分为PBS对照组、Angptl2组、Ad-C+Angptl2组、Ad-PirB-siRNA+Angptl2组。采用TRIzol Reagent提取总RNA,参照PrimeScriptTM RT reagent Kit试剂盒说明对RNA进行逆转录,再采用SYBR® Premix Ex TaqTM Ⅱ进行荧光定量PCR检测各组炎症因子IL-1β、IL-6、TNF-α的mRNA表达。
1.3 统计学分析使用SPSS 21.0统计软件进行分析,相对表达量以x±s表示,2组间差异比较采用t检验,4组间差异比较采用方差分析,差异有统计学意义时进一步用LSD法做两两比较,检验水准:α=0.05。
2 结果 2.1 LPS诱导眼内Angptl2的mRNA表达增加LPS玻璃体腔注射后,RT-PCR显示实验组大鼠的Angptl2 mRNA(2.153±0.129)表达较对照组(1.001±0.055)明显增高,差异具有统计学意义(P < 0.05)。
2.2 Angptl2激活Müller细胞增殖在Müller细胞中加入外源性Angptl2后,Angptl2组与PBS对照组的24 h细胞增殖率分别为478%、103%,24 h的细胞计数曲线显示Angptl2组较PBS组增殖速率加快(图 1);低倍显微镜下可见在18、24 h的Müller细胞,Angptl2组增殖较PBS组多,0、6 h无明显变化(图 2),与细胞计数增殖曲线相符。
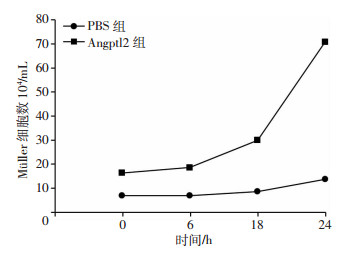
|
| 图 1 加入外源性Angptl2后Müller 24 h的细胞计数分析 |

|
| 图 2 显微镜下观察加入外源性Angptl2后0、6、18、24 h Müller细胞增殖变化 (×200) |
2.3 Angptl2促进Müller细胞活化释放促炎因子
荧光显微镜下Angptl2组GFAP表达较PBS对照组明显增加(图 3A)。RT-PCR检测加入外源性Angptl2 6 h后,Angptl2组Müller细胞分泌的促炎因子IL-1β、IL-6、TNF-α均高于PBS对照组,差异具有统计学意义(P < 0.05,图 3B)。

|
| A:加入外源性Angptl2 24 h Müller细胞GFAP的表达(荧光显微镜×200);B:加入外源性Angptl2 6 h Müller细胞促炎因子IL-1β、IL-6、TNF-α的表达 a: P < 0.05, 与PBS组比较 图 3 Angptl2促进Müller细胞活化释放促炎因子 |
2.4 干扰PirB表达可抑制Müller细胞分泌促炎因子
Müller细胞的鉴定及其PirB的表达见图 4,纯度约为95%;Müller细胞转染Ad-PirB后,PirB蛋白的表达明显降低(图 5);Müller细胞加入外源性Angptl2 6 h后,RT-PCR可见Ad-PirB-siRNA+Angptl2组较Angptl2组和Ad-C+Angptl2组炎症因子IL-6、TNF-α降低,差异具有统计学意义(P < 0.05,图 6)。
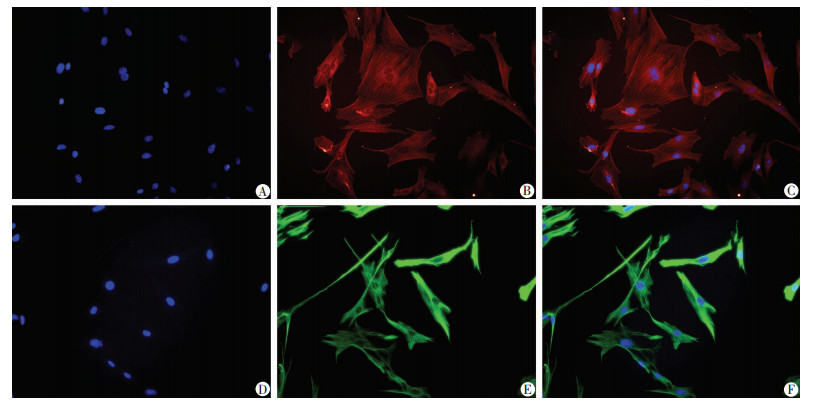
|
| A:DAPI;B:PirB;C:DAPI+PirB;D:DAPI;E:Vimentin;F:DAPI+Vimentin PirB呈红色,Vimentin呈绿色 图 4 Müller细胞的鉴定及PirB的表达 (荧光显微镜×200) |
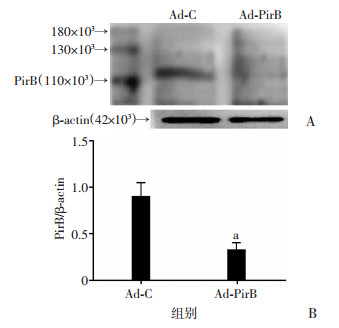
|
| a: P < 0.05,与Ad-C组比较 图 5 Western blot检测PirB的干扰效率及半定量分析 |
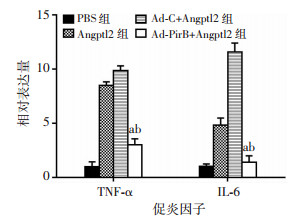
|
| a: P < 0.05,与Angptl2组比较;b: P < 0.05,与Ad-C+Angptl2组比较 图 6 干扰PirB后促炎因子IL-6、TNF-α的表达 |
3 讨论
近年来,Angptl2被认为是重要的炎症诱导因子,研究表明Angptl2在角膜炎、炎症性脉络膜新生血管、急性眼内炎中参与了重要作用[6-7, 9]。LPS眼内注射是经典的急性眼内炎症模型,LPS注入眼内后不仅可引起葡萄膜炎症,也可引起视网膜的炎症(如Behcet’s病)[11]。本研究也证实在大鼠玻璃体腔注射LPS诱导眼内急性炎症后,可明显促进视网膜Angptl2的表达。Angptl2可由脂肪细胞、巨噬细胞和内皮细胞分泌[12]。我们推测玻璃体腔注入LPS后视网膜Angptl2的增高可能来自于视网膜小胶质细胞或吸附至视网膜血管的白细胞。在视网膜,小胶质细胞活化后充当“巨噬细胞”发挥免疫和吞噬功能,白细胞浸润增多,它们成了Angptl2新的来源,形成炎症的级联扩大反应,进一步促进视网膜炎症的发展[7]。
但Angptl2诱导视网膜炎症的作用和机制目前尚不明确。既往研究主要以单核/巨噬细胞为研究对象,发现Angptl2主要通过integrin α5β1,进一步激活NF-κB通路,来促进促炎症因子的释放[8-9, 13]。但视网膜中缺乏单核/巨噬细胞,既往研究认为视网膜小胶质细胞是视网膜的主要免疫细胞,当小胶质细胞活化后,可发挥类似巨噬细胞的功能,通过TLR4/NF-κB通路,分泌IL-6、TNF-α等促炎因子,增加视网膜促炎细胞和促炎因子的释放和聚集,形成视网膜慢性炎症环境,介导如缺血性视网膜病变、糖尿病性视网膜病变等慢性低度炎症[14-15]。但在这些视网膜的炎症中,不光有小胶质细胞的活化,还有大量Müller细胞的激活,两者可通过促炎因子、趋化因子和黏附分子等相互作用,共同介导视网膜的炎症[16-17]。但小胶质细胞仅占视网膜胶质细胞的10%~20%[18],Müller细胞才是视网膜主要的且特有的胶质细胞,它贯穿视网膜全层,对视网膜起着支架作用,是视网膜炎症因子最主要的来源[10]。在炎症情况下,Müller细胞反应性胶质激活,GFAP表达增多,分泌细胞因子如IL-1β、TNF-α、IL-6、IL-8、趋化因子等参与炎症的发展[19]。因此,我们在Müller细胞加入外源性Angptl2刺激后,Müller细胞增殖率明显高于PBS对照组,Angptl2组GFAP表达较PBS对照组也明显增加。Angptl2激活Müller细胞还进一步促进炎症因子IL-1β、IL-6、TNF-α的分泌。说明Angptl2能促进视网膜Müller细胞参与炎症因子的分泌。
ANGPTLs一直被认为是“孤儿”配体,虽然结构上与血管生成素相似,但并不与血管生成素的受体结合。研究发现人类白细胞免疫球蛋白(Ig)B2受体[leukocyte immunoglobulin (Ig)-like receptor B2,LILRB2]及在鼠的直接同源物配对免疫球蛋白样受体B(paired Ig-like receptor B,PirB)是多种ANGPTLs的受体,ANGPTLs通过与PirB相结合发挥下游信号[20],另有研究发现Angptl2可与PirB结合抑制胶原受体糖蛋白Ⅵ和整合素aiibb3介导的信号通路,抑制血小板的激活[21]。因此,我们推测Angptl2可能与其受体PirB结合激发下游信号。本研究发现视网膜Müller细胞上也存在PirB的表达。进一步采用腺病毒载体对Müller细胞的PirB干扰后,Ad-PirB-siRNA+Angptl2组较单独Angptl2组和对照组的炎症因子IL-6、TNF-α显著降低, 说明在视网膜Müller细胞上,Angptl2可能是通过PirB来调控炎症因子的释放。
综上,本研究发现Angptl2诱导眼内炎症的新作用机制,Angptl2能够促进视网膜Müller细胞增殖,胶质激活,并且通过PirB来促进Müller细胞促炎因子IL-1β、IL-6、TNF-α的释放参与眼内炎症的发展。此外,既往研究表明PirB配体主要有MHC Ⅰ类分子和髓鞘相关抑制因子,主要表达在神经元细胞和各种免疫细胞(如T细胞、B细胞、肥大细胞、巨噬细胞等),主要参与抑制神经生长和免疫反应。我们发现PirB除了上述作用外,还可表达在视网膜Müller细胞参与眼内炎症。但本研究也有不足,许多疾病均与炎症相关,本研究并没有对特定某种炎症疾病进行研究,也未研究Angptl2对其他视网膜胶质细胞(如小胶质细胞)的作用,缺乏炎症因子的蛋白水平检测。另外,本研究有待进一步体内验证眼内炎症状态下Müller的增殖及激活,以及在体抑制PirB表达后促炎因子的变化,这能更有力的证明Angptl2通过PirB介导眼内炎症。
| [1] |
TABATA M, KADOMATSU T, FUKUHARA S, et al. Angiopoietin-like protein 2 promotes chronic adipose tissue inflammation and obesity-related systemic insulin resistance[J]. Cell Metab, 2009, 10(3): 178-188. DOI:10.1016/j.cmet.2009.08.003 |
| [2] |
KADOMATSU T, TABATA M, OIKE Y. Angiopoietin-like proteins: emerging targets for treatment of obesity and related metabolic diseases[J]. FEBS J, 2011, 278(4): 559-564. DOI:10.1111/j.1742-4658.2010.07979.x |
| [3] |
WANG J Y, XIAO H B, SUN Z L, et al. Angiopoietin-like protein 2 may mediate the inflammation in murine mastitis through the activation of interleukin-6 and tumour necrosis factor-Α[J]. World J Microbiol Biotechnol, 2015, 31(8): 1235-1240. DOI:10.1007/s11274-015-1873-7 |
| [4] |
UMIKAWA M, UMIKAWA A, ASATO T, et al. Angiopoietin-like protein 2 induces proinflammatory responses in peritoneal cells[J]. Biochem Biophys Res Commun, 2015, 467(2): 235-241. DOI:10.1016/j.bbrc.2015.09.183 |
| [5] |
NAKAMURA T, OKADA T, ENDO M, et al. Angiopoietin-like protein 2 promotes inflammatory conditions in the ligamentum flavum in the pathogenesis of lumbar spinal canal stenosis by activating interleukin-6 expression[J]. Eur Spine J, 2015, 24(9): 2001-2009. DOI:10.1007/s00586-015-3835-z |
| [6] |
TOYONO T, USUI T, YOKOO S, et al. Angiopoietin-like protein 2 is a potent hemangiogenic and lymphangiogenic factor in corneal inflammation[J]. Invest Ophthalmol Vis Sci, 2013, 54(6): 4278-4285. DOI:10.1167/iovs.12-11497 |
| [7] |
KANDA A, NODA K, OIKE Y, et al. Angiopoietin-like protein 2 mediates endotoxin-induced acute inflammation in the eye[J]. Lab Invest, 2012, 92(11): 1553-1563. DOI:10.1038/labinvest.2012.111 |
| [8] |
YANG W, LIU W, YU W, et al. Angptl2 deficiency attenuates paraquat (PQ)-induced lung injury in mice by altering inflammation, oxidative stress and fibrosis through NF-κB pathway[J]. Biochem Biophys Res Commun, 2018, 503(1): 94-101. DOI:10.1016/j.bbrc.2018.05.186 |
| [9] |
BHATTACHERJEE P, WILLIAMS R N, EAKINS K E. An evaluation of ocular inflammation following the injection of bacterial endotoxin into the rat foot pad[J]. Invest Ophthalmol Vis Sci, 1983, 24(2): 196-202. |
| [10] |
BRINGMANN A, IANDIEV I, PANNICKE T, et al. Cellular signaling and factors involved in Müller cell gliosis:neuroprotective and detrimental effects[J]. Prog Retin Eye Res, 2009, 28(6): 423-451. DOI:10.1016/j.preteyeres.2009.07.001 |
| [11] |
HOEKZEMA R, VERHAGEN C, VAN HAREN M, et al. Endotoxin-induced uveitis in the rat. The significance of intraocular interleukin-6[J]. Invest Ophthalmol Vis Sci, 1992, 33(3): 532-539. |
| [12] |
FARHAT N, MAMARBACHI A M, THORIN E, et al. Cloning, expression and purification of functionally active human angiopoietin-like protein 2[J]. Springerplus, 2014, 3: 337. DOI:10.1186/2193-1801-3-337 |
| [13] |
KUMAR A, PANDEY R K, MILLER L J, et al. Muller Glia in retinal innate immunity: a perspective on their roles in endophthalmitis[J]. Crit Rev Immunol, 2013, 33(2): 119-135. DOI:10.1615/CritRevImmunol.2013006618 |
| [14] |
FEIT-LEICHMAN R A, KINOUCHI R, TAKEDA M, et al. Vascular damage in a mouse model of diabetic retinopathy: relation to neuronal and glial changes[J]. Invest Ophthalmol Vis Sci, 2005, 46(11): 4281-4287. DOI:10.1167/iovs.04-1361 |
| [15] |
LEE J J, WANG P W, YANG I H, et al. High-fat diet induces toll-like receptor 4-dependent macrophage/microglial cell activation and retinal impairment[J]. Invest Ophthalmol Vis Sci, 2015, 56(5): 3041-3050. DOI:10.1167/iovs.15-16504 |
| [16] |
WANG M, WANG X, ZHAO L, et al. Macroglia-microglia interactions via TSPO signaling regulates microglial activation in the mouse retina[J]. J Neurosci, 2014, 34(10): 3793-3806. DOI:10.1523/jneurosci.3153-13.2014 |
| [17] |
ABCOUWER S F. Müller cell-microglia cross talk drives neuroinflammation in diabetic retinopathy[J]. Diabetes, 2017, 66(2): 261-263. DOI:10.2337/dbi16-0047 |
| [18] |
HANISCH U K. Microglia as a source and target of cytokines[J]. Glia, 2002, 40(2): 140-155. DOI:10.1002/glia.10161 |
| [19] |
KIM I, MOON S O, KOH K N, et al. Molecular cloning, expression, and characterization of angiopoietin-related protein. angiopoietin-related protein induces endothelial cell sprouting[J]. J Biol Chem, 1999, 274(37): 26523-26528. DOI:10.1074/jbc.274.37.26523 |
| [20] |
ZHENG J K, UMIKAWA M, CUI C H, et al. Inhibitory receptors bind ANGPTLs and support blood stem cells and leukaemia development[J]. Nature, 2012, 485(7400): 656-660. DOI:10.1038/nature11095 |
| [21] |
FAN X M, SHI P L, DAI J, et al. Paired immunoglobulin-like receptor B regulates platelet activation[J]. Blood, 2014, 124(15): 2421-2430. DOI:10.1182/blood-2014-03-557645 |



