2. 102206 北京,北京生命科学研究所;
3. 400038 重庆,陆军军医大学(第三军医大学)第二附属医院,神经外科;
4. 400010 重庆,重庆医科大学附属第二医院麻醉科
2. National Institute of Biological Sciences, Beijing, 102206;
3. Department of Neurosurgery, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037;
4. Department of Anesthesiology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
哺乳动物的生物钟(circadian clock)指约24 h为周期的生理过程和周期行为[1]。哺乳动物的核心生物钟是由相互作用的顺式、反式转录调控元件构成的转录-翻译负反馈环路,其中正向转录因子CLOCK和BMAL1形成异源二聚体,结合在位于转录抑制因子CRY1、CRY2和PER1、PER2以及核激素受体REV-ERB启动子区域的E-box(CACGTG)元件上,从而调控其表达量,Per和Cry基因表达量增加后可反过来抑制CLOCK/BMAL1异源二聚体的活性[2]。
生物钟存在于生物体的多种生理及病理过程中,大量研究证实生物钟的紊乱与心脏疾病、糖尿病和癌症的进展具有显著相关性[3-5]。机体生物钟分为中枢生物钟和外周生物钟,中枢生物钟主要由视交叉上核(suprachiasmatic nucleus,SCN)调控。SCN能够接受外界的光照信息,调节机体的生物钟与外界同步。虽然机体外周组织不会对光照产生直接应答,但SCN接收光信息后能同步外周组织的生物钟,使机体形成一个同步的时钟[6]。外周组织的生物钟不单受到中枢时钟的调控,在一定程度上也可以自我调控[7]。有研究证实,地塞米松不会影响SCN中时钟基因的表达,但能够改变肝、肾、心时钟基因的相位[8]。同时,对于机体外周组织而言,其生物钟对于维持自身的正常功能更加重要[5]。所以在研究外界影响因素对机体生物钟的影响时,除了研究对中枢生物钟的影响,也很有必要研究对外周组织生物钟的影响。
研究证实,除了光照,噪音、饮食等外界因素能够影响机体生物钟[9-10],药物的使用也可能影响机体生物钟。有研究报道5.7%地氟醚白天麻醉大鼠5 h后能够显著降低大鼠的褪黑激素水平[11]。已知体内褪黑激素的分泌具有强健的时钟性,从而猜测地氟醚能够影响哺乳动物的生物钟,但目前地氟醚对哺乳动物中枢及外周生物钟分子层面影响的仍不清楚,且各浓度地氟醚的麻醉效果也不明确。因此,本研究探讨吸入麻醉药地氟醚的有效作用浓度,以及地氟醚有效作用浓度下对小鼠中枢、外周肾脏和肝脏组织时钟基因表达量的影响及其作用机制。
1 材料与方法 1.1 材料 1.1.1 动物40只8周雄性野生型C57BL/6J小鼠,购于南京模式动物中心。Per1-/-/Per2-/-母代小鼠由苏州大学剑桥-苏大基因组资源中心徐璎教授惠赠。小鼠均饲养于北京生命科学研究所SPF级动物房,室温24.3 ℃,湿度48.2%;开关灯时间分别为北京时间07:00和19:00。光照工作照度249 lx,动物照度18 lx,噪音50 dB,压强梯度30 Pa。野生型C57BL/6J小鼠饲养1周后开始实验;选择8只雄性、纯合、8~9周龄、体质量23~25 g的Per1-/-/Per2-/-小鼠进行实验,动物实验均按照北京生命科学研究所动物管理和使用委员会机构(Institutional Animal Care and Use Committee,IACUC)的指导方针进行。
1.1.2 试剂与耗材TRIzol、无RNA酶水购于Invitrogen公司;无水乙醇购于北京化工厂;异丙醇、氯化钠购于北京益利精细化学品有限公司;三氯甲烷购于国药集团化学试剂有限公司;RNA反转录试剂盒PrimeScriptTM RT Master Mix购于TaKaRa公司;Real-time PCR试剂盒KAPA SYBR FAST Real-time PCR Master Mix购于Kapa Biosystems公司。
1.1.3 仪器与设备气体麻醉诱导箱、废气回收罐购于沃瑞德生物科技有限公司;大容量离心机、低速冷冻离心机购于Eppendorf公司;CFX96荧光定量PCR仪购于Bio-Rad公司。
1.2 方法 1.2.1 基因鉴定将待鉴定基因型的小鼠鼠尾剪至EP管中,加入500 μL裂解液和5 μL蛋白酶K(20 mg/mL),置于55 ℃过夜,每管样本加入5 mol/L的氯化钠溶液300 μL,颠倒混匀,置于4 ℃离心机离心(12 000 r/min,10 min)。取上清液置新EP管中,每管加入与上清液等体积的异丙醇,颠倒混匀,室温静置15 min,出现白色沉淀,置于离心机离心(12 000 r/min,15 min)。弃上清液,室温放置5 min,75%乙醇洗涤沉淀。晾干沉淀后加50 μL水,置于55 ℃水浴10 min,得到待鉴定小鼠的DNA。将DNA进行PCR反应,反应体系为:10 μL 2× Taq mix溶液,1 μL模板DNA,0.8 μL上游引物,0.8 μL下游引物,7.4 μL灭菌水,总体系20 μL。所用引物序列为:Per1-KO上游5′- TGCTTTCCTTGGTCAGGCAGTA-3′, 下游5′-ATCCGCCCAAAGGGAACTG-3′;Per1-WT上游5′-CAGGATGTGGGTGTCTTCTATGGC-3′, 下游5′-ATGGGGTTAGGC-GGAATGGC-3′;Per2-KO上游5′-GCTCCAGACTGCCTTGGGAAAA-3′, 下游5′-GGTTAGGGAAACTCACTCGGACT-3′;Per2-WT上游5′-TCTACAGACCAGCCCAGA-CCACCA-3′,下游5′-GCTCCGAAGTCCCTCAGATGAA-AAC-3′。PCR反应条件:94 ℃ 3 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,34个循环,72 ℃ 5 min,4 ℃保存。反应产物10 μL加入1%琼脂糖凝胶孔中,连接电泳仪,分析条带。
1.2.2 药物处理及分组利用完全随机法将C57BL/6J小鼠分为5组(n=6),依次对应3%、4%、6%、7%和9%地氟醚组,各浓度地氟醚与空气混合,以6 L/min的速度通入麻醉诱导箱,检测地氟醚各浓度下小鼠的翻正反射。分别将C57BL/6J小鼠和Per1-/-/Per2-/-小鼠按照完全随机法分为2组(n=4),共计4组。ZT2(即小鼠饲养环境开灯后2 h)时开始地氟醚麻醉,地氟醚组以6 L/min的流速通入7%地氟醚与空气的混合气体,对照组以6 L/min的流速通入空气。临床手术中吸入麻醉药地氟醚为持续性长时间使用,本研究选择检测地氟醚麻醉后2 h小鼠下丘脑组织及外周肾脏和肝脏组织时钟基因的表达量。
1.2.3 检测小鼠的翻正反射(loss of righting reflex,LORR)将各浓度地氟醚麻醉后的小鼠从麻醉诱导箱取出,将小鼠以背部向下,四肢向上的姿势置于匀速转动的圆形转盘,转速为3 r/min,小鼠不能立即恢复正常姿势,且四肢失去自主活动趋势,则判断为小鼠的翻正反射消失,小鼠达到全身麻醉水平。
1.2.4 小鼠组织取材颈椎脱臼快速处死小鼠,剪开小鼠胸腹腔,暴露肾脏和肝脏,用4.5号针头刺入小鼠心尖部,剪开静脉窦,打开恒速泵注器,持续泵入常温PBS溶液,待肝脏颜色变浅后取下丘脑(包括视交叉上核)、肾脏和肝脏组织于无RNA酶的EP管中,迅速放入液氮冷冻。后保存于-80 ℃冰箱。
1.2.5 RT-qPCR检测时钟基因表达量肾脏和肝脏组织分别置于装有液氮的研钵中充分研磨,收集粉末于TRIzol中提取RNA,下丘脑组织(包括视交叉上核)则置于装有TRIzol的匀浆器中充分研磨后提取RNA。提取的RNA用PrimeScriptTM RT Master Mix反转录为cDNA。用CFX96荧光定量PCR仪检测目的基因的表达量,运行程序为:95 ℃ 3 min,95 ℃ 3 s,60 ℃ 30 s(40个循环),引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 产物长度/bp |
| mβ-actin | 上游:GGCTGTATTCCCCTCCATCG 下游:CAGTTGGTAACAATGCCATGT |
153 |
| mCry1 | 上游:TTCCCTCCCTTGAAGCTCTC 下游:GATCCTCAAGACACTGAAGC |
241 |
| mPer1 | 上游:GCTTCAGAGATCTTGGCAGG 下游:GAGGGCACAGGTGAAGGATG |
199 |
| mPer2 | 上游:GAAAGCTGTCACCACCATAGAA 下游:AACTCGCACTTCCTTTTCAGG |
186 |
| mDbp | 上游:TGACCCTCGGAGACACCGCT 下游:CACCACCTCCTGCCGCAACA |
238 |
| mClock | 上游:GAGTTCTGATGGTCAGTCAC 下游:ACCCCAGCTCCTTAATGAGG |
304 |
| mBmal1 | 上游:CTCGACACGCAATAGATGGGA 下游:CTTCCTTGGTCCACGGGTT |
267 |
1.3 统计学分析
用Excel进行数据记录和分析,比较实验组与对照组样本时钟基因的表达量采用t检验,检验水准:α=0.05,用Graphpad Prism 7和Origin作图。
2 结果 2.1 C57BL/6J小鼠达到翻正反射消失时地氟醚的有效作用浓度结果显示,3%地氟醚处理后,无小鼠达到翻正反射消失;4%地氟醚处理后,16.7%的小鼠达到翻正反射消失;6%地氟醚处理后,50%的小鼠达到翻正反射消失;7%和9%地氟醚处理后,100%的小鼠达到翻正反射消失(图 1)。即7%及以上浓度地氟醚可达到小鼠的全身麻醉水平。
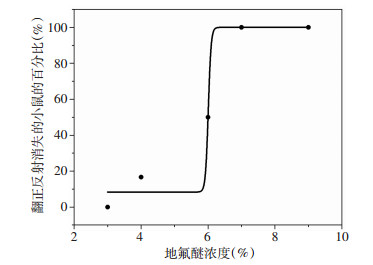
|
| 图 1 各浓度地氟醚使C57BL/6J小鼠达到翻正反射 |
消失的百分比
2.2 地氟醚改变C57BL/6J小鼠中枢时钟基因的表达RT-qPCR检测2组C57BL/6J小鼠下丘脑组织时钟基因Per1、Per2、Dbp、Bmal1、Clock、Cry1的表达量。结果显示,与对照组比较,7%地氟醚处理组C57BL/6J小鼠下丘脑组织时钟基因Per2的表达量显著降低(P < 0.01,图 2)。
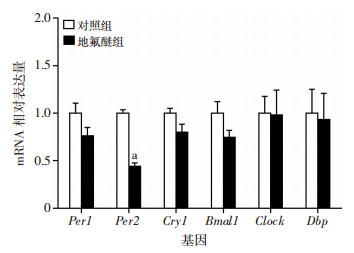
|
| a: P < 0.01,与对照组比较 图 2 RT-qPCR检测7%地氟醚麻醉后C57BL/6J小鼠下丘脑组织时钟基因的表达量 |
2.3 地氟醚改变C57BL/6J小鼠外周组织时钟基因的表达
RT-qPCR检测2组C57BL/6J小鼠肾脏、肝脏组织时钟基因Per1、Per2、Dbp、Bmal1、Clock、Cry1的表达量。结果显示,与对照组比较,7%地氟醚处理组C57BL/6J小鼠肾脏组织时钟基因Per1的表达量显著升高,而时钟基因Bmal1、Dbp的表达量显著降低(P < 0.05,图 3A)。肝脏组织时钟基因Per1的表达量显著升高(P < 0.01,图 3B)。
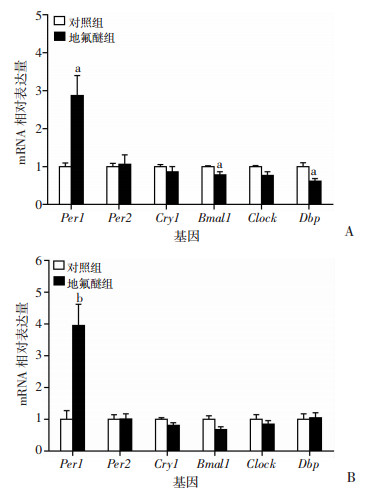
|
| a: P < 0.05,b:P < 0.01,与对照组比较A:肾脏组织时钟基因mRNA相对表达量分析;B:肝脏组织时钟基因mRNA相对表达量分析 图 3 RT-qPCR检测7%地氟醚麻醉后C57BL/6J小鼠肾脏组织和肝脏组织时钟基因的表达量 |
2.4 Per1-/-/Per2-/-小鼠的基因型鉴定
鉴定结果显示,条带在440 bp处表示为Per1-/-小鼠,条带在320 bp处表示为Per2-/-小鼠,在440 bp和320 bp处均有条带表示为Per1-/-/Per2-/-小鼠,在416 bp处有条带表示为Per1+/+小鼠,在388 bp处有条带表示为Per2+/+小鼠,在416 bp和388 bp处均有条带表示为Per1+/+/Per2+/+小鼠(图 4)。
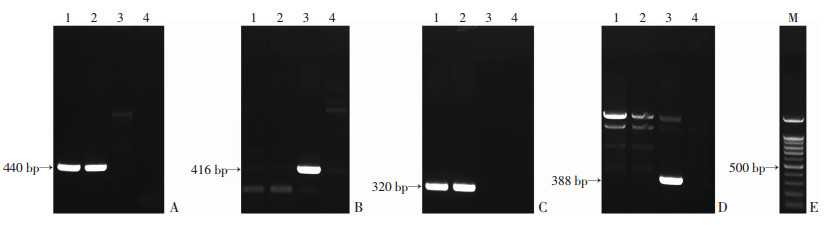
|
| 1、2: Per1-/-/Per2-/-; 3:C57BL/6J;4:H2O; M:标准A:PCR检测Per1敲除型;B:PCR检测Per1野生型;C:PCR检测Per2敲除型;D:PCR检测Per2野生型;E:条带标记物 图 4 PCR鉴定Per1-/-/Per2-/-小鼠的基因型 |
2.5 地氟醚改变Per1-/-/Per2-/-小鼠中枢时钟基因的表达
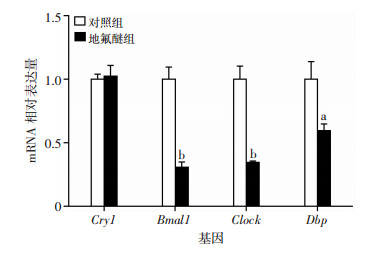
RT-qPCR检测2组Per1-/-/Per2-/-小鼠下丘脑组织时钟基因Dbp、Bmal1、Clock、Cry1的表达量。结果显示,与对照组比较,7%地氟醚处理组Per1-/-/Per2-/-小鼠下丘脑组织时钟基因Bmal1、Clock、Dbp的表达量显著降低(P < 0.05,图 5)。
|
| a: P < 0.05,b:P < 0.01,与对照组比较 图 5 RT-qPCR检测7%地氟醚麻醉后Per1-/-/Per2-/-小鼠下丘脑组织时钟基因的表达量 |
2.6 地氟醚改变Per1-/-/Per2-/-小鼠外周组织时钟基因的表达
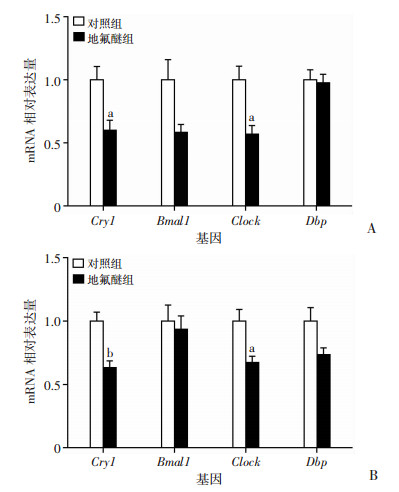
RT-qPCR检测2组Per1-/-/Per2-/-小鼠肾脏、肝脏组织时钟基因Dbp、Bmal1、Clock、Cry1的表达量。结果显示,与对照组比较,7%地氟醚处理组Per1-/-/Per2-/-小鼠肾脏组织时钟基因Cry1、Clock的表达量显著降低(P < 0.05,图 6A);肝脏组织时钟基因Cry1、Clock的表达量也显著降低(P < 0.05,图 6B)。
|
| a: P < 0.05,b:P < 0.01,与对照组比较A:肾脏组织时钟基因mRNA相对表达量分析;B:肝脏组织时钟基因mRNA相对表达量分析 图 6 RT-qPCR检测7%地氟醚麻醉后Per1-/-/Per2-/-小鼠肾脏组织和肝脏组织时钟基因的表达量 |
3 讨论
翻正反射是指动物处于异常体位时所产生的自主的恢复正常体位的反射,通常通过检测翻正反射是否消失判断是否达到动物的全身麻醉水平。已有研究采用了此种判定方法[12]。本研究参照该方法检测了地氟醚各浓度下达到小鼠翻正反射消失的情况,结果显示,在地氟醚浓度为7%时,能够达到100%小鼠翻正反射的消失。查阅已发表的有关地氟醚与小鼠的基础研究报道,大部分研究选择了7.4%、8%的地氟醚浓度进行实验[13-14]。因此,本研究选择7%地氟醚作为研究地氟醚对小鼠生物钟基因影响的背景浓度。
关于麻醉药物对生物钟影响的研究发现七氟醚、咪达唑仑对小鼠视交叉上核时钟基因Per2的表达量有显著的抑制作用[15-16];丙泊酚、右美托咪定对大鼠整个脑部组织时钟基因Per2 mRNA水平的表达量也有明显的抑制作用[17]。表明麻醉药物能够对哺乳动物中枢组织或脑部组织的生物钟产生显著影响,但目前没有进一步研究麻醉药物对小鼠外周组织生物钟基因的影响。因此,本课题着重讨论了麻醉药物地氟醚对小鼠外周组织生物钟基因的影响。
本研究不仅发现地氟醚麻醉小鼠2 h后对下丘脑组织的时钟基因Per2 mRNA水平的表达量有显著的抑制作用,而且发现地氟醚对外周肾脏和肝脏组织的时钟基因Per1 mRNA水平的表达量有显著的增加作用。已知中枢生物钟改变后会同步改变机体外周组织的生物钟,目前有报道机体的中枢和外周各内脏组织的生物钟通过体内激素作用产生了同步化[6]。也有研究报道,视交叉上核对外周不同内脏组织的调控是通过不同的作用通路产生的[18],但具体的分子调控机制尚不明确。由于下丘脑组织时钟基因Per2和外周组织时钟基因Per1的表达量发生了显著性改变,所以猜测地氟醚可能通过作用于Per基因影响整个机体的生物钟。
为了证实地氟醚是否通过Per基因对小鼠生物钟产生影响,本研究继续检测地氟醚麻醉Per1-/-/Per2-/-小鼠后中枢与外周时钟基因表达量的改变,在中枢和外周组织均敲除Per1、Per2后,检测地氟醚是否还能对其他时钟基因的表达产生影响。相较于C57BL/6J小鼠,小鼠Per1和Per2两个核心生物钟基因敲除后肯定会影响机体的内在生物钟,为避免此种影响对研究结果的干扰,将地氟醚处理后Per1-/-/Per2-/-敲基因小鼠生物钟相关基因的表达与未经地氟醚处理的Per1-/-/Per2-/-敲基因小鼠(对照组)进行比较。结果显示,地氟醚麻醉Per1-/-/Per2-/-小鼠后仍对下丘脑、肝脏和肾脏的其他时钟基因的表达量有显著影响,说明麻醉药物地氟醚并不是通过直接改变中枢或外周组织Per基因的表达量而改变了生物钟核心环路,相反,Per基因的变化是地氟醚影响机体生物钟而产生的结果。地氟醚的具体作用靶点有待进一步研究。
地氟醚虽不是直接通过Per基因产生作用,但Per基因参与机体生物钟的核心环路,Per基因表达量的显著性改变仍然会影响PER和CRY形成的异源二聚体,对CLOCK/BMAL1异源二聚体活性的抑制程度也受到影响,同时CLOCK/BMAL1异源二聚体对支环路时钟基因Dbp的激活作用发生改变,Dbp的表达量则受到影响,Dbp的表达量发生改变后又可反过来影响Bmal1的转录[19]。从而可能导致机体整个生物钟核心环路紊乱。本研究也观察到地氟醚对C57小鼠外周肾脏组织时钟基因Bmal1、Dbp表达量的抑制作用。
外周组织生物钟基因的紊乱对各组织器官病理过程有影响。研究报道,肝脏时钟基因Per1能够绑定在位于Ccr2启动子区域的PPAR-γ上,增加PPAR-γ对Ccr2的表达量有抑制作用[20],其中肝脏Ccr2能够参与肝脏的炎症应答,即地氟醚可能通过影响肝脏的生物钟而对肝脏的炎症应答产生影响。肾脏中时钟基因Per1能够调控醛固酮的水平,同时调控了编码参与肾脏溶质重吸收关键蛋白的基因的转录,其中包括α-ENaC、NCC和WNK4激酶[21],即地氟醚可能通过影响肾脏的生物钟而对肾脏的重吸收能力产生影响。
综上所述,本研究证实麻醉药物地氟醚对小鼠中枢和外周肾脏、肝脏组织时钟基因的表达量均产生显著影响,但并不是以Per基因作为作用靶点;同时,外周肾脏和肝脏组织的时钟基因Per1均显著增加,这可能是研究地氟醚参与调节肝肾功能作用机制的重要突破点。
| [1] |
TAKAHASHI J S. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet, 2017, 18(3): 164-179. DOI:10.1038/nrg.2016.150 |
| [2] |
ZHANG E E, KAY S A. Clocks not winding down: unravelling circadian networks[J]. Nat Rev Mol Cell Biol, 2010, 11(11): 764-776. DOI:10.1038/nrm2995 |
| [3] |
MAN K, LOUDON A, CHAWLA A. Immunity around the clock[J]. Science, 2016, 354(6315): 999-1003. DOI:10.1126/science.aah4966 |
| [4] |
ROENNEBERG T, MERROW M. The circadian clock and human health[J]. Curr Biol, 2016, 26(10): R432-R443. DOI:10.1016/j.cub.2016.04.011 |
| [5] |
TAKAHASHI J S, HONG H, KO C H, et al. The genetics of mammalian circadian order and disorder: implications for physiology and disease[J]. Nat Rev Genet, 2008, 9(10): 764-775. DOI:10.1038/nrg2430 |
| [6] |
MOHAWK J A, GREEN C B, TAKAHASHI J S. Central and peripheral circadian clocks in mammals[J]. Annu Rev Neurosci, 2012, 35: 445-462. DOI:10.1146/annurev-neuro-060909-153128 |
| [7] |
YAGITA K, TAMANINI F, VAN DER HORST G T, et al. Molecular mechanisms of the biological clock in cultured fibroblasts[J]. Science, 2001, 292(5515): 278-281. DOI:10.1126/science.1059542 |
| [8] |
BALSALOBRE A, BROWN S A, MARCACCI L, et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling[J]. Science, 2000, 289(5488): 2344-2347. DOI:10.1126/science.289.5488.2344 |
| [9] |
BARKAI N, LEIBLER S. Circadian clocks limited by noise[J]. Nature, 2000, 403(6767): 267-268. DOI:10.1038/35002258 |
| [10] |
STOKKAN K A, YAMAZAKI S, TEI H, et al. Entrainment of the circadian clock in the liver by feeding[J]. Science, 2001, 291(5503): 490-493. DOI:10.1126/science.291.5503.490 |
| [11] |
OCMEN E, ERDOST H A, DURU L S, et al. Effect of day/night administration of three different inhalational anesthetics on melatonin levels in rats[J]. Kaohsiung J Med Sci, 2016, 32(6): 302-305. DOI:10.1016/j.kjms.2016.04.016 |
| [12] |
GELEGEN C, MIRACCA G, RAN M Z, et al. Excitatory pathways from the lateral habenula enable propofol-induced sedation[J]. Curr Biol, 2018, 28(4): 580-587. DOI:10.1016/j.cub.2017.12.050 |
| [13] |
TAO G R, XUE Q S, LUO Y, et al. Isoflurane is more deleterious to developing brain than desflurane: the role of the akt/GSK3β signaling pathway[J]. Biomed Res Int, 2016, 2016: 7919640. DOI:10.1155/2016/7919640 |
| [14] |
XU K X, TAO J, ZHANG N, et al. Neuroprotective properties of vitamin C on equipotent anesthetic concentrations of desflurane, isoflurane, or sevoflurane in high fat diet fed neonatal mice[J]. Int J Clin Exp Med, 2015, 8(7): 10444-10458. |
| [15] |
GILE J, SCOTT B, ECKLE T. The period 2 enhancer nobiletin as novel therapy in murine models of circadian disruption resembling delirium[J]. Crit Care Med, 2018, 46(6): e600-e608. DOI:10.1097/CCM.0000000000003077 |
| [16] |
OHE Y, ⅡJIMA N, KADOTA K, et al. The general anesthetic sevoflurane affects the expression of clock gene mPer2 accompanying the change of NAD+ level in the suprachiasmatic nucleus of mice[J]. Neurosci Lett, 2011, 490(3): 231-236. DOI:10.1016/j.neulet.2010.12.059 |
| [17] |
YOSHIDA Y, NAKAZATO K, TAKEMORI K, et al. The influences of propofol and dexmedetomidine on circadian gene expression in rat brain[J]. Brain Res Bull, 2009, 79(6): 441-444. DOI:10.1016/j.brainresbull.2009.04.015 |
| [18] |
GUO H N, BREWER J M, CHAMPHEKAR A, et al. Differential control of peripheral circadian rhythms by suprachiasmatic-dependent neural signals[J]. Proc Natl Acad Sci U S A, 2005, 102(8): 3111-3116. DOI:10.1073/pnas.0409734102 |
| [19] |
TAKAHASHI J S. Molecular components of the circadian clock in mammals[J]. Diabetes Obes Metab, 2015, 17(Suppl 1): 6-11. DOI:10.1111/dom.12514 |
| [20] |
WANG T, WANG Z, YANG P, et al. PER1 prevents excessive innate immune response during endotoxin-induced liver injury through regulation of macrophage recruitment in mice[J]. Cell Death Dis, 2016, 7: e2176. DOI:10.1038/cddis.2016.9 |
| [21] |
FIRSOV D, BONNY O. Circadian rhythms and the kidney[J]. Nat Rev Nephrol, 2018, 14(10): 626-635. DOI:10.1038/s41581-018-0048-9 |



