失血性休克(hemorrhagic shock,HS)是创伤最常见的并发症,约占创伤早期死亡的50%[1-2]。在休克晚期会继发脓毒症、肺炎等二次感染并引起多器官功能衰竭(multiple organ failure,MOF)甚至死亡。这一方面是由于休克后血管低反应性、血管渗漏等血管功能障碍导致难治性低血压[1-2];另一方面也与失血性休克后机体代谢紊乱密切相关。研究表明,失血性休克会导致机体缺血缺氧并触发一系列物质代谢和能量代谢改变[3]。而线粒体作为休克后较早发生损害的细胞器之一,其功能的改变与机体物质代谢和能量代谢等均密切相关[4]。研究表明在多种疾病中线粒体动力相关蛋白Drp1(dynamin-related protein 1)对线粒体的功能调控具有重要意义[5]。Drp1是一个含有GTP酶活性的蛋白,其大部分存在于细胞质中,主要介导线粒体分裂过程。近年来研究表明Drp1表达及其活性变化对于线粒体功能调节、细胞自噬、细胞凋亡等细胞功能以及心脏、脑组织等器官功能的调节都具有重要意义[5]。但是失血性休克后血管组织Drp1如何变化,Drp1介导的线粒体功能改变是否与休克后代谢异常有关,其相互作用关系又如何,目前尚不清楚。因此,本研究以失血性休克小鼠和缺氧处理血管平滑肌细胞为模型,观察失血性休克后血管组织代谢变化。同时使用Drp1敲除小鼠模型和Drp1shRNA处理血管平滑肌细胞(vascular smooth muscle cell,VSMC)模型深入探究休克后Drp1介导的线粒体功能改变与能量代谢之间的关系及其作用机制,为失血性休克的探讨提供实验参考。
1 材料与方法 1.1 主要试剂和仪器血管平滑肌细胞系(vascular smooth muscle cells,VSMC)来源于中国科学院上海细胞库,传代并液氮保存于陆军特色医疗中心。Drp1抗体(货号:ab56788)、β-actin抗体(货号:ab8227)、JC-1荧光探针检测试剂盒(货号:ab113850)、ROS荧光探针试剂盒(货号:ab113851)均购于美国Abcam公司。谷胱甘肽(GSH,Glutathione)检测试剂盒(货号:S0052)购于碧云天生物技术研究所,寡霉素(货号:QN0054-DWF)、线粒体解偶联剂FCCP(货号:M00176-UDO)、鱼藤酮(货号:QN0743-GMO)等OCR相关试剂均购于北京百奥莱博科技有限公司。Drp1过表达腺病毒由上海和元生物科技有限公司协助合成包装。Drp1敲除(knockout,KO)鼠(Drp1 +/-)和野生鼠(wild type,WT)每组48只,体质量20~25 g,雄性,由上海南方模式生物科技股份有限公司提供。代谢组学分析和代谢笼检测由上海阿趣生物科技公司和河北智海生物科技有限公司协助完成。共聚焦显微镜(Leica TCS SP5,美国);双色红外荧光成像系统(Odyssey,美国);Orbitrap质谱仪(Q Exactive Orbitrap, Thermo Fisher,美国);24 h昼夜节律与代谢追踪系统(代谢笼,ColumbusOxymax/CLAMS,德国)。
1.2 实验分组及失血性休克模型制备60只C57雌鼠(8周龄,体质量约20 g),30只进行缺血休克4 h处理作为休克WT组,其余不予以处理作为常态WT组。60只Drp1 KO雌鼠(C57品系,8周龄,体质量约20 g),30只进行缺血休克4 h处理作为休克Drp1 KO组,其余不予以处理作为常态Drp1 KO组。失血性休克模型制备方法是在小鼠股动脉位置剪一切口并在显微镜下用止血钳对股动脉和股静脉进行钝性分离[6],动脉插管后使用三通旋塞连接血压计,15 min放血至血压40 mmHg,维持休克4 h。建模成功后,取肠系膜上动脉进行急性分离,使用Orbitrap质谱仪对血管组织样本的代谢组学进行定性定量分析[7]。使用Columbus Oxymax/CLAMS代谢分析系统动态监测小鼠休克后的能量代谢变化。
1.3 细胞缺氧模型制备通过对细胞缺氧处理(缺氧组)模拟整体动物失血性休克状态[6],用于机制研究。首先,VSMC细胞接种在培养皿中待贴壁后,置于37℃密封罐中,进行缺氧处理。缺氧步骤为先通入缺氧气体(95%N2和5%CO2)15 min后关闭通气阀,10 min后重新开启通入缺氧气体,重复4次直到密封罐内氧气浓度低于0.2%,密封开始计时4 h。
1.4 线粒体功能检测 1.4.1 细胞ROS荧光探针和JC-1线粒体膜电位荧光探针检测将VSMC接种在共聚焦培养皿中,贴壁后进行干预处理。PBS洗涤后,加入1%的ROS荧光探针或者0.1%的JC-1染色工作液,37 ℃孵育30 min。孵育结束后用PBS重复洗涤3次,然后将培养皿置于共聚焦显微镜下观察(绿色荧光激发波488 nm,红色荧光激发波633 nm)。
1.4.2 组织样本ROS试剂盒和线粒体呼吸强度(OCR)检测将血管平滑肌组织样本放入预冷PBS中清洗,用眼科剪将组织剪碎后放在预冷的PBS中进一步漂洗,加入适量酶消化液,37℃恒温水浴消化30 min,期间进行间断震荡和吹打细胞。用预冷PBS终止消化,收集细胞,500×g离心10 min后去上清,并用PBS洗1~2次,重悬制备细胞悬液。其中一部分细胞悬液加入1%的ROS荧光探针,37 ℃孵育30 min,用PBS洗涤1~2次,离心收集细胞沉淀物用于ROS荧光检测(最佳激发波长500 nm、最佳发射波长525 nm)。另一部分细胞悬液进行细胞计数后,确定细胞密度。按照每孔120 000细胞数接种到24孔生物能量分析仪细胞培养板中,维持温度37 ℃。在测量前1 h,用含有17.5 mmol/L葡萄糖和1 mmmol/L丙酮酸盐的培养基37 ℃孵育培养板1 h。将事先配制好的浓度分别为8、9、10、10 μmol/L的寡霉素、FCCP、鱼藤酮和抗霉素A工作液, 按25 μL/孔加入到相应孔中,测量3次作为对应组织样本OCR结果。
1.5 细胞免疫荧光检测Drp1与线粒体共定位情况将接种的VSMC细胞放在室温下,用PBS清洗3次。用4%多聚甲醛室温下固定20 min,再用PBS清洗3次。然后用0.3%Triton室温孵育15 min,再用PBS清洗3次。37 ℃ BSA封闭1 h。Drp1一抗(Drp1 :BSA= 1 :200)4 ℃孵育过夜。用PBS清洗后37 ℃孵育FITC荧光二抗45 min。再避光DAPI孵育5 min,PBS清洗3次。加Mitotracker染色(1 :10 000)4 ℃孵育30 min,用无钙台式液清洗后共聚焦显微镜下观察VSMC缺氧后Drp1与Mitotracker标记的线粒体共定位情况。
1.6 Western blot检测Drp1表达变化取血管平滑肌组织样本加入100 μL裂解液后冰上剪碎。4 ℃静置30 min后,4 ℃条件下12 000×g离心15 min,取上清加入上样缓冲液混匀后,105 ℃加热6 min使蛋白变性,冰上降温后放入蛋白盒-20 ℃保存。制备蛋白样品后使用10%的SDS-PAGE凝胶电泳分离蛋白。湿转法将蛋白转移到PVDF膜上。用5%脱脂奶粉封闭2 h后,用TBST洗涤3次,Drp1抗体和β-actin抗体4 ℃孵育过夜,TBST洗涤3次后,二抗(抗鼠)室温孵育1 h,TBST洗涤4次后,使用Odyssey双色红外荧光成像系统检测膜上Drp1蛋白表达变化。
1.7 统计学处理统计软件使用SPSS 17.0分析软件。定量资料以x±s表示,两组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,当方差分析结果有统计学意义时,再采用SNK法或者LSD法进行多重比较,休克后小鼠能量代谢监测采用重复测量设计资料的方差分析。
2 结果 2.1 模型制备情况休克WT组和休克Drp1 KO组小鼠动脉插管后失血0.7~0.8 mL血压即已达到40 mmHg目标血压值,小鼠呼吸急促,四肢末端冰冷,提示体循环血量严重不足,失血性休克模型制备成功。休克4 h后小鼠死亡率为30%~40%,符合失血性休克后病理发展过程。
2.2 失血性休克后机体能量代谢和线粒体代谢变化代谢笼结果显示:与常态WT组相比,休克WT组能量代谢从休克2 h后开始明显减低(P < 0.05),休克4 h后能量代谢水平大约是正常组的51.2%,并且休克7 h后休克WT组能量代谢仍然没有恢复到正常水平(P < 0.05,图 1A)。代谢组学分析结果显示:休克WT组与常态WT组比较,线粒体能量代谢明显减少,主要与线粒体糖代谢、线粒体辅酶A(CoA)生物合成、线粒体泛醌生物合成、谷胱甘肽代谢、谷氨酰胺代谢、谷氨酸代谢等线粒体代谢异常有关(图 1B)。上述结果提示失血性休克后机体能量代谢紊乱与线粒体代谢异常密切相关。

|
| A:常态WT组和休克WT组代谢笼检测结果(n=8,x±s) a:P < 0.05,与常态WT组比较; B:常态WT组和休克WT组线粒体代谢组学热图 图 1 2组小鼠能量代谢和线粒体代谢变化 |
2.3 休克/缺氧后血管平滑肌细胞线粒体功能变化
通过比较常态WT组和休克WT组血管组织ROS产生量、ATP含量、线粒体呼吸强度(OCR),发现休克后ROS产生量增高2.3倍,ATP含量减少了67.8%,线粒体OCR水平仅为正常情况下的50%(P < 0.05,表 1),提示失血性休克后血管组织线粒体存在明显功能障碍和代谢紊乱。我们在细胞水平进行缺氧处理模拟整体动物水平失血性休克状态。缺氧组线粒体ROS荧光强度是正常组的4倍(P < 0.05,图 2)。缺氧后线粒体膜电位(ΔΨm)(即JC-1探针的聚合体/单体比值)是正常组的23.3%(P < 0.05,图 3)。上述结果提示缺氧后血管平滑肌细胞VSMC存在ROS水平增高、线粒体膜电位减低等线粒体功能障碍和线粒体代谢紊乱的情况。
| 组别 | ROS产生量(荧光强度) | ATP含量/nmol·mg-1 | 线粒体呼吸强度(%) |
| 常态WT组 | 0.038±0.012 | 0.033±0.004 | 100.0±5.3 |
| 休克WT组 | 0.144±0.013a | 0.010±0.002a | 50.7±5.1a |
| a:P < 0.05,与常态WT组比较 | |||
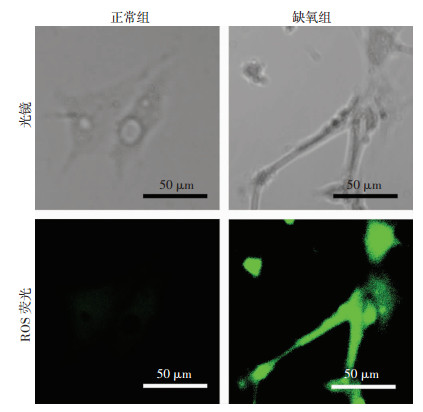
|
| 图 2 2组血管平滑肌细胞线粒体ROS荧光强度 |
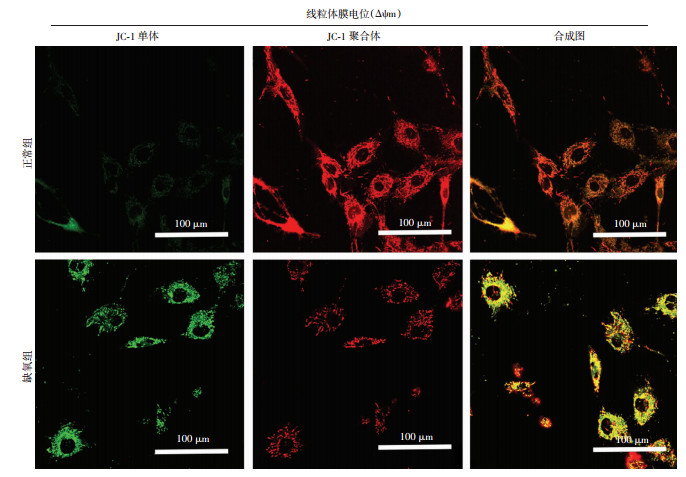
|
| 图 3 2组血管平滑肌细胞线粒体膜电位(ΔΨm)JC-1荧光图 |
2.4 休克/缺氧后血管线粒体动力相关蛋白Drp1表达变化
Western blot结果显示休克后血管组织Drp1总蛋白水平无明显变化(P>0.05),但是Drp1 Ser616磷酸化水平明显增高、线粒体Drp1表达量明显增高(P < 0.05,图 4),提示失血性休克后线粒体动力相关蛋白Drp1发生了明显的活化和线粒体转位。共聚焦结果显示缺氧后血管平滑肌细胞VSMC中Drp1荧光强度没有明显改变(P>0.05),但是缺氧后Drp1与线粒体共定位情况是正常组的2.6倍(P < 0.05)。缺氧后线粒体长度也明显缩短,正常组共聚焦显微镜下观察到的Mitotracker标记的线粒体长度为(26.67 ±11.22)μm,缺氧组线粒体长度为(9.03±1.21) μm,差异有统计学意义(P < 0.05,图 5),提示缺氧后Drp1发生了明显的线粒体转位,并且对线粒体结构和功能具有重要影响。

|
| 图 4 2组小鼠Drp1表达及活性变化 |
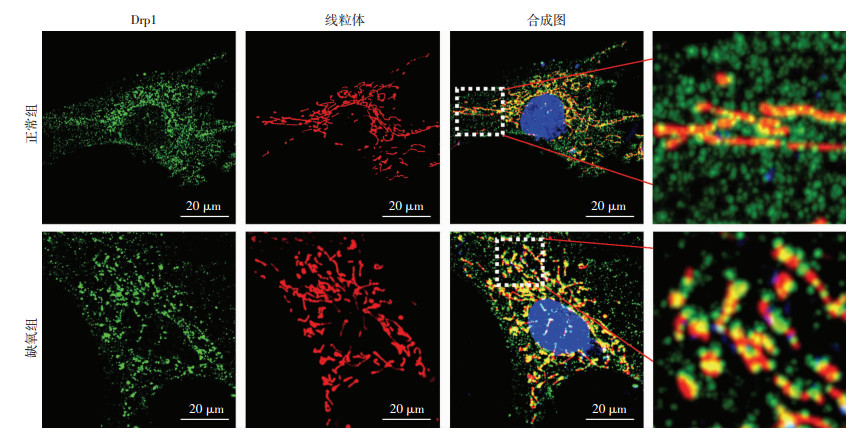
|
| 图 5 2组血管平滑肌细胞Drp1与线粒体共定位情况 |
2.5 干预Drp1对休克机体能量代谢和线粒体代谢的影响
与休克WT组相比,休克Drp1 KO组代谢笼结果显示干预Drp1后可以明显改善休克后的机体能量代谢水平,尤其是休克后2~4 h,差异有统计学意义(P < 0.05,图 6A),提示休克后活化Drp1对于机体能量代谢的降低具有重要作用。代谢组学分析结果显示:Drp1 KO可以引起休克后谷胱甘肽代谢、谷氨酰胺代谢、谷氨酸代谢水平的上调(图 6B),提示休克后谷胱甘肽等线粒体代谢异常与Drp1密切相关。检测结果显示:常态WT组血管组织谷胱甘肽绝对值为(1.35±0.0.42) nmol/μg,休克WT组谷胱甘肽绝对值降低为(0.55±0.20) nmol/μg,而休克Drp1 KO组血管组织谷胱甘肽水平(0.94±0.30)nmol/μg明显高于休克WT组,差异有统计学意义(P < 0.05,图 6C);常态WT组血管组织谷胱甘肽还原型/氧化型比值为(1.38±0.35),休克WT组谷胱甘肽还原型/氧化型比值降低为(0.17±0.03),而休克Drp1 KO组血管组织谷胱甘肽还原型/氧化型比值(0.91±0.17)明显高于休克WT组(P < 0.05,图 6D)。上述结果表明休克后活化Drp1可抑制谷胱甘肽代谢过程,引起休克后血管组织线粒体谷胱甘肽含量下调,影响机体能量代谢。

|
| A:休克Drp1 KO组和休克WT组代谢笼结果(n=8,x±s);B:休克Drp1 KO组和休克WT组代谢组学火山图(蓝色代表Drp1 KO后下调,红色代表Drp1 KO后上调);C:休克Drp1 KO组和休克WT组血管组织谷胱甘肽绝对值(GSH)(n=8,x±s);D:休克Drp1 KO组和休克WT组血管组织谷胱甘肽还原型/氧化型比值(GSH/GSSG)(n=8,x±s) a:P < 0.05,与常态WT组比较;b:P < 0.05,与休克WT组比较 图 6 Drp1 KO组休克后机体能量代谢和线粒体代谢变化 |
2.6 干预Drp1介导的谷胱甘肽代谢途径对线粒体功能影响
对正常血管平滑肌细胞进行Drp1过表达腺病毒转染后,发现ROS荧光强度增加约3.3倍(P < 0.05),而进一步补充外源性谷胱甘肽(10 mmol/L)后发现ROS探针荧光强度一定程度上减低(P < 0.05,图 7)。Drp1过表达后血管平滑肌细胞线粒体膜电位(ΔΨm)明显减低,而进一步补充谷胱甘肽(10 mmol/L)后JC-1聚合体/单体的值比Drp1过表达组增加了42.7%(P < 0.05,图 8)。上述结果表明活化Drp1介导的谷胱甘肽线粒体代谢异常会最终引起线粒体功能紊乱。

|
| 图 7 干预Drp1介导的谷胱甘肽代谢途径对线粒体ROS的影响 |
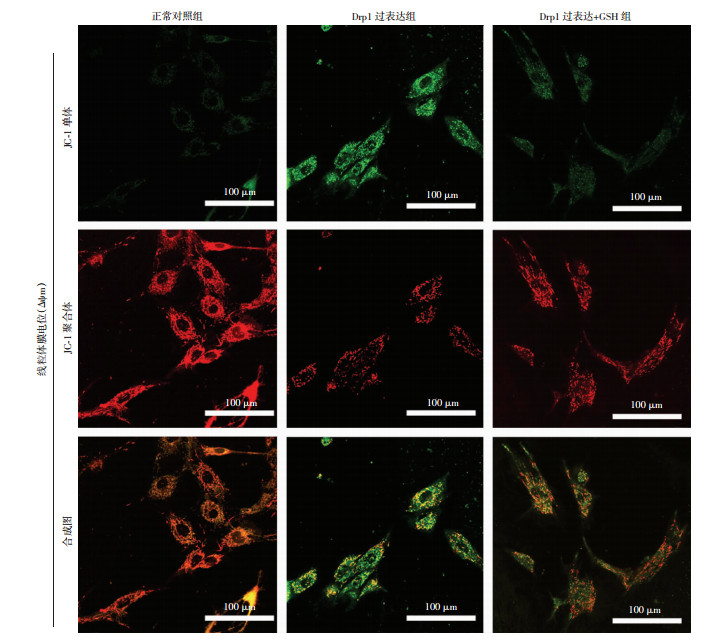
|
| 图 8 干预Drp1介导的谷胱甘肽代谢途径对线粒体膜电位的影响 |
3 讨论
线粒体是细胞物质代谢和能量代谢的中心,其主要功能包括氧化磷酸化、活性氧ROS生成、钙稳态调节等。线粒体氧化磷酸化是细胞内ATP产生和机体能量代谢的主要方式,线粒体呼吸链损伤时,线粒体ROS堆积过多造成氧化损伤,最终引起线粒体功能障碍。以往研究显示在心力衰竭、动脉粥样硬化、高血压等多种心血管疾病中均出现机体能量代谢紊乱,并且线粒体损伤会加剧这些疾病的发展[8]。本研究发现在失血性休克后同样存在机体能量代谢降低,并且代谢组学结果进一步发现这个过程与血管组织线粒体三羧酸循环和线粒体氧化呼吸链中关键代谢物(包括辅酶Q和谷胱甘肽等)异常有关。
Drp1作为重要的线粒体调控蛋白,对线粒体结构和功能调节具有重要意义。Drp1也被称为DNM1L、DLP1,由SHIN等[9]于1997年首次报道,主要以多聚体(尤其是四聚体)形式分布于细胞质。Drp1编码基因定位于染色体12p11.21,包括N末端GTP酶结构域、C末端中间区域、非保守区域以及卷曲螺旋结构域。Drp1蛋白的主要功能包括:①通过影响线粒体微管的分布过程而促使线粒体分裂,与线粒体融合蛋白对抗,共同维持线粒体形态的稳定;②Drp1 GTP酶结构域通过与GTP结合将其分解为GDP和磷酸,参与线粒体剪切;③对线粒体外膜磷脂作用进行脂质调节[10];④通过与肌动蛋白actin互作影响细胞骨架[11]和tau蛋白运输[12]。本研究发现Drp1对于线粒体代谢也具有重要调控作用。此外,研究表明在肺癌[13]、乳腺癌[14]、胶质瘤[15]等多种肿瘤疾病中均发现Drp1表达升高,Drp1通过调节线粒体再分布及细胞板状伪足的形成调控肿瘤细胞的迁移与浸润。SONG等[16]在创伤性脑损伤的研究中观察到Drp1表达也明显增高且Drp1活性未发生改变。本研究发现,在失血性休克疾病模型中,血管组织Drp1总表达量并未发生明显变化,但Drp1活性增强且Drp1发生从细胞质到线粒体的转位。Drp1的功能多样性和表达修饰变化的差异可能与疾病模型和组织细胞差异有关。
ZHANG等[17]利用LPS刺激气道平滑肌细胞后同样发生Drp1活化,并且发现LPS诱导的线粒体代谢紊乱依赖于活化Drp1介导的糖酵解过程,提示活化Drp1对于线粒体代谢是有调控作用的。本研究发现,活化Drp1可抑制谷胱甘肽线粒体代谢途径,影响线粒体ROS生成和机体能量代谢。谷胱甘肽作为一种由3个氨基酸组成的短肽,能够清除体内的超氧离子和自由基,保护细胞膜完整性,具有抗脂质氧化和维持细胞正常代谢功能的作用[18-19]。我们推测,失血性休克后活化Drp1通过抑制谷胱甘肽线粒体代谢,导致休克后氧自由基清除不足,引起ROS堆积和线粒体膜电位降低等线粒体功能障碍。而线粒体膜电位降低又会进一步抑制线粒体呼吸链,导致氧自由基产生增多,加重线粒体损伤,影响机体能量代谢,形成恶性循环。
以往对于Drp1与谷胱甘肽代谢的相关研究也有零星报道,但均为平行观察研究。KIM等[20]对海马神经元使用ROS激动剂后发现Drp1 Ser637磷酸化水平下调、谷胱甘肽含量降低。ZHAN等[21]对神经性疼痛大鼠使用线粒体抗氧化剂Mito-Tempo后发现谷胱甘肽含量增加、Drp1表达降低。上述研究虽然提示Drp1、谷胱甘肽代谢、线粒体ROS堆积三者之间可能存在一定相关性,但是对于Drp1与谷胱甘肽代谢之间的调控关系并未报道。本研究发现,外源性补充谷胱甘肽后可以一定程度上改善Drp1过表达引起的线粒体ROS增加和膜电位降低。但同时我们也发现,缺氧后外源性补充谷胱甘肽并没有完全恢复活化Drp1造成的线粒体损伤,提示休克后活化Drp1还可能通过其他途径影响线粒体功能,其机制有待进一步探究。
综上所述,本研究发现失血性休克后活化Drp1可通过抑制谷胱甘肽线粒体代谢引起线粒体功能障碍和机体能量代谢紊乱。本研究成果一定程度上诠释了失血性休克晚期机体代谢紊乱无法得到有效恢复的原因。而针对失血性休克的治疗,是否可以从Drp1介导的线粒体能量代谢的调控机制入手,进而调控线粒体功能和机体的能量代谢,作为防治手段值得进一步探究。随着基因组学、代谢组学的深入研究,休克后能量代谢过程及其调控机制将会进一步阐明,为未来失血性休克救治提供新的思路。
| [1] |
DUAN C Y, ZHANG J, WU H L, et al. Regulatory mechanisms, prophylaxis and treatment of vascular leakage following severe trauma and shock[J]. Mil Med Res, 2017, 4: 11. DOI:10.1186/s40779-017-0117-6 |
| [2] |
DUAN C Y, YANG G M, LI T, et al. Advances in vascular hyporeactivity after shock: the mechanisms and managements[J]. Shock, 2015, 44(6): 524-534. DOI:10.1097/SHK.0000000000000457 |
| [3] |
LI Z Q, LI J, ZHANG S W, et al. Metabolomics analysis of gut barrier dysfunction in a trauma-hemorrhagic shock rat model[J]. Biosci Rep, 2019, 39(1): BSR20181215. DOI:10.1042/BSR20181215 |
| [4] |
DUAN C Y, LI T, LIU L M. Efficacy of limited fluid resuscitation in patients with hemorrhagic shock: a meta-analysis[J]. Int J Clin Exp Med, 2015, 8(7): 11645-11656. |
| [5] |
FONSECA T B, SÁNCHEZ-GUERRERO Á, MILOSEVIC I, et al. Mitochondrial fission requires DRP1 but not dynamins[J]. Nature, 2019, 570(7761): E34-E42. DOI:10.1038/s41586-019-1296-y |
| [6] |
DUAN C Y, CHEN K, YANG G M, et al. HIF-1α regulates Cx40-dependent vasodilatation following hemorrhagic shock in rats[J]. Am J Transl Res, 2017, 9(3): 1277-1286. |
| [7] |
DUAN C Y, CAO Z Z, TANG F Q, et al. MiRNA-mRNA crosstalk in myocardial ischemia induced by calcified aortic valve stenosis[J]. Aging (Albany NY), 2019, 11(2): 448-466. DOI:10.18632/aging.101751 |
| [8] |
TANG X Q, CHEN X F, CHEN H Z, et al. Mitochondrial sirtuins in cardiometabolic diseases[J]. Clin Sci, 2017, 131(16): 2063-2078. DOI:10.1042/CS20160685 |
| [9] |
SHIN H W, SHINOTSUKA C, TORⅡ S, et al. Identification and subcellular localization of a novel mammalian dynamin-related protein homologous to yeast Vps1p and Dnm1p[J]. J Biochem, 1997, 122(3): 525-530. DOI:10.1093/oxfordjournals.jbchem.a021784 |
| [10] |
ADACHI Y, ⅡJIMA M, SESAKI H. An unstructured loop that is critical for interactions of the stalk domain of Drp1 with saturated phosphatidic acid[J]. Small GTPases, 2018, 9(6): 472-479. DOI:10.1080/21541248.2017.1321614 |
| [11] |
NISHIMURA A, SHIMAUCHI T, TANAKA T, et al. Hypoxia-induced interaction of filamin with Drp1 causes mitochondrial hyperfission-associated myocardial senescence[J]. Sci Signal, 2018, 11(556): eaat5185. DOI:10.1126/scisignal.aat5185 |
| [12] |
BARDAI F H, ORDONEZ D G, BAILEY R M, et al. Lrrk promotes tau neurotoxicity through dysregulation of actin and mitochondrial dynamics[J]. PLoS Biol, 2018, 16(12): e2006265. DOI:10.1371/journal.pbio.2006265 |
| [13] |
REHMAN J, ZHANG H J, TOTH P T, et al. Inhibition of mitochondrial fission prevents cell cycle progression in lung cancer[J]. FASEB J, 2012, 26(5): 2175-2186. DOI:10.1096/fj.11-196543 |
| [14] |
ZHAO J, ZHANG J, YU M, et al. Mitochondrial dynamics regulates migration and invasion of breast cancer cells[J]. Oncogene, 2013, 32(40): 4814-4824. DOI:10.1038/onc.2012.494 |
| [15] |
HAGENBUCHNER J, KUZNETSOV A V, OBEXER P, et al. BIRC5/Survivin enhances aerobic glycolysis and drug resistance by altered regulation of the mitochondrial fusion/fission machinery[J]. Oncogene, 2013, 32(40): 4748-4757. DOI:10.1038/onc.2012.500 |
| [16] |
SONG Y, LI T, LIU Z G, et al. Inhibition of Drp1 after traumatic brain injury provides brain protection and improves behavioral performance in rats[J]. Chem Biol Interact, 2019, 304: 173-185. DOI:10.1016/j.cbi.2019.03.013 |
| [17] |
ZHANG L X, MA C, WANG X Y, et al. Lipopolysaccharide-induced proliferation and glycolysis in airway smooth muscle cells via activation of Drp1[J]. J Cell Physiol, 2019, 234(6): 9255-9263. DOI:10.1002/jcp.27605 |
| [18] |
SEIDKHANI-NAHAL A, ALLAMEH A, SOLEIMANI M. Antioxidant and reactive oxygen species scavenging properties of cellular albumin in HepG2 cells is mediated by the glutathione redox system[J]. Biotechnol Appl Biochem, 2019, 66(2): 163-171. DOI:10.1002/bab.1708 |
| [19] |
SIMEUNOVIC D, ODANOVIC N, PLJESA-ERCEGOVAC M, et al. Glutathione transferase P1 polymorphism might be a risk determinant in heart failure[J]. Dis Markers, 2019, 2019: 6984845. DOI:10.1155/2019/6984845 |
| [20] |
KIM K Y, HWANG S K, PARK S Y, et al. L-Serine protects mouse hippocampal neuronal HT22 cells against oxidative stress-mediated mitochondrial damage and apoptotic cell death[J]. Free Radic Biol Med, 2019, 141: 447-460. DOI:10.1016/j.freeradbiomed.2019.07.018 |
| [21] |
ZHAN L, LI R, SUN Y H, et al. Effect of mito-TEMPO, a mitochondria-targeted antioxidant, in rats with neuropathic pain[J]. Neuroreport, 2018, 29(15): 1275-1281. DOI:10.1097/WNR.0000000000001105 |



