多发性骨髓瘤(multiple myeloma,MM)是浆细胞恶性增殖性肿瘤,其发病率逐渐上升,已成为血液系统第二大肿瘤[1-2]。目前广泛应用的蛋白酶体抑制剂、自体造血干细胞移植和相关化疗方案的改善,极大地提高了疗效。然而,相当多的患者可能在几年,甚至几个月内复发。相关研究表明,微小残留病灶(minimal residual disease,MRD)的形成是MM复发和难治的重要原因之一,而肿瘤的迁移和侵袭与MRD的形成密切相关[3]。
转录调节因子核蛋白1(nuclear protein 1, NUPR1)又称作p8和Com1,是一种参与调控细胞生物学行为及多种信号通路的小分子蛋白[4-5]。国内外研究报道NUPR1在乳腺癌、非小细胞肺癌、甲状腺癌等肿瘤中过度表达[6]。研究显示,敲低NUPR1可抑制HepG2肝癌细胞和非小细胞肺癌细胞的迁移,但其机制尚未阐明[7-8]。另有研究表明,NUPR1与肿瘤细胞自噬调节相关[9],而自噬被证明在MM的病理生理学中起着至关重要的作用[10],还可参与调节肿瘤细胞的迁移和侵袭。我们前期研究表明MM细胞内自噬水平较高[11-12]。于是,我们推测MM细胞中较高水平自噬可能与NUPR1高表达相关。因此,本研究通过敲低NUPR1表达来观察其对骨髓瘤U266细胞自噬、迁移和侵袭能力的影响及相互间是否存在关联,以进一步明确NUPR1在MM中的作用,为MM靶向治疗提供新的可能。
1 材料与方法 1.1 实验材料 1.1.1 人多发性骨髓瘤U266细胞株由侯健教授(上海仁济医院)惠赠。
1.1.2 实验试剂慢病毒和聚凝胺(Polybrene)购于吉凯基因公司;雷帕霉素(50 mg)和RPMI1640购于Sigma Aldrich公司;胎牛血清购于PAN-Biotech GmbH公司;TRIzol、PCR试剂盒及PCR引物均购于TaKaRa公司;蛋白提取、浓度测定(BCA法)试剂盒和蛋白免疫印迹实验相关试剂均购于碧云天公司;PVDF膜购于Milipore公司;嘌呤霉素(Puromycin)购于赛默飞世尔科技公司;NUPR1抗体购于Novus Biologicals公司;LC3、AKT、p-AKT、MMP9、CXCR4和ATG5抗体均购于万类生物科技公司;Beclin1、β-actin、mTOR、p-mTOR和P62抗体均购于Proteintech公司。
1.2 实验方法 1.2.1 慢病毒载体的构建运用专业软件确定NUPR1基因的特异性shRNA干扰序列为5′-CCAAG-CTGCAGAATTCAGA-3′;同时设计无关序列为5′-TTC-TCCGAACGTGTCACGT-3′。由上海吉凯基因公司完成shRNA序列慢病毒载体的构建、包装及效价测定。
1.2.2 稳定株制备取对数生长期的U266细胞,分装于2个孔,每孔接种5×104个细胞,于24孔板中培养。转染无关序列shRNA慢病毒的细胞作为阴性对照组,转染NUPR1-shRNA慢病毒的细胞作为敲低组,细胞感染复数(multiplicity of infection, MOI)为100,同时加入Polybrene(5 μg/mL),培养12 h后更换培养液。于72 h后观察和测定绿色荧光率。观察到荧光后,用0.5 mg/L的Puromycin持续筛选(每1~2天更换新配制溶液)。2周后获得稳定转染细胞株。
1.2.3 qRT-PCR检测提取各组细胞RNA并逆转录获得cDNA(总体系20 μL)。依照PCR反应条件(95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s)进行50个循环。每组3个复孔,重复3次。引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 产物长度/bp |
| NUPR1 | 上游:AGGACTTATTCCCGCTGACTGA 下游:TGCCGTGCGTGTCTATTTATTG |
194 |
| β-actin | 上游:CCACGAACTACCTTCAACTCC 下游:GTGATCTCCTTCTGCATCCTGT |
132 |
1.2.4 Western blot检测
提取各组蛋白后进行凝胶电泳(上样量为30 μg),然后转膜和封闭。在PVDF膜上滴加一抗于4 ℃孵育过夜,翌日分3次清洗(TBST,30 min),待加入二抗后置于37 ℃孵箱,60 min后取出清洗(方法同前),ECL法显影,以β-actin作为内参测定灰度值。实验重复3次。
1.2.5 透射电镜观察自噬分别收集阴性对照组及敲低组细胞(每组1×106个)于2 mL EP管中,1 200 r/min离心10 min后,弃上清,4 ℃戊二醛固定24 h后0.1 mol/L PBS洗30 min(分为3次),然后4 ℃ 1%锇酸固定和电子转染2 h,最后制成超薄切片,使用透射电子显微镜进行观察并拍照。
1.2.6 迁移实验取对数生长期的阴性对照组和敲低组细胞分别给予100 ng/mL雷帕霉素处理24 h后,收集各组细胞(包括未用雷帕霉素处理的细胞),用无血清培养基重悬,取1×105个细胞400 μL放入Transwell小室上层。下室加入含10%FBS的培养基600 μL,37 ℃孵育24 h。然后收集各组下室细胞,制成20 μL细胞悬液,用细胞计数板于显微镜下计数。迁移细胞数=计数板四大格细胞均数×104×0.02个。
1.2.7 侵袭实验将基质胶用无血清RPMI 1640按1 :8稀释混匀,取50 μL覆盖在小室上室面,37 ℃放置30 min。余下操作方法同迁移实验。
1.3 统计学分析采用SPSS 19.0统计软件。数据以x±s表示,独立样本t检验用于两组间比较,配对样本t检验用于雷帕霉素处理前后同组间比较。P < 0.05表示差异有统计学意义。
2 结果 2.1 NUPR1-shRNA慢病毒成功转染U266细胞 2.1.1 观察和测定荧光表达情况NUPR1-shRNA慢病毒转染U266细胞后转染率达90%(图 1),说明细胞转染成功。
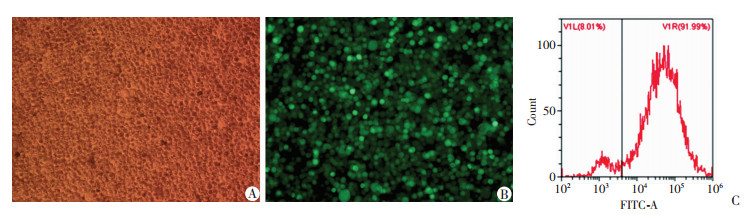
|
| A:相差显微镜观察敲低组U266细胞形态(×100);B:荧光显微镜观察敲低组U266细胞荧光表达(×100);C:流式细胞仪检测细胞荧光表达 图 1 NUPR1-shRNA慢病毒感染后荧光表达观察和测定 |
2.1.2 在mRNA和蛋白水平成功敲低NUPR1
敲低组NUPR1 mRNA和蛋白相对表达量均较阴性对照组显著降低(P < 0.05,图 2、表 2)。
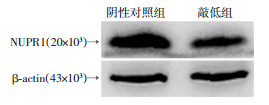
|
| 图 2 各组U266细胞NUPR1蛋白表达 |
| 组别 | mRNA相对表达量 | 蛋白相对表达量 |
| 阴性对照组 | 1.057±0.208 | 1.337±0.365 |
| 敲低组 |
0.046±0.039 | 0.483±0.212 |
| P值 | 0.001 | 0.025 |
2.2 沉默NUPR1下调U266细胞自噬水平 2.2.1 透射电镜观察自噬小体
NUPR1沉默后,U266细胞自噬小体明显减少(图 3)。
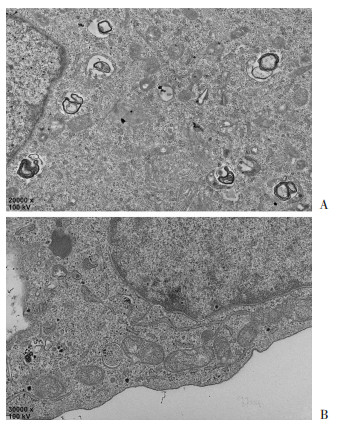
|
| A:阴性对照组(×20 000);B:敲低组(×30 000) 图 3 TEM观察沉默NUPR1后U266细胞自噬小体 |
2.2.2 自噬相关蛋白表达
Western blot检测发现,敲低组LC3Ⅱ/LC3Ⅰ、Beclin1和ATG5蛋白相对表达量较阴性对照组明显减少,而P62蛋白相对表达量显著高于阴性对照组(P < 0.05)。经雷帕霉素处理后,阴性对照组和敲低组LC3Ⅱ/LC3Ⅰ、Beclin1和ATG5蛋白相对表达量均较处理前明显增加,但敲低组仍低于阴性对照组(P < 0.001);两组P62蛋白相对表达量均较处理前显著降低,但敲低组仍高于阴性对照组(P < 0.05,表 3、图 4)。
| 组别 | LC3Ⅱ/LC3Ⅰ | Beclin1 | ATG5 | P62 | |||||||
| 处理前 | 处理后 | 处理前 | 处理后 | 处理前 | 处理后 | 处理前 | 处理后 | ||||
| 阴性对照组 | 1.813±0.469 | 3.363±0.296 | 1.550±0.147 | 2.753±0.193 | 1.286±0.258 | 1.883±0.229 | 2.430±0.376 | 0.677±0.121 | |||
| 敲低组 |
0.803±0.155 | 1.513±0.060 | 1.030±0.139 | 1.580±0.080 | 0.780±0.107 | 1.097±0.031 | 3.610±0.338 | 1.233±0.260 | |||
| P值 | 0.024 | <0.001 | 0.011 | 0.001 | 0.035 | 0.004 | 0.016 | 0.028 | |||
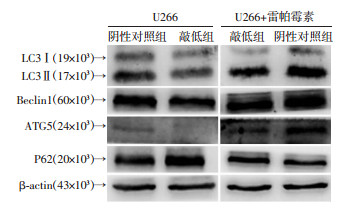
|
| 图 4 雷帕霉素处理前后对各组细胞自噬蛋白的影响 |
2.3 沉默NUPR1增强U266细胞迁移和侵袭能力 2.3.1 迁移实验
敲低组穿过小室的细胞数为(825±129),显著多于阴性对照组[(411±113),P=0.014]。雷帕霉素处理后,两组穿过小室的细胞数均较处理前明显减少,但敲低组仍多于阴性对照组[(327±27) vs (207±44),P=0.016,图 5]。
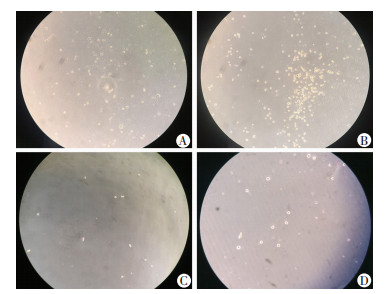
|
| A:阴性对照组;B:敲低组;C:阴性对照组+雷帕霉素;D:敲低组+雷帕霉素 图 5 沉默NUPR1对U266细胞迁移能力的影响(×40) |
2.3.2 侵袭实验
敲低组穿过小室的细胞数为(326±59),显著多于阴性对照组[(175±60),P=0.037]。雷帕霉素处理后,两组穿过小室的细胞数均较处理前明显减少,但敲低组仍多于阴性对照组[(125±24) vs (70±17),P=0.035,图 6]。
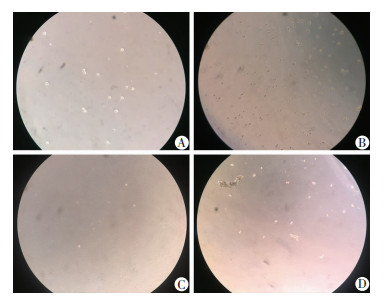
|
| A:阴性对照组;B:敲低组;C:阴性对照组+雷帕霉素;D:敲低组+雷帕霉素 图 6 沉默NUPR1对U266细胞侵袭能力的影响(×40) |
2.3.3 迁移和侵袭相关蛋白检测
敲低组细胞MMP9和CXCR4蛋白相对表达量均显著高于阴性对照组。经雷帕霉素处理后,两组MMP9和CXCR4蛋白相对表达量均较处理前减少,但敲低组仍高于阴性对照组(P < 0.05, 表 4、图 7)。
| 组别 | MMP9 | CXCR4 | |||
| 处理前 | 处理后 | 处理前 | 处理后 | ||
| 阴性对照组 | 0.617±0.045 | 0.289±0.009 | 0.890±0.431 | 0.550±0.099 | |
| 敲低组 |
1.239±0.028 | 0.642±0.024 | 2.481±0.817 | 1.205±0.180 | |
| P值 | <0.001 | <0.001 | 0.041 | 0.016 | |
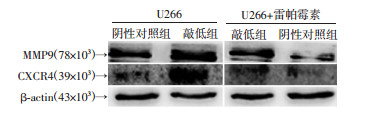
|
| 图 7 沉默NUPR1对U266细胞MMP9和CXCR4蛋白表达的影响 |
2.4 AKT/mTOR信号通路蛋白表达
Western blot结果表明,敲低组p-AKT/T-AKT和p-mTOR/T-mTOR蛋白相对表达量较阴性对照组明显增加。雷帕霉素处理后,两组p-AKT/T-AKT和p-mTOR/ T-mTOR蛋白相对表达量均较处理前减少,但敲低组仍显著高于阴性对照组(P < 0.001,图 8、表 5)。
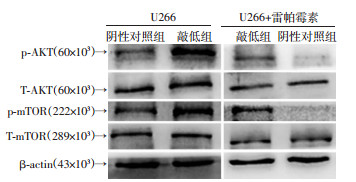
|
| 图 8 沉默NUPR1对AKT、mTOR蛋白表达的影响 |
| 组别 | p-AKT/T-AKT | p-mTOR/T-mTOR | |||
| 处理前 | 处理后 | 处理前 | 处理后 | ||
| 阴性对照组 | 1.223±0.127 | 0.427±0.040 | 1.493±0.051 | 0.343±0.252 | |
| 敲低组 |
1.749±0.201 | 0.900±0.056 | 2.017±0.280 | 0.937±0.031 | |
| P值 | 0.019 | <0.001 | 0.034 | <0.001 | |
3 讨论
本课题组既往研究发现NUPR1在MM中高表达,且下调NUPR1表达可抑制U266细胞增殖,促进细胞凋亡[12]。为更全面了解NUPR1在MM中的作用,本研究靶向敲低NUPR1观察其对MM自噬和迁袭的影响,结果显示,NUPR1在mRNA和蛋白水平敲低均有效,在mRNA水平敲低效果较蛋白水平更显著。基因翻译水平变化往往滞后于转录水平,且蛋白质较mRNA结构更稳定,降解速度更缓慢,因而出现上述情况。
本研究显示,沉默NUPR1后,自噬小体明显减少,自噬标志性蛋白LC3Ⅰ向LC3Ⅱ转化减少。此外,自噬底物相关蛋白P62的表达增加,Beclin1和ATG5表达降低。由此可见,沉默NUPR1对U266细胞自噬有抑制作用。MM细胞较高水平的自噬对其生存具有保护作用,若抑制MM细胞自噬,将促进其死亡[13]。
有学者认为MM患者骨髓中MMP9和CXCR12均呈高表达[14]。MMP9是一种锌肽酶,主要作用于细胞外基质降解过程,表达上调能增强肿瘤细胞的迁袭能力[15]。CXCR12与其受体CXCR4结合可促进肿瘤细胞黏附于血管内皮细胞,进而加速癌细胞的转移。为进一步探明沉默NUPR1对MM细胞迁移和侵袭的影响,本研究利用RNA干扰技术沉默NUPR1后发现,U266细胞迁袭能力增加。同时,检测MMP9和CXCR4蛋白表达增加。提示沉默NUPR1可提高U266细胞迁移和侵袭能力。
那么,沉默NUPR1对MM细胞自噬、迁移和侵袭的影响相互间是否存在关联呢?我们运用自噬诱导剂雷帕霉素处理后发现,U266细胞自噬水平较处理前有所恢复,同时迁移和侵袭能力较处理前降低。该结果表明,随着NUPR1沉默,U266细胞迁移和侵袭能力的改变可能与自噬水平降低相关。我们推测自噬流的抑制导致MMP9及CXCR4蛋白部分降解途径受阻而在细胞中累积。
我们前期研究结果提示NUPR1在MM中可能具有促癌作用,而本研究发现沉默NUPR1能促进MM的迁移和侵袭。多项研究发现NUPR1对于不同肿瘤作用不一,甚至同一种肿瘤中也可能发挥相反的作用[16-17]。我们认为肿瘤的发生、发展是一个动态变化的复杂过程,每个环节有多种因子参与调节。NUPR1所发挥的作用是综合调控多种因子总效应的结果。故其可能在MM发展的不同阶段发挥不同作用。
研究表明,MM的增殖、自噬和迁袭能力的调控均与AKT/mTOR信号通路相关[18-21]。为进一步探究NUPR1影响MM细胞这些生物学行为是否与该通路有关,本研究检测了AKT、mTOR蛋白及其磷酸化水平。结果发现沉默NUPR1可上调AKT及其下游的mTOR磷酸化水平,在用雷帕霉素(一种mTOR的特殊抑制剂)处理后,敲低组AKT和mTOR磷酸化水平降低,同时细胞自噬水平较处理前增高,迁袭能力较处理前降低,即NUPR1可能通过AKT/mTOR途径调控U266细胞自噬、迁移和侵袭。
综上所述,沉默NUPR1可降低U266细胞自噬水平并增强其迁移、侵袭能力。微小残留病灶导致MM难治的问题仍比较棘手。若通过干扰NUPR1的表达能够影响MM细胞死亡和迁袭能力,减少MRD形成,将对MM的防治有着重要意义。本实验仅初步观察了NUPR1对MM自噬、迁移和侵袭的影响,其具体参与调控的基因及相关机制仍有待进一步研究。
| [1] |
AL-HUJAILY E M, OLDHAM R A, HARI P, et al. Development of novel immunotherapies for multiple myeloma[J]. Int J Mol Sci, 2016, 17(9): E1506. DOI:10.3390/ijms17091506 |
| [2] |
BARWICK B G, GUPTA V A, VERTINO P M, et al. Cell of origin and genetic alterations in the pathogenesis of multiple myeloma[J]. Front Immunol, 2019, 10: 1121. DOI:10.3389/fimmu.2019.01121 |
| [3] |
YANAMANDRA U, KUMAR S K. Minimal residual disease analysis in myeloma-when, why and where[J]. Leuk Lymphoma, 2018, 59(8): 1772-1784. DOI:10.1080/10428194.2017.1386304 |
| [4] |
MATSUNAGA K, FUJISAWA K, TAKAMI T, et al. NUPR1 Acts as a pro-survival factor in human bone marrow-derived mesenchymal stem cells and is induced by the hypoxia mimetic reagent deferoxamine[J]. J Clin Biochem Nutr, 2019, 64(3): 209-216. DOI:10.3164/jcbn.18-112 |
| [5] |
TAN L, YAMMANI R R. Nupr1 regulates palmitate-induced apoptosis in human articular chondrocytes[J]. Biosci Rep, 2019, 39(2): BSR20181473. DOI:10.1042/BSR20181473 |
| [6] |
李丁. 转录调节因子NUPR1在相关疾病发生发展中的作用及其机制研究进展[J]. 山东医药, 2018, 58(35): 111-114. LI D. Advances in the role of transcriptional regulatory factor NUPR1 in the development of related diseases and its mechanism[J]. Shandong Med J, 2018, 58(35): 111-114. DOI:10.3969/j.issn.1002-266X.2018.35.031 |
| [7] |
黄红艳, 张彦斌, 王小利, 等. 靶向敲低核蛋白1抑制HepG2肝癌细胞的增殖及迁移[J]. 细胞与分子免疫学杂志, 2015, 31(6): 782-786. HUANG H Y, ZHANG Y B, WANG X L, et al. Nuclear protein 1 knockdown inhibits proliferation and migration of HepG2 cells[J]. Chin J Cell Mol Immunol, 2015, 31(6): 782-786. |
| [8] |
邓跃林, 陈艳丽, 吴华杰, 等. Nupr1调控非小细胞肺癌细胞迁移、凋亡机制的研究[J]. 现代生物医学进展, 2017, 17(19): 3636-3640. DENG Y L, CHEN Y L, WU H J, et al. Nupr1 regulates the migration and apoptosis of non-small cell lung cancer cells[J]. Prog Mod Biomed, 2017, 17(19): 3636-3640. DOI:10.13241/j.cnki.pmb.2017.19.009 |
| [9] |
MU Y, YAN X, LI D, et al. NUPR1 maintains autolysosomal efflux by activating SNAP25 transcription in cancer cells[J]. Autophagy, 2018, 14(4): 654-670. DOI:10.1080/15548627.2017.1338556 |
| [10] |
WU H, LIU C, YANG Q, et al. MIR145-3p promotes autophagy and enhances bortezomib sensitivity in multiple myeloma by targeting HDAC4[J]. Autophagy, 2019, 15(9): 1-15. DOI:10.1080/15548627.2019.1635380 |
| [11] |
李星欣, 曾沉思, 杨泽松, 等. 沉默NUPR1基因对人多发性骨髓瘤U266细胞自噬的影响及机制研究[J]. 重庆医科大学学报, 2019, 44(2): 146-151. LI X X, ZENG C S, YANG Z S, et al. Effect of silencing NUPR1 gene on autophagy in human multiple myeloma U266 cells and its mechanism[J]. J Chongqing Med Univ, 2019, 44(2): 146-151. |
| [12] |
ZENG C, LI X, LI A, et al. Knockdown of NUPR1 inhibits the growth of U266 and RPMI8226 multiple myeloma cell lines via activating PTEN and caspase activation-dependent apoptosis[J]. Oncol Rep, 2018, 40(3): 1487-1494. DOI:10.3892/or.2018.6544 |
| [13] |
王纪珍, 陈君敏, 曾志勇, 等. 自噬调节药物对多发性骨髓瘤细胞增殖、凋亡和自噬的影响[J]. 中国实验血液学杂志, 2018, 26(3): 817-823. WANG J Z, CHEN J M, ZENG Z Y, et al. Effects of autophagy regulating drugs on proliferation, apoptosis and autophagy of multiple myeloma cells[J]. J Exp Hematol, 2018, 26(3): 817-823. DOI:10.7534/j.issn.1009-2137.2018.03.031 |
| [14] |
SKLIRIS A, LABROPOULOU V T, PAPACHRISTOU D J, et al. Cell-surface serglycin promotes adhesion of myeloma cells to collagen type I and affects the expression of matrix metalloproteinases[J]. FEBS J, 2013, 280(10): 2342-2352. DOI:10.1111/febs.12179 |
| [15] |
YANG G L, TAO H R, WANG H W, et al. Ara-C increases gastric cancer cell invasion by upregulating CD-147-MMP-2/MMP-9 via the ERK signaling pathway[J]. Oncol Rep, 2015, 33(4): 2045-2051. DOI:10.3892/or.2015.3748 |
| [16] |
CANO C E, HAMIDI T, GARCIA M N, et al. Genetic inactivation of Nupr1 Acts as a dominant suppressor event in a two-hit model of pancreatic carcinogenesis[J]. Gut, 2014, 63(6): 984-995. DOI:10.1136/gutjnl-2013-305221 |
| [17] |
HAMIDI T, ALGVL H, CANO C E, et al. Nuclear protein 1 promotes pancreatic cancer development and protects cells from stress by inhibiting apoptosis[J]. J Clin Invest, 2012, 122(6): 2092-2103. DOI:10.1172/JCI60144 |
| [18] |
ZHANG L, WANG H D, ZHU J H, et al. Mollugin induces tumor cell apoptosis and autophagy via the PI3K/AKT/mTOR/p70S6K and ERK signaling pathways[J]. Biochem Biophys Res Commun, 2014, 450(1): 247-254. DOI:10.1016/j.bbrc.2014.05.101 |
| [19] |
TONG Y, ZHU W, HUANG X, et al. PI3K inhibitor LY294002 inhibits activation of the Akt/mTOR pathway induced by an oncolytic adenovirus expressing TRAIL and sensitizes multiple myeloma cells to the oncolytic virus[J]. Oncol Rep, 2014, 31(4): 1581-1588. DOI:10.3892/or.2014.3020 |
| [20] |
HU J, HU W X. Targeting signaling pathways in multiple myeloma: Pathogenesis and implication for treatments[J]. Cancer Lett, 2018, 414: 214-221. DOI:10.1016/j.canlet.2017.11.020 |
| [21] |
罗国平, 刘芬, 谷文, 等. 褐藻糖胶对U266细胞自噬、迁移及侵袭的影响[J]. 上海交通大学学报(医学版), 2017, 37(3): 312-317. LUO G P, LIU F, GU W, et al. Effect of fucoidan on autophagy, migration and invasion of U266 cells[J]. J Shagnhai Jiaotong Univ(Med Sci), 2017, 37(3): 312-317. DOI:10.3969/j.issn.1674-8115.2017.03.007 |



