2. 610083 成都,中国人民解放军西部战区总医院中心实验室
2. Central Laboratory, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China
肝细胞癌(hepatocellular carcinoma,HCC)是严重影响我国人民健康的一种重大疾病,每年全球超过一半的新发病例都发生在中国[1]。由于缺乏有效的早期诊断和药物治疗措施,其死亡率非常高[2]。其原因是肝癌发现晚,易复发及易转移的调控机制尚不清楚。因此,揭示肝癌发生发展的机制,同时寻找肝癌的早期诊断标记具有重要的意义。
上皮-间质转化(epithelial-to-mesenchymal tran-sition,EMT)和肿瘤干细胞(cancer stem cells,CSCs)都被认为与肿瘤恶性的进展有关,然而EMT和CSCs之间关系尚不清楚。综合国内外文献,正常肝干细胞(liver normal stem cells,LNSCs)恶性转化是肝癌干细胞(liver cancer stem cells,LCSCs)的重要来源之一的学说越来越得到认可[3-6]。有学者推测肝癌发生的过程可能就是LNSCs反复发生EMT,最后转变成LCSCs[7]。
ATP酶家族AAA结构域蛋白(ATPase family AAA domain protein,ATAD3A)是一种核编码的干细胞线粒体膜蛋白,涉及线粒体动力学、蛋白质翻译、细胞生长和胆固醇代谢[8-9]。近来研究发现,其在肺癌、胶质瘤、乳腺癌中存在异常表达,并与肿瘤的耐药及增殖密切相关[10-14],同时还发现其对几种有机体的发育至关重要[15-17]。然而,目前研究者对ATAD3A在LNSCs和HCC中的生物学功能和调节机制中的作用还不是很清楚。因此,本研究旨在探讨过表达ATAD3A基因对大鼠LNSCs系(WBF-344)发生EMT过程的调控作用,分析过表达ATAD3A基因对WBF-344细胞恶性转化的影响,以揭示ATAD3A促进LNSCs发生EMT转化的相关机制。这些将有助于为LCSCs起源学说提供理论支持,为肝癌的早期诊断提供潜在的分子标记,同时为LNSCs治疗HCC提供理论指导。
1 材料与方法 1.1 材料大鼠上皮样肝干细胞——WBF-344细胞株购于商城北纳创联生物科技有限公司;胎牛血清(FBS)和DMEM高糖培养基购自Gibco公司;anti-ATAD3A抗体、anti-N-cadherin抗体、anti-E-cadherin抗体购自Abcam公司;过表达ATAD3A慢病毒购自上海吉凯基因;所有引物由擎科生物合成,引物序列见表 1。胰酶-EDTA购自北京索莱宝科技有限公司;SPF级裸鼠购于四川达硕生物科技公司;反转录试剂盒及RT-qPCR试剂购自大连宝生物科技公司。
| 基因 | 上游引物 | 下游引物 |
| ATAD3A | 5′-AGGAAGCGAGCAACTGAAAA-3′ | 5′-CAAAGCAGACCATCTCGTCA-3′ |
| E-cadherin | 5′-TTGAGAATGAGGTCGGTGCC-3′ | 5′-CAGAATGCCCTCGTTGGTCT-3′ |
| N-cadherin | 5′-GGGTCATCCCTCCGATCAAC-3′ | 5′-ATGAAGATGCCCGTTGGAGG-3′ |
| ZEB1 | 5′-TGCCCAAACTGCAAGAAACG-3′ | 5′-GGACTGCCTGGTGATGTTGA-3′ |
| ZEB2 | 5′-CTCGCAGCACATGAATCACAG-3′ | 5′-ATGCTCTGCAAGTAAGCCCG-3′ |
| GAPDH | 5′-AGTGCCAGCCTCGTCTCATA-3′ | 5′-GACTGTGCCGTTGAACTTGC-3′ |
1.2 方法 1.2.1 正常肝干细胞的培养
将WBF-344细胞接种于含10%胎牛血清的高糖培养基(包含100×104 U/L青霉素及100 mg/L链霉素)中,培养条件为37 ℃、5%CO2专用细胞培养箱。每2~3 d进行1次传代,选取对数期的细胞进行后续实验。
1.2.2 稳定转染细胞株的构建将WBF-344细胞以约2.5×105接种于6孔板中。实验分为3组:正常对照(normal)组、空载对照(vector)组和过表达(over expression-ATAD3A,OE-ATAD3A)组。待细胞生长至6孔板70%~80%时,向培养基中加入浓度为0、2、4、6、8、10 ng/mL的嘌呤霉素,每隔1 d更换1次培养基,连续培养2周,最终确定嘌呤霉素的最低工作浓度为1 ng/mL。参照说明书以最适滴度的含过表达ATAD3A基因的慢病毒转染入WBF-344细胞,即为过表达组;同时将不携带过表达ATAD3A基因的载体转入WBF-344细胞,即为空载对照组;正常对照组不做额外处理。在vector组和OE-ATAD3A组转染48 h后留取四分之一的细胞于原孔板中,其余细胞进行冻存。向细胞中加入终浓度为1 ng/mL的嘌呤霉素,连续筛选培养3~4周。在筛选出单克隆细胞后将细胞转接于10 cm直径的细胞培养皿中继续扩大培养,此后每次传代留取部分冻存,其余进行后续实验研究。
1.2.3 细胞形态观察在获得稳定转染细胞后,以0.25%的胰酶消化传代培养,当完全贴壁培养约12 h后应用倒置相差显微镜(日本尼康)观察细胞形态变化情况,观察倍数为100倍。
1.2.4 实时荧光定量PCR检测基因的表达收集扩增后的细胞用TRIzol法提取WBF-344细胞的总RNA后,依据TaKaRa公司反转录试剂盒说明书步骤合成cDNA,再按照RT-qPCR试剂盒说明书步骤进行PCR扩增。实验中所有引物由四川擎科生物公司合成。扩增条件为95 ℃预变性1 min,95 ℃变性10 s,60 ℃退火10 s,共计进行40个循环,此后65~95 ℃进行溶解曲线检测引物特异性。采用2-△△Ct法计算WBF-344细胞中各个目标基因的表达水平。
1.2.5 Western blot检测蛋白表达每组收集2个10 cm直径培养皿的细胞后,参照凯基全蛋白提取试剂盒说明书的方法提取WBF-344细胞的总蛋白,之后参照索莱宝BCA蛋白定量检测试剂盒说明书对所提取的蛋白进行浓度测定。取定量合格总蛋白,加入上样缓冲液充分混匀后,在沸水中变性15 min。取适量的样品进SDS-PAGE电泳分离,采用转膜仪将目标分子量的蛋白转至PVDF膜上,放入5%的脱脂奶粉中封闭1 h。之后加入目标抗体在4 ℃环境过夜孵育,第2天拿出用TBS洗涤,添加对应二抗在室温孵育1 h后,再次洗涤干净,之后利用化学发光仪检测ECL显影。应用Image Pro Plus 6.0软件测定条带灰度值计算结果。
1.2.6 划痕实验检测细胞迁移能力在6孔板中按每组3个孔各接种同等适宜数量的细胞,待细胞生长至70%~80%后,在孔板底部用记号笔横向画3条横线,用20 μL的枪头沿直尺纵向在每个孔中划出同样宽度痕缝,用PBS清洗至无漂浮细胞后继续培养。拍照记录0、24、48、72 h细胞生长状态,每次拍照位点为记号笔横线和划痕交叉处横线上下各取一个视野的区域。
1.2.7 Transwell实验检测细胞侵袭能力将3组细胞常规消化后,添加无血清的DMEM培养基制备1×106/mL的细胞悬液。实验前以浓度为1 g/L的基质胶对Transwell小室上室聚碳酸酯微孔膜进行包被,于培养箱内聚合反应30 min后,向24孔板Transwell小室的上层小室中加入200 μL细胞悬液,下层小室中加入含10%胎牛血清的DMEM高糖培养基,每组实验重复3次。在细胞培养箱中常规培养48 h后,取出小室用10%中性甲醛固定。用棉签轻柔地将小室膜内侧黏附细胞搽除,之后用0.1%结晶紫溶液对小室膜外侧染色30 min,洗涤晾干后取下小室膜,利用载玻片封片以后在显微镜下观察、拍照。
1.2.8 裸鼠皮下成瘤检测恶性转化程度取各组对数期细胞,胰蛋白酶消化以后用无血清培养基洗涤重悬,制备成单细胞悬液(5×107/mL)。取5周龄左右的SPF级裸鼠,分别于裸鼠左右两侧臀部皮下注射已制备好的细胞悬液200 μL,每隔1 d观察记录有无瘤体形成。
1.3 统计学分析采用SPSS13.0统计软件。数据以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。
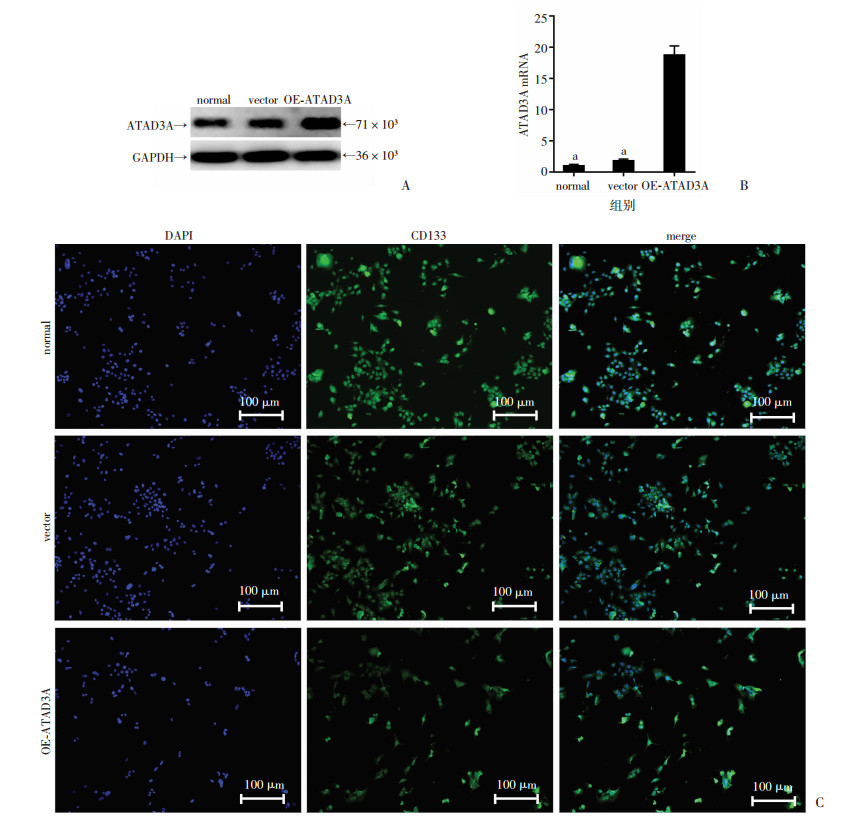
2 结果 2.1 成功构建过表达ATAD3A细胞株在转染病毒后,RT-qPCR检测结果显示,与normal组和vector组比较,OE-ATAD3A组ATAD3A基因表达明显升高(P < 0.01,图 1A);通过Western blot验证蛋白表达水平也明显升高(图 1B)。将细胞株进行爬片培养,并用CD133进行干性标记染色,结果3组并无明显差别(图 1C)。
|
| A: PCR验证mRNA相对表达量; B: Western blot验证蛋白水平的表达量(n=3, x±s);a:P < 0.01,与OE-ATAD3A组比较;C:CD133标记染色结果 图 1 WBF-344细胞稳定过表达ATAD3A基因的验证及干性鉴定 |
|
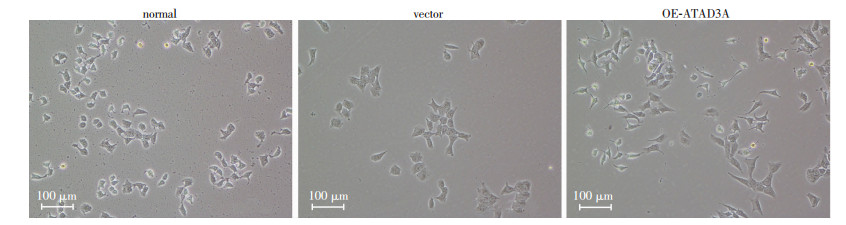
| 图 2 过表达ATAD3A后细胞形态学观察 |
2.2 过表达ATAD3A后细胞形态发生改变
倒置相差显微镜观察结果发现,normal组细胞呈卵圆状上皮样特点生长,vector组形态与normal组相似,而OE-ATAD3A组细胞形态发生明显改变,表现为由卵圆形向长条形和梭形的间质细胞形态特征转变。提示过表达ATAD3A后可能促使WBF-344细胞发生EMT转变。
2.3 过表达ATAD3A后增强细胞迁移能力细胞划痕实验显示,与vector组和normal组比较,OE-ATAD3A组WBF-344细胞的迁移速度明显增加(图 3),差异有统计学意义(P < 0.05)。

|
| 图 3 细胞划痕实验检测稳定过表达ATAD3A细胞的迁移能力 |
2.4 过表达ATAD3A后增强细胞侵袭能力
Transwell小室实验观察显示,OE-ATAD3A组的细胞侵袭能力明显高于vector组和normal组(图 4),差异有统计学意义(P < 0.01,图 5)。

|
| 图 4 结晶紫染色观察过表达ATAD3A后对WBF-344细胞侵袭能力的影响 |

|
| a:P < 0.01,与OE-ATAD3A组比较 图 5 过表达ATAD3A后各组染色细胞数分析 (n=9, x±s) |
2.5 EMT相关表面标志物表达发生改变
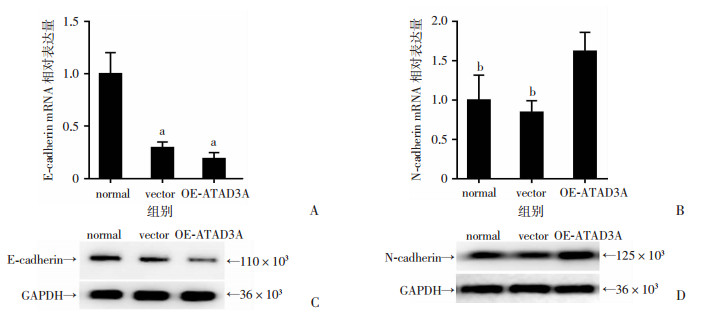
设计EMT相关细胞上皮标志物E-cadherin和间质标志物N-cadherin的引物,通过PCR的方法检测其基因表达情况。结果显示,与vector组和normal组比较,OE-ATAD3A组上皮标志物E-cadherin表达量明显降低(图 6A),而间质标志物N-cadherin的表达量明显升高(图 6B);Western blot检测其蛋白表达情况与基因表达一致(图 6C、D)。差异均有统计学意义(P < 0.05)。提示过表达ATAD3A可以促进WBF-344细胞发生EMT的特征转变。
|
| a:P < 0.01,b:P < 0.05,与OE-ATAD3A组比较; A:PCR验证E-cadherin的mRNA相对表达量;B:PCR验证N-cadherin的mRNA相对表达量;C:Western blot检测E-cadherin蛋白的表达;D:Western blot检测N-cadherin蛋白的表达 图 6 检测EMT相关表面标记的结果 (n=6, x±s) |
2.6 EMT相关转录因子发生改变
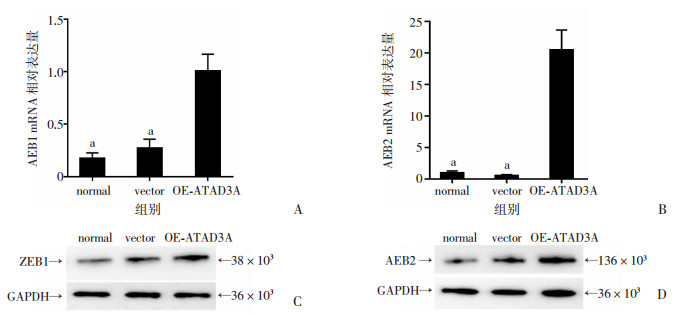
设计与EMT标志物相关的转录因子ZEB1和ZEB2的引物,通过PCR检测其基因表达情况,Western blot法检测其蛋白表达变化。结果显示与vector组和normal组比较,OE-ATAD3A组上皮标志物E-cadherin和间质标志物N-cadhein转录相关ZEB1/ZEB2的基因表达明显升高(P < 0.01, 图 7A、B),其蛋白表达也呈现一致的变化趋势(P < 0.01, 图 7C、D)。
|
| a:P < 0.01,与OE-ATAD3A组比较; A:PCR检测ZEB1的基因表达;B:PCR检测ZEB2的基因表达;C:Western blot检测ZEB1蛋白的表达;D:Western blot检测ZEB2相关蛋白的表达 图 7 EMT相关转录因子的检测结果 (n=6, x±s) |
2.7 裸鼠皮下成瘤实验结果
将各组细胞接种裸鼠皮下以后,观察3周,未能观察到肿瘤块的形成。提示过表达ATAD3A后能促使WBF-344细胞发生EMT,促进侵袭和迁移能力增强,但是其诱导的恶性程度还不足以使细胞发展成为恶性肿瘤。
3 讨论原发性HCC是我国常见的恶性肿瘤之一,其发现晚,治疗效果差,患者的平均5年生存率不足15%[1],寻找有效的早期诊断标志,早期治疗是目前公认的能有效提高患者生存时间的方法。甲胎蛋白虽然是目前临床运用最多,特异性较高的预测标志[18],新近的研究也发现一些其他分子,如miRNA-7也能有效预测HCC患者的发生和预后[19]。因此,筛选更有效的分子标记对早期发现HCC以及对患者的治疗十分重要。
近年来发现ATAD3A是功能多样的干细胞线粒体膜蛋白超家族中的一员,以保守的AAA+模块序列为特征[20-21],对几种有机体的发育至关重要,包括秀丽隐杆线虫、黑腹果蝇和小家鼠等[15-17]。ATAD3A又作为脂质和脂肪酸代谢的关键调节器,参与代谢性疾病[22-23]。已有研究报道,在胶质瘤、肺腺癌、子宫颈癌和头颈部肿瘤中ATAD3A呈现异常表达,尤其是在某些特定情况下,与早癌的发生和癌症复发后总生存率有关[10-14]。尽管其在发育和部分肿瘤中的作用已经得到证实,但是ATAD3A在肝癌发生、发展中的机制,尤其是对肝干细胞的影响仍然不清楚。因此,本研究旨在探讨过表达ATAD3A基因对大鼠LNSCs系(WBF-344)发生EMT过程的调控作用,进一步分析过表达ATAD3A基因对WBF-344细胞恶性转化的影响。结果显示ATAD3A的过表达与大鼠肝干细胞的侵袭和转移有密切的关系,与对照组比较,过表达ATAD3A后WBF-344细胞形态发生明显改变,表现为由卵圆形向长条形和梭形的间质细胞形态特征转变,WBF-344细胞的侵袭和迁移能力得到明显的增强,提示可能发生EMT转变。进一步研究显示,过表达ATAD3A后,与EMT相关的上皮标志物E-cadherin表达量明显降低,而间质标志物N-cadherin表达量则明显升高,证实了我们起初的猜想。再次验证与E-cadherin和N-cadherin转录相关的上游转录因子ZEB1和ZEB2的表达,也得到了相同的表达趋势的结果。提示过表达ATAD3A能诱导WBF-344细胞的EMT发生、发展,其可能与E-cadherin和N-cadherin的上游转录因子相关。
在癌细胞中ATAD3A的过表达与肿瘤生长和转移密切相关,而ATAD3A的突变和缺失与发育和神经障碍有关[23-24]。结合本研究和前期文献基础,证实在LNSCs中过表达ATAD3A能诱导EMT的发生,并促进LNSCs的侵袭和转移。ATAD3A的过表达能增加癌细胞合成代谢,特别是对于类固醇合成和对化学疗法和放射疗法的抗性,部分通过抑制自噬和线粒体自噬来实现[25]。最近已经证明几种调节ATAD3A在控制线粒体功能中的分子机制,包括mTOR-ATAD3A功能轴和ATAD3A-FAT1相互作用[26]。这些发现支持ATAD3A在肿瘤发生和发展中的关键作用。作为潜在的致癌基因,ATAD3A代表了开发抗癌新疗法的良好候选者。本研究表明,过表达ATAD3A后能诱导大鼠LNSCs发生EMT,并增强细胞的侵袭和迁移能力。但其具体的分子机制,还需进一步的研究分析。总之,ATAD3A可能是一种新的人类癌症治疗靶点。
| [1] |
WU J, YANG S G, XU K J, et al. Patterns and trends of liver cancer incidence rates in Eastern and Southeastern Asian countries (1983-2007) and predictions to 2030[J]. Gastroenterology, 2018, 154(6): 1719-1728. DOI:10.1053/j.gastro.2018.01.033 |
| [2] |
LI W, LI Q, JING L, et al. P57-mediated autophagy promotes the efficacy of EGFR inhibitors in hepatocellularcarcinoma[J]. Liver Int, 2019, 39(1): 147-157. DOI:10.1111/liv.13957 |
| [3] |
ARVIO M, MONONEN I. Aspartylglycosaminuria: a review[J]. Orphanet J Rare Dis, 2016, 11: 162. DOI:10.1186/s13023-016-0544-6 |
| [4] |
LIU W H, WANG X, YOU N, et al. Efficient enrichment of hepatic cancer stem-like cells from a primary rat HCC model via a density gradient centrifugation-centeredmethod[J]. PLoS ONE, 2012, 7(4): e35720. DOI:10.1371/journal.pone.0035720 |
| [5] |
LUO H, LIU W H, LIANG H Y, et al. Differentiation-inducing therapeutic effect of Notch inhibition in reversing malignant transformation of liver normal stem cells via MET[J]. Oncotarget, 2018, 9(27): 18885-18895. DOI:10.18632/oncotarget.24421 |
| [6] |
SUZUKI A, SEKIYA S, ONISHI M, et al. Flowcytometric isolation and clonal identification of self-renewing bipotent hepatic progenitor cells in adult mouse liver[J]. Hepatology, 2008, 48(6): 1964-1978. DOI:10.1002/hep.22558 |
| [7] |
XIE H, LIAO N, LAN F, et al. 3D-cultured adipose tissue-derived stem cells inhibit liver cancer cell migration and invasion through suppressing epithelial-mesenchymal transition[J]. Int J Mol Med, 2018, 41(3): 1385-1396. DOI:10.3892/ijmm.2017.3336 |
| [8] |
GILQUIN B, TAILLEBOURG E, CHERRADI N, et al. The AAA+ ATPase ATAD3A controls mitochondrial dynamics at the interface of the inner and outermembranes[J]. Mol Cell Biol, 2010, 30(8): 1984-1996. DOI:10.1128/MCB.00007-10 |
| [9] |
JIN G, XU C, ZHANG X, et al. Atad3a suppresses Pink1-dependent mitophagy to maintain homeostasis of hematopoietic progenitor cells[J]. Nat Immunol, 2018, 19(1): 29-40. DOI:10.1038/s41590-017-0002-1 |
| [10] |
HUBSTENBERGER A, LABOURDETTE G, BAUDIER J, et al. ATAD 3A and ATAD 3B are distal 1p-located genes differentially expressed in humanglioma cell lines and present in vitro anti-oncogenic and chemoresistant properties[J]. Exp Cell Res, 2008, 314(15): 2870-2883. DOI:10.1016/j.yexcr.2008.06.017 |
| [11] |
YOU W C, CHIOU S H, HUANG C Y, et al. Mitochondrial protein ATPase family, AAA domain containing 3A correlates withradioresistance in glioblastoma[J]. Neuro-oncology, 2013, 15(10): 1342-1352. DOI:10.1093/neuonc/not077 |
| [12] |
CHIANG S F, HUANG C Y, LIN T Y, et al. An alternative import pathway of AIF to the mitochondria[J]. Int J Mol Med, 2012, 29(3): 365-372. DOI:10.3892/ijmm.2011.849 |
| [13] |
CHEN T C, HUNG Y C, LIN T Y, et al. Human papillomavirus infection and expression of ATPase family AAA domain containing 3A, a novel anti-autophagy factor, in uterine cervical cancer[J]. Int J Mol Med, 2011, 28(5): 689-696. DOI:10.3892/ijmm.2011.743 |
| [14] |
FANG H Y, CHANG C L, HSU S H, et al. ATPase family AAA domain-containing 3A is a novel anti-apoptotic factor in lung adenocarcinoma cells[J]. J Cell Sci, 2010, 123(Pt 7): 1171-1180. DOI:10.1242/jcs.062034 |
| [15] |
HOFFMANN M, BELLANCE N, ROSSIGNOL R, et al. C.elegans ATAD-3 is essential for mitochondrial activity and development[J]. PLoS ONE, 2009, 4(10): e7644. DOI:10.1371/journal.pone.0007644 |
| [16] |
KAMATH R S, FRASER A G, DONG Y, et al. Systematic functional analysis of theCaenorhabditis elegans genome using RNAi[J]. Nature, 2003, 421(6920): 231-237. DOI:10.1038/nature01278 |
| [17] |
GOLLER T, SEIBOLD U K, KREMMER E, et al. Atad3 function is essential for early post-implantation development in the mouse[J]. PLoS ONE, 2013, 8(1): e54799. DOI:10.1371/journal.pone.0054799 |
| [18] |
BAI D S, ZHANG C, CHEN P, et al. The prognostic correlation of AFP level at diagnosis with pathological grade, progression, and survival of patients with hepatocellularcarcinoma[J]. Sci Rep, 2017, 7(1): 12870. DOI:10.1038/s41598-017-12834-1 |
| [19] |
KABIR T D, GANDA C, BROWN R M, et al. A microRNA-7/growth arrest specific 6/TYRO3 axis regulates the growth and invasiveness ofsorafenib-resistant cells in human hepatocellular carcinoma[J]. Hepatology, 2018, 67(1): 216-231. DOI:10.1002/hep.29478 |
| [20] |
IYER L M, LEIPE D D, KOONIN E V, et al. Evolutionary history and higher order classification of AAA+ ATPases[J]. J Struct Biol, 2004, 146(1/2): 11-31. DOI:10.1016/j.jsb.2003.10.010 |
| [21] |
SNIDER J, THIBAULT G, HOURY W A. The AAA+ superfamily of functionally diverseproteins[J]. Genome Biol, 2008, 9(4): 216. DOI:10.1186/gb-2008-9-4-216 |
| [22] |
DIENSTMANN R, RODON J, PRAT A, et al. Genomic aberrations in the FGFR pathway: opportunities for targeted therapies in solidtumors[J]. Ann Oncol, 2014, 25(3): 552-563. DOI:10.1093/annonc/mdt419 |
| [23] |
DESAI R, FRAZIER A E, DURIGON R, et al. ATAD3 gene cluster deletions cause cerebellar dysfunction associated with altered mitochondrial DNA and cholesterol metabolism[J]. Brain, 2017, 140(6): 1595-1610. DOI:10.1093/brain/awx094 |
| [24] |
COOPER H M, YANG Y, YLIKALLIO E, et al. ATPase-deficient mitochondrial inner membrane protein ATAD3A disturbs mitochondrial dynamics in dominant hereditary spastic paraplegia[J]. Hum Mol Genet, 2017, 26(8): 1432-1443. DOI:10.1093/hmg/ddx042 |
| [25] |
TENG Y, LANG L W, SHAY C. ATAD3A on the path tocancer[J]. Adv Exp Med Biol, 2019, 1134: 259-269. DOI:10.1007/978-3-030-12668-1_14 |
| [26] |
CHEN D Y, YUAN X H, LIU L J, et al. Mitochondrial ATAD3A regulates milk biosynthesis and proliferation of mammary epithelial cells from dairy cow via themTOR pathway[J]. Cell Biol Int, 2018, 42(5): 533-542. DOI:10.1002/cbin.10929 |



