甲状腺癌作为最常见的内分泌肿瘤,近几十年发病率以每年3.6%的速率增长[1]。其中约90%为分化良好的甲状腺乳头状癌(papillary thyroid carcinoma,PTC)和甲状腺滤泡状癌(follicular thyroid carcinoma,FTC),即分化型甲癌(differentiated thyroid carcinoma,DTC)。大多数DTC患者经过标准的三步疗法,即外科手术切除原发病灶+放射性131I治疗+TSH激素抑制治疗,可达临床治愈标准,10年生存率高达90%。放射性131I治疗是DTC患者治疗过程中至关重要的一个环节,有助于清除术中未切除的残余病灶及远处转移灶,改善患者预后[2]。然而,15%~20%的患者会失去或在131I治疗的过程中逐渐失去摄碘能力,即发展成为碘难治型甲状腺癌(radioiodine-refractory differentiated thyroid carcinoma,RR-DTC)。这已成为影响甲状腺癌患者总体生存率的主要因素。目前对于RR-DTC的治疗多采取靶向药物治疗或局部姑息性125I粒子植入[3-5],但临床资料显示治疗效果并不理想,患者10年生存率仅10%[6]。基于放射性核素治疗在甲状腺癌治疗中的重要作用和碘难治型甲状腺癌的治疗现状,研究者希望能找到RR-DTC与DTC之间的差异蛋白,一方面初步阐释RR-DTC发生的分子机制,另一方面从大量差异蛋白中找到可能的核素分子治疗靶点,为患者提供更有效的治疗方式。
蛋白质组学已成熟运用于肿瘤领域研究,通过蛋白质组学技术得到的差异蛋白,不仅可作为肿瘤诊断的标志物,监测患者预后,同时为肿瘤的治疗提供新的思考方向。近年来,iTRAQ技术由于其高通量及高稳定性的优势,已广泛运用于肿瘤和其他疾病差异蛋白的筛选[7-8]。iTRAQ技术可同时监测8个样本之间的差异蛋白并进行定量分析,在蛋白质组学研究中拥有不可取代的地位。本实验运用iTRAQ技术联合质谱分析,筛选碘难治型甲状腺癌与分化型甲状腺癌之间的差异蛋白,并通过生物信息学方法,分析差异蛋白在RR-DTC发生、发展中的作用及其可能的机制。
1 材料与方法 1.1 病例收集选取2018年6月至2019年3月重庆医科大学附属第一医院核医学科碘难治型甲状腺癌患者颈部转移淋巴结3例,其中女性1例,男性2例。3例病例均经病理检查和大剂量131I全身扫描证实符合RR-DTC标准。选取分化型甲状腺癌患者颈部转移淋巴结3例作对照,其中女性1例,男性2例。本研究获得本院伦理委员会审查批准(2019年2月),患者均签署知情同意书。
1.2 实验方法① 蛋白质提取及Bradford法进行蛋白定量;②蛋白质酶解:每个样品取100 μg蛋白体积,14 000×g离心40 min,4 ℃,弃上清;加入两倍体积50% TEAB,14 000×g离心40 min,4 ℃,弃上清;加入1 μg/μL胰蛋白酶,37 ℃恒温水浴过夜后冻干消化液;加入TEAB(水:TEAB=1 :1)复溶肽段;③肽段标记:根据SCIEX公司iTRAQ© Reagent-8Plex Multiplex Kit说明书操作,DTC标记113标签,RR-DTC标记114标签;④HPLC预分离:选用RIGOL L-3000液相系统,分离柱型号为250×4.60 mm的SCX柱对样品进行分离,得到16个组分;⑤肽段纯化:选用Phenomenex公司strata-X C18反相色谱除盐;样品用1 mL MilliQ水稀释过柱,1 mL 5%乙腈洗柱除盐;低温离心抽干乙腈后加入甲酸复溶纯化后的肽段;⑥质谱检测:质谱仪使用Thermo Q-Exactive,纳升液相选用Dionex ultimate 3000 nano LC system;流动相A液为0.1%甲酸+2% ACN+98%水,B液为0.1%甲酸+2% ACN+98%水;流动速率为0.4 μL/min;质谱检测的参数设置如下:离子模式为正电子模式,母离子扫描范围为350~2 000 m/z,二级分辨率为17 500,离子源电压为1 800 V。
1.3 生物信息学分析将处理后的数据通过Mascot软件进行检索(Mascot T2.3.0),利用GO数据库和KEGG数据库对鉴定到的蛋白进行功能注释和生物通路信息分析,利用TCGA、TCPA数据库对部分差异蛋白在甲状腺癌中的表达进行验证。
1.4 统计学分析根据蛋白质丰度水平差异,实验组和对照组之间采用t检验进行差异显著性评估。蛋白丰度改变倍数>1.2倍,P < 0.05的蛋白被视差异蛋白。
2 结果 2.1 蛋白鉴定结果本研究共鉴定得到差异蛋白665个,其中在RR-DTC中显著上调的蛋白327个,显著下调的蛋白338个。部分差异蛋白见表 1。
| 数据库编号 | 蛋白名称 | 编码基因 | 变化趋势 |
| Q16610 | Extracellularmatrix protein 1 | ECM1 | ↑ |
| P26447 | Protein S100-A4 | S100A4 | ↑ |
| D3GKD8 | A-gamma globin Osilo variant | HBG1 | ↑ |
| P36222 | Chitinase-3-like protein 1 | CHI3L1 | ↑ |
| P12492 | Annexin A3 | ANXA3 | ↑ |
| P31947 | 14-3-3 protein sigma | SFN | ↑ |
| P12270 | Nucleoprotein TPR | TPR | ↑ |
| O15230 | Laminin subunit alpha-5 | LAMA5 | ↑ |
| P09211 | Glutathione S-transferase P6 | GSTP1 | ↑ |
| P04792 | Heat shock protein beta-1 | HSPB1 | ↑ |
| P60953 | Cell division control protein 42 | CDC42 | ↓ |
| P15153 | Ras-related C3 botulinum toxin substrate | RAC2 | ↓ |
| P29590 | Protein PML | PML | ↓ |
| P24844 | Myosin regulatory light polypeptide 9 | MYL9 | ↓ |
| Q9Y490 | Talin-1 | TLN1 | ↓ |
| P62805 | Histone H4 | HIST1H4A | ↓ |
| P16402 | Histone H1.3 | HIST1H1D | ↓ |
| P02647 | Apolipoprotein A-1 | APOA1 | ↓ |
| P35579 | Myosin-9 | MYH9 | ↓ |
| Q13707 | ACTA2 protein | ACTA2 | ↓ |
| “数据库编号”为Pubmed中蛋白的Accession;↑表示相对于DTC,该蛋白在RR-DTC中表达显著上调;↓表示相对于DTC,该蛋白在RR-DTC中表达显著下调 | |||
2.2 GO功能注释
通过GO功能注释,本研究发现较多差异蛋白富集涉及细胞进程,单有机体进程,代谢过程,生物调节进程及应激反应等生物进程。此外,差异蛋白的主要功能包括离子结合,蛋白结合,氧化酶活性,转运体活性及酶调节活性。细胞组分功能中差异蛋白主要参与细胞器,细胞质成分,细胞间组分及细胞膜的构成(图 1)。
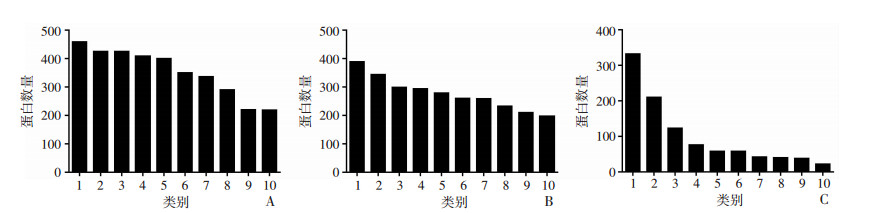
|
| A:细胞成分 1: cellular component; 2: cell; 3: cell part; 4: intracellular; 5: intracellular part; 6: cytoplasm; 7: organelle; 8: cytoplasmic part; 9: organelle part; 10: intracellular organelle part; B:生物过程 1:cellular process; 2: single-organism process; 3: metabolic process; 4: single-organism cellular process; 5: organic substance metabolic process; 6: cellular metabolic process; 7: primary metabolic process; 8: biological regulation; 9: regulation of biological process; 10: response to stimulus; C:分子功能 1: binding; 2: ion binding; 3: metal binding; 4: protein binding; 5: stuctural molecule activity; 6: oxidoreductase activity; 7: transporter activity; 8: molecular function regular; 9: enzyme regular activity; 10: transmembrane transporter activity 图 1 差异蛋白的GO功能注释 |
2.3 KEGG通路分析
通过对差异蛋白进行KEGG通路分析,本研究发现差异蛋白广泛参与代谢通路,黏着斑,核糖体,ECM受体相互作用等28条细胞代谢通路,提示碘难治型甲状腺癌的出现涉及复杂的生物学通路改变,而非单因素作用。
2.4 TCGA、TCPA数据库检索本研究发现,大量编码差异蛋白的基因经TCGA数据库证实在甲状腺癌中发生改变。HBG1, S100A1, ANXA3, LAMA5, CDC42, RAC2, PML等基因在甲状腺癌中发生突变,SFN, TPR, HSPB1, CHI3L1, MYH9等基因出现拷贝数的增加。TCPA数据库显示,14-3-3 epsilon, 14-3-3 sigma, 14-3-3 eta, MYH9, MYH11在甲状腺癌中的表达显著高于癌旁正常组织。本研究发现14-3-3 epsilon和14-3-3 sigma在RR-DTC中的表达显著高于DTC,而MYH9和MYH11在RR-DTC中的表达较DTC显著下调。
3 讨论碘难治型甲状腺癌的出现被认为与酪氨酸激酶通路和磷酸肌醇通路的改变密切相关[9-11],针对酪氨酸激酶代谢通路的靶向药物索拉菲尼已被美国FDA批准用于碘难治型甲状腺癌的晚期治疗,但目前临床数据显示索拉菲尼等靶向药物疗效欠佳。基于RR-DTC对患者生存质量的影响和生命的威胁,研究者积极探索其可能的发病机制和有效的治疗方式[12-13]。目前对于RR-DTC的研究多基于基因层面,如Braf、TERT等。Braf基因突变被认为与RR-DTC的出现有一定相关性,但机制尚不明确[14-15]。基因需经过转录、翻译及修饰,通过蛋白表达起作用,因此,蛋白水平的研究更能阐释疾病的发生机制。本研究得到的大量差异蛋白,包括细胞外基质蛋白(extracellular matrix protein 1,ECM1)、谷胱甘肽转移酶(glutathione S-transferase,GST)、细胞分裂控制蛋白42(cell division control protein 42,CDC42)、Ras相关C3肉毒毒素底物(ras-related C3 botulinum toxin substrate,RAC2)、肌球蛋白调节轻链多肽(myosin regulatory light polypeptide 9,MYL-9)、辅肌动蛋白(actinin)等,广泛参与到RR-DTC发展过程中,对肿瘤血管生成,侵袭转移及细胞失分化起到重要作用。
目前认为,NIS蛋白表达的降低是甲状腺癌失分化过程中一个重要的蛋白水平改变[16-17]。研究表明,通过慢病毒转染过表达NIS蛋白后甲状腺癌细胞摄碘率显著增高[18]。本研究显示,NIS蛋白在RR-DTC和DTC之间表达量差异不明显,可能是RR-DTC中该蛋白虽然表达,但其生物活性受到通路中其他蛋白表达量改变的影响,导致病灶不摄碘但NIS蛋白表达量未出现下调。通过GO分析,本研究发现NIS蛋白参与的生物过程,包括离子转运、钠离子转运及跨膜转运等,生物过程中存在大量差异蛋白富集,这些蛋白表达水平的改变会影响蛋白之间的相互作用及蛋白自身的活性。其中,参与跨膜转运的蛋白14-3-3 eta、线粒体ATP合成酶亚单位E及受体酪氨酸蛋白磷酸酶等在RR-DTC中表达显著降低,可能是导致甲状腺癌细胞NIS蛋白功能障碍的重要原因。
本研究通过KEGG通路分析发现,在MAPK信号通路中,RAC2及CDC42在RR-DTC中的表达水平较DTC显著下调。RAC2和CDC42位于MAPK信号通路的上游,通过与MEK相互作用促进MKK4的表达,进一步提高其通路下游蛋白JNK的表达。JNK蛋白的表达水平被认为与细胞分化程度有关。TCPA数据库显示,JNK2在DTC中表达接近于癌旁正常组织,提示DTC细胞分化良好。而在RR-DTC中,RAC2和CDC42的表达显著下调,使得它们与MEK的相互作用减弱,影响与MKK4的相互作用,进一步引起JNK2蛋白表达水平降低,导致细胞分化不良,抗凋亡能力增强。因此,我们推测MAPK通路中蛋白水平的改变在RR-DTC细胞失分化过程中起到重要作用。
本研究发现,TRK在RR-DTC中的表达显著高于DTC。TPK被称为转位启动子蛋白(translocated promoter region,TPR)。该蛋白与核孔复合体相互作用,是mRNA和蛋白运输的必要组分。编码该蛋白的基因5’末端与多种激酶基因的融合可导致肿瘤的发生。TRK与Ras蛋白结合引起VEGF/MMPs表达上调,改变细胞微环境,促进肿瘤血管生成,为肿瘤细胞的存活提供必要条件。此外,在VEGF信号通路中,热休克蛋白27(heat shock protein 27,HSP27)在RR-DTC中表达水平上调,使得肌动蛋白(actin)重组,提高细胞的迁移能力;同时,在黏着斑通路中,ECM、actinin及踝蛋白(talin)在RR-DTC中表达水平下调,它们与肌动蛋白的结合减弱增强了细胞活动性。两条通路中多种蛋白表达水平的改变为RR-DTC细胞侵袭能力较DTC细胞增强提供了理论支持。
除此之外,本研究发现部分差异蛋白之间存在紧密的联系。例如,ECM1和几丁质酶3-1(chitinase 3 like 1,CHI3L1)在RR-DTC中的表达显著上调。研究提示ECM1可抑制基质蛋白金属酶-9(matrix metalloproteinase-9,MMP-9)的表达,导致肿瘤抑素表达降低,促进肿瘤生长[19];ECM1抑制基底膜多糖的表达,使得内皮素的表达水平降低,内皮素具有抑制肿瘤血管形成的作用,其表达水平降低有利于肿瘤血管的形成。TCGA数据库显示,CHI3L1在甲状腺癌中基因拷贝数增加,CHI3L1可刺激RAGE蛋白表达,导致肿瘤发生;还可与syndecan-1相互作用,激活ERK1/2 MAPK通路促进肿瘤的增殖生长[20]。大量差异蛋白的相互作用揭示了RR-DTC发生机制的复杂性,但与此同时,也为我们寻找诊断和治疗的标志物提供了可能。如MAPK信号通路中的多种差异蛋白CDC42、ECM1和CHI3L1有可能成为核素治疗的潜在靶点。
与目前大量肿瘤蛋白组学研究不同,本研究对照组选用DTC组织而非正常癌旁甲状腺组织。因此,所得到的结果更能反映RR-DTC细胞失分化后蛋白表达水平变化引起的细胞功能的改变,这是未来研究可以考虑的方向。本研究的主要不足之处在于纳入的病例数较少,标本之间的个体差异可能在一定程度上影响结果的确定性。RR-DTC出现颈部淋巴结转移且处在疾病进展期的病例不多见,大样本的收集需要长时间的积累,因而大样本差异蛋白的验证有待后续跟进。
iTRAQ作为一项高通量的蛋白组学研究技术,在肿瘤研究领域具有重要的作用。通过该技术联合质谱分析鉴定得到RR-DTC与DTC之间的差异蛋白,为肿瘤基础研究提供大量可用信息。生物信息学分析中得到的各信号通路中蛋白水平的改变需要长时间、大样本的验证,这也为后续研究提供了方向,希望能够进一步阐明RR-DTC发生的分子机制。
志谢 感谢重庆医科大学附属第一医院内分泌乳腺外科、病理科在实验过程中给予的帮助;感谢北京华大蛋白公司为本实验提供的技术支持。| [1] |
LIM H, DEVESA S S, SOSA J A, et al. Trends in thyroid cancer incidence and mortality in the United States, 1974-2013[J]. JAMA, 2017, 317(13): 1338-1348. DOI:10.1001/jama.2017.2719 |
| [2] |
KLAIN M, PACE L, ZAMPELLA E, et al. Outcome of patients with differentiated thyroid cancer treated with 131-iodine on the basis of a detectable serum thyroglobulin level after initial treatment[J]. Front Endocrinol (Lausanne), 2019, 10: 146. DOI:10.3389/fendo.2019.00146 |
| [3] |
YU S T, GE J N, LUO J Y, et al. Treatment-related adverse effects with TKIs in patients with advanced or radioiodine refractory differentiated thyroid carcinoma: a systematic review and meta-analysis[J]. Cancer Manag Res, 2019, 11: 1525-1532. DOI:10.2147/CMAR.S191499 |
| [4] |
SUZUKI C, KIYOTA N, IMAMURA Y, et al. Exploratory analysis of prognostic factors for lenvatinib in radioiodine-refractory differentiated thyroid cancer[J]. Head Neck, 2019, 41(9): 3023-3032. DOI:10.1002/hed.25784 |
| [5] |
张文文, 郝珊瑚, 王治国, 等. 125I粒子植入治疗131I难治性分化型甲状腺癌淋巴结转移的临床价值[J]. 中华核医学与分子影像杂志, 2018, 38(1): 9-13. ZHANG W W, HAO S H, WANG Z G, et al. Clinical value of 125I seeds implantation in treatment of lymph nodes metastases from 131I refractory differentiated thyroid carcinoma[J]. Chin J Nucl Med Mol Imaging, 2018, 38(1): 9-13. DOI:10.3760/cma.j.issn.2095-2848.2018.01.003 |
| [6] |
KREISSL M C, JANSSEN M J R, NAGARAJAH J. Current treatment strategies in metastasized differentiated thyroidcancer[J]. J Nucl Med, 2019, 60(1): 9-15. DOI:10.2967/jnumed.117.190819 |
| [7] |
张墨, 陈骊珠, 杨泽宇, 等. 基于iTRAQ蛋白质组学技术对前列腺癌血清标志物的筛查[J]. 现代肿瘤医学, 2018, 26(1): 18-21. ZHANG M, CHEN L Z, YANG Z Y, et al. Screening study for prostate cancer serum biomarkers based on iTRAQ proteomic technology[J]. J Mod Oncol, 2018, 26(1): 18-21. DOI:10.3969/j.issn.1672-4992.2018.01.005 |
| [8] |
CHAERKADY R, HARSHA H C, NALLI A, et al. Aquantitative proteomic approach for identification of potential biomarkers in hepatocellular carcinoma[J]. J Proteome Res, 2008, 7(10): 4289-4298. DOI:10.1021/pr800197z |
| [9] |
WEITZMAN S P, SHERMAN S I. Novel drug treatments of progressive radioiodine-refractory differentiated thyroidcancer[J]. Endocrinol Metab Clin North Am, 2019, 48(1): 253-268. DOI:10.1016/j.ecl.2018.10.009 |
| [10] |
WÄCHTER S, WUNDERLICH A, GREENE B, et al. Selumetinib activity in thyroid cancer cells: modulation of sodium iodide symporter and associated miRNAs[J]. Int J Mol Sci, 2018, 19(7): 2077. DOI:10.3390/ijms19072077 |
| [11] |
武元元, 王军. 甲状腺未分化癌的靶向药物治疗进展[J]. 国际肿瘤学杂志, 2019, 46(2): 98-101. WU Y Y, WANG J. Advancement of targeted agents in the treatment of anaplastic thyroid carcinoma[J]. J Int Oncol, 2019, 46(2): 98-101. DOI:10.3760/cma.j.issn.1673-422X.2019.02.008 |
| [12] |
BERDELOU A, LAMARTINA L, KLAIN M, et al. Treatment of refractory thyroidcancer[J]. Endocr Relat Cancer, 2018, 25(4): R209-R223. DOI:10.1530/ERC-17-0542 |
| [13] |
NAOUM G E, MORKOS M, KIM B, et al. Novel targeted therapies and immunotherapy for advanced thyroidcancers[J]. Mol Cancer, 2018, 17(1): 51. DOI:10.1186/s12943-018-0786-0 |
| [14] |
SHIN E, KOO J S. Expression of proteins related toautotaxin-lysophosphatidate signaling in thyroid tumors[J]. J Transl Med, 2019, 17(1): 288. DOI:10.1186/s12967-019-2028-7 |
| [15] |
GALUPPINI F, VIANELLO F, CENSI S, et al. Differentiated thyroid carcinoma in pediatric age: genetic and clinicalscenario[J]. Front Endocrinol(Lausanne), 2019, 10: 552. DOI:10.3389/fendo.2019.00552 |
| [16] |
DE MORAIS R M, SOBRINHO A B, DE SOUZA SILVA C M, et al. The role of the NIS (SLC5A5) gene in papillary thyroid cancer: A systematic review[J]. Int J Endocrinol, 2018, 2018: 1-11. DOI:10.1155/2018/9128754 |
| [17] |
CHENG L X, LIU M, RUAN M M, et al. Challenges and strategies on radioiodine treatment for differentiated thyroid carcinoma[J]. Hell J Nucl Med, 2016, 19(1): 23-32. DOI:10.1967/s002449910334 |
| [18] |
SON S H, GANGADARAN P, AHN B C. A novel strategy of transferring NIS protein to cells using extracellular vesicles leads to increase in iodine uptake andcytotoxicity[J]. Int J Nanomed, 2019, 14: 1779-1787. DOI:10.2147/IJN.S189738 |
| [19] |
ZHANG K, LIU J Q, LI C L, et al. Identification and validation of potential target genes in papillary thyroid cancer[J]. Eur J Pharmacol, 2019, 843: 217-225. DOI:10.1016/j.ejphar.2018.11.026 |
| [20] |
CHI J S, XIA X J, ZHANG L F, et al. Helicobacter pylori induces GATA3-dependentchitinase 3 like 1 (CHI3L1) upregulation and contributes to vascular endothelial injuries[J]. Med Sci Monit, 2019, 25: 4837-4848. DOI:10.12659/MSM.916311 |



