结直肠癌是在美国发病率与病死率均排名第3位的恶性肿瘤[1]。虽然在我国目前结直肠癌的发病与病死率排名第5[2],但统计数据显示近年来我国结直肠癌的发病率和病死率分别以3.33%和3.05%的速度逐年升高,已经严重危害我国国民的生命健康[3]。目前,手术仍然是早期结直肠癌的首选治疗方式,但是由于发病隐匿,早期症状不典型,多数结直肠癌患者就诊时已处于晚期而失去手术机会。因此,提高早期诊断水平对于延长结直肠癌患者生存和提高生存质量都尤为重要。
癌胚抗原(carcinoembryonic antigen,CEA)仍是目前最常用的结直肠癌临床诊断参考标志物。然而临床实践证实,单独检测血清CEA无法满足结直肠癌早期诊断的要求[4]。脱嘌呤脱嘧啶核酸内切酶1(apurinic/ apyrimidinic endonuclease 1,APE1)是碱基切除修复(base excision repair,BER)途径的关键限速酶,负责BER中切除脱嘌呤脱嘧啶位点,除此之外APE1还具有氧化还原功能,作为共刺激因子与HIF、TP53等分子相互作用,参与多种细胞生理过程[5-6]。研究证实,APE1在维持基因组的稳定性方面发挥着重要的作用,不仅参与肿瘤的发生、发展,而且与肿瘤预后以及治疗反应有着密切的关系[7]。本课题组前期分别在非小细胞肺癌和结直肠癌患者的外周血中检测到显著高于健康人群的APE1抗体[8-9],随后又发现在非小细胞肺癌患者外周血中能够检测到APE1蛋白,并且其水平与肿瘤组织中的表达显著相关[10]。但是APE1抗体是机体免疫系统对血清中APE1蛋白的间接反映,而APE1蛋白在结直肠癌患者血清中的表达情况尚不清楚。因此,本研究检测结直肠癌患者血清APE1蛋白的表达,进一步与CEA联合分析,评价血清APE1在结直肠癌诊断中的作用及潜在临床价值。
1 资料与方法 1.1 研究对象及分组本研究纳入从2010年1月到2015年9月就诊于本院肿瘤中心,经组织病理学确诊为结直肠癌且未接受过任何治疗患者202例(病例组)。其中包括男性124例,女性78例,中位年龄63岁。入组的结直肠癌患者均排除创伤、感染、其他恶性肿瘤、自身免疫性疾病以及其他特殊疾病等。利用医院电子病历系统,收集其年龄、性别、吸烟史、饮酒史、TMN分期等临床信息。同时,纳入同期于本院健康体检中心行体检确定无肿瘤病史及其他疾病的242例健康人群作为对照组,其中男性128例,女性114例,中位年龄为55岁。
1.2 血清样本采集于清晨空腹条件下采集研究对象静脉血,在室温下静置30 min后以3 000 r/min离心10 min,分离出血清,保存于-80 ℃。检测前进行筛选,剔除溶血等不合格血清样本。
1.3 血清APE1蛋白检测采用由本实验室与天津华博特生物科技有限公司共同研发的APE1定量检测试剂盒进行检测,其中制备试剂盒所需APE1纯化蛋白、APE1单克隆抗体以及APE1多克隆抗体按照Wilson实验室方法纯化[7]。实验前1 d将待测血清标本置于4 ℃冰箱缓融。检测前将标本与试剂平衡至室温(20~28 ℃)。具体检测方法:①将3.1 mg/mL蛋白原液配制成浓度为0、0.1、0.4、1.6、4、8 ng/mL的蛋白检测标准品;②将标准品和待测血清标本100 μL分别加至相应的微孔底部,轻轻振荡混匀,盖板后置于恒温箱37 ℃条件下温育60 min;③倒掉孔内液体,每孔加入清洗液200 μL,轻轻振荡后倒掉,共洗板5次。将微孔板置于吸水纸上轻拍,以去除孔内残液;④分别于每孔加入100 μL酶结合物,轻轻振荡混匀,盖板后再次置于37 ℃恒温箱中温育60 min;⑤重复步骤3过程洗板;⑥每个微孔分别加入显色剂A和B的混合液;⑦再次于37 ℃恒温箱中反应15 min;⑧取出微孔板,每孔加入50 μL终止液(2 mol/L硫酸)终止显色,轻轻振荡混匀后,利用酶标仪(测定波长450 nm,参比波长620 nm)测定各孔的光密度值[D(450)]。再利用Origin 9.0软件将D(450)值推算成浓度水平。
1.4 血清CEA水平的检测采用C-12肿瘤诊断用蛋白芯片试剂盒(浙江湖州数康生物科技有限公司)进行检测。CEA的正常参考范围 < 5 ng/mL。高于5 ng/mL则判定为阳性。
1.5 APE1免疫组化染色结直肠癌患者组织APE1蛋白表达检测采用二步法。鼠抗人APE1单克隆抗体购自Novus Biologicals公司(Litlleton,CO),工作浓度为1 :2 000;S-P免疫组化试剂盒PowerVisionTM(IgG抗体- HRP多聚体)购自北京中山公司。4 μm连续石蜡切片,二甲苯脱蜡,乙醇梯度水化,3%H2O2-甲醇室温10 min,EDTA热修复抗原,滴加一抗,4 ℃过夜,复温后PBS冲洗3次,PowerVisionTM复合物50 μL,37 ℃孵育30 min,DAB-H2O2显色,苏木精复染。以PBS代替一抗作阴性对照。
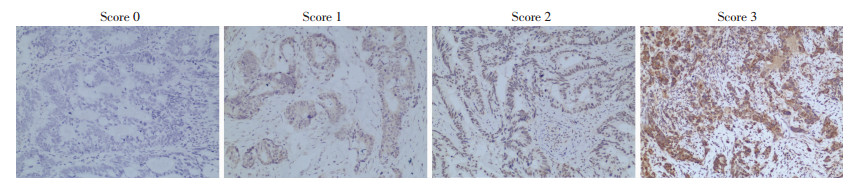
APE1免疫组化评分=染色强度×着色细胞数量。染色强度计0~3分,0:无着色,1:轻度着色,2:中度着色,3:高度着色;着色细胞数量计0~3分,0:无阳性细胞,1:阳性细胞比例≤25%;2:25%<阳性细胞比例<75%;3:阳性细胞比例≥75%。根据免疫组化评分判断APE1的表达强度,阴性(Score 0):APE1免疫组化评分为0;低表达(Score 1):免疫组化评分1~3;中度表达(Score 2):免疫组化评分4~6;高表达(Score 3):免疫组化评分7~9。
1.6 统计学分析运用SPSS 23.0和GraphPad 7.0软件进行统计学分析和绘图。两组临床基线资料比较采用卡方检验;两组血清APE1水平比较采用非参数检验。运用Logistic回归分析血清APE1和CEA与结直肠癌发病相关性,Spearman法分析APE1在肿瘤组织中的表达与血清表达水平的相关性。绘制受试者工作特征曲线(receiver operative characteristic curve,ROC曲线),通过计算曲线下面积(area under curve,AUC)和约登系数(Youden’s index,灵敏度+特异性-1)判定血清APE1在结直肠癌诊断中的合理性及其决断值(cut-off值),将血清APE1水平高于此cut-off值定义为阳性。检验水准:α=0.05。
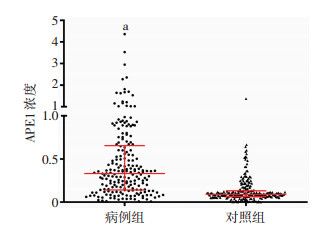
2 结果 2.1 两组人群临床基线资料和血清APE1水平对比202例结直肠癌患者中位年龄为63(24~90)岁,242例健康对照人群中位年龄为55(29~89)岁,两组差异有统计学意义(P < 0.05)。其他临床基线资料(性别、吸烟、饮酒、肿瘤家族史)之间差异均无统计学意义(表 1)。ELISA检测结果显示,结直肠癌患者的中位血清APE1蛋白浓度为0.331(0.007~4.359)ng/mL,健康对照人群的中位血清APE1浓度为0.091(0~1.374) ng/mL,病例组的血清APE1浓度显著高于健康对照组(P < 0.01,图 1)。
| 临床因素 | 病例组 | 对照组 | P值 |
| 年龄/岁 | |||
| <60 | 80(39.60) | 156(64.46) | < 0.05 |
| ≥60 | 122(60.40) | 86(35.54) | |
| 性别 | |||
| 男 | 124(61.39) | 128(52.89) | 0.072 |
| 女 | 78(38.61) | 114(47.11) | |
| 吸烟史 | |||
| 有 | 65(32.18) | 97(40.08) | 0.085 |
| 无 | 137(67.82) | 145(59.92) | |
| 饮酒史 | |||
| 有 | 42(20.79) | 56(23.14) | 0.552 |
| 无 | 160(79.21) | 186(76.86) | |
| 肿瘤家族史 | |||
| 有 | 29(14.36) | 31(12.81) | 0.635 |
| 无 | 173(85.64) | 211(87.19) | |
|
| a:P < 0.01,与对照组比较 图 1 病例组血清APE1浓度与对照组血清APE1浓度的比较 |
2.2 血清APE1浓度与结直肠癌患者临床因素的关系
结直肠癌患者血清APE1浓度与年龄、性别、吸烟史、饮酒史、肿瘤家族史以及TNM分期等临床因素之间均无明显的统计学相关性(表 2)。
| 临床因素 | n | 中位APE1/ng·mL-1 | P值 |
| 年龄/岁 | |||
| <60 | 80 | 0.360 | 0.294 |
| ≥60 | 122 | 0.307 | |
| 性别 | |||
| 男 | 124 | 0.358 | 0.062 |
| 女 | 78 | 0.290 | |
| 吸烟史 | |||
| 有 | 65 | 0.330 | 0.720 |
| 无 | 137 | 0.332 | |
| 饮酒史 | |||
| 有 | 42 | 0.281 | 0.354 |
| 无 | 160 | 0.345 | |
| TNM分期 | |||
| Ⅰ+Ⅱ | 75 | 0.297 | 0.119 |
| Ⅲ+Ⅳ | 127 | 0.360 | |
2.3 结肠癌患者组织APE1的表达与血清APE1浓度的关系
在202例结直肠癌患者样本中,收集匹配了其中46例患者的肿瘤组织进行APE1蛋白免疫组化检测。结果显示,APE1在结直肠癌中呈高表达状态(图 2),其中score 3为28例,score 2为9例,score 1为5例,score 0为4例。APE1高表达(score 2+score 3)和低表达(score 1+score 0)与患者的年龄、性别、吸烟史、饮酒史及TMN分期等临床因素之间均无明显的统计学相关性(表 3)。相关分析显示,APE1在肿瘤组织中的表达水平与血清APE1浓度呈正相关(r=0.331,P=0.025)。
|
| 图 2 结肠癌组织APE1的表达 (S-P ×200) |
| 临床因素 | n | APE1低表达 | APE1高表达 | P值 | |||
| score 0 | score 1 | score 2 | score 3 | ||||
| 总数 | 46 | 4 | 5 | 9 | 28 | ||
| 年龄/岁 | |||||||
| < 60 | 22 | 1 | 2 | 6 | 13 | 0.464 | |
| ≥60 | 24 | 3 | 3 | 3 | 15 | ||
| 性别 | |||||||
| 男性 | 26 | 2 | 3 | 5 | 16 | 1.000 | |
| 女性 | 20 | 2 | 2 | 4 | 12 | ||
| 吸烟史 | |||||||
| 有 | 19 | 1 | 2 | 4 | 12 | 0.716 | |
| 无 | 27 | 3 | 3 | 5 | 16 | ||
| 饮酒史 | |||||||
| 有 | 12 | 1 | 1 | 4 | 6 | 1.000 | |
| 无 | 34 | 3 | 4 | 5 | 22 | ||
| TNM分期 | |||||||
| Ⅰ+Ⅱ | 10 | 0 | 2 | 1 | 7 | 1.000 | |
| Ⅲ+Ⅳ | 36 | 4 | 3 | 8 | 21 | ||
2.4 利用ROC曲线分析血清APE1在结直肠癌中的诊断价值
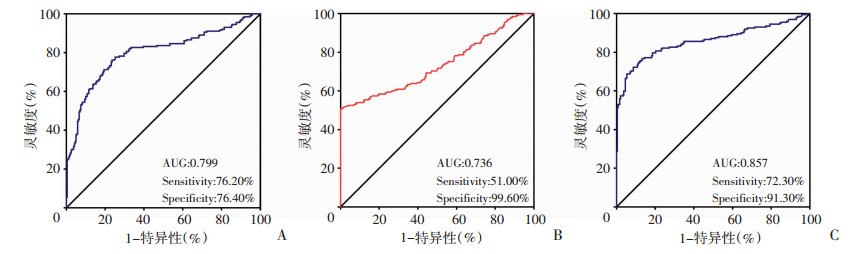
在血清APE1的ROC曲线中,曲线下面积(AUC)为0.799(95%CI=0.756~0.843),根据约登指数,其cut-off值为0.136,在此cut-off值时,利用血清APE1诊断结直肠癌的灵敏度为76.20%,特异性为76.40%。在血清CEA的ROC曲线中,其AUC为0.736(95%CI=0.687~0.785),其灵敏度为51.00%,特异性为99.60%。利用Logistic回归模型,分析血清APE1和CEA联合效果,绘制ROC曲线,AUC、灵敏度及特异性均得到综合性提升,其AUC为0.857(95%CI=0.819~0.896),灵敏度为72.30%,特异性为91.30%(图 3)。
|
| A:APE1;B:CEA;C:APE1联合CEA 图 3 血清APE1、CEA以及两者联合诊断结直肠癌的ROC曲线分析 |
3 讨论
DNA损伤修复相关蛋白通过维持基因组稳定性,参与肿瘤发生、发展及肿瘤细胞耐药等多个病理过程,并且在肿瘤的诊断及预后评估等方面显示出了巨大的潜力[11-12]。APE1是BER途径中的关键酶,具有氧化还原功能。既往研究证实APE1是结直肠癌等恶性肿瘤稳定的组织标志物[13]。首先,APE1在结直肠癌肿瘤组织中的表达模式与正常组织明显不同,主要体现在表达强度增高和胞质异位表达,而这种异常的表达形式与结直肠癌的发生、放化疗抵抗以及不良预后等密切相关[14-15]。向德兵等[15]利用人APE1 siRNA重组腺病毒Ad5/F35-APE1 siRNA转染直肠癌LOVO细胞株,可显著增强LOVO细胞对5-FU化疗敏感性及放射敏感性。此外,LAI等[16]研究表明APE1的基因多态性(Asp148Glu和T-656G)也与结直肠癌的发病相关。
我们的前期研究与其他研究均发现在血清中能够检测到APE1蛋白,并可作为多种肿瘤的诊断标志物。2015年,SHIN等[17]首次在膀胱癌患者中检测到血清APE1的表达,其浓度显著高于对照人群,被认为是膀胱癌潜在的血清标志物。同时本课题组首次在非小细胞肺癌患者外周血中检测到高水平的APE1蛋白,其浓度与肿瘤组织中APE1的表达水平呈正相关,且与非小细胞肺癌化疗敏感性有关,提示血清APE1是非小细胞肺癌的潜在肿瘤标志物,并且是预测患者的化疗预后的有效指标[10]。随后,PASCUT等[18]在晚期肝癌患者血清中再次证实存在APE1的表达,其浓度显著高于正常人和肝硬化患者,可作为肝癌诊断的标志物,其诊断效力优于现有标志物AFP。最近,HUAJUN等[19]对60例结直肠癌患者进行血清学APE1抗体的检测,结果显示结直肠癌患者的APE1自身抗体显著高于正常对照人群,APE1自身抗体联合CEACAM-1检测的敏感性和诊断正确率更优。上述研究均提示血清APE1可能在结直肠癌的诊断中也有意义。本研究结果显示,结直肠癌患者血清中的APE1浓度显著高于正常对照人群,且与组织中APE1的表达水平呈正相关,与上述国内外研究结果基本一致。然而,目前对于外周血中出现APE1蛋白的原因尚不明确,我们推测其可能与外泌体机制有关,并已在肺癌、肝癌等肿瘤中进行探索研究。
目前,临床上用于结直肠癌诊断的经典标志物仍是CEA。其在评价肿瘤进展,特别是监测疗效方面具有较大的应用价值,而作为单项指标的敏感性仍达不到早期诊断的要求[20-21]。因此,合理选择肿瘤标志物联合检测,对于提高肿瘤诊断的敏感性和特异性至关重要。本研究通过绘制ROC曲线发现血清APE1诊断结直肠癌有较高的灵敏度,但特异性较低,进而运用Logistic回归分析,绘制ROC曲线发现血清APE1和CEA联合后的综合预测效力得到显著提升,提示血清APE1可以与CEA联合作为结直肠癌早期筛查指标。
综上,结直肠癌患者血清APE1水平与肿瘤组织APE1表达正相关且较健康对照人群显著增高。血清APE1可与CEA联合作为结直肠癌辅助诊断的血清学标志物。由于样本量有限,且临床数据中预后部分尚未完善,本研究的结论仍需扩大样本量进一步验证,血清APE1水平与结直肠癌患者预后相关性仍有待进一步研究。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
CHEN W Q, SUN K X, ZHENG R S, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [4] |
DE MAIO G, RENGUCCI C, ZOLI W, et al. Circulating and stool nucleic acid analysis for colorectal cancer diagnosis[J]. World J Gastroenterol, 2014, 20(4): 957-967. DOI:10.3748/wjg.v20.i4.957 |
| [5] |
LI M X, WILSON D M 3rd. Human apurinic/apyrimidinic endonuclease 1[J]. Antioxid Redox Signal, 2014, 20(4): 678-707. DOI:10.1089/ars.2013.5492 |
| [6] |
KELLEY M R, GEORGIADIS M M, FISHEL M L. APE1/Ref-1 role in redox signaling: translational applications of targeting the redox function of the DNA repair/redox protein APE1/Ref-1[J]. Curr Mol Pharmacol, 2012, 5(1): 36-53. DOI:10.2174/1874-470211205010036 |
| [7] |
TELL G, FANTINI D, QUADRIFOGLIO F. Understanding different functions of mammalian AP endonuclease (APE1) as a promising tool for cancer treatment[J]. Cell Mol Life Sci, 2010, 67(21): 3589-3608. DOI:10.1007/s00018-010-0486-4 |
| [8] |
DAI N, CAO X J, LI M X, et al. Serum APE1 autoantibodies: a novel potential tumor marker and predictor of chemotherapeutic efficacy in non-small cell lung cancer[J]. PLoS ONE, 2013, 8(3): e58001. DOI:10.1371/journal.pone.0058001 |
| [9] |
何乐, 杨宇馨, 张诗珩, 等. 血清APE1自身抗体在结直肠癌诊断中的价值[J]. 第三军医大学学报, 2016, 38(11): 1297-1301. HE L, YANG Y X, ZHANG S H, et al. Diagnostic value of serum APE1 autoantibodies in colorectal cancer[J]. J Third Mil Med Univ, 2016, 38(11): 1297-1301. DOI:10.16016/j.1000-5404.201601165 |
| [10] |
ZHANG S H, HE L, DAI N, et al. Serum APE1 as a predictive marker for platinum-based chemotherapy of non-small cell lung cancer patients[J]. Oncotarget, 2016, 7(47): 77482-77494. DOI:10.18632/oncotarget.13030 |
| [11] |
GORGOULIS V G, VASSILIOU L V, KARAKAIDOS P, et al. Activation of the DNA damage checkpoint and genomic instability in human precancerous lesions[J]. Nature, 2005, 434(7035): 907-913. DOI:10.1038/nature03485 |
| [12] |
LI Z, QING Y, GUAN W, et al. Predictive value of APE1, BRCA1, ERCC1 and TUBB3 expression in patients with advanced non-small cell lung cancer (NSCLC) receiving first-line platinum-paclitaxel chemotherapy[J]. Cancer Chemother Pharmacol, 2014, 74(4): 777-786. DOI:10.1007/s00280-014-2562-1 |
| [13] |
CHOI S, JOO H K, JEON B H. Dynamic regulation of APE1/ref-1 as a therapeutic target protein[J]. Chonnam Med J, 2016, 52(2): 75-80. DOI:10.4068/cmj.2016.52.2.75 |
| [14] |
向德兵, 牟江洪, 谢家印, 等. 大肠癌APE1的表达特点及临床意义[J]. 解放军医学杂志, 2006, 31(2): 115-116. XIANG D B, MOU J H, XIE J Y, et al. Expression feature of APE1 and its clinical implication in colorectal carcinoma[J]. Med J Chin PLA, 2006, 31(2): 115-116. DOI:10.3321/j.issn:0577-7402.2006.02.011 |
| [15] |
XIANG D B, CHEN Z T, WANG D, et al. Chimeric adenoviral vector Ad5/F35-mediated APE1 siRNA enhances sensitivity of human colorectal cancer cells to radiotherapy in vitro and in vivo[J]. Cancer Gene Ther, 2008, 15(10): 625-635. DOI:10.1038/cgt.2008.30 |
| [16] |
LAI C Y, HSIEH L L, TANG R, et al. Association between polymorphisms of APE1 and OGG1 and risk of colorectal cancer in Taiwan[J]. World J Gastroenterol, 2016, 22(12): 3372-3380. DOI:10.3748/wjg.v22.i12.3372 |
| [17] |
SHIN J H, CHOI S, LEE Y R, et al. APE1/ref-1 as a serological biomarker for the detection of bladder cancer[J]. Cancer Res Treat, 2015, 47(4): 823-833. DOI:10.4143/crt.2014.074 |
| [18] |
PASCUT D, SUKOWATI C H C, ANTONIALI G, et al. Serum AP-endonuclease 1 (sAPE1) as novel biomarker for hepatocellular carcinoma[J]. Oncotarget, 2019, 10(3): 383-394. DOI:10.18632/oncotarget.26555 |
| [19] |
HUAJUN W, YING F, HONGXING Z, et al. Clinical value of combined detection of serum APE1-Aabs and CEACAM-1 in the diagnosis of colorectal cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22(5): 1286-1289. DOI:10.26355/eurrev_201803_14469 |
| [20] |
陈虞梅, 黄钢. 肿瘤标志物CEA, CA50和CA19-9在大肠癌诊断中的意义[J]. 放射免疫学杂志, 2005, 18(1): 8-10. CHEN Y M, HUANG G. Diagnostic significance of tumor markers CEA, CA50 and CA19-9 for colorectal cancer[J]. J Radioimmunol, 2005, 18(1): 8-10. DOI:10.3969/j.issn.1008-9810.2005.01.003 |
| [21] |
FAKIH M G, PADMANABHAN A. CEA monitoring in colorectal cancer. What you should know[J]. Oncology(Williston Park), 2006, 20(6): 579-587. |



