心肌梗死后,有效的血管网络重建和功能性心肌细胞存活二者在恢复心功能上相辅相佐,缺一不可[1]。因此,心肌缺血后若能建立有效的微循环系统对保护心脏功能、改善远期预后起着举足轻重的作用。心肌微血管内皮细胞(cardiac microvascular endothelial cells,CMVECs)是冠状动脉微血管衍生而来的特殊细胞类型,与大血管内皮细胞相比,其具有快速扩张和促进血管生成的能力[2-3]。因此,心肌梗死后新生血管的形成离不开心肌微血管内皮细胞的增殖和迁移。外泌体(exosomes)作为细胞旁分泌效应的主要产物,因其生物安全性及有效性而被广泛用于预处理细胞,促进细胞增殖、分化及存活等研究。然而,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)来源的exosomes是否具有促进心肌微血管内皮细胞增殖及机制仍不清楚。
外泌体是细胞在不同应激状态下所释放出的直径介于30~100 nm的双凹圆盘状囊泡样小体[4-5]。主要通过所携带的与供体细胞来源密切相关的遗传信息如microRNA、蛋白质及mRNA等发挥生物学作用。目前已有大量研究报道骨髓间充质干细胞源外泌体(BMSC-exosomes)参与调控包括血管内皮细胞、多发性骨髓瘤细胞及成纤维细胞增殖[6-7]。然而,不同细胞来源及不同的应激环境下分泌的exosomes所携带的遗传信息有所不同,所产生的生物学效应也存在差异[8]。目前,微小核糖核酸(microRNA,miRNA)已被证明是exosomes发挥功能作用的重要物质,更重要的是,GRAY等[9]报道,与常氧来源的干细胞exosomes相比,缺氧预处理的细胞源exosomes具有更显著的组织修复能力,并验证了该作用可能与缺氧环境改变exosomes中miRNA水平有关,后者经exosomes传递至靶细胞发挥作用。
经检索Exocarta数据库(http://exocarta.org/index.html)发现骨髓细胞系所分泌的exosomes中富含miRNA-214。我们前期研究发现,缺氧预处理BMSCs源exosomes高表达miR-214,并具有抗细胞氧化应激效应[10],但其是否对心肌微血管内皮细胞增殖产生影响,目前尚不清楚。因此,本研究拟通过分离提取常氧及缺氧预处理的BMSCs源exosomes,将其与CMVECs共培养,观察不同处理的exosomes后CMVECs细胞增殖作用及miR-214表达变化,验证BMSCs源exosomes传递miR-214对CMVECs细胞增殖作用。
1 材料与方法 1.1 主要材料清洁级2~3周龄SD大鼠30只,雌雄不拘,体质量40~50 g[陆军军医大学动物实验中心,许可证号:SCXK-(渝)2007-0005];EBM-2培养液购自HyClone公司;胎牛血清购自赛默飞世尔生物化学制品有限公司;L-DMEM培养液、胰蛋白酶购自Gibco公司;Ⅱ型胶原酶购自Sigma公司;双抗购自Solarbio公司;Edu试剂盒购自广州锐博生物有限公司;细胞周期试剂盒购自上海索莱宝生物科技有限公司。
1.2 大鼠BMSCs分离、培养及缺氧预处理颈椎脱臼法处死大鼠,于75%酒精中浸泡10 min;无菌条件下取双下肢骨骼至含4%双抗的无菌培养皿内,分离去除软组织及肌肉,剪去骨两端,充分暴露骨髓腔,用5 mL无菌注射器抽吸L-DMEM培养基反复冲洗骨髓腔获取骨髓细胞,收集于50 mL无菌离心管中,800 ×g离心5 min,去上清后用L-DMEM完全培养基重悬,分装于培养瓶,37 ℃、5%CO2孵箱培养,待细胞融合达90%左右,进行传代培养。细胞传代后,3 d换液1次,反复传代扩增,最终取P3~P5 BMSCs用于后续实验。MSCs按既往摸索的缺氧条件预处理[10],即予以含94%N2、1%O2、5%CO2的条件培养细胞24 h作为缺氧预处理条件。
1.3 大鼠CMVECs的培养SD大鼠肝素化后行颈椎脱臼法处死,无菌条件下取出心脏,分离心室并将其剪成约1 mm×1 mm×1 mm组织碎块;随后加入5 mL 0.1%Ⅱ胶原酶,37 ℃恒温下磁力搅拌器搅拌消化10 min,终止消化后静置,并收集细胞悬液备用。再次向沉淀内加入5 mL 0.1%Ⅱ胶原酶,重复操作,待大部分组织块变成白色后,800×g离心5 min,收集细胞悬液并用200目细胞筛网过滤,800×g离心5 min,弃上清,细胞沉淀用含体积分数为10%胎牛血清的EBM-2完全培养基重悬,分装于培养瓶中,置于37 ℃培养箱中培养。60 min差速贴壁后(心肌成纤维细胞最先贴壁),将未贴壁的细胞悬液(含有心肌细胞及心肌微血管内皮细胞)收集到离心管中,800×g离心5 min,弃上清,加入含10%胎牛血清的EBM-2完全培养基重悬细胞,接种于事先包被纤连蛋白的培养瓶内,37 ℃培养箱继续培养。观察细胞贴壁情况,进行换液,待细胞融合至80%~90%,可行CMVECs的传代培养,并进行后续实验。
1.4 骨髓间充质干细胞exosomes分离提取采用差速超速离心法(4 ℃,100 000×g,10 h)制备不含外泌体的胎牛血清(Exosomes-Free FBS);取常氧或缺氧预处理的生长良好的P3~P5代BMSCs,弃尽培养基,PBS洗2次;换15%不含外泌体的胎牛血清配置L-DMEM培养基,孵箱中继续培养48 h(缺氧组按上述缺氧条件处理24 h),随后收集BMSCs培养基上清液,经两次离心(4 ℃,500×g,5 min及4 ℃,2 000×g,20 min)去除死细胞及细胞碎片、保留上清液,0.22 μm滤器过滤上清液进一步去除死细胞及细胞碎片。将过滤后的上清液转移至超速离心管中,加满、勿留气泡;第1次超速离心(4 ℃,100 000×g,2 h)、弃尽上清液;10 mL PBS反复冲洗全管内壁;将重悬的exosomes悬液转移至新的超速离心管中;第2次超速离心(4 ℃,100 000×g,70 min),弃尽上清液;沉淀为所提取的exosomes,予以100 μL PBS反复冲洗全管内壁,置于-80 ℃低温冰箱保存备用。
1.5 骨髓间充质干细胞exosomes鉴定透射电镜检测exosomes形态:取50 μL exosomes悬液,2.5%戊二醛固定于100目碳膜铜网置于滤纸上,将20 μL已固定的exosomes悬液滴于碳膜铜网上,室温静置2 min,再使用红外灯烘干。随后滴加1滴1%磷钨酸钠溶液(pH=6.8)染色,室温静置2 min,红外灯烘干;透射电镜下观察exosomes的形态。
Western blot检测exosomes标记物CD63、CD9、Alix:取各组细胞蛋白并测定浓度(按BCA蛋白定量试剂盒说明书操作),所提取蛋白与上样缓冲液按比例混合后煮沸6 min,等量上样至SDS-PAGE凝胶,80 V,55 min跑积层胶,120 V跑至胶底部,然后转膜至PVDF膜,5%脱脂奶封闭1 h,一抗孵育4 ℃过夜,加入辣根过氧化酶标记二抗室温孵育1 h,用Bio-blot曝光仪检测灰度值,实验重复3次。
为验证BMSCs源exosomes对CMVECs增殖的影响,将实验分为4组:①正常对照组(Control):正常培养的CMVECs;②空白对照组(free exosomes, Free-Exos):CMVECs的培养基中加入去除exosomes的BMSCs条件培养基200 μL;③常氧外泌体组(normal exosomes,Nor-Exos):CMVECs的培养基中加入200 μL含常氧处理BMSCs源exosomes的PBS液;④缺氧外泌体组(hypoxia exosome,Hypoxia-Exos):CMVECs的培养基中加入200 μL含缺氧预处理BMSCs源exosomes的PBS液(外泌体浓度为400 μg/μL,与CMVECs共培养24 h)。
1.6 CMVECs内化BMSCs来源的exosomesCMVECs以105/mL接种至pitro皿中;取约100 μg的BMSCs-exosomes,加入1 mL的Dil染色液(1 μg/mL),混匀后37 ℃孵育5 min,随后转移至4 ℃冰箱中15 min,PBS洗1次,超速离心(100 000×g,2 h)、弃上清,100 μL EBM-2培养液重悬exosomes-Dil;待心肌微血管内皮细胞贴壁后,将exosomes-Dil悬液滴加至心肌微血管内皮细胞培养液中,“8”字轨迹轻摇混匀,孵箱继续培养(37 ℃,5%CO2)24 h;PBS洗2次,弃尽残留液体,再加入DAPI染色液染色5 min;PBS洗2次,弃尽残留液体,滴加抗荧光淬灭剂的封片液, 荧光显微镜观察结果。
1.7 Edu法检测CMVECs增殖效应按照各组处理条件及时间内处理细胞后,每个皿内加入50 μmol/L Edu培养基,37 ℃、5%CO2培养箱中培养2 h,弃培养基,PBS洗2遍/5 min,4%多聚甲醛室温固定30 min,弃固定液,加入0.2%甘氨酸摇床孵育5 min,PBS洗5 min,加入0.5% Triton-100破膜10 min,PBS洗1遍/5 min,每孔加入100 μL Apollo染色反应液,避光室温摇床孵育30 min,弃反应液,加入0.5% Triton-100摇床清洗2次/10 min,之后加入100 μL甲醇清洗1次/5 min,PBS洗1次/5 min; DAPI染色20 min,PBS洗3次/5 min,荧光显微镜观察结果。
1.8 细胞周期法检测细胞增殖按不同处理条件干预培养,随后收集细胞进行离心(1 000×g,5 min),弃上清液,加入PBS 2 mL重悬细胞,随后1 000×g,5 min后按照细胞周期试剂盒操作说明用流式细胞仪进行细胞周期测定,并分析不同周期细胞所占比例,每组重复3次进行统计学分析。
1.9 荧光定量RCR检测外泌体及细胞中miRNA-214的表达按RNA抽提试剂盒说明书进行,提取总RNA,通过茎环法反转录试剂盒说明书进行反转录,按miRNA荧光定量PCR试剂盒进行cDNA扩增。以U6为内参,miR-214反转录引物5′-GTCGTATCCAGTGCAGG-GTCCGAGGTATTCGCACTGGATACGACAACCGAT-3′;miR-214上游引物5′-TTGGGCATATGTGACCATCA-3′,下游引物5′-GGAGCTCAACCATACCAGGA-3′; U6反转录引物5′-AACGCTTCACGAATTTGCGT-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。实验重复3次,数据通过Ct比较法进行分析,定量2-△△ct表示miR-214的相对表达量。
1.10 抑制缺氧预处理BMSCs源exosomes中miR-214的表达取生长良好的BMSCs,经消化、离心收集细胞并进行细胞计数,按每孔5×105个的细胞接种于6孔板中,37℃孵箱继续培养过夜,观察细胞生长状态、弃去培养基,然后每孔加入F12培养基1.5 mL(预实验中按30、50、100 nmol/L浓度摸索出最佳转染浓度为50 nmol/L)。配制溶液A:245 μL F12培养基加5 μL miRNA inhibitor(Inhibitor-Exos组)/inhibitor negative control(INC-Exos组);配制溶液B:245 μL F12培养基加5 μL脂质体2000;孵育5 min后,将A液与B液轻轻混匀,室温孵育20 min后,加入6孔板内,继续孵育4~6 h后(37 ℃,5%CO2)更换成完全培养基继续培养48 h,并予以上述缺氧预处理条件处理细胞后提取exosomes,qRT-PCR验证exosomes中miR-214的相对表达量变化。
1.11 统计学分析采用SPSS 13.0统计软件,正态分布资料以x±s表示,组间比较采用单因素方差分析,方差齐采用LSD法,方差不齐采用Tambane’s T2法,偏态分布资料采用多个独立样本非参数比较。
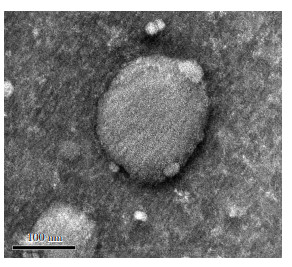
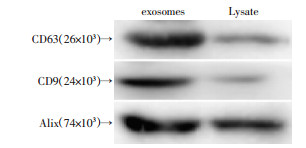
2 结果 2.1 骨髓间充质干细胞源exosomes鉴定提取的exosomes在透射电镜下观察。可见较多个大小不一、圆形或椭圆形,有脂质膜结构的囊状小泡,腔内可见低密度光亮区,电子显微镜观察exosomes直径30~100 nm(图 1)。Western blot测定exosomes膜蛋白表达情况,结果显示,exosomes膜蛋白CD63、CD9、Alix为阳性表达(图 2)。
|
| 图 1 透射电子显微镜观察缺氧预处理大鼠间充质干细胞源exosomes形态 |
|
| 图 2 Western blot鉴定exosomes膜表面分子 |
2.2 CMVECs内化BMSCs源exosomes
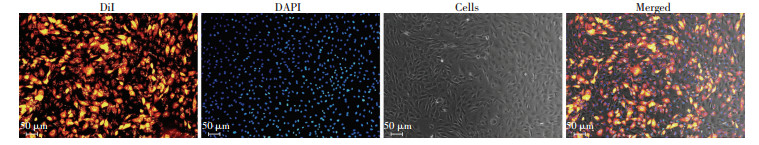
应用Dil膜染色剂标记exosomes,将exosomes-Dil与CMVECs共培养24 h后,经荧光显微镜检可见红色荧光点聚集于细胞内,说明CMVECs摄取了exosomes(图 3)。
|
| 图 3 荧光显微镜观察细胞内化DiI标记的exosomes (表达红色荧光) |
2.3 Edu检测BMSCs源exosomes对CMVECs增殖的影响
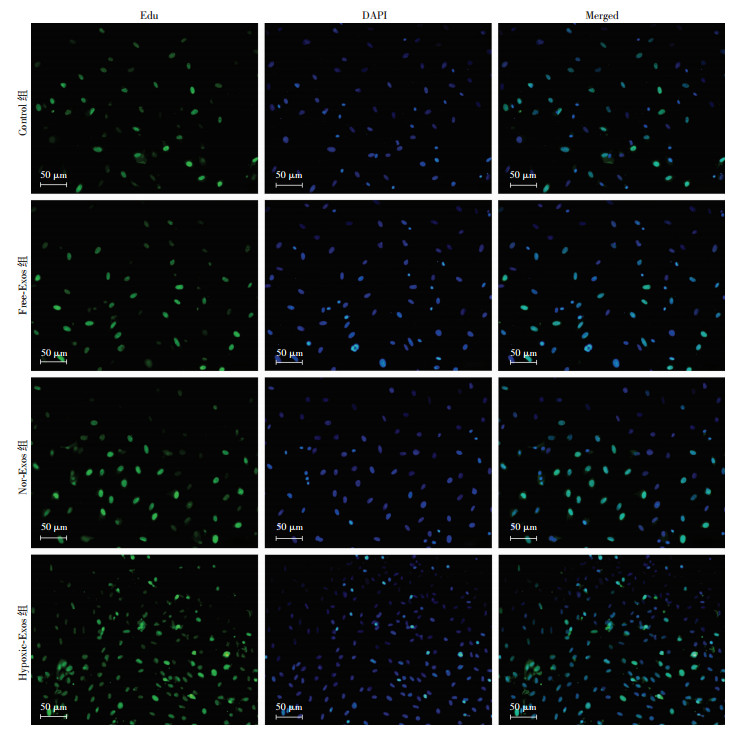
Control、Free-Exos两组中均可见细胞核表达绿色荧光,但组间差异无统计学意义(P>0.05),Nor-Exos组中绿色荧光表达明显较Control及Free-Exos组中增多(P < 0.05),与Nor-Exos组比较,Hypoxic-Exos组中细胞增殖活性增加更为显著(P < 0.05,图 4),推测缺氧预处理BMSCs来源的exosomes可有效促进CMVECs增殖。
|
| 图 4 BMSCs源exosomes增强CMVECs增殖能力 |
2.4 流式细胞术检测exosomes对CMVECs周期的影响
与Control组比较,Free-Exos组G0/G1和S+G2/M期细胞无明显变化(P>0.05);与Free-Exos组比较,Nor-Exos组细胞S+G2/M期比例明显升高(P < 0.05);与Nor-Exos组比较,Hypoxic-Exos组细胞S+G2/M期比例明显升高(P < 0.05,图 5)。
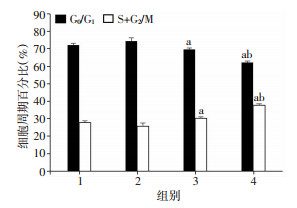
|
| 1:Control组;2:Free-Exos组;3:Nor-Exos组;4:Hypoxia-Exos组;a:P < 0.05,与Control组比较;b:P < 0.05,与Nor-Exos组比较 图 5 不同条件处理后流式细胞术检测CMVECs周期变化(n=3,x±s) |
2.5 qRT-PCR检测exosomes处理后的CMVECs中miR-214表达变化
与Nor-Exos组比较,经缺氧预处理后BMSCs-Exosomal miRNA-214明显上升(P < 0.05)。将常氧及缺氧预处理的exosomes与CMVECs共培养24 h,待其内化后,检测各组细胞中miR-214表达变化,qRT-PCR结果显示(图 6),与Control组比较,Free-Exos组中miRNA-214表达无显著差异,内化BMSCs-exosomes后,Nor-Exos组及Hypoxia-Exos组中miR-214均上调,且后者明显高于前者,差异具有统计学意义(P < 0.05)。推测缺氧预处理BMSCs源exosomes的促增殖作用可能通过传递miR-214至CMVECs。
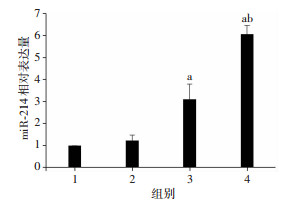
|
| 1:Control组; 2:Free-Exos组; 3:Nor-Exos组; 4:Hypoxia-Exos组; a:P < 0.05, 与Control组比较; b:P < 0.05, 与Nor-Exos组比较 图 6 qRT-PCR检测各组CMVECs中miRNA-214相对表达量(n=9,x±s) |
2.6 qRT-PCR检测miR-214抑制剂对缺氧预处理BMSCs源exosomes中miR-214表达的影响
与Hypoxia-Exos组比较,miR-214抑制剂转染可显著降低缺氧预处理来源exosomes中miR-214的表达量(P < 0.05)。将Nor-Exos、Hypoxia-Exos、Inhibitor-Exos、INC-Exos与CMVECs共培养24 h,待其内化后qRT-PCR检测各组细胞中miR-214表达变化,结果显示(图 7):与Nor-Exos组比较,Hypoxia-Exos组中miRNA-214表达显著增加(P < 0.05),而与Hypoxia-Exos组比较,Inhibitor-Exos组中miR-214表达明显下降(P < 0.05)。由此可见,缺氧预处理BMSCs源exosomes可能通过携带miR-214发挥促进CMVECs增殖作用。
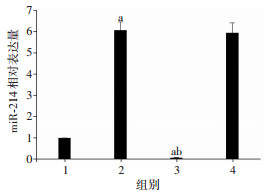
|
| 1:Nor-Exos组;2:Hypoxia-Exos组;3:Inhibitor-Exos组;4:INC-Exos组;a:P < 0.05,与Nor-Exos组比较;b:P < 0.05,与Hypoxia-Exos组比较 图 7 qRT-PCR检测miR-214抑制剂对CMVECs中miRNA-214相对表达量的影响(n=9,x±s) |
2.7 Edu法检测下调miR-214后exosomes对CMVECs增殖作用的影响
与Nor-Exos组比较,Hypoxia-Exos组中细胞增殖活性增加更为显著(P < 0.05),而Inhibitor-Exos组中表达Edu绿色荧光的细胞数较Hypoxia-Exos组明显减少(P < 0.05,图 8),说明miR-214是缺氧预处理BMSCs源exosomes促进心肌微血管内皮细胞增殖的效应分子之一。
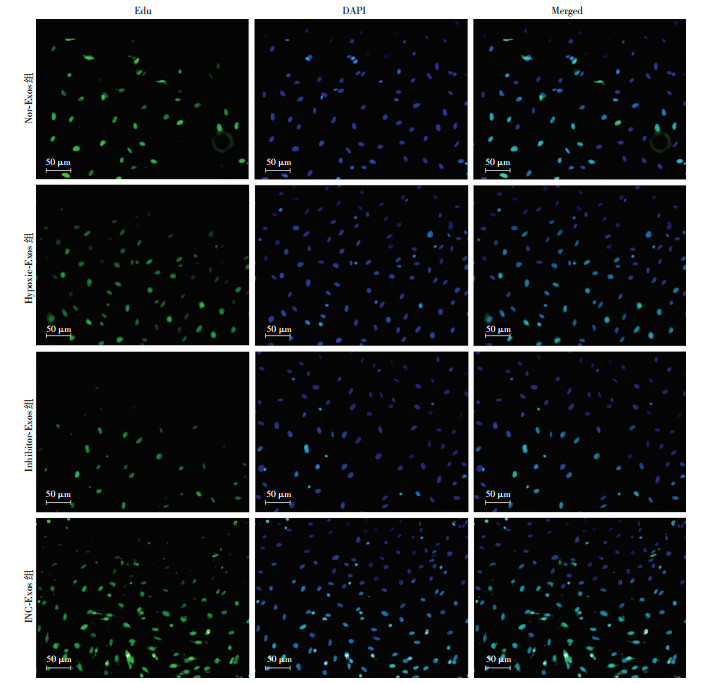
|
| 图 8 荧光显微镜检测下调BMSCs源exosomes中miR-214抑制CMVECs增殖能力 |
2.8 流式细胞术检测抑制miR-214的exosomes对CMVECs周期的影响
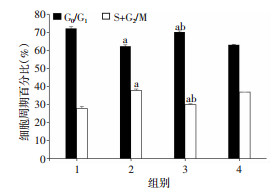
与Nor-Exos组比较,Hypoxic-Exos组细胞S+G2/M期比例明显升高(P < 0.05),提示细胞处于增殖状态的细胞比例增加,而与Hypoxic-Exos组比较,抑制miR-214后,细胞处于S+G2/M期的比例明显减少(P < 0.05,图 9)。进一步验证上述结论,即缺氧预处理的BMSCs源exosomes可能通过miR-214发挥促进CMVECs增殖的作用。
|
| 1:Nor-Exos组;2:Hypoxia-Exos组;3:Inhibitor-Exos组;4:INC-Exos组;a:P < 0.05,与Nor-Exos组比较;b:P < 0.05,与Hypoxia-Exos组比较 图 9 不同条件处理后流式细胞术检测心肌微血管内皮细胞周期(n=3,x±s) |
3 讨论
心肌微血管内皮细胞CMVECs通过细胞间连接,在心肌细胞之间形成连续的内皮,对调节和维持心脏功能起着十分重要的作用[11]。心肌梗死后如果受损心肌微血管内皮细胞不能及时增殖补充,微血管壁连续性破坏,造成冠脉微循环障碍,促使原本存活的心肌细胞凋亡或坏死,严重者可致患者出现心功能不全和心源性死亡[12]。近年来,细胞旁分泌效应在改善心肌梗死局部微环境、修复梗死心肌中发挥着举足轻重的作用,其中exosomes是旁分泌途径发挥作用的主要物质,已经成为血管再生和心脏修复的关键调节剂[13]。
Exosomes富含大量细胞特异性蛋白、mRNA及miRNA等遗传物质,在介导细胞间信号传导及免疫调控等多种生物学过程中扮演重要角色[14]。BMSCs因其强大的旁分泌效应,体外容易分离培养,增殖速率快,扩增能力强,不易污染,生存能力强等优点成为提取exosomes最理想的种子细胞。近年来,已有大量研究报道BMSCs-exosomes在治疗心血管疾病[15]、糖尿病肾损伤[16]、免疫性疾病[17]、肿瘤[18]中取得可喜成绩。在心肌梗死治疗方面,有研究者在猪和老鼠急性心肌梗死模型中注射BMSC的条件培养液,发现其可明显减小心肌梗死面积[19-20]。这为BMSCs-exosomes治疗急性心肌梗死的相关研究奠定了基石,但BMSCs外泌体是否对心肌微血管内皮细胞增殖、分化产生影响尚不明确。
Exosomes是在某些特殊生理或者病理状态下,细胞选择性地将一部分蛋白以及遗传物质包裹进入囊泡继而释放到细胞外环境中的直径介于30 ~100 nm的胞外囊泡样小体[21]。研究发现exosomes可通过向受体细胞传递特异性mRNA、microRNA及蛋白质等遗传物质,在调控细胞间信号传递等多种生物学过程中扮演着举足轻重的作用[22]。目前exosomes提取的方法主要有超速离心法[23]、试剂盒提取法[24]及PEG聚沉+超速离心清洗法[19]等。超速离心法被认为是目前获取exosomes纯度较高的方法,因此本研究采用超速离心法提取外泌体,透射电镜下可见exosomes呈大小不一、圆形或椭圆形,有脂质膜结构的囊状小体,且直径在30~100 nm之间;Western blot检测exosomes中特异性标记CD63、CD9及Alix呈阳性表达。
Exosomes必须先被受体细胞内化摄取,才能进一步发挥信息传递作用。根据文献报道,予DiI荧光染料标记的BMSCs-exosomes与CMVECs共培养24 h,在荧光显微镜下观察到CMVECs可以追踪到DiI标记exosomes的红色荧光,说明exosomes可被CMVECs内化摄取。研究显示,缺氧预处理可有效促进BMSCs释放外泌体,此外缺氧预处理的骨髓间充质干细胞exosomes可显著改善心肌梗死后心梗面积及血管网络[25]。本研究Edu及细胞周期结果显示,常氧预处理的BMSCs源exosomes可有效促进CMVECs增殖,而同等体积的去掉exosomes的BMSCs条件培养基对CMVECs增殖无明显作用,重要的是,缺氧预处理的BMSCs源exosomes较常氧来源的exosomes的促细胞增殖效应更强,但作用的具体机制不清楚。
miRNA已被公认为是exosomes发挥功能作用的重要物质之一,且不同病理生理条件下exosomes中miRNA表达有所差异,FENG等[26]发现通过缺氧预处理诱导多能干细胞iPS-MSCs后,其exosomal miRNA-2、miRNA-22、miRNA-24、miRNA-199a-3p及miRNA-210明显升高,且对组织细胞修复效应显著增强。在众多miRNAs中,miRNA-214为心脏谱系miRNAs,在缺血性心脏病发生发展过程中发挥重要作用。LU等[27]报道,在缺血性疾病患者血液中发现miRNA-214明显升高,此外,在心肌梗死鼠模型的心梗区域及心梗边缘区亦发现升高趋势。本实验发现BMSCs-exosomes含有miR-214,在BMSCs经缺氧预处理后外泌体中的miR-214表达明显上调,这与ExoCarta数据库及miR-214生物特性相符合。提取的exosomes经CMVECs内化后采用qRT-PCR检测发现,缺氧预处理的BMSCs源exosomes处理可使CMVECs中miR-214表达量显著增高,这与exosomes通过传递miRNA介导细胞间信息交流,发挥生物学作用的研究相符。进一步采用miR-214抑制剂转染BMSCs,经缺氧预处理后提取细胞exosomes,采用qRT-PCR检测发现exosomes中miR-214的表达量明显下降。此外,抑制了miR-214的exosomes促进细胞增殖的能力被显著抑制,而过表达CMVECs中miR-214后,细胞增殖能力也显著增强。
综上所述,缺氧预处理BMSCs源exosomes可明显促进CMVECs增殖效应,并验证了该作用可能为缺氧预处理促进BMSCs释放的exosomes中miR-214表达升高,从而将其传递至CMVECs发挥促增殖效应。
| [1] |
DÍEZ VILLANUEVA P, SANZ-RUIZ R, NÚÑEZ GARCÍA A, et al. Functional multipotency of stem cells: What do we need from them in the heart?[J]. Stem Cells Int, 2012, 2012: 817364. DOI:10.1155/2012/817364 |
| [2] |
YU F, LIU Y Z, XU J M. Pro-BDNF contributes to hypoxia/reoxygenation injury in myocardial microvascular endothelial cells: roles of receptors p75NTR and sortilin and activation of JNK and caspase 3[J]. Oxid Med Cell Longev, 2018, 2018: 3091424. DOI:10.1155/2018/3091424 |
| [3] |
SEILER C, STOLLER M, PITT B, et al. The human coronary collateral circulation: development and clinical importance[J]. Eur Heart J, 2013, 34(34): 2674-2682. DOI:10.1093/eurheartj/eht195 |
| [4] |
SHAO L B, ZHANG Y, LAN B B, et al. MiRNA-sequence indicates that mesenchymal stem cells and exosomes have similar mechanism to enhance cardiac repair[J]. Biomed Res Int, 2017, 2017: 4150705. DOI:10.1155/2017/4150705 |
| [5] |
XIAO K, THUM T. Exosomal microRNAs released by pediatric cardiac progenitor cells[J]. Circ Res, 2017, 120(4): 607-609. DOI:10.1161/CIRCRESAHA.117.310443 |
| [6] |
LIU X L, LI Q, NIU X, et al. Exosomes secreted from human-induced pluripotent stem cell-derived mesenchymal stem cells prevent osteonecrosis of the femoral head by promoting angiogenesis[J]. Int J Biol Sci, 2017, 13(2): 232-244. DOI:10.7150/ijbs.16951 |
| [7] |
SHABBIR A, COX A, RODRIGUEZ-MENOCAL L, et al. Mesenchymal stem cell exosomes induce proliferation and migration of normal and chronic wound fibroblasts, and enhance angiogenesis in vitro[J]. Stem Cells Dev, 2015, 24(14): 1635-1647. DOI:10.1089/scd.2014.0316 |
| [8] |
SLUIJTER J P, VERHAGE V, DEDDENS J C, et al. Microvesicles and exosomes for intracardiac communication[J]. Cardiovasc Res, 2014, 102(2): 302-311. DOI:10.1093/cvr/cvu022 |
| [9] |
GRAY W D, FRENCH K M, GHOSH-CHOUDHARY S, et al. Identification of therapeutic covariant microRNA clusters in hypoxia-treated cardiac progenitor cell exosomes using systems biology[J]. Circ Res, 2015, 116(2): 255-263. DOI:10.1161/CIRCRESAHA.116.304360 |
| [10] |
WANG Y, ZHAO R Z, LIU D B, et al. Exosomes derived from miR-214-enriched bone marrow-derived mesenchymal stem cells regulate oxidative damage in cardiac stem cells by targeting CaMKⅡ[J]. Oxid Med Cell Longev, 2018, 2018: 4971261. DOI:10.1155/2018/4971261 |
| [11] |
WEIR R A, MURPHY C A, PETRIE C J, et al. Micro-vascular obstruction remains a portent of adverse remodeling in optimally treated patients with left ventricular systolic dysfunction after acute myocardial infarction[J]. Circ Cardiovasc Imaging, 2010, 3(4): 360-367. DOI:10.1161/CIRCIMAGING.109.897439 |
| [12] |
HEWSON C, CAPRARO D, BURDACH J, et al. Extra-cellular vesicle associated long non-coding RNAs functionally enhance cell viability[J]. Noncoding RNA Res, 2016, 1(1): 3-11. DOI:10.1016/j.ncrna.2016.06.001 |
| [13] |
RIBEIRO-RODRIGUES T M, LAUNDOS T L, PEREIRA-CARVALHO R, et al. Exosomes secreted by cardiomyocytes subjected to ischaemia promote cardiac angiogenesis[J]. Cardiovasc Res, 2017, 113(11): 1338-1350. DOI:10.1093/cvr/cvx118 |
| [14] |
BLONDIAUX E, PIDIAL L, AUTRET G, et al. Bone marrow-derived mesenchymal stem cell-loaded fibrin patches act as a reservoir of paracrine factors in chronic myocardial infarction[J]. J Tissue Eng Regen Med, 2017, 11(12): 3417-3427. DOI:10.1002/term.2255 |
| [15] |
ZHANG W, ZHOU X J, ZHANG H, et al. Extracellular vesicles in diagnosis and therapy of kidney diseases[J]. Am J Physiol Renal Physiol, 2016, 311(5): F844-F851. DOI:10.1152/ajprenal.00429.2016 |
| [16] |
CZERNEK L, DVCHLER M. Functions of cancer-derived extracellular vesicles in immunosuppression[J]. Arch Immunol Ther Exp (Warsz), 2017, 65(4): 311-323. DOI:10.1007/s00005-016-0453-3 |
| [17] |
GAJOS-MICHNIEWICZ A, CZYZ M. Role of miRNAs in melanoma metastasis[J]. Cancers (Basel), 2019, 11(3): E326. DOI:10.3390/cancers11030326 |
| [18] |
XIAO T T, ZHANG W W, JIAO B, et al. The role of exosomes in the pathogenesis of Alzheimer' disease[J]. Transl Neurodegener, 2017, 6: 3. DOI:10.1186/s40035-017-0072-x |
| [19] |
LAI R C, ARSLAN F, LEE M M, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury[J]. Stem Cell Res, 2010, 4(3): 214-222. DOI:10.1016/j.scr.2009.12.003 |
| [20] |
KREKE M, SMITH R R, MARBÁN L, et al. Cardiospheres and cardiosphere-derived cells as therapeutic agents following myocardial infarction[J]. Expert Rev Cardiovasc Ther, 2012, 10(9): 1185-1194. DOI:10.1586/erc.12.102 |
| [21] |
KISHORE R, KHAN M. Cardiac cell-derived exosomes: changing face of regenerative biology[J]. Eur Heart J, 2017, 38(3): 212-215. DOI:10.1093/eurheartj/ehw324 |
| [22] |
JIANG X C, GAO J Q. Exosomes as novel bio-carriers for gene and drug delivery[J]. Int J Pharm, 2017, 521(1/2): 167-175. DOI:10.1016/j.ijpharm.2017.02.038 |
| [23] |
HELWA I, CAI J W, DREWRY M D, et al. A comparative study of serum exosome isolation using differential ultracentrifugation and three commercial reagents[J]. PLoS ONE, 2017, 12(1): e0170628. DOI:10.1371/journal.pone.0170628 |
| [24] |
ZLOTOGORSKI-HURVITZ A, DAYAN D, CHAUSHU G, et al. Human saliva-derived exosomes: comparing methods of isolation[J]. J Histochem Cytochem, 2015, 63(3): 181-189. DOI:10.1369/0022155414564219 |
| [25] |
BIAN S Y, ZHANG L P, DUAN L F, et al. Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J]. J Mol Med, 2014, 92(4): 387-397. DOI:10.1007/s00109-013-1110-5 |
| [26] |
FENG Y L, HUANG W, WANI M, et al. Ischemic pre-conditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J]. PLoS ONE, 2014, 9(2): e88685. DOI:10.1371/journal.pone.0088685 |
| [27] |
LU H Q, LIANG C, HE Z Q, et al. Circulating miR-214 is associated with the severity of coronary artery disease[J]. J Geriatr Cardiol, 2013, 10(1): 34-38. DOI:10.3969/j.issn.1671-5411.2013.01.007 |



