2. 400042 重庆,陆军军医大学(第三军医大学)大坪医院药剂科
2. Department of Pharmacy, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
类风湿性关节炎(rheumatoid arthritis, RA)是一种以多关节滑膜炎症、骨及软骨破坏为主要特征的一类慢性自身免疫性疾病。该病久治不愈,致伤、致残率极高,严重影响生活质量,是造成劳动力丧失的主要原因之一[1]。RA的患病率全球基本相似,目前流行病学研究显示我国RA患病率为0.19%~0.41%[2]。目前任何一种治疗方案均不能彻底治愈RA,故RA患者的治疗目标是使疾病缓解或处于低疾病活动状态,治疗目的仍以镇痛、控制炎症、预防关节软骨及骨破坏和防止关节功能丧失和残疾为主[3]。RA在藏医学中被称为“真布”,藏医临床治疗“真布”主张内外结合,口服复方藏药,外用藏药药浴等手段,可消除和缓解局部病变,减轻疼痛,目前藏医治疗“真布”已卓有成效,独具特色[4-5]。
诃子(Terminalia chebula Retz)在藏药中应用及其广泛,藏医药学认为:诃子有全部藏药具备的六味、八性、三化味和十七效,能治疗很多种疾病,有“藏药之王”的称号[6]。以诃子为主要组分的藏药扎冲十三味丸、风湿止痛丸等,目前在临床治疗“真布”中应用广泛。本课题组前期通过胶原蛋白诱导关节炎(collagen induced arthritis)模型对诃子中的有效成分诃子宁的抗RA药效进行了初步探讨[7],且通过文献调研对诃子抗类风湿性关节炎的药效物质基础进行了初步探讨,结果显示:目前对诃子及其有效成分抗RA的药理研究较多,主要集中在药效学研究,但针对诃子治疗RA的具体作用机制目前还尚未阐明[8]。
网络药理学(network pharmacology)作为药物研究的新模式,因强调整体性、动态性和系统性的特点,与中医药整体观、辨证论治、组方配伍的原则不谋而合[9]。这种药物研究模式给传统的新药研发模式带来了革命性的转变。因此,目前利用网络药理学构建中药及其复方制剂的成分-靶点-疾病网络并阐明其多组分、多靶点、多途径的作用机制成为当下的研究热点[10-11]。网络药理学使得中医药的系统整体研究飞速发展, 为中药现代化研究提供新的契机[12]。因此,本文拟采用网络药理学手段对藏药诃子治疗RA的作用机制进行全面探讨,构建“活性成分-靶点-通路”网络,为后续的实验验证及应用拓展提供科学依据,同时也为探讨藏药作用机制提供新的方法和思路。
1 材料与方法 1.1 数据库与软件包括:中药系统药理学数据库与分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)、生物医学文献数据库PubMed(https://www.ncbi.nlm.nih.gov/pubmed)、有机小分子生物活性数据库Pubchem(https://pubchem.ncbi.nlm.nih.gov/);反向分子对接服务器(DRAR-CPI,https://cpi.bio-x.cn/drar/)、通用蛋白质数据库Uniprot(https://www.uniprot.org)、人类基因综合数据库Genecards(https://www.genecards.org)、国家生物技术信息中心数据库NCBI(https://www.ncbi.nlm.nih.gov/gene/)、网络拓扑属性分析软件Cytoscape 3.6.1、蛋白互作平台STRING version 10.5(https://string-db.org)、生物学信息注释数据库DAVID 6.8 (https://david.ncifcrf.gov/)。
1.2 建立诃子候选化合物库利用TCMSP数据库,以“诃子”或“Terminalia chebula Retz”为关键词检索,根据口服生物利用度(oral bioavailablity, OB) %>30%、类药性(drug likeness, DL)>0.18的原则筛选出候选化合物[10]。随后再在CNKI知网和PubMed数据库中以“诃子”或“Terminalia chebula Retz”为关键词,筛选出含量较高、有药理作用的活性成分,最后通过PubChem数据库对这些化合物进行结构辨别,收集诃子的活性成分,并根据PubChem CID、OB%、DL等数据参数,建立诃子候选化合物数据库。
1.3 分子对接与药物作用靶点筛选登陆DRAR-CPI服务器,将检索到的诃子活性成分逐一上传,对诃子活性成分进行模拟分子-靶蛋白对接,按照服务器推荐的Z′-score<-1.5作为候选药物作用靶标[10]。通过UniProt数据库转换成蛋白质特定ID号以及Genecards数据库对应的基因名称(Gene name)。在Genecards数据库和NCBI gene数据库中输入关键词“rheumatoid arthritis”,得到类风湿性关节炎相关靶基因。最后将类风湿性关节炎相关靶基因与药物作用靶点基因映射筛选,找出两者的交集基因,得到诃子治疗类风湿性关节炎的靶点。
1.4 靶蛋白相互作用(protein-protein interaction, PPI)网络的构建为研究诃子治疗RA的靶蛋白之间的相互作用,在STRING version 10.5平台构建相关靶蛋白相互作用(protein-protein interaction, PPI)网络。物种设为“Homo sapiens”(人类),最低相互作用阈值设为中等置信度“medium confidence”0.4,其余参数保持默认设置[11]。然后使用Cytoscape 3.6.1软件中的Network Analyzer功能对PPI网络进行拓扑属性研究,绘制PPI网络图。
1.5 京都基因与基因组百科全书通路富集与基因本体生物过程分析采用生物学信息注释数据库DAVID 6.8,对诃子治疗RA的靶基因采用京都基因与基因组百科全书(Kyoto encyclopedia of genes and gnomes,KEGG)数据库进行通路富集和基因本体(Gene Ontology,GO)生物过程富集,以分析诃子治疗RA靶点的主要代谢通路及GO过程(以P<0.05判断相关)。
1.6 活性成分-靶点-作用通路网络的构建根据上述诃子化学成分的靶点预测结果以及KEGG分析,采用Cytoscape 3.6.1软件的Merge功能构建诃子的“活性成分-靶点-作用通路”网络。在该网络中,节点(node)代表化合物、靶点和通路,若某一靶点为某化合物的潜在作用靶点,则以边(edge)相连。节点间的连接原则为当活性成分作用靶点与作用通路相关靶点相同时,则通过Merge功能将活性成分与作用通路关联起来,从而形成活性成分-靶点-作用通路网络。
2 结果 2.1 诃子治疗RA的主要活性成分筛选利用TCMSP数据库进行挖掘,共收集到41个化学成分,根据OB%>30%,DL>0.18的原则,同时再结合CNKI或PubMed检索到的文献报道,补充了一些OB%、DL值虽然较低或暂无,但含量较高、药理活性较好的成分,最终得到10个主要活性成分,见表 1。
| 序号 | 化合物名称 | Pubchem CID | OB% | DL |
| 1 | 鞣花酸(ellagic acid) | 5281855 | 43.06 | 0.43 |
| 2 | 柯里拉京(corilagin) | 12303949 | 3.01 | 0.44 |
| 3 | 3, 4, 5-三羟基苯甲酸,即没食子酸(3, 4, 5-trihydroxybenzoic acid) | 370 | 31.69 | 0.04 |
| 4 | 诃黎勒酸(chebulagic acid) | 250397 | - | - |
| 5 | 诃子宁(chebulanin) | 44567158 | - | - |
| 6 | 诃子次酸(chebulic acid) | 71308174 | 72.00 | 0.32 |
| 7 | 玫瑰树碱(ellipticine) | 3213 | 30.82 | 0.28 |
| 8 | 霹雳萝芙辛碱(Peraksine) | 78146432 | 82.58 | 0.78 |
| 9 | 碎叶紫堇碱(cheilanthifoline) | 440582 | 46.51 | 0.72 |
| 10 | 奎尼丁(Quinidine Sulfate) | 5748152 | 55.88 | 0.40 |
2.2 诃子活性成分作用于类风湿性关节炎的靶点预测与筛选
将10个活性成分的结构导入DRAR-CPI服务器,Z′-score<-1.5的靶点共筛出186个,将此结果利用UniProt数据库转换成对应的基因名称和Uniprot ID。通过Genecards数据库和NCBI数据库挖掘到RA相关靶基因1 953个。将预测得到的186个药物作用靶基因与1 953个类风湿性关节炎相关靶基因映射,得到47个共同靶基因,预测为诃子类风湿性关节炎的作用靶基因。10个活性成分所涉及的47个相关靶点见表 2。
| 序号 | 化学成分 | 靶基因 | 靶点数 |
| 1 | 鞣花酸(ellagic acid) | AR、CXCL8、ESR1、GSK3B、GSTM1、GSTP1、HSP90AB1、IGF2、JAK2、MMP-2、MMP-9、NFKBIA、PRKCB、RELA、SERPINE1、SYK、VEGFA | 17 |
| 2 | 柯里拉京(corilagin) | FAP、HMOX1、IL10、IL1B、IL6、PTGS2、RELA、TNF | 8 |
| 3 | 3, 4, 5-三羟基苯甲酸,即没食子酸(3, 4, 5-trihydroxybenzoic acid) | CASP3、HSP90AB1、PIK3CG、PTGS1、PTGS2、TNF、TP53 | 7 |
| 4 | 诃黎勒酸(chebulagic acid) | DHFR、GC、IL4 | 3 |
| 5 | 诃子宁(chebulanin) | GC、IL6、JAK3、MAPK14、PIN1、SYK、TNF | 7 |
| 6 | 诃子次酸(chebulic acid) | CD2、DHODH、GSTT1、IL4、PIN1、PTGS2、SOD1、SYK | 8 |
| 7 | 玫瑰树碱(ellipticine) | BCL2、BCL2L1、CASP3、CASP8、CYP1A2、PTGS1、PTGS2、TP53 | 8 |
| 8 | 霹雳萝芙辛碱(Peraksine) | ADRB2、AR、CHRM3、HTR2A | 4 |
| 9 | 碎叶紫堇碱(cheilanthifoline) | ADRB2、CHRM、HSP90AB1、HTR2A、PDE3A、PTGS1、PTGS2 | 7 |
| 10 | 奎尼丁(Quinidine Sulfate) | ADRB2、CHRM3、CHRNA7、HSP90AB1、HTR2A、PDE3A、PTGS1、PTGS2 | 8 |
在筛选出的10个活性成分中,鞣花酸、柯里拉京、没食子酸、诃黎勒酸、诃子宁和诃子次酸均为酚酸类化合物,其中鞣花酸的靶点数最多,为17个;其他几个酚酸类化合物的靶点数为3~8个。其余玫瑰树碱、霹雳萝芙辛碱、碎叶紫堇碱和奎尼丁均为生物碱类,作用靶点4~8个。10个活性成分共作用于47个靶蛋白发挥抗类风湿性关节炎作用,各活性成分间作用靶点不尽相同,说明诃子不同活性成分不仅可作用于相同的靶点,也可以作用于不同的靶点,体现了其多组分、多靶点的作用机制。
2.3 PPI网络分析采用STRING version10.5网络平台对筛选出来的诃子治疗RA靶点进行PPI分析,将数据导出并导入cytoscape 3.6.1软件,进行Network Analysis分析。靶蛋白PPI网络图见图 1。
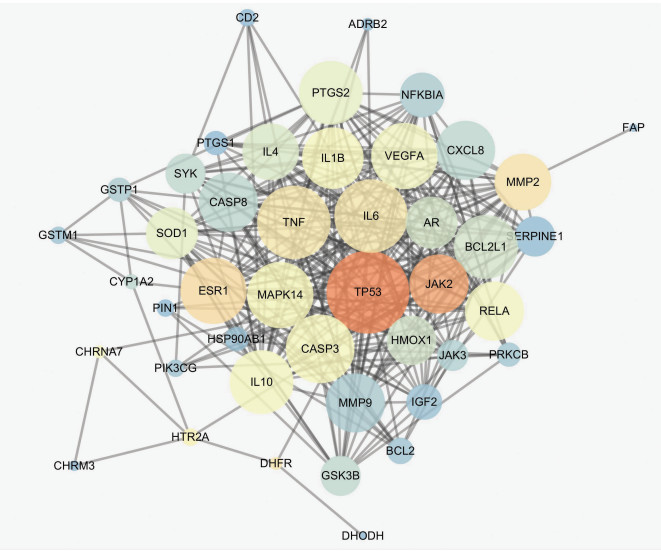
|
| 图 1 诃子靶蛋白的PPI网络 |
度值和介数中心数越大,说明靶点越处于PPI网络中心,发挥关键作用。图中靶点圆越大,表明度值越大,颜色越接近橙色,表明介数中心数越大。将度值和介数中心数均较大的Top 15靶点列表,相关靶点名称、Uniprot ID号、度值和介数中心性具体见表 3。
| 序号 | 靶点 | 靶基因 | Uniport ID | 度值 | 介数中心数 |
| 1 | 细胞肿瘤抗原P53 | TP53 | P04637 | 33 | 0.158 |
| 2 | 肿瘤坏死因子 | TNF | P01375 | 29 | 0.043 |
| 3 | 白介素-6 | IL6 | P05231 | 29 | 0.043 |
| 4 | 半胱氨酸天冬氨酸蛋白酶3 | CASP3 | P42574 | 27 | 0.023 |
| 5 | 雌激素受体1 | ESR1 | P03372 | 26 | 0.059 |
| 6 | 丝裂原活化蛋白激酶14 | MAPK14 | Q16539 | 26 | 0.023 |
| 7 | 血管内皮生长因子A | VEGFA | P15692 | 26 | 0.019 |
| 8 | 白介素-10 | IL10 | P22301 | 25 | 0.019 |
| 9 | 前列腺素G/H合酶2 | PTGS2 | P35354 | 25 | 0.016 |
| 10 | B淋巴细胞瘤因子-2样蛋白1 | BCL2L1 | Q07817 | 25 | 0.012 |
| 11 | 白介素-1β | IL1B | P01584 | 24 | 0.021 |
| 12 | 酪氨酸蛋白激酶JAK2 | JAK2 | O60674 | 23 | 0.127 |
| 13 | 转录因子p65 | RELA | Q04206 | 23 | 0.018 |
| 14 | 白介素-8 | CXCL8 | P10145 | 23 | 0.008 |
| 15 | 半胱氨酸天冬氨酸蛋白酶8 | CASP8 | Q14790 | 23 | 0.008 |
2.4 诃子活性成分潜在靶点的通路注释
将诃子活性成分预测得到的47个作用靶点通过DAVID 6.8平台进行GO富集分析和KEGG通路注释分析。GO富集分析主要包括生物过程(biological process, BP)、分子功能(molucular function, MF)和细胞组分(cellular component, CC)3个分支。通过GO富集分析探讨预测诃子抗类风湿性关节炎靶点的功能分布,其中预测靶点在生物过程中调节凋亡(regulation of apoptosis)和调节程序性细胞死亡(regulation of programmed cell death)列前两位;在细胞组分中细胞外间隙(extracellular space)和胞质溶液(cytosol)比例最大;而在分子功能中与相对蛋白结合(identical protein binding)和酶结合(emzyme binding)关系最密切,具体结果见图 2。
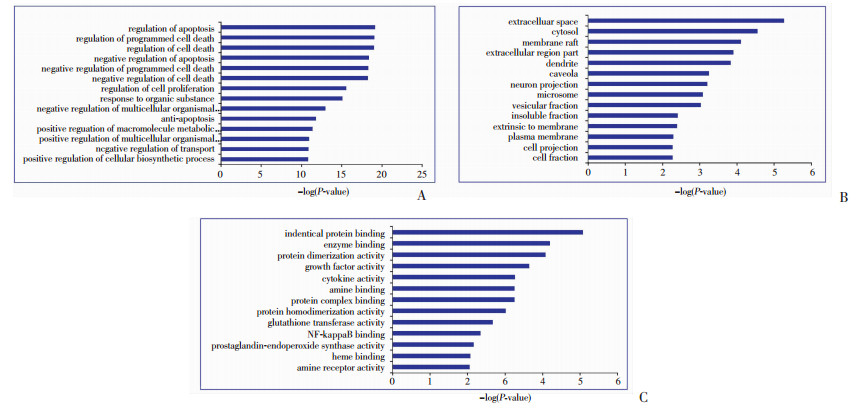
|
| A:生物过程;B:细胞组分;C:分子功能 图 2 诃子抗RA预测靶点GO富集分析 |
通过KEGG分析结果诃子抗类风湿性关节炎预测靶点的通路分布,结果共有54条KEGG代谢通路参与其中,图 3列举了排在前面的15条通路,主要涉及细胞凋亡、NOD样受体(NOD like receptor,NLR)信号通路、Toll样受体(Toll like receptor, TLR)信号通路、T细胞受体信号通路、JAK-STAT信号通路和MAPK信号通路等。由此可见,诃子通过调节多种代谢通路共同发挥抗RA的作用。
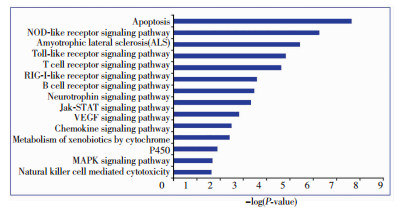
|
| 图 3 诃子抗RA预测靶点KEGG通路分析结果 |
2.5 诃子活性成分-靶点-作用通路网络构建
采用Cytoscape软件的Merge功能构建诃子抗类风湿性关节炎的活性成分-靶点-作用通路网络,见图 4。
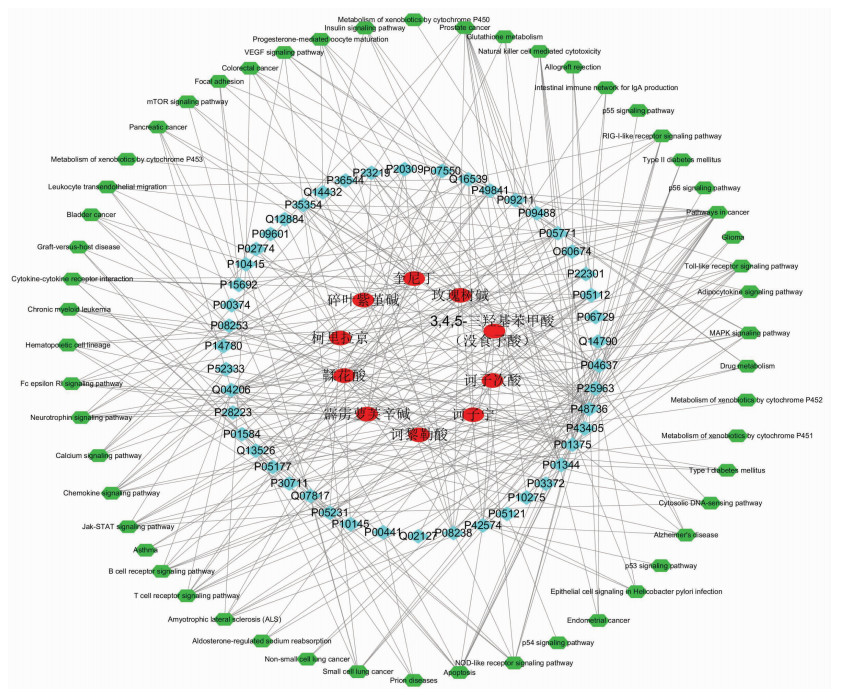
|
| 图中红色圆形代表诃子化学成分,如诃黎勒酸;蓝色菱形代表靶点,编号表示靶点的蛋白编号,如P04637表示TP53;绿色六边形代表对应的型号通路,如Apoptosis 图 4 诃子抗RA活性成分-靶点-作用通路网络图 |
从图中可见诃子10个活性成分,预测通过作用于47个作用靶点,通过54条通路,涉及细胞凋亡、炎症反应与免疫调节等多个环节,提示诃子通过多组分、多靶点、多途径发挥抗类风湿性关节炎的作用。
3 讨论 3.1 诃子治疗RA活性成分与靶标诃子在藏药中应用极其广泛,其所含的化学成分丰富多样,用于多种疾病的治疗。既往研究表明:诃子的水提物和醇提物显示出良好镇痛抗关节炎效果[13-14],提示诃子治疗RA的活性成分多数为极性化合物。此次基于现已有的研究和公共数据库得到的结果证实诃子中的酚酸类成分和生物碱类成分是抗RA的主要活性成分,而预测靶点经PPI分析,显示TP53、TNF-α和IL-6等几个炎症因子在RA的发生、发展中发挥重要作用[15-16],目前针对TNF-α的单克隆抗体如阿达木单抗、英夫利昔单抗和针对IL-6的单克隆抗体如托珠单抗已广泛应用于临床,成为治疗RA的强效药[17]。而PTGS2、CASP3和PIK3CG等靶蛋白在关节炎症、软骨损伤以及细胞凋亡等过程发挥关键调控作用[18-20]。本研究运用网络药理学的方法进行研究,发现诃子多个成分可能通过上述多个靶点协同发挥抗RA效果,具有良好的开发前景。
3.2 诃子治疗RA作用机制研究中的信号通路RA作为一种以多关节滑膜炎症、骨及软骨破坏为主要特征的慢性自身免疫性疾病。炎症反应、免疫调节和细胞增殖、凋亡等在疾病的发生、发展中发挥重要作用,同时也是药物研发所关注的重要靶点。
RA是一种慢性自身免疫性疾病,患者的免疫功能紊乱也是疾病发生、发展过程中的一个重要病理方面,涉及的免疫细胞主要有巨噬细胞、树突状细胞、B细胞、T细胞等[21]。此外,软骨细胞、破骨细胞和成纤维细胞等也参与疾病进程。NOD样受体(NLR)信号通路、Toll样受体(TLR)信号通路和T细胞受体信号通路和B细胞信号通路是免疫调节中的重要通路[22]。且TLR信号通路的激活可进一步激活下游的NF-κB通路,分泌炎症因子IL-1β和IFN-γ等,进一步加重RA病程。研究显示诃子活性成分可通过作用于CASP8、HSP90AB1、IL-1β、IL-6、IL-8、NFKBIA、RELA、TNF等靶基因,靶向至上述4种免疫调节信号通路,发挥免疫调节功能,治疗RA。
MAPK信号通路是炎症反应的网络枢纽通路,对RA具有中枢调控作用[23]。RA早期病程主要涉及滑膜细胞的炎症反应,因此,对炎症的控制是早期治疗RA的重要策略。而本研究结果显示诃子活性成分可通过作用于IL-1β、IL-6、TNF、MMP-9、PTGS2、NFKBIA和RELA等靶基因,通过MAPK信号通路调控相关炎症因子的表达,降低关节炎症反应,从而治疗RA。
此外,RA患者的发病与细胞凋亡过程异常密切相关[24]。本研究结果显示:诃子可通过作用于BCL2、BCL2L1、COL1A1、HSP90AB1、IL-6、PIK3CG、RELA、TP53和VEGFA等靶基因调控细胞凋亡和JAK-STAT信号通路发挥抗RA功效。YOON等[25]研究发现从诃子中提取的活性成分没食子酸,分别以0.1、1.0 μmol/L剂量处理从RA患者体内分离出的滑膜细胞,均能显著增加Caspase-3活性,调控凋亡相关蛋白Bc1-2、Bax、p53、pAkt的生成,发挥抗凋亡作用,进一步验证了本研究结果。
综上所述,本文基于网络药理学的方法,采用TCMSP、DRAR-CPI、GeneCards等数据库,借助STRING平台、DAVID平台和Cytoscape 3.6.1软件,从诃子中筛选出的10个活性成分中,主要分为酚酸类和生物碱类,其中鞣花酸命中靶点最多,有17个,其次为柯里拉京、诃子宁、诃子次酸、玫瑰树碱和奎尼丁,各命中8个靶点;而没食子酸、诃子宁和碎叶紫堇碱命中7个靶点。而47个靶点中,TP53、TNF、IL-6、CASP3、ESR1、MAPK14、VEGFA、IL-10、PTGS2、BCL2L1是排名前10的关键靶点。在RA相关54条通路中,细胞凋亡、NLR信号通路、TLR信号通路、T细胞受体信号通路、B细胞信号通路、JAK-STAT信号通路和MAPK信号通路是诃子活性成分主要作用通路,在诃子治疗RA中发挥重要作用。后续课题组将选择诃子提取物以及上述一种或多种化学成分,以动物模型和细胞模型,通过ELISA和PCR测定相关炎症因子和基因,就NLR、TLR、JAK-STAT和MAPK信号通路去验证诃子治疗RA的可能作用机制。
| [1] |
SMOLEN J S, ALETAHA D, MCINNES I B. Rheumatoid arthritis[J]. Lancet, 2016, 388(10055): 2023-2038. DOI:10.1016/s0140-6736(16)30173-8 |
| [2] |
Global Burden of Disease Study Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 386(9995): 743-800. DOI:10.1016/S0140-6736(15)60692-4 |
| [3] |
WANG G, XU H J, MU R. Management of rheumatoid arthritis in People's republic of China——focus on tocilizumab and patient considerations[J]. Int J Gen Med, 2015, 187. DOI:10.2147/ijgm.s81633 |
| [4] |
卓玛措. 藏医对类风湿性关节炎的病理机制探讨[J]. 中国民族医药杂志, 2016, 22(8): 45-46. ZHUO M C. Pathological mechanism of Tibetan medicine on rheumatoid arthritis[J]. J Med Pharm Chin Minor, 2016, 22(8): 45-46. DOI:10.16041/j.cnki.cn15-1175.2016.08.031 |
| [5] |
安太措, 青羊尖措. 藏药浴结合藏药外敷治疗类风湿性关节炎56例临床研究[J]. 中国民族医药杂志, 2017, 23(6): 10-11. AN T C, QING Y J C. Clinical study on 56 cases of rheumatoid arthritis treated by Tibetan medicine bath and external application of Tibetan medicine[J]. J Med Pharm Chin Minor, 2017, 23(6): 10-11. DOI:10.16041/j.cnki.cn15-1175.2017.06.006 |
| [6] |
张媛媛, 曾慧婷, 袁源见, 等. 藏药诃子的化学成分与药理活性研究进展[J]. 中国药房, 2018, 29(14): 2002-2006. ZHANG Y Y, ZENG H T, YUAN Y J, et al. Research progress on chemical constituents and pharmacological activities of Terminalia chebula[J]. China Pharm, 2018, 29(14): 2002-2006. DOI:10.6039/j.issn.1001-0408.2018.14.29 |
| [7] |
ZHAO Y L, LIU F, LIU Y, et al. Anti-arthritic effect of chebulanin on collagen-induced arthritis in mice[J]. PLoS ONE, 2015, 10(9): e0139052. DOI:10.1371/journal.pone.0139052 |
| [8] |
刘芳, 张璞, 赵鸿燕, 等. 诃子抗类风湿性关节炎的药效物质基础及药理作用研究[J]. 中国药房, 2017, 28(25): 3575-3578. LIU F, ZHANG P, ZHAO H Y, et al. Study on the pharmacodynamic substances and pharmacological action of Terminalia chebula against rheumatoid arthritis[J]. China Pharm, 2017, 28(25): 3575-3578. DOI:10.6039/j.issn.1001-0408.2017.25.31 |
| [9] |
李学军, 许海玉. 网络药理学与中药研究[J]. 药学学报, 2018, 53(9): 1385-1386. LI X J, XU H Y. Network pharmacology and traditional Chinese medicine research[J]. Acta Pharm Sin, 2018, 53(9): 1385-1386. |
| [10] |
杨释岑, 刘志强, 刘和波, 等. 利用网络药理学方法研究交泰丸治疗糖尿病的作用机制[J]. 中国药房, 2018, 29(19): 2656-2661. YANG S C, LIU Z Q, LIU H B, et al. Study on the mechanism of jiaotai pills in the treatment of diabetes by using network pharmacology[J]. China Pharm, 2018, 29(19): 2656-2661. DOI:10.6039/j.issn.1001-0408.2018.19.15 |
| [11] |
唐策, 文检, 杨娟, 等. 藏药翼首草抗类风湿性关节炎活性成分靶点的网络药理学研究[J]. 中国药房, 2017, 28(19): 2666-2670. TANG C, WEN J, YANG J, et al. Study on the active components targets of Tibetan medicine Pterocephalus hookeri in anti-rheumatoid arthritis based on network pharmacology[J]. China Pharm, 2017, 28(19): 2666-2670. DOI:10.6039/j.issn.1001-0408.2017.19.21 |
| [12] |
ZHANG R Z, ZHU X, BAI H, et al. Network pharmacology databases for traditional Chinese medicine: review and assessment[J]. Front Pharmacol, 2019, 10: 123. DOI:10.3389/fphar.2019.00123 |
| [13] |
SIREERATAWONG S, JAIJOY K, KHONSUNG P, et al. Analgesic and anti-inflammatory activities of the water extract from Terminalia chebula Rezt[J]. Afr J Trad Compl Alt Med, 2015, 11(6): 77. DOI:10.4314/ajtcam.v11i6.8 |
| [14] |
SEO J B, JEONG J Y, PARK J Y, et al. Anti-arthritic and analgesic effect of NDI10218, a standardized extract of Terminalia chebula, on arthritis and pain model[J]. Biomol Ther (Seoul), 2012, 20(1): 104-112. DOI:10.4062/biomolther.2012.20.1.104 |
| [15] |
HWANG D, KIM W U. Rheumatoid arthritis: Modelling cytokine signalling networks[J]. Nat Rev Rheumatol, 2017, 13(1): 5-6. DOI:10.1038/nrrheum.2016.194 |
| [16] |
BUI V L, BRAHN E. Cytokine targeting in rheumatoid arthritis[J]. Clin Immunol, 2018, S1521-S6616(18): 30180-3. DOI:10.1016/j.clim.2018.04.001 |
| [17] |
刘丽丽, 毛艳艳, 高柳滨. 类风湿关节炎全球药物研发状况分析[J]. 科技导报, 2016, 34(24): 44-55. LIU L L, MAO Y Y, GAO L B. An analysis on global drug development status of rheumatoid arthritis[J]. Sci Technol Rev, 2016, 34(24): 44-55. |
| [18] |
MURPHY G, KNÄUPER V, ATKINSON S, et al. Matrix metalloproteinases in arthritic disease[J]. Arthritis Res, 2002, 4(Suppl 3): S39-S49. DOI:10.1186/ar572 |
| [19] |
MALYSHEVA I E, TOPCHIEVA L V, BARYSHEVA O Y, et al. The level of cytokines and expression of caspase genes in rheumatoid arthritis[J]. Dokl Biochem Biophys, 2016, 468(1): 226-228. DOI:10.1134/S1607672916030194 |
| [20] |
HAYER S, PUNDT N, PETERS M A, et al. PI3Kgamma regulates cartilage damage in chronic inflammatory arthritis[J]. FASEB J, 2009, 23(12): 4288-4298. DOI:10.1096/fj.09-135160 |
| [21] |
HAMMAKER D, SWEENEY S, FIRESTEIN G S. Signal transduction networks in rheumatoid arthritis[J]. Ann Rheum Dis, 2003, 62(Suppl 2): ii86-ii89. DOI:10.1136/ard.62.suppl_2.ii86 |
| [22] |
YAP H Y, TEE S Z, WONG M M, et al. Pathogenic role of immune cells in rheumatoid arthritis: implications in clinical treatment and biomarker development[J]. Cells, 2018, 7(10): E161. DOI:10.3390/cells7100161 |
| [23] |
SCHETT G, ZWERINA J, FIRESTEIN G. The p38 mitogen-activated protein kinase (MAPK) pathway in rheumatoid arthritis[J]. Ann Rheum Dis, 2008, 67(7): 909-916. DOI:10.1136/ard.2007.074278 |
| [24] |
LIU H T, POPE R M. The role of apoptosis in rheumatoid arthritis[J]. Curr Opin Pharmacol, 2003, 3(3): 317-322. DOI:10.1016/S1471-4892(03)00037-7 |
| [25] |
YOON C H, CHUNG S J, LEE S W, et al. Gallic acid, a natural polyphenolic acid, induces apoptosis and inhibits proinflammatory gene expressions in rheumatoid arthritis fibroblast-like synoviocytes[J]. Joint Bone Spine, 2013, 80(3): 274-279. DOI:10.1016/j.jbspin.2012.08.010 |



