2. 100020 北京,中国科学院生物物理研究所交叉科学所重点实验室
2. Key Laboratory of Interdisciplinary Research, Institute of Biophysics, Chinese Academy of Sciences, Beijing, 100020, China
膀胱储尿期兴奋性异常增高所致的逼尿肌过度活动(detrusor overactivity, DO)是临床最常见的膀胱兴奋性异常[1]。有关DO的发生机制目前尚未完全阐明,神经源性/肌源性两大学说一直存在争议,且神经源性学说长期占据主导地位,临床治疗膀胱兴奋性异常也主要采用神经受体活性药物,如M受体阻断剂等,但许多患者的治疗效果并不理想[2]。近年来,逼尿肌自发性(肌源性)兴奋异常在DO发生中的作用日益受到重视,阐明DO的肌源性兴奋调控机制将对其临床治疗起到重要的作用。
雷尼丁受体(Ryanodine receptor, RyR)是位于细胞肌浆网上的一种钙释放通道,现已发现有RyR1、RyR2和RyR3三种亚型,RyR2是分布于膀胱平滑肌的主要亚型[3]。既往研究发现:肌浆网上RyR2的开放可降低逼尿肌的兴奋性[4]。前期的研究也证实:逼尿肌中RyR2的下调是DO逼尿肌兴奋性增高的关键因素[5]。
他克莫司(FK506)结合蛋白12.6(FK506 binding protein 12.6, FKBP12.6)是一种FK506结合蛋白,其能与RyR2通道特异性结合,稳定其于关闭状态[6]。在心肌和平滑肌中,结合在RyR2通道上的FKBP12.6可显著影响肌肉的兴奋性[7-8]。目前,FKBP12.6对DO的影响尚不清楚。本研究拟利用FKBP12.6全敲纯合子小鼠,探讨FKBP12.6敲除对小鼠DO的影响及其作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物野生型(wild type, WT)和FKBP12.6敲除型(全敲鼠,纯合子;knockout, KO)雌性8~10周龄129系小鼠,来源于中科院生物物理所实验动物中心。动物实验按照陆军军医大学和中国科学院生物物理研究所动物护理委员会批准的相关指南和规定进行。
1.1.2 相关试剂NaCl、KCl、CaCl2、MgCl2、HEPES、Glucose购自美国Sigma-Aldrich公司;FKBP12.6, RyR2抗体购自美国Abcam公司,β-actin抗体购自中杉金桥公司;生物机能实验系统来自成都泰盟软件有限公司。
1.2 方法 1.2.1 建立DO模型小鼠分为WT组和KO组,参考LI等[9]的方法,在麻醉状态下将26G的留置针沿尿道插入膀胱,下腹部开5 mm左右切口,使用4-0尼龙线结扎尿道。术后6周,以储尿期出现≥1 mmHg的膀胱压波动为判断DO建模成功的标准。
1.2.2 小鼠尿斑实验参考文献[10]的方法,将小鼠放于25 cm×15 cm铺有中性滤纸的盒中,记录3 h内小鼠的排尿情况。使用ImageJ 7.0统计面积在0.1~10.0 mm2的尿斑数以反映尿频状态。
1.2.3 小鼠尿动力实验参考文献[5]的方法,5%水合氯醛麻醉小鼠,以直径0.61 mm的塑料导管做耻骨上膀胱造瘘,导管另一端沿皮下从小鼠肩胛部穿出。24 h后,在三溴乙醇麻醉下,以2 mL/h的速度向小鼠膀胱内泵注生理盐水,使用生物机能实验系统记录小鼠膀胱压和直肠压。
1.2.4 腹腔脏器充盈反应(visceromotor responses, VMRs)和膀胱平滑肌电活动膀胱造瘘方法与上述相同。VMRs使用SCHWARTZ等[11]的方法,在三溴乙醇麻醉下,将小鼠膀胱压力分别稳定在40、50、60、70、80 mmHg, 10 s,使用生物机能实验系统记录小鼠腹部骨骼肌的电活动情况。同样将小鼠膀胱压力稳定在40、50、60、70、80 mmHg,10 s,使用生物机能实验系统记录不同膀胱压力情况下小鼠膀胱平滑肌的电活动情况。计算肌电图曲线下面积,并以静息状态下的电活动情况做标准化。
1.2.5 膀胱平滑肌肌条实验处死小鼠,在冰上的生理液中(NaCl 140 mmol/L, KCl 5 mmol/L, CaCl2 2 mmol/L, MgCl2 2 mmol/L, HEPES 5 mmol/L, Glucose 10 mmol/L)取膀胱平滑肌条(3 mm×1 mm, 去内膜)。将处理好的肌条在37 ℃的生理液中拉伸,稳定于3 mN,60 min,观察肌条的自发性收缩情况。
1.2.6 Western blot检测参考文献[5]的方法,蛋白提取物100 ℃加热10 min,使用6%(RyR2)、15%(FKBP12.6)SDS-PAGE胶,45 mA衡流电泳60 min,400 mA恒流转移到硝酸纤维素膜(nitrocellulose filter membrane, NC)上(RyR2转膜过夜,转膜液中加入0.1% SDS;FKBP12.6转膜45 min)。5%脱脂奶粉封闭1 h,4 ℃一抗孵育过夜。TBST清洗3次,每次10 min,二抗常温孵育1 h。再使用TBST清洗3次,每次10 min,使用化学发光成像系统(SAGECREATION)曝光。结果采用ImageJ 7.0分析。目标蛋白都以β-actin作为内参,并以WT组的均值做均一化。
1.2.7 膀胱组织HE染色观察小鼠的膀胱组织在4%多聚甲醛溶液中固定48 h,保存于75%酒精中。石蜡包埋后,使用半自动切片机(Leica公司)切成5 μm连续切片,45 ℃下烘干15 min,37 ℃过夜,进行HE染色。在全景扫描仪(Leica公司)上进行拍摄,观察组织形态特征。
1.3 统计学分析使用Graphpad 6.01对数据进行统计分析,数据以x±s表示,组间数据比较采用独立样本t检验。检验水准:α=0.05。
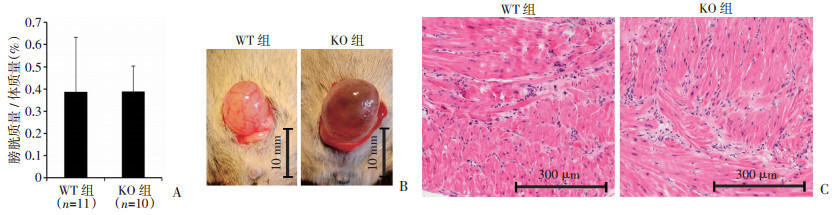
2 结果 2.1 FKBP12.6敲除不会对小鼠的膀胱逼尿肌形态产生明显的影响FKBP12.6敲除并不会对DO模型小鼠的膀胱/体质量比例产生明显的影响(图 1A)。两组膀胱逼尿肌组织学形态比较也没有明显的差异(图 1B、C)。
|
| A:两组小鼠膀胱质量/体质量;B:膀胱大体观察;C:膀胱逼尿肌组织HE染色观察 图 1 FKBP12.6敲除对小鼠膀胱形态无明显影响 |
2.2 FKBP12.6敲除使小鼠排尿频率增加,并使储尿期膀胱压力波动增多
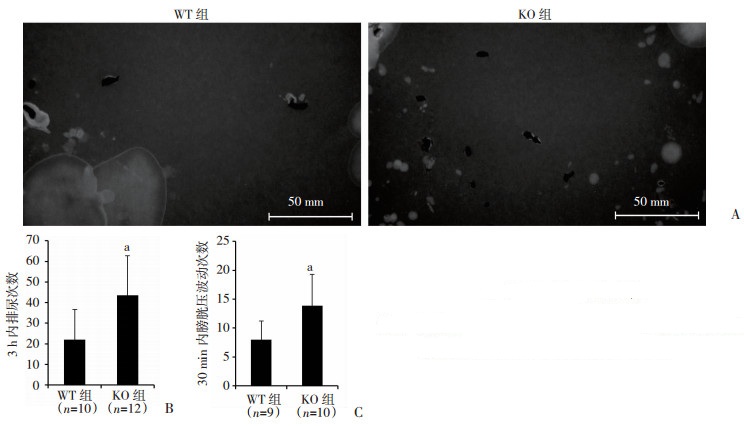
尽管形态上的变化不明显,但KO组小鼠的膀胱DO程度要明显高于WT组。在排尿频率方面,尿斑实验证实FKBP12.6敲除使小鼠的排尿频率增加了98%(P < 0.05, 图 2A、B)。
|
| a: P < 0.05, 与WT组比较 图 2 凝胶成像系统观察两组小鼠尿斑数量(A)以及排尿频率(B)、储尿期膀胱压波动次数(C)分析 |
尿动力实验进一步说明,FKBP12.6敲除将导致DO模型小鼠的逼尿肌在储尿期出现更加明显的不稳定现象,以30 min内储尿期膀胱压大于1 mmHg的波动数对这种不稳定现象进行量化,FKBP12.6敲除使DO模型小鼠储尿期膀胱压力的波动明显增加(P < 0.05, 图 2C)。
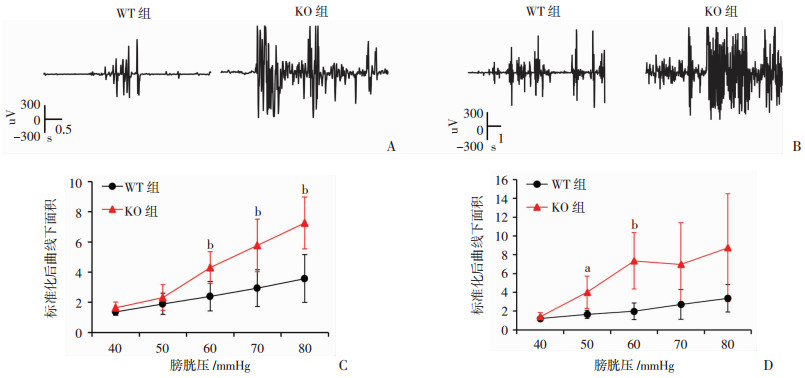
2.3 FKBP12.6敲除使膀胱对压力的敏感性增高FKBP12.6的敲除使VMRs反映的膀胱敏感性在60、70、80 mmHg时升高(P < 0.01,图 3A、C)。此外,FKBP12.6敲除也会导致小鼠膀胱逼尿肌对压力反应的电活动增强(图 3B、D), 在膀胱压为50、60 mmHg时,KO组逼尿肌电活动增强(P < 0.05, P < 0.01),而在膀胱压为70、80 mmHg时,KO组的膀胱逼尿肌电活动也呈现出更加活跃的趋势(P=0.06)。
|
| A:80 mmHg膀胱压下VMRs特征;B:80 mmHg膀胱压下平滑肌电活动特征;C:WT组(n=8)和KO组(n=7)不同膀胱压下VMRs定量分析;D:WT组(n=8)和KO组(n=7)不同膀胱压下平滑肌电活动定量分析 a:P < 0.05, b:P < 0.01,与WT组比较 图 3 两组小鼠膀胱敏感性和平滑肌电活动分析 |
2.4 FKBP12.6敲除使逼尿肌自发性收缩增强
FKBP12.6敲除使逼尿肌条大于0.1 mN的自发性收缩频率由(1.200±0.245)次/min提高到了(3.200±0.648)次/min(P < 0.01)。但是在收缩的幅度上,两组间并没有明显差异(图 4)。

|
| A:两组小鼠平滑肌自发性收缩典型图;B:自发性收缩频率分析(n=4);C:收缩幅度分析(n=4) < < a: P < 0.01,与WT组比较 图 4 两组小鼠逼尿肌条的自发性收缩频率及收缩幅度 |
2.5 FKBP12.6敲除导致RyR2表达明显下调
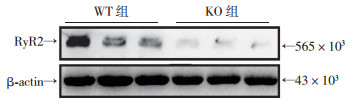
FKBP12.6敲除后,与WT组(1.000±0.444)比较,KO组RyR2表达下降(0.154±0.106,n=6),下降了85%(P < 0.01, 图 5)。提示FKBP12.6敲除加重小鼠的DO症状很可能与RyR2的显著下调有关。
|
| 图 5 Westen blot检测FKBP12.6敲除后小鼠逼尿肌中RyR2的表达 |
2.6 DO发生后FKBP12.6表达量下调
此外,相较于正常对照组(1.000±0.082),DO模型小鼠逼尿肌中的FKBP12.6表达也会出现明显的下调(0.668±0.145,n=6,图 6)。说明FKBP12.6缺失在DO的发生过程中起到了一定的作用。
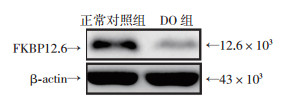
|
| 图 6 Westen blot检测DO发生后小鼠逼尿肌中FKBP12.6的表达 |
3 讨论
前期的研究认为:FKBP12.6的敲除将导致小鼠出现心脏肥大,从而影响心脏功能[12]。本研究发现:FKBP12.6对膀胱形态无明显的影响,提示FKBP12.6敲除引起的DO加重是非形态依赖性的。在膀胱功能方面,FKBP12.6敲除对DO的影响显而易见,无论是在活体功能(尿斑、尿动力、VMRs、逼尿肌电活动),还是在逼尿肌条的自发性收缩方面,FKBP12.6的敲除都将导致DO的进一步加重。以往的研究提示:RyR/Kca介导的负调控机制在调控逼尿肌兴奋性及DO的发生中起着重要作用[13]。利用Ryanodine选择性阻断RyR2通道后,正常离体逼尿肌条自发性收缩频率和幅度均显著上升,提示RyR2开放通过RyR2/Kca介导的负调控机制显著抑制逼尿肌的自发性兴奋和收缩[5]。HOTTA等[14]进一步利用RyR2基因敲除鼠发现:RyR2 +/-小鼠RyR2开放显著低于RyR2+/+鼠,导致RyR2+/-鼠出现尿频、尿急、急迫性尿失禁等类似于DO膀胱的表现。
以上研究提示:RyR2/Kca介导的负调控作用在抑制储尿期逼尿肌兴奋、防止逼尿肌出现不稳定收缩(DO)中起到重要作用,这一结论越来越被广泛接受[15]。FKBP12.6和RyR2主要表达于心肌和平滑肌,通过FKBP12.6与RyR2复合物的解离,使RyR2激活并已经在心肌[16]、冠状动脉平滑肌细胞[17]、肺动脉平滑肌细胞[18]、气道平滑肌[19]和胰岛[20]等组织中有所报道。既往关于FKBP12.6的研究提示:FKBP12.6的上调能够通过减少RyR开放,导致家兔蛛网膜下腔出血模型的脑动脉平滑肌兴奋性增高,这被认为是蛛网膜下腔出血时脑动脉平滑肌收缩增强的重要原因[8]。
与预期相反,本研究发现FKBP12.6的敲除使小鼠的DO症状更加严重,Western blot实验也进一步证实: KO组中RyR2的表达量出现了明显的下调,仅为WT组的15.4%。我科前期的研究已经证明:RyR2的表达下调在促进DO的发生中起到了关键性的作用,其表达量显著下调导致的RyR2/Kca功能减弱是DO发生的重要原因[5]。
在膀胱逼尿肌功能的正常发挥中,FKBP12.6起到了重要的作用,相较于正常对照组逼尿肌,DO模型小鼠逼尿肌中的FKBP12.6表达会出现明显的下调,这就说明FKBP12.6与DO的发生、发展有着密切的联系,其表达量的下调很可能是小鼠DO发生的原因。本研究也发现:FKBP12.6敲除将进一步加重小鼠的DO症状,且FKBP12.6的敲除会导致RyR2表达出现明显下调,这很可能是FKBP12.6敲除后小鼠DO症状加重的重要原因。因此,在DO的治疗过程中,提高逼尿肌中FKBP12.6的表达量或增强其功能,可能会起到意想不到的效果,这也将为DO的治疗提供全新的思路。
综上所述,本研究发现KO组中RyR2的表达较WT组显著下降可能是FKBP12.6 KO导致小鼠DO症状进一步加重的主要原因。其相关机制仍值得进一步探讨。可以预见的是:FKBP12.6作为一类重要的蛋白,其在DO诊治中的作用将越来越受到重视。
| [1] |
SERATI M, GHEZZI F. Severity of symptoms of overactive bladder: a predictor of success and of failure[J]. Eur Urol, 2015, 67(1): 15-16. DOI:10.1016/j.eururo.2014.07.018 |
| [2] |
GINSBERG D A, SCHNEIDER L K, WATANABE T K. Improving outcomes in patients with refractory idiopathic and neurogenic detrusor overactivity: management strategies[J]. Arch Phys Med Rehabil, 2015, 96(9 Suppl): S341-S357.e1. DOI:10.1016/j.apmr.2015.05.016 |
| [3] |
XIN W K, SODER R P, CHENG Q P, et al. Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation[J]. Am J Physiol, Cell Physiol, 2012, 303(10): C1079-C1089. DOI:10.1152/ajpcell.00162.2012 |
| [4] |
PARAJULI S P, ZHENG Y M, LEVIN R, et al. Big-conductance Ca2+-activated K+ channels in physiological and pathophysiological urinary bladder smooth muscle cells[J]. Channels (Austin), 2016, 10(5): 355-364. DOI:10.1080/19336950.2016.1180488 |
| [5] |
JIANG HH, SONG B, LU G S, et al. Loss of ryanodine receptor calcium-release channel expression associated with overactive urinary bladder smooth muscle contractions in a detrusor instability model[J]. BJU Int, 2005, 96(3): 428-433. DOI:10.1111/j.1464-410X.2005.05644.x |
| [6] |
WEHRENS X H, LEHNART S E, HUANG F N, et al. FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exercise-induced sudden cardiac death[J]. Cell, 2003, 113(7): 829-840. DOI:10.1016/s0092-8674(03)00434-3 |
| [7] |
ZHAO Y T, GUO Y B, GU L, et al. Sensitized signalling between L-type Ca2+ channels and ryanodine receptors in the absence or inhibition of FKBP12.6 in cardiomyocytes[J]. Cardiovasc Res, 2017, 113(3): 332-342. DOI:10.1093/cvr/cvw247 |
| [8] |
KOIDE M, NYSTORIAK M A, KRISHNAMOORTHY G, et al. Reduced Ca2+ spark activity after subarachnoid hemorrhage disables BK channel control of cerebral artery tone[J]. J Cereb Blood Flow Metab, 2011, 31(1): 3-16. DOI:10.1038/jcbfm.2010.143 |
| [9] |
LI Y H, HE M K, LIN W Y, et al. Responses of bladder smooth muscle to the stretch go through extracellular signal-regulated kinase (ERK)/p90 ribosomal S6 protein kinase (p90RSK)/nuclear factor-κB (NF-κB) pathway[J]. Neurourol Urodyn, 2019, 38(6): 1504-1516. DOI:10.1002/nau.24003 |
| [10] |
POWERS S A, RYAN T E, PAK E S, et al. Chronic high-fat diet decreased detrusor mitochondrial respiration and increased nerve-mediated contractions[J]. Neurourol Urodyn, 2019, 38(6): 1524-1532. DOI:10.1002/nau.24015 |
| [11] |
SCHWARTZ E S, LA J H, YOUNG EE, et al. Chronic prostatitis induces bladder hypersensitivity and sensitizes bladder afferents in the mouse[J]. J Urol, 2016, 196(3): 892-901. DOI:10.1016/j.juro.2016.03.077 |
| [12] |
YUAN Q, CHEN Z, SANTULLI G, et al. Functional role of Calstabin2 in age-related cardiac alterations[J]. Sci Rep, 2014, 4: 7425. DOI:10.1038/srep07425 |
| [13] |
LI L K, JIANG C H, SONG B, et al. Altered expression of calcium-activated K and Cl channels in detrusor overactivity of rats with partial bladder outlet obstruction[J]. BJU Int, 2008, 101(12): 1588-1594. DOI:10.1111/j.1464-410X.2008.07522.x |
| [14] |
HOTTA S, MORIMURA K, OHYA S, et al. Ryanodine receptor type 2 deficiency changes excitation-contraction coupling and membrane potential in urinary bladder smooth muscle[J]. J Physiol (Lond), 2007, 582(Pt 2): 489-506. DOI:10.1113/jphysiol.2007.130302 |
| [15] |
PETKOV G V. Central role of the BK channel in urinary bladder smooth muscle physiology andpathophysiology[J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(6): R571-R584. DOI:10.1152/ajpregu.00142.2014 |
| [16] |
WEHRENS X H, LEHNART S E, REIKEN S R, et al. Protection from cardiac arrhythmia through ryanodine receptor-stabilizing protein calstabin2[J]. Science, 2004, 304(5668): 292-296. DOI:10.1126/science.1094301 |
| [17] |
TANG W X, CHEN Y F, ZOU A P, et al. Role of FKBP12.6 in cADPR-induced activation of reconstituted ryanodine receptors from arterial smooth muscle[J]. Am J Physiol Heart Circ Physiol, 2002, 282(4): H1304-H1310. DOI:10.1152/ajpheart.00843.2001 |
| [18] |
LIAO B, ZHENG Y M, YADAV V R, et al. Hypoxia induces intracellular Ca2+ release by causing reactive oxygen species-mediated dissociation of FK506-binding protein 12.6 from ryanodine receptor 2 in pulmonary artery myocytes[J]. Antioxid Redox Signal, 2011, 14(1): 37-47. DOI:10.1089/ars.2009.3047 |
| [19] |
DU Y, ZHAO J H, LI X, et al. Dissociation of FK506-binding protein 12.6 kD from ryanodine receptor in bronchial smooth muscle cells in airway hyperresponsiveness in asthma[J]. Am J Respir Cell Mol Biol, 2014, 50(2): 398-408. DOI:10.1165/rcmb.2013-0222OC |
| [20] |
NOGUCHI N, YOSHIKAWA T, IKEDA T, et al. FKBP12.6 disruption impairs glucose-induced insulin secretion[J]. Biochem Biophys Res Commun, 2008, 371(4): 735-740. DOI:10.1016/j.bbrc.2008.04.142 |



