脓毒症是由宿主对感染的反应失调引起威胁生命的器官功能障碍[1-2]。脓毒症后会引起血管低反应性,导致组织器官灌注不足,最终出现严重的多器官功能衰竭。尽管近年针对抗感染治疗及血管功能支持技术已取得较大进展,但脓毒症的病死率仍然居高不下。因此,寻找预防和治疗脓毒症休克致血管功能障碍的措施,对降低脓毒症的发生率和病死率具有重要意义。周细胞(pericyte, PC)是位于微血管系统内皮细胞基底膜侧的一种血管壁细胞,具有维持血管稳定性和调节血压的功能。以往大量的研究表明,周细胞对血管内皮屏障功能的调节发挥着重要的作用[3-4]。有研究提示,周细胞还具有调节血管舒缩的功能。如周细胞可以通过自身收缩作用调控大脑毛细血管的血流量[5]。KUTCHER等[6]研究发现,周细胞中Rho GTPases依赖的信号通路可引起周细胞的收缩。同时,基础研究显示,Rho激酶能磷酸化肌球蛋白轻链磷酸酯酶(myosin light chain phosphatase, MLCP),抑制MLCP的活性,使得肌球蛋白轻链激酶(myosin light chain kinase,MLCK)和MLCP的活性比值上升,使肌球蛋白轻链磷酸化(p-MLC20)水平增加,最终增加血管平滑肌细胞的收缩[7]。那么,周细胞是否也对脓毒症血管反应性具有调控作用,能否作为脓毒症后血管低反应性的救治靶点,有待进一步研究。
本研究采用盲肠结扎穿孔(cecal ligation puncture, CLP)的方法复制脓毒症大鼠休克模型,观察周细胞对脓毒症大鼠血管舒缩反应性的保护作用,对组织器官灌注的影响,进一步探讨血管MLC20磷酸化水平在周细胞调节血管反应性中的作用,旨在为脓毒症的救治提供新的措施。
1 材料与方法 1.1 材料SPF级SD大鼠64只,12~14周龄,雌雄各半,体质量(200±20)g(陆军军医大学野战外科研究所实验动物中心提供)。周细胞专用培养基和FBS购自美国Science Cell公司,胰蛋白酶购自美国HyClone公司,PC标志物PDGFR-β、NG-2购自英国Abcam公司,p-MLC20购自美国Sigma公司,MLC20购自美国Cell signaling公司,FITC(羊抗兔)、TRITC(羊抗鼠)荧光二抗购自中国中杉金桥公司,Ⅰ型胶原酶购自美国Sigma公司。
1.2 方法 1.2.1 脓毒症模型的建立SD大鼠常规腹部消毒,暴露盲肠,将盲肠末端的粪便充盈,在距末端0.6 cm处用无菌线丝结扎,采用三角锥贯穿结扎盲肠段的中央,将盲肠按照原来的位置送回腹腔,逐层缝合后,放回笼中,自由饮水。观察大鼠平均动脉血压(mean arterial blood pressure,MAP),当MAP下降30%以上,模型成功,本次实验模型成功率达到89%以上。
1.2.2 动物分组及处理将大鼠按随机单位设计方法分为4组(n=16,8只用于测定肠系膜微动脉舒缩反应性,另8只用于测定肠系膜微血管动静脉流速、肝肾血流量和肠系膜上动脉p-MLC20的表达):正常对照组、脓毒症组(Sep组)、常规治疗组(CT组)、PC治疗组(PC组)。正常对照组仅开腹和关腹处理,脓毒症组在模型建立后不作任何处理。常规治疗组为脓毒症模型12 h后行常规复苏[液体复苏(乳酸林格氏液体35 mL/kg), 升压药(多巴胺1.75 mg/kg)及抗生素(头孢呋辛钠100 mg/kg),使平均动脉压(mean arterial blood pressure, MAP)>70 mmHg, 中心静脉压维持在8 mmHg;PC治疗组在常规治疗的基础上静脉注射PC(106/只,重悬于0.5 mL PBS,CT组静脉注射相等量的PBS作为对照)。观察治疗后24 h,各组大鼠肠系膜微血管舒缩反应性、动静脉流速和肝肾血流量及肠系膜上动脉p-MLC20蛋白表达的变化。
1.2.3 大鼠PC的培养及鉴定取初断乳大鼠的视网膜,反复剪至细小片状,转入2 g/L的Ⅰ型胶原酶中, 轻轻吹打, 在37 ℃细胞培养箱中消化25 min后,立即加入含有20%FBS的周细胞培养基。将滤液过50 μm滤网, 翻转滤网, 冲洗收集含微血管片段洗脱液, 4 ℃ 250×g离心5 min。吸除上清液, 加入适量周细胞专用培养基,将沉淀轻轻吹打混匀, 接种于25 cm2的细胞培养瓶中。当细胞长至80%~90%时,立即消化传代。取3~5代的PC接于激光共聚焦培养皿,待其成长覆盖率80%左右时,采用细胞免疫荧光技术,检测PC标志性蛋白(PDGFR-β和NG-2)的表达。
1.2.4 肠系膜微血管舒缩反应性和动静脉流速的测定动物麻醉后,剪去腹部毛发,沿着腹部正中剖开2~3 cm的切口,腹腔中加入37 ℃的生理盐水,并暴露盲肠。将动物仰卧在观察板上, 轻轻提出小肠,并将小肠展放在有观察孔的观察板上,在表面连续滴加37 ℃生理盐水保持温度和湿度。用配有37 ℃恒温装置的生物显微镜(OLYMPUS)进行观察。
选取直径在30~50 μm之间,200 μm长无分支,无明显弯曲的肠系膜微动脉,通过彩色CCD摄像机(DP21)进行观察。在10 min基础观察结束后,依次滴加不同浓度的NE(10-7、10-6、10-5、10-4 mol/L),最后直接滴加10-3 mol/L浓度的Ach,记录微动脉血管直径的变化。采用Image-Pro Plus 5.0软件测量血管直径的变化,血管收缩率计算公式为:(DBaseline-DNE)/DBaseline×100%,血管舒张率计算公式为:(DAch- DNE10-4)/(DBaseline-DNE)×100%。
另选取肠系膜微血管,通过超敏感摄像机(HAMAMATSU, C11440)进行观察。在10 min基础观察结束后,以1 000帧/s的速度,记录微血管动静脉的流速。用Image-Pro Plus 5.0软件测定红细胞流速。用μm/s表示大鼠肠系膜微动脉和微静脉的血流速度。
1.2.5 MLC20磷酸化水平的测定收集各组肠系膜上动脉,使用RIPA裂解液提取蛋白。BCA试剂盒测定蛋白浓度后,加入等体积的上样缓冲液。将变性后的蛋白等量上样,行SDS-PAGE(12%的浓缩胶)电泳,用电转膜仪将蛋白转至PVDF膜上,放入5%脱脂奶粉中封闭1 h,加入一抗(兔抗p-MLC20,1 :1 000;兔抗MLC20,1 :1 000;鼠抗β-actin,1 :7 000)4 ℃过夜,TBST缓冲液清洗3次后,室温下孵育二抗(山羊抗兔IgG,山羊抗鼠IgG)1 h,TBST缓冲液冲洗3次后使用Oddsey红外成像仪进行PVDF膜扫描。
1.2.6 肝肾血流量的检测用激光多普勒血流灌注成像仪(PeriCam PSI ZR, Sweden)测定大鼠肝脏和肾脏的血流量。麻醉大鼠并置于鼠板上,剪开腹部,充分暴露肝脏和肾脏,将低能量的氦-氖激光器探头分别置于肝脏和肾脏上14 cm处,检测各组大鼠肝脏和肾脏的血流量。用血流量分析软件(PIMsoft)计算大鼠肝肾血流量。
1.3 统计学方法采用SPSS 13.0统计软件进行数据分析,计量资料以x±s表示,多组间差异比较采用单因素方差分析,组内两两比较采用t检验。检验水准:α=0.05。
2 结果 2.1 PC对脓毒症大鼠肠系膜微血管舒缩反应性的影响镜下PC胞体宽大、扁平,呈不规则三角形或多角形。细胞免疫荧光显示PC的表面抗原标记物PDGFR-β和NG-2呈阳性表达(图 1A)。与正常对照组相比,脓毒症大鼠肠系膜微动脉舒缩反应性明显降低,表现为肠系膜微动脉对NE的收缩反应性和对Ach的舒张反应性分别下降至21.2%和27.0%(P < 0.01)。常规治疗可部分改善肠系膜微血管舒缩反应。与常规治疗组相比,PC治疗可以显著改善肠系膜微血管舒缩反应性,收缩和舒张反应性分别达到81.5%和86.9%(P < 0.01,图 1B~D)。表明PC可改善脓毒症后血管低反应性。
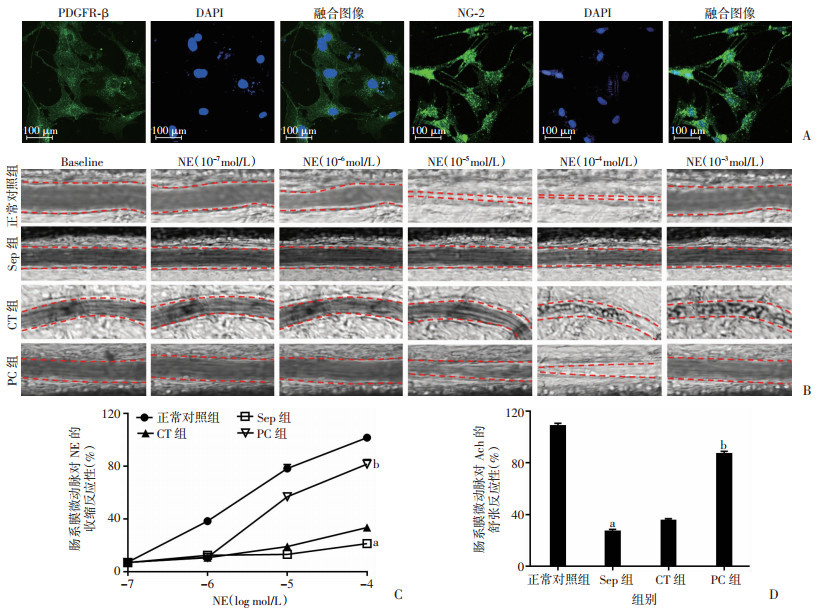
|
| A:荧光显微镜观察PDGFR-β和NG-2标记PC;B:肠系膜微动脉舒收反应性的测定;C:各组微动脉收缩反应性的变化率(n=8,x±s);D:各组微动脉舒张反应性的变化率(n=8,x±s);a:P < 0.01,与正常对照组比较;b:P < 0.01,与CT组比较 图 1 各组大鼠肠系膜微血管舒缩反应性的变化 |
2.2 PC对脓毒症大鼠肠系膜动静脉流速的影响
与正常对照组相比,脓毒症后肠系膜动静脉流速明显降低,表现为肠系膜微血管动脉和静脉红细胞流速分别下降了88.4%和87.0%(P < 0.01)。常规治疗可部分改善肠系膜微血管动静脉流速。PC治疗可以显著改善肠系膜微血管动静脉流速,与常规治疗组相比,PC治疗后脓毒症肠系膜动脉和静脉流速分别增加147.8%和137.5%,差异有统计学意义(P < 0.01,图 2)。
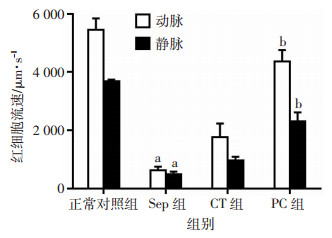
|
| a:P < 0.01,与正常对照组比较;b:P < 0.01,与CT组比较 图 2 各组大鼠肠系膜微血管动静脉流速的变化(n=8,x±s) |
2.3 PC对脓毒症大鼠肝肾血流量的影响
与正常对照组相比,脓毒症后肝脏、肾脏血流量明显降低,表现为肝脏和肾脏血流量分别降低了75.9%和79.2%(P < 0.01)。常规复苏可部分恢复脓毒症大鼠的肝肾血流量。PC可显著改善脓毒症大鼠的肝肾血流量,与常规治疗组相比,肝脏和肾脏的血流量分别增加了66.1%和80.4%(P < 0.01,图 3、4)。以上结果提示,PC通过改善脓毒症血管反应性从而保护组织器官的灌注量。
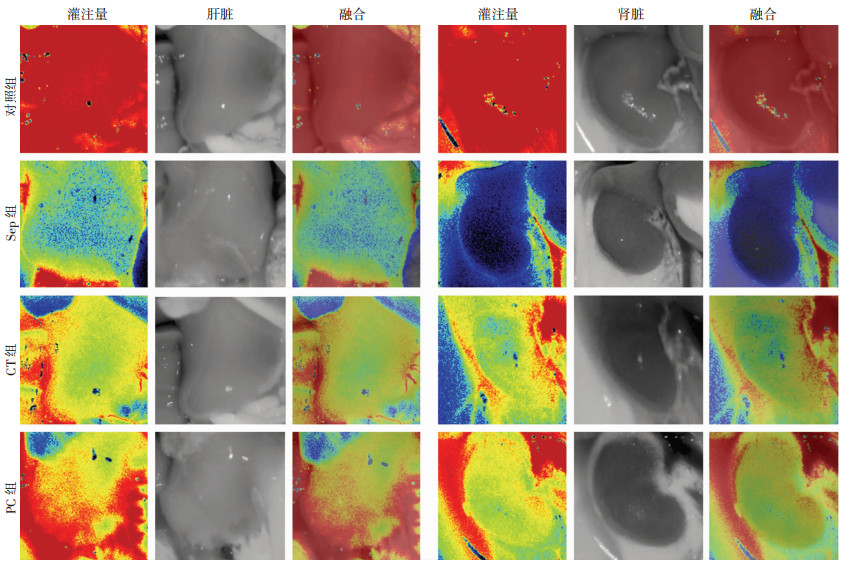
|
| 图 3 激光多普勒检测各组大鼠肝脏和肾脏血流量结果 |
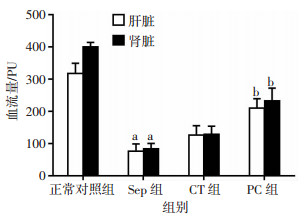
|
| a:P < 0.01,与正常对照组比较;b:P < 0.01,与CT组比较 图 4 各组大鼠肝肾血流量变化的定量分析(n=8,x±s) |
2.4 PC对脓毒症大鼠肠系膜上动脉p-MLC20蛋白表达的变化
与正常对照组相比,脓毒症组p-MLC20的表达明显降低(P < 0.01)。常规复苏对p-MLC20的表达有轻微的改变。PC治疗后,脓毒症大鼠血管p-MLC20的表达明显升高,差异有统计学意义(P < 0.01,图 5)。
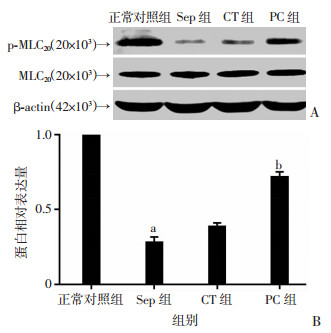
|
| A:Western blot分析;B:各组p-MLC20相对表达量(n=3, x±s);a:P < 0.01,与正常对照组比较;b:P < 0.01,与CT组比较 图 5 Western blot检测各组肠系膜上动脉p-MLC20蛋白的表达 |
3 讨论
脓毒症是临床常见的危重病症,其发生率和病死率均很高。血管功能障碍是脓毒症患者器官功能衰竭甚至死亡的主要原因。血管功能障碍包括血管低反应性和血管渗漏[1]。本研究发现,外源性的PC对脓毒症大鼠血管收缩和舒张反应性具有明显的保护作用,进一步研究发现,PC可明显改善脓毒症大鼠的组织灌注量。机制研究发现,PC通过调节血管p-MLC20的表达来改善脓毒症大鼠血管反应性。
以往周细胞的研究主要是对内皮屏障功能的调控。DANEMAN等[8]发现在胚胎形成过程中,周细胞在血管上的覆盖率决定着血管内皮屏障功能的变化。BELL等[9]发现周细胞的缺失导致血脑屏障的破坏,增加大脑异常蛋白的累积和大分子物质的浸润。而本研究发现,周细胞通过改善脓毒症大鼠血管舒缩反应性实现了对组织器官的保护作用。
近年来,大量的研究证实,PC具有调节血管收缩和舒张功能。周细胞的收缩主要由钙离子浓度所介导[10]。如PEPPIATT等[11]采用膜片钳技术,通过电刺激视网膜周细胞激发毛细血管收缩,并能以约2 μm/s的速度压缩远端的周细胞,当去除周细胞胞内钙离子后,电刺激处理周细胞的收缩现象消失。同时,中枢神经系统周细胞中钙离子通路与周细胞收缩性也有关系,钙离子激活的钾离子通道可以调控周细胞的静息膜电位,钙离子可通过L-型电压依赖的钙离子通道进入细胞,导致周细胞内钙离子浓度升高,引起周细胞的收缩,而胞内钙离子浓度下降则引起周细胞舒张[12]。研究还发现,周细胞可通过激活多种类型的钾离子通道来调节自身的收缩性,如内部整流器钾离子(KIR)通道、电压门控钾离子通道、钙离子激活的钾离子通道、ATP-敏感的钾离子通道[13-14]。基础研究显示,血管平滑肌细胞收缩和舒张功能主要受MLC20磷酸化及脱磷酸化调节,其调节途径包括钙依赖途径和钙敏感性途径[15]。本实验室前期的研究发现,休克后血管低反应性的发生与血管平滑肌MLC20磷酸化水平的降低有关[16]。本研究发现,周细胞可以增加血管平滑肌MLC20磷酸化的表达,改善脓毒症血管低反应性。但是周细胞进入体内后是如何调节血管平滑肌p-MLC20水平的,是通过钙依赖途径还是钙敏感性途径,还有待进一步研究。
| [1] |
RABBOLINI D J, ANGE N, WALTERS G D, et al. Systemic capillary leak syndrome: recognition prevents morbidity and mortality[J]. Intern Med J, 2013, 43(10): 1145-1147. DOI:10.1111/imj.12271 |
| [2] |
SHARAWY N, LEHMANN C. New directions for sepsis and septic shock research[J]. J Surg Res, 2015, 194(2): 520-527. DOI:10.1016/j.jss.2014.12.014 |
| [3] |
AHMAD A A, TABOADA C B, GASSMANN M, et al. Astrocytes and pericytes differentially modulate blood: brain barrier characteristics during development and hypoxic insult[J]. J Cereb Blood Flow Metab, 2011, 31(2): 693-705. DOI:10.1038/jcbfm.2010.148 |
| [4] |
GERTZ K, KRONENBERG G, UHLEMANN R, et al. Partial loss of VE-cadherin improves long-term outcome and cerebral blood flow after transient brain ischemia in mice[J]. BMC Neurol, 2016, 16: 144. DOI:10.1186/s12883-016-0670-8 |
| [5] |
FERNANDEZ-KLETT F, OFFENHAUSER N, DIRNAGL U, et al. Pericytes in capillaries are contractile in vivo, but arterioles mediate functional hyperemia in the mouse brain[J]. Proc Natl Acad Sci U S A, 2010, 107(51): 22290-22295. DOI:10.1073/pnas.1011321108 |
| [6] |
KUTCHER M E, KOLYADA A Y, SURKS H K, et al. Pericyte rho GTPase mediates both pericyte contractile phenotype and capillary endothelial growth state[J]. Am J Pathol, 2007, 171(2): 693-701. DOI:10.2353/ajpath.2007.070102 |
| [7] |
HODGE R G, RIDLEY A J. Regulating rho GTPases and their regulators[J]. Nat Rev Mol Cell Biol, 2016, 17(8): 496-510. DOI:10.1038/nrm.2016.67 |
| [8] |
DANEMAN R, ZHOU L, KEBEDE A A, et al. Pericytes are required for blood-brain barrier integrity during embryogenesis[J]. Nature, 2010, 468(7323): 562-566. DOI:10.1038/nature09513 |
| [9] |
BELL R D, WINKLER E A, SAGARE A P, et al. Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging[J]. Neuron, 2010, 68(3): 409-427. DOI:10.1016/j.neuron.2010.09.043 |
| [10] |
WINKLER E A, BELL R D, ZLOKOVIC B V. Central nervous system pericytes in health and disease[J]. Nat Neurosci, 2011, 14(11): 1398-1405. DOI:10.1038/nn.2946 |
| [11] |
PEPPIATT C M, HOWARTH C, MOBBS P, et al. Bidirectional control of CNS capillary diameter by pericytes[J]. Nature, 2006, 443(7112): 700-704. DOI:10.1038/nature05193 |
| [12] |
KAMOUCHI M, KITAZONO T, AGO T, et al. Calcium influx pathways in rat CNS pericytes[J]. Mol Brain Res, 2004, 126(2): 114-120. DOI:10.1016/j.molbrainres.2004.03.008 |
| [13] |
CAO C H, GOO J H, LEE-KWON W, et al. Vasa recta pericytes express a strong inward rectifier K+ conductance[J]. Am J Physiol-Regul Integr Comp Physiol, 2006, 290(6): R1601-R1607. DOI:10.1152/ajpregu.00877.2005 |
| [14] |
HIRAO M, OKU H, GOTO W, et al. Effects of adenosine on optic nerve head circulation in rabbits[J]. Exp Eye Res, 2004, 79(5): 729-735. DOI:10.1016/j.exer.2004.08.008 |
| [15] |
KITAZAWA T, ETO M, WOODSOME T P, et al. Agonists trigger G protein-mediated activation of the CPI-17 inhibitor phosphoprotein of myosin light chain phosphatase to enhance vascular smooth muscle contractility[J]. J Biol Chem, 2000, 275(14): 9897-9900. DOI:10.1074/jbc.275.14.9897 |
| [16] |
LI T, LIU L M, LIU J C, et al. Mechanisms of rho kinase regulation of vascular reactivity after hemorrhagic shock in rats[J]. Shock, 2008, 29(1): 65-70. DOI:10.1097/shk.0b013e318063e477 |



