2. 430071 武汉,中国人民解放军中部战区总医院皮肤整形美容科
2. Department of Plastic Surgery, General Hospital of Central Theater Command of PLA, Wuhan, Hubei Province, 430071, China
由于皮肤组织结构和功能的复杂性,目前组织工程技术只能实现皮肤结构、功能的部分替代,而在体外进行皮肤器官的直接培养,可以克服人工皮肤组织工程技术的不足,保持皮肤局部器官的相对完整,利用皮肤组织的生长、变化进行体外观察,用于皮肤病发病机制、药代学、毒理学及创伤愈合等方面的研究[1-2]。准静态平面均匀流场是本课题组发明的一种新型灌注培养装置[3],采用计算流体动力学的模拟分析,优化了装置结构的设计,解决了营养供应的均匀性问题。该设备先后用于成纤维细胞的成骨分化[4],组织工程真皮的生长代谢[5],以及游离鼠皮皮片的培养研究[6],通过实验获得了流场应用时的一些基本实验参数。为了建立成熟稳定的人体皮肤标本的体外研究模型,仍需要探索更加合理的培养方案。本研究利用两种不同频次的灌注液流,通过组织形态学观察比较了两组游离皮片结构及细胞功能的变化情况。
1 材料与方法 1.1 主要试剂DMEM高糖培养基购自美国HyClone公司,注射用青霉素与链霉素(哈药集团制药)胎牛血清购自美国Gibco公司,多聚甲醛购自重庆北碚化学试剂厂,苏木精染色液、伊红染色液、中性树胶购自北京中杉金桥生物技术有限公司,盐酸酒精分化液、碳酸锂溶液购自重庆川东化工有限公司化学试剂厂,高效切片石蜡购自上海华永石蜡有限公司,Van Gieson染色液、过碘酸-雪夫染色液购自北京索莱宝科技有限公司,柠檬酸盐缓冲液、30% H2O2溶液、牛血清白蛋白、DAPI、抗荧光淬灭剂购自碧云天生物公司,TUNEL细胞凋亡检测试剂盒购自德国Roche公司。
1.2 主要仪器自制准静态平面均匀流场培养系统、皮片打孔器、超净工作台购自苏州安泰公司,CO2培养箱购自香港力康生物公司,BANTE821溶解氧测量仪购自上海般特仪器有限公司,荧光显微镜购自日本OLYMPUS公司,恒温摊片烤片机购自常州中威电子公司,恒温培养箱购自上海一恒公司,石蜡切片机购自德国Leica公司。
1.3 实验方法 1.3.1 培养液配制培养基溶液总量配比DMEM高糖液体培养基450 mL+胎牛血清50 mL+氢化可的松0.2 mg+表皮细胞生长因子5 μg+人重组胰岛素60 U+脯氨酸17.5 mg。
1.3.2 流场装置组成及运行原理准静态平面均匀流场样机主要由3部分构成,储液瓶、蠕动泵和培养盒(图 1)。其核心部件培养盘位于培养盒内,通过培养盘的结构设计使得游离皮片处于气液界面,营养供应均匀,所受的剪切力大小一致。连接硅胶管后,培养基在蠕动泵的驱动下由储液瓶进入静压槽,通过挡板到达培养板下面的培养区,再越过溢流坝经泄流沟流入培养盒,最后多余的培养基又会重新回流到储液瓶,整个流场回路完全封闭[6]。

|
| A:灌注设备;B:4 mm游离皮片;C:打孔钳 图 1 准静态平面均匀流场及培养标本制作 |
1.3.3 标本处理方法及灌注培养分组方案
实验所用包皮环切组织于本院泌尿外科门诊手术获得。在无菌工作台上,将标本用75%酒精棉球消毒灭菌,用眼科剪修剪皮下结缔组织,用准备好的打孔钳制取4 mm大小的圆形皮片数枚,置于PBS液体中备用(图 1B、C)。连接组装两套灭菌过的灌注系统部件,分别加入DMEM高糖培养基500 mL,将游离皮片置于改良后的24孔规格培养板上,表皮朝上。把培养装置放于37 ℃、5% CO2孵箱中培养。设置流速80 mL/min,实验组灌注频次设定为运行4 min,间停2 min;对照组灌注频次设定为运行1 h,间停5 h。两组皆于培养后3、6、9、12 d作为取材时间点。
1.3.4 PAS染色标本取材后浸入4%多聚甲醛固定液中,常规脱水、浸蜡、包埋,制成石蜡标本,切片后经脱蜡、水合后,20 ℃下1%高碘酸溶液中氧化5 min,水洗,预冷Schiff氏液避光染色15 min,偏重亚硫酸钠分化浸洗,苏木精染色,脱水,透明,封片。显微镜下观察拍照。
1.3.5 VG染色石蜡切片用Weigert氏铁苏木精染液染色2 min,1%盐酸酒精分化,再经Van Gieson氏染液染色1 min,95%乙醇急速分化,二甲苯透明,中性树胶封片,显微镜下观察拍照,染色后胶原纤维呈鲜红色,肌纤维呈黄色,细胞核呈蓝色。
1.3.6 HE染色将石蜡标本连续5 μm厚度切片,苏木精-伊红(HE)染色。中性树胶封片,显微镜下拍照。每张切片于高倍镜下随机选取5个视野进行细胞计数并进行统计分析。
1.3.7 TUNEL荧光染色石蜡切片经脱蜡、水合后,参照TUNEL试剂盒说明书进行荧光染色。在荧光显微镜下采集图片。每张切片于高倍镜下计数TUNEL阳性细胞,计算凋亡百分比,并统计分析。绿色荧光即为TUNEL凋亡阳性细胞。
1.3.8 溶解氧模拟检测在不计游离皮片真实营养消耗的情况下,模拟检测两种灌注频次下培养液中溶解氧含量的变化情况。先将两套装有500 mL培养基的培养装置置于37 ℃,5% CO2孵箱中静置1 h。然后打开溶解氧测量仪校准仪表,将电极端插入培养基溶液中,设置培养所用流速及灌注频次。于静置时及灌注后14、28、42、56 min, 2、3、4、5、6 h,采集数据并绘制溶解氧变化曲线。
1.4 统计学分析采用SPSS 17.0统计软件,数据以x±s表示。数据来源于3次以上独立性试验,两组比较采用双因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 肉眼形态学观察肉眼可见对照组皮片在培养后的各个时间点颜色逐渐加深,皮片皱缩,12 d时,皮片呈现坏死特征。轻触皮片弹性较差,表真皮有分离迹象。实验组在培养后,仍能保持颜色鲜活,弹性度良好。见图 2。

|
| 图 2 肉眼观察两组皮片标本不同培养时间的形态变化 |
2.2 PAS染色情况
基底膜染色结果显示,实验组保持了基底膜带的完整性,无中断或分离现象,表皮与真皮连接紧密;而对照组标本表真皮出现严重分离,无法识别基底膜结构,基底层附近细胞数目稀少,皮肤结构和功能遭到破坏。见图 3。
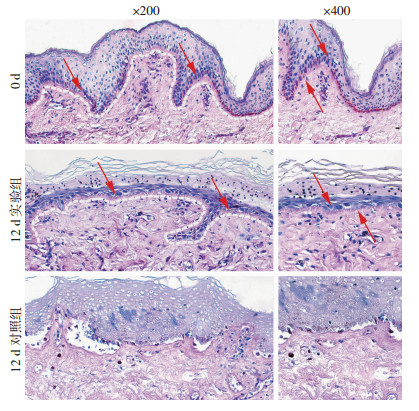
|
| 红色箭头示基底膜位置; 白色断线代表基底膜条带走向 图 3 两组皮片PAS染色比较 |
2.3 VG染色情况
VG染色可见实验组真皮胶原纤维排列方向不一,显得疏松而富有弹性,与原始未经过培养的游离皮片染色结构相近。而对照组培养12 d后出现胶原纤维着色变淡,向下沉淀堆积,分布不均,走行多以水平方向为主。见图 4。
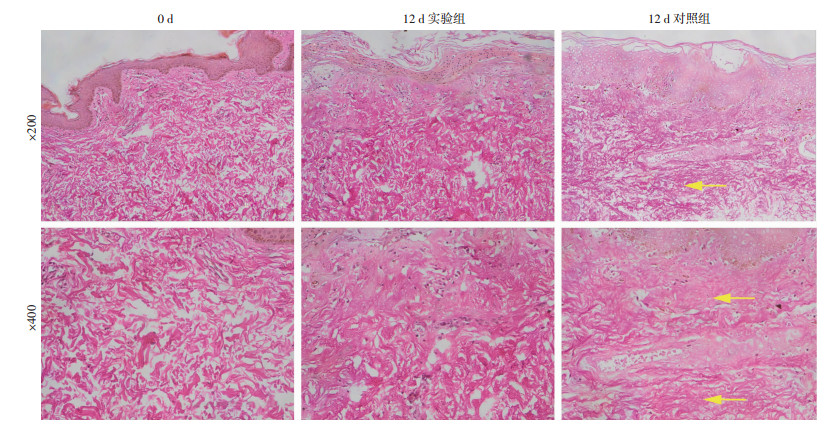
|
| 箭头示胶原纤维分布方向 图 4 VG染色观察两组皮片形态学变化 |
2.4 HE染色、TUNEL凋亡检测情况
HE染色结果见图 5,实验组游离皮片经过12 d的体外培养,表真皮内染色细胞数为(249.35±13.00),与原始0 d皮片(315.00±10.80)比较,差异无统计学意义(P < 0.05);表皮基底层细胞过度分化,排列紊乱,但无显明空泡化现象。而对照组染色细胞数较0 d皮片明显减少[(37.50±9.18),P < 0.001],染色变淡,细胞核固缩,空泡化严重。TUNEL凋亡检测主要反映两组皮片的存活状态。原始0 d皮片中细胞凋亡水平较低,培养12 d后由于营养、环境、温度的变化,两组皮片细胞凋亡水平都有所增加,表皮层为细胞凋亡集中区域,见图 5。12 d时对照组细胞凋亡率为(59.73±8.04)%,显著高于实验组[(9.91±3.89)%,P < 0.001]。

|
| 箭头示凋亡阳性细胞 图 5 两组皮片HE染色、TUNEL凋亡情况比较(×200) |
2.5 培养基中溶解氧检测情况
通过3次模拟检测培养基的办法,获得溶解氧的浓度值,绘制曲线图(图 6)。在1 h内,观察到溶解氧数值处于相对稳定的状态,差异性不大。然而在对照组灌注间停的5 h内,溶解氧数值明显下降约50%,实验组溶解氧数值未出现较大波动。
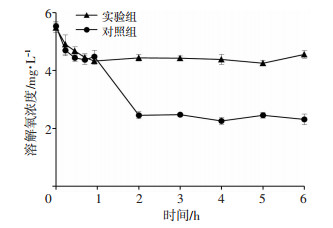
|
| 图 6 两组培养基中溶解氧模拟检测情况比较 |
3 讨论
近年来,随着实验动物3R原则的倡导与实施,传统的动物实验面临严峻挑战,替代方法技术的研究应用得到了重视和发展。目前比较成熟的方法包括离体器官实验和体外细胞培养实验。取自于人体的鲜活皮肤标本保留了组织的原始架构和多种细胞的功能布局,能够比较真实地呈现体外的生理反应[7-8]。而准静态平面均匀流场采用灌注式及气液界面培养更近似于人体的生理环境。二者结合起来无论从结果的可靠性还是研究花费方面等方面的考虑,都会为基础医学及药物的研发带来广阔前景。并且体外实验模型的成功建立有希望替代动物实验,于体外即可探讨某些新发明药物的药理作用[9]。
本实验我们拟在灌注频次上探讨液流对游离包皮皮片存活的影响,希望为游离皮片的体外培养提供真实可靠的理论依据。本实验设计了高、低两种灌注频次,结果低频次灌注组培养物出现表皮结构分离,真皮胶原纤维变性,细胞数目减少,凋亡细胞比例上升等情况,明显不及高频次灌注方案。该研究表明尽管低频次灌注方案曾成功用于新生鼠皮皮片的体外培养[6],但对游离包皮皮片的培养并不适合。其原因可能如下:第一,由于对照组灌注间歇期较长,实际上只相当于传统的静态培养,而静态培养在培养三维形态的组织时具有多种局限性。例如在三维组织中团块物质受到扩散限制,pH值,溶解氧,代谢物和葡萄糖达到临界浓度梯度,使得培养环境控制不良,同时培养物细胞对刺激性应答反应性降低[10]。这就要求进行三维组织培养时,培养物的厚度应在1~2 mm之间[11],否则难以保证体外存活的时间。而包皮组织不同于一般组织工程的三维组织,不仅结构致密,而且偏厚,所以局部营养的扩散及传输必然受到限制。第二,我们通过对两组培养基的模拟检测,结果显示对照组灌注间歇期内溶解氧含量为2~4 mg/L,明显低于实验组。低氧环境已被证明可诱导细胞凋亡和自噬的发生,并可刺激干细胞增殖[12-14]。对照组细胞凋亡明显,说明与溶解氧水平降低具有密切关系。实验组通过提高灌注频次,促进了营养的供应和废物的清除,增强了团块物质的传递,维持了培养基的溶氧水平,延长了游离人体皮肤组织的体外存活时间。而且在培养时间内未发生因蠕动泵频繁运转而出现硅胶管磨损破裂的情况。
由于影响体外器官培养的因素还有很多,除了灌注式生物反应器的机械运行参数,还与培养基成分[15-16]、环境温度[17]、pH值、溶解氧浓度[12]、剪切力[18]等有关。在本次实验中,实验组在培养期内也出现了表皮层角化过度,基底层细胞数目减少的现象,因此如果要建立稳定的皮肤病药用或创伤愈合模型,仍需进一步摸索培养条件。
| [1] |
VARANI J, PERONE P, SPAHLINGER D M, et al. Human skin in organ culture and human skin cells (keratinocytes and fibroblasts) in monolayer culture for assessment of chemically induced skin damage[J]. Toxicol Pathol, 2007, 35(5): 693-701. DOI:10.1080/01926230701481907 |
| [2] |
LIU H, TUCHINDA P, FISHELEVICH R, et al. Human in vitro skin organ culture as a model system for evaluating DNA repair[J]. J Dermatol Sci, 2014, 74(3): 236-241. DOI:10.1016/j.jdermsci.2014.02.003 |
| [3] |
伍津津.一种适用于三维组织细胞灌注培养的生物反应器: CN103966095A[P]. 2014-08-06. WU J J. The bioreactor suitable for three-dimensional tissue perfusion culture: CN103966095A[P]. 2014-08-06. |
| [4] |
张维, 谭燃景, 唐辉, 等. 三维培养条件下流体剪切力对人真皮成纤维细胞成骨分化的影响[J]. 第三军医大学学报, 2016, 38(12): 1416-1421. ZHANG W, TAN R J, TANG H, et al. Fluid shear stress affects osteogenic differentiation of human dermal fibroblasts in three-dimensional culture condition[J]. J Third Mil Med Univ, 2016, 38(12): 1416-1421. DOI:10.16016/j.1000-5404.201512010 |
| [5] |
唐辉, 闫洪涛, 陈年, 等. 不同灌注流速对复方壳多糖组织工程真皮生长代谢的影响[J]. 中华皮肤科杂志, 2016, 49(12): 865-870. TANG H, YAN H T, CHEN N, et al. Effects of different medium perfusion rates on the growth and metabolism of composite chitosan-based tissue-engineered dermis[J]. Chin J Dermatol, 2016, 49(12): 865-870. DOI:10.3760/cma.j.issn.0412-4030.2016.12.008.j.issn.0412-4030.2016.12.008 |
| [6] |
YAN H T, TANG H, QIU W M, et al. A new dynamic culture device suitable for rat skin culture[J]. Cell Tissue Res, 2019, 375(3): 723-731. DOI:10.1007/s00441-018-2945-4 |
| [7] |
LUNI C, SERENA E, ELVASSORE N. Human-on-chip for therapy development and fundamental science[J]. Curr Opin Biotechnol, 2014, 25: 45-50. DOI:10.1016/j.copbio.2013.08.015 |
| [8] |
ZHOU L J, ZHANG X Q, PAUS R, et al. The renaissance of human skin organ culture: A critical reappraisal[J]. Differentiation, 2018, 104: 22-35. DOI:10.1016/j.diff.2018.10.002 |
| [9] |
ARORA T, MEHTA A K, JOSHI V, et al. Substitute of animals in drug research: an approach towards fulfillment of 4R's[J]. Indian J Pharm Sci, 2011, 73(1): 1-6. DOI:10.4103/0250-474X.89750 |
| [10] |
VOLKMER E, DROSSE I, OTTO S, et al. Hypoxia in static and dynamic 3D culture systems for tissue engineering of bone[J]. Tissue Eng Part A, 2008, 14(8): 1331-1340. DOI:10.1089/ten.tea.2007.0231 |
| [11] |
PIOLA M, SONCINI M, CANTINI M, et al. Design and functional testing of a multichamber perfusion platform for three-dimensional scaffolds[J]. Sci World J, 2013, 2013: 123974. DOI:10.1155/2013/123974 |
| [12] |
ZHANG K, ZHAO T, HUANG X, et al. Dissolved oxygen concentration in the medium during cell culture:Defectsandimprovements[J]. Cell Biol Int, 2016, 40(3): 354-360. DOI:10.1002/cbin.10570 |
| [13] |
URBANI L, PICCOLI M, FRANZIN C, et al. Hypoxia increases mouse satellite cell clone proliferation maintaining both in vitro and in vivo heterogeneity and myogenic potential[J]. PLoS ONE, 2012, 7(11). DOI:10.1371/journal.pone.0049860 |
| [14] |
HU Y L, DELAY M, JAHANGIRI A, et al. Hypoxia-induced autophagy promotes tumor cell survival and adaptation to antiangiogenic treatment in glioblastoma[J]. Cancer Res, 2012, 72(7): 1773-1783. DOI:10.1158/0008-5472.CAN-11-3831 |
| [15] |
KLESZCZYNSKI K, FISCHER T W. Development of a short-term human full-thickness skin organ culture model in vitro under serum-free conditions[J]. Arch Dermatol Res, 2012, 304(7): 579-587. DOI:10.1007/s00403-012-1239-z |
| [16] |
LU Z, HASSE S, BODO E, et al. Towards the development of a simplified long-term organ culture method for human scalp skin and its appendages under serum-free conditions[J]. Exp Dermatol, 2007, 16(1): 37-44. DOI:10.1111/j.1600-0625.2006.00510.x |
| [17] |
ISHIKAWA J, OSHIMA M, IWASAKI F, et al. Hypothermic temperature effects on organ survival and restoration[J]. Sci Rep, 2015, 5: 9563. DOI:10.1038/srep09563 |
| [18] |
GEORGIEV M I, EIBL R, ZHONG J J. Hosting the plant cells in vitro: recent trends in bioreactors[J]. Appl Microbiol Biotechnol, 2013, 97(9): 3787-3800. DOI:10.1007/s00253-013-4817-x |



