2. 400016 重庆, 重庆医科大学:基础医学院
2. College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
脑出血(intracerebral hemorrhage,ICH)是脑实质的出血,是中风的一种亚型,约占所有中风的15%。脑出血病死率和发病率均较高,1年生存率仅为30%[1]。目前,脑出血的机制尚不完全清楚,临床上缺乏有效的治疗手段。PTPN22(protein tyrosine phosphatase, nonreceptor type 22)是一种蛋白酪氨酸磷酸酶,参与细胞免疫反应及炎症,与多种自身免疫性疾病有关[2-3]。研究表明在小鼠模型中,PTPN22缺乏可以导致结肠炎,增加NLRP3磷酸化,降低成熟的IL-1β水平[4]。相反,炎症性肠病(IBD)患者携带自身免疫相关PTPN22水平增加,促进NLRP3去磷酸化,增加成熟的IL-1β水平。酪氨酸磷酸化作为NLRP3的重要调节机制,可防止异常的炎性体激活[5]。但PTPN22在脑出血中的作用尚未见报道。胞内Nod样受体(NLR)在免疫应答和炎症反应过程中起关键作用[6]。NLRP3炎性体是NLR家族中最具代表性的成员,是一种多蛋白复合物,由NLRP3,凋亡相关的斑点样蛋白(ASC)和半胱天冬酶-1(caspase-1)组成[7]。激活的caspase-1(cleaved-caspase-1)可以剪切Pro-IL-1β和Pro-IL-18,形成其成熟和活跃形式,促进cleaved-IL-1β,cleaved-IL-18的释放,导致其他免疫细胞如中性粒细胞的募集和激活[8-9]。本课题组前期研究表明NLRP3炎性体的激活可以加重脑缺血再灌注损伤[10-12],与炎性体激活有关的机制是近年来研究的热点。
本实验通过采用自体血建立大鼠脑出血模型,通过抑制PTPN22的表达,研究PTPN22在大鼠脑出血后炎症反应中的作用。并探究干扰PTPN22是否可以通过抑制NLRP3炎性体激活,从而在脑出血后炎症反应中发挥作用。
1 材料与方法 1.1 实验动物成年雄性SD大鼠108只,体质量250~300 g,在重庆医科大学实验动物中心繁殖和饲养。本实验通过重庆医科大学医学伦理委员会。36只SD大鼠随机分为6组:sham组(即假手术组),ICH3、6、12、24、48 h,每组6只,用于筛选PTPN22在脑出血模型后表达的时间窗。另外72只大鼠随机分配为以下4组(n=18):sham组,ICH组(ICH24 h),ICH+NC组(即ICH+阴性对照组);ICH+ PTPN22siRNA组(即ICH+ PTPN22干扰组),研究PTPN22在炎症反应中的作用。
1.2 方法 1.2.1 建立ICH模型采用自体血注入诱导脑出血模型。将大鼠随机分配到实验组,通过腹膜内注射用4%水合氯醛(1 mL/100 g)麻醉,并固定于脑定位仪上。从股动脉收集自体血(50 μL),并转移到具有显微注射泵的抗凝注射器中。将血液以前囟后0.2 mm,旁开3.0 mm和深度5.8 mm的距离注入右侧纹状体。在深度5.0 mm时注入10 μL血液,留针2 min; 最后再进针到深度为5.8 mm时注入剩下的40 μL血液,留针15 min后缓慢拔出针头。Sham组的大鼠仅插入针头[13]。
1.2.2 PTPN22 siRNA的筛选PTPN22 siRNA由上海吉马公司设计并合成。四种PTPN22-rat-siRNA片段分别为:PTPN22-rat-1833(正义链:5′-CCUCCUCUUCUUAUAGUAATT-3′,反义链:5′-UUACUAUAAGAAGAGGAGGAGGTT-3′);PTPN22-rat-1419(正义链:5′-GCAGAUGUCACAACUCAAATT-3′,反义链:5′-UUUGAUUUGUGACAUCUGCTT-3′);PTPN22-rat-1185(正义链:5′-GCCUUAGAACUUCUAAGAUTT-3′,反义链:5′-AUCUUAGAAGUUCUAAGGCTT-3′);PTPN22-rat-494(正义链:5′-GCAUGUAUGGAGUUCGAAATT-3′,反义链:5′-UUUCGAACUCCAUACAUGCTT-3′);以及阴性对照序列。在ICH模型建立前24 h将PTPN22siRNA注射到右侧脑室中。免疫印迹检测转染检测出效果最好的干扰片段是PTPN22-rat-494(正义链:5′-GCAUGUAUGGAGUUCGAAATT-3′,反义链:5′-UUUCGAACUCCAUACAUGCTT-3′)。
1.2.3 PTPN22-rat-siRNA转染将每管PTPN22-rat-siRNA于高速离心机(4 000 r/min, 5 min)离心, 然后将其溶溶于10 μL DEPC水中,振荡,离心3次。然后注入前囟后2 mm,旁开1 mm,深度3.5 mm的侧脑室内(每只大鼠10 μL),留针15 min。阴性对照的siRNA使用相同的方法注入。
1.2.4 神经功能评分在改良神经功能评分(mNSS)中,通过运动实验(6分),感官实验(2分),平衡木实验(6分),反射表现和不正常运动(4分)来评价各组大鼠神经功能受损情况(总分18分,分数越高,表示大鼠神经功能受损越严重)[14]。
1.2.5 脑含水量测定各组SD大鼠测量脑含水量,将大鼠麻醉后,在没有灌注的情况下,将大脑移除,去除小脑。立即用称重电子天平称量大脑标本获得湿重,然后在100 ℃烤箱中烘干24 h并再次称重以获得干重。下面的公式用于计算脑含水量:[(湿重-干重)/湿重]×100%。
1.2.6 HE和Nissl染色进行HE和Nissl染色以评估形态学变化。各组SD大鼠经心脏灌注0.9%氯化钠和3.5%多聚甲醛,断头取脑,将脑组织于4%的多聚甲醛中固定2 d,然后脱水,浸蜡,包埋和切片。根据标准方案,切片用0.1%甲酚紫(Nissl染色)或HE染色。于正置显微镜下观察形态学变化。
1.2.7 免疫荧光各组SD大鼠麻醉后,先用生理盐水灌注后,再用4%的多聚甲醛灌注固定,然后将脑组织于4%的多聚甲醛中固定2 d,之后,用30%蔗糖溶液将其脱水至沉底,并使用低温恒温器切片机在脑组织血肿周围做连续冠状切片(8 μm), 取切片置于常温,用PBS洗涤5 min/次×3次,然后用5%BSA封闭1 h, 孵一抗MPO(abcam公司,1 :40)过夜。取切片于37 ℃水浴箱中复温30 min,PBS洗涤5 min/次×3次,孵荧光二抗(Proteintech公司,1 :200)2 h, PBS洗涤5 min/次×3次(避光),暗室封片。荧光显微镜下观察,细胞核为蓝色,MPO细胞呈绿色。
1.2.8 Western blot检测麻醉各组SD大鼠,0.9%生理盐水灌注后快速取脑,取血肿周围脑组织加入含有蛋白酶抑制剂PMSF的RIPA缓冲液中冰上研磨成匀浆。将混合的裂解物放入4 ℃离心机,以12 000×g离心15 min,并吸取上清液。用BCA蛋白质分析试剂盒(Beyotime)测定蛋白质浓度。通过聚丙烯酰胺凝胶电泳分离等量的蛋白质样品(50 μg)并电转移至硝酸纤维素膜。用5%脱脂牛奶封闭2 h, PTPN22一抗(Cell Signaling, #14693S, 1 :500),NLRP3(Cell Signaling,#15101S,1 :1000),cleaved-IL-1β一抗(Affinity, AF4006,1 :500),cleaved-IL-18一抗(Proteintech, 10663-1-AP, 1 :500), cleaved-caspase-1一抗(Cell Signal, #3866S,1 :1 000), beta-actin一抗(Proteintech, 1 :1 000)孵育4 ℃过夜。然后,将用TBST洗膜10 min/次×3次,二抗(Proteintech,1 :2 000)在室温下孵育2 h,再次用TBST清洗10 min/次×3次。通过增强的化学发光系统检测蛋白质条带的特异性信号。通过ImageJ计算条带强度,目的条带的灰度值与β-actin的比值即为蛋白表达量。每个免疫印迹实验重复至少3次。
1.3 统计学分析采用GraphPad Prism7.0统计软件,数据表示为x±s,通过单向或双向方差分析(ANOVA)确定多组之间的差异,组间比较使用t检验。检验水准:α=0.05.
2 结果 2.1 PTPN22在脑出血后表达的时间窗Western blot检测大鼠脑出血后血肿周围PTPN22表达的时间窗,与sham组相比,ICH后12 h PTPN22的表达开始升高,24 h达到峰值,48 h开始降低(P < 0.05, 图 1)。因此,后续实验我们均选择ICH后24 h的大鼠脑组织标本。

|
| A:Western blot检测PTPN22在大鼠脑出血后各时间点的表达情况; B:PTPN22在大鼠脑出血后各时间点的半定量分析(n=3, x±s) a:P < 0.05,与sham组相比 图 1 PTPN22在脑出血后表达的时间窗 |
2.2 干扰PTPN22减轻了大鼠脑出血后神经功能损伤
用Western blot检测PTPN22干扰效果最好的片段为siRNA-494(P < 0.05, 图 2A、B)对各组大鼠进行神经功能评分,ICH组神经功能评分高于sham组,ICH+PTPN22siRNA组的大鼠神经功能评分明显低于ICH+NC组,且ICH组与ICH+NC组评分无明显差异,说明干扰PTPN22可以减轻大鼠脑出血后神经功能损伤(P < 0.05, 图 2C)。
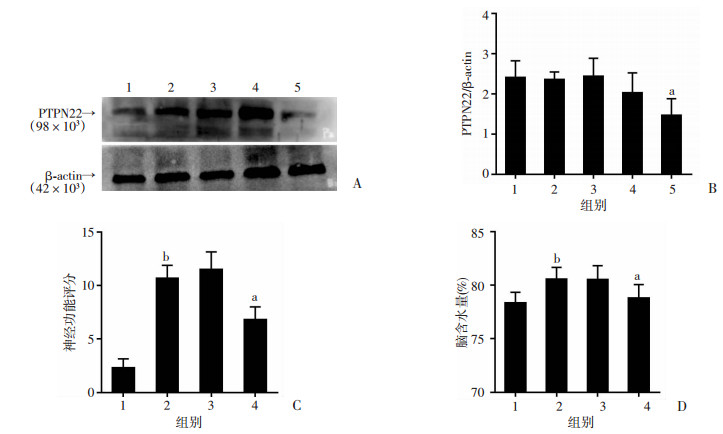
|
| a:P < 0.05,与ICH+NC组相比; b:P < 0.05, 与sham组相比 A:Western blot筛选PTPN22的有效干扰siRNA 1: ICH+NC; 2: siRNA-1883; 3: siRNA-1419; 4: siRNA-1185; 5: siRNA-494; B:PTPN22的半定量分析 1: ICH+NC; 2: siRNA-1883; 3: siRNA-1419; 4: siRNA-1185; 5: siRNA-494; C:神经功能评分 1: sham; 2: ICH; 3: ICH+NC; 4: ICH+PTPN22 siRNA; D:脑含水量测定 1: sham; 2: ICH; 3: ICH+NC; 4: ICH+PTPN22 siRNA 图 2 筛选PTPN22有效片段以及各组大鼠脑出血后神经功能评分和脑含水量 (n=6, x±s) |
2.3 干扰PTPN22降低了大鼠脑出血后脑含水量
ICH组脑含水量高于sham组,ICH+PTPN22siRNA组大鼠的脑含水量与ICH+NC组相比降低,ICH组与ICH+NC组脑含水量无明显差异(P < 0.05, 图 2D)。
2.4 干扰PTPN22减轻了大鼠脑组织损伤HE染色结果可见ICH组和ICH+NC组脑组织大量核固缩,溶解,间质稀疏水肿和弥漫性空泡化,而ICH+PTPN22siRNA组呈现出核固缩的无序排列,脑组织损伤程度与ICH+NC组相比明显减轻,但相比sham加重。Nissl染色可见sham组尼氏体完整,核呈深蓝色,ICH组和ICH+NC组脑组织尼氏体减少、解体甚至消失,而ICH+PTPN22siRNA组尼氏体又重新出现、增多,与ICH+NC组相比脑组织损伤程度明显减轻(图 3)。
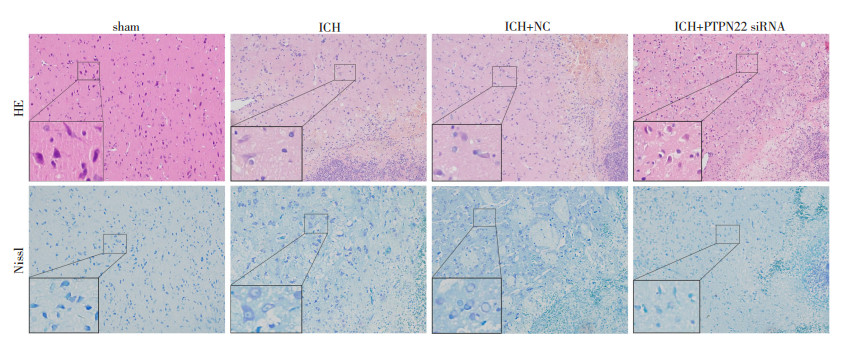
|
| 图中右下角为血肿区域,矩形方框内为组织局部区域,其放大图置于图片左下角 图 3 各组大鼠血肿周围脑组织HE和Nissl染色 (×200) |
2.5 干扰PTPN22减少了大鼠脑出血后血肿周围NLRP3、cleaved-IL-1β、cleaved-IL-18以及cleaved-caspase-1的表达
用Western blot检测大鼠脑出血后血肿周围NLRP3、cleaved-IL-1β、cleaved-IL-18以及cleaved-caspase-1的表达,ICH组NLRP3、cleaved-IL-1β、cleaved-IL-18以及cleaved-caspase-1的表达与sham组相比明显增高(P < 0.05),ICH+PTPN22siRNA组NLRP3、cleaved-IL-1β、cleaved-IL-18以及cleaved-caspase-1的表达与ICH+NC组相比明显降低(P < 0.05), 而ICH组与ICH+NC组相比无明显差异(P>0.05, 图 4)。
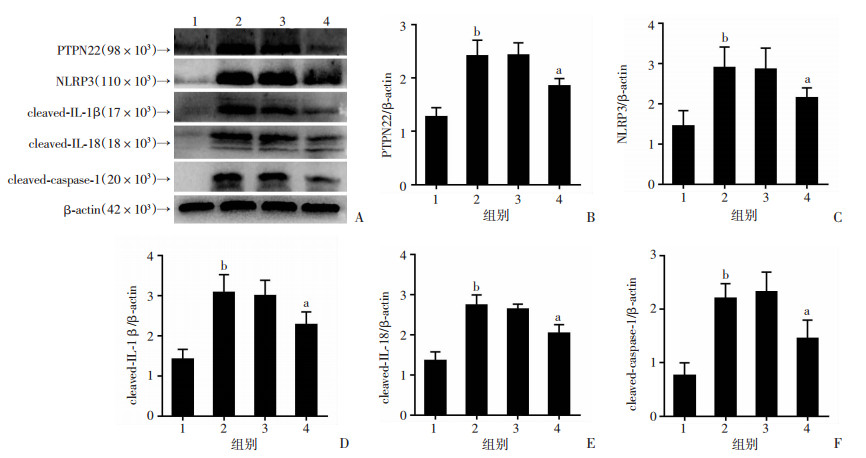
|
| 1: sham; 2: ICH; 3:ICH+NC; 4: ICH+PTPN22siRNA; a:P < 0.05,与ICH+NC组相比; b:P < 0.05, 与sham组相比; A:Western blot检测血肿周围PTPN22,NLRP3, cleaved-IL-1β, cleaved-IL-18和cleaved-caspase-1的表达情况; B-F:PTPN22,NLRP3, cleaved-IL-1β, cleaved-IL-18和cleaved-caspase-1的半定量分析 图 4 各组大鼠脑出血后血肿周围NLRP3、cleaved-IL-1β、cleaved-IL-18以及cleaved-caspase-1的表达 (n=6, x±s) |
2.6 干扰PTPN22减少了大鼠脑出血后血肿周围的MPO的数量
与sham组相比ICH组血肿周围可见大量MPO细胞,ICH+PTPN22siRNA组MPO细胞与ICH+NC组相比明显减少(图 5)。表明干扰PTPN22后减少了大鼠脑出血后血肿周围的MPO的数量。

|
| ↑:示MPO阳性细胞 图 5 各组大鼠脑出血后血肿周围MPO的表达情况 |
3 讨论
继发性损伤是脑出血病理和治疗的关键因素之一,而炎症反应在脑出血后继发性损伤中起着重要的作用[1, 15-16]。因此,脑出血后炎症反应已成为研究的热点,以及发展新型ICH治疗的目标[15]。
PTPN22(protein tyrosine phosphatase, nonreceptor type 22)是一种蛋白酪氨酸磷酸酶,参与细胞免疫反应及炎症,与多种自身免疫性疾病有关。PTPN22参与自噬激活和MDP诱导信号传导和细胞因子分泌[17-18]。研究发现PTPN22的敲除可以导致对小鼠实验性关节炎以及DSS诱导的结肠炎的敏感性增加[19]。SPALINGER等[4]的研究表明PTPN22缺乏导致结肠炎,增加NLRP3磷酸化,降低成熟的IL-1β水平。相反的,研究表明炎症性肠病(IBD)患者携带自身免疫相关PTPN22水平增加,促进NLRP3和成熟的IL-1β水平增加。目前对于NLRP3及IL-1β水平与结肠炎的关系尚存在争议,有文献[20]报道NLRP3缺乏可以减轻结肠炎,而有的文献表明NLRP3缺乏会导致上皮屏障功能不足而加重结肠炎[21]。但是,PTPN22在炎性体活化和IL-1β分泌中的功能作用是一致的。SPALINGER等提出一种新型的NLRP3炎性体激活机制,即NLRP3的Tyr861的磷酸化作用。研究发现PTPN22在促炎症损伤后与NLRP3相互作用并使其去磷酸化,从而允许NLRP3活化和IL-1β分泌。在PTPN22缺陷细胞和小鼠中,NLRP3磷酸化增强,炎性体组装减少,导致IL-1β分泌减少[5]。然而,ICH后脑组织中PTPN22的表达尚未见报道。在本实验中,我们用si-RNA小干扰片段减少PTPN22的表达,讨论了PTPN22在大鼠ICH后炎症反应中的作用,并研究其介导炎症性损伤的可能机制。我们的研究发现,与ICH+NC组相比,干扰PTPN22后可以改善大鼠神经功能评分,降低脑含水量,减轻脑组织损伤。但是干扰PTPN22减轻大鼠脑出血损伤的具体调控机制尚不明确。
NLRP3炎症体是自然免疫应答中最具特征的模式识别受体(PRR),与ICH诱导的炎症密切相关并且产生促炎因子如IL-1β,有研究表明PTPN22可以通过去磷酸化NLRP3的Tyr861激活NLRP3[5],而NLRP3的激活可以募集ASC和caspase-1形成炎症体,导致一系列炎症因子的产生[8]。我们假设干扰PTPN22可以通过抑制NLRP3炎性体的激活,从而减轻大鼠脑出血后炎症反应。在本实验中,与ICH+NC组相比,ICH+PTPN22siRNA组的NLRP3及其下游cleaved-IL-1β,cleaved-IL-18, cleaved-caspase-1的表达降低,免疫荧光检测血肿周围MPO的表达降低,说明干扰PTPN22后,减轻了脑出血后的炎症反应,这种作用是通过抑制NLRP3炎性体激活来实现的。本课题组下一步将进一步探索PTPN22是否通过去磷酸化NLRP3从而激活NLRP3炎性体,二者是否相互结合发挥调控作用,以及探究PTPN22的上游调控机制。
总之,我们的研究表明干扰PTPN22可以通过抑制NLRP3炎性体的激活,减少下游IL-1β,IL-18炎症因子的表达,从而减轻了大鼠脑出血后炎症反应,改善大鼠脑出血后神经功能障碍,减少脑水肿含量,减轻脑组织损伤。
| [1] |
KEEP R F, HUA Y, XI G H. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets[J]. Lancet Neurol, 2012, 11(8): 720-731. DOI:10.1016/S1474-4422(12)70104-7 |
| [2] |
VILLANI A C, LEMIRE M, FORTIN G, et al. Common variants in the NLRP3 region contribute to Crohn's disease susceptibility[J]. Nat Genet, 2009, 41(1): 71-76. DOI:10.1038/ng.285 |
| [3] |
LIU C M, SHI B Z, ZHOU J S. Effects of thrombin on the secondary cerebral injury ofperihematomal tissues of rats after intracerebral hemorrhage[J]. Genet Mol Res, 2014, 13(2): 4617-4626. DOI:10.4238/2014.June.18.4 |
| [4] |
SPALINGER M R, LANG S, WEBER A, et al. Loss of protein tyrosine phosphatase nonreceptor type 22 regulates interferon-γ-induced signaling in human monocytes[J]. Gastroenterology, 2013, 144(5): 978-988. DOI:10.1053/j.gastro.2013.01.048 |
| [5] |
SPALINGER M R, KASPER S, GOTTIER C, et al. NLRP3 tyrosine phosphorylation is controlled by protein tyrosine phosphatase PTPN22[J]. J Clin Invest, 2016, 126(11): 4388. DOI:10.1172/JCI90897 |
| [6] |
MOHAMED I N, ISHRAT T, FAGAN S C, et al. Role of inflammasome activation in the pathophysiology of vascular diseases of the neurovascular unit[J]. Antioxid Redox Signal, 2015, 22(13): 1188-1206. DOI:10.1089/ars.2014.6126 |
| [7] |
LIU H X, ZHAO L, YUE L, et al. Pterostilbene attenuates early brain injury following subarachnoid hemorrhage via inhibition of the NLRP3 inflammasome and Nox2-related oxidative stress[J]. Mol Neurobiol, 2017, 54(8): 5928-5940. DOI:10.1007/s12035-016-0108-8 |
| [8] |
REN H L, KONG Y, LIU Z J, et al. Selective NLRP3 (pyrin domain-containing protein 3) inflammasome inhibitor reduces brain injury after intracerebral hemorrhage[J]. Stroke, 2018, 49(1): 184-192. DOI:10.1161/STROKEAHA.117.018904 |
| [9] |
ELLIOTT E I, SUTTERWALA F S. Initiation and perpetuation of NLRP3inflammasome activation and assembly[J]. Immunol Rev, 2015, 265(1): 35-52. DOI:10.1111/imr.12286 |
| [10] |
HE Q, LI Z Y, WANG Y T, et al. Resveratrol alleviates cerebral ischemia/reperfusion injury in rats by inhibiting NLRP3 inflammasome activation through Sirt1-dependent autophagy induction[J]. Int Immunopharmacol, 2017, 50: 208-215. DOI:10.1016/j.intimp.2017.06.029 |
| [11] |
WANG Y T, MENG CC, ZHANG J Y, et al. Inhibition of GSK-3β alleviates cerebral ischemia/reperfusion injury in rats by suppressing NLRP3 inflammasome activation through autophagy[J]. Int Immunopharmacol, 2019, 68: 234-241. DOI:10.1016/j.intimp.2018.12.042 |
| [12] |
YU C, HE Q, ZHENG J, et al. Sulforaphane improves outcomes and slows cerebral ischemic/reperfusion injury via inhibition of NLRP3 inflammasome activation in rats[J]. Int Immunopharmacol, 2017, 45: 74-78. DOI:10.1016/j.intimp.2017.01.034 |
| [13] |
LI Z Y, HE Q, ZHAI X, et al. Foxo1-mediated inflammatory response after cerebral hemorrhage in rats[J]. Neurosci Lett, 2016, 629: 131-136. DOI:10.1016/j.neulet.2016.06.013 |
| [14] |
WILKINSON D A, PANDEY A S, THOMPSON B G, et al. Injury mechanisms in acute intracerebral hemorrhage[J]. Neuropharmacology, 2018, 134(Pt B): 240-248. DOI:10.1016/j.neuropharm.2017.09.033 |
| [15] |
WANG X, ARIMA H, YANG J, et al. Mannitol and outcome in intracerebral hemorrhage: propensity score and multivariable intensive blood pressure reduction in acute cerebral hemorrhage trial 2 results[J]. Stroke, 2015, 46(10): 2762-2767. DOI:10.1161/STROKEAHA.115.009357 |
| [16] |
KURAMATSU J B, HUTTNER H B, SCHWAB S. Advances in the management ofintracerebral hemorrhage[J]. J Neural Transm (Vienna), 2013, 120(Suppl 1): S35-S41. DOI:10.1007/s00702-013-1040-y |
| [17] |
SPALINGER M R, LANG S, VAVRICKA S R, et al. Protein tyrosine phosphatase non-receptor type 22 modulates NOD2-induced cytokine release and autophagy[J]. PLoS ONE, 2013, 8(8): e72384. DOI:10.1371/journal.pone.0072384 |
| [18] |
SPALINGER M R, LANG S, GOTTIER C, et al. PTPN22 regulates NLRP3-mediated IL1B secretion in an autophagy-dependent manner[J]. Autophagy, 2017, 13(9): 1590-1601. DOI:10.1080/15548627.2017.1341453 |
| [19] |
ZHANG J Y, ZAHIR N, JIANG Q H, et al. The autoimmune disease-associated PTPN22 variant promotes calpain-mediated Lyp/Pep degradation associated with lymphocyte and dendritic cell hyperresponsiveness[J]. Nat Genet, 2011, 43(9): 902-907. DOI:10.1038/ng.904 |
| [20] |
BAUER C, DUEWELL P, MAYER C, et al. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]. Gut, 2010, 59(9): 1192-1199. DOI:10.1136/gut.2009.197822 |
| [21] |
ZAKI M H, BOYD K L, VOGEL P, et al. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]. Immunity, 2010, 32(3): 379-391. DOI:10.1016/j.immuni.2010.03.003 |



