骨骼是人体的重要器官,具有支撑身体、辅助运动和保护内脏器官等功能。近年来研究发现骨骼也参与人体免疫调节,还能分泌相关内分泌分子如骨钙素等调节人体糖代谢、大脑发育等。作为骨骼重要的组成细胞,在骨骼发育和重建过程中,成骨细胞(osteoblasts)主要发挥骨形成的作用。成骨细胞经历增殖、细胞外基质成熟、矿化和凋亡4个阶段[1]或成熟后被类骨质包埋分化为骨细胞[2]。成骨细胞功能的改变既可直接影响骨代谢,还可经间接调节破骨细胞的形成和功能,影响骨形成和骨吸收间的动态平衡[3]。因此,探讨成骨细胞调控机制对维持骨稳态,寻找促进骨形成的措施有重要意义。
成纤维细胞生长因子(fibroblast growth factors,FGFs)/成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFRs)信号是调节机体发育和稳态的重要信号通路[4]。FGFs/FGFRs信号通路也是脊椎动物骨骼发育的重要调节因子,其信号的传导可以调节间充质的形成,并且在维持骨稳态方面起关键作用[5],但FGFRs对成骨细胞的调控作用尚不明确。因此,明确FGFRs在成骨细胞不同分化阶段的表达情况及作用,对研究其调节成骨细胞的机制具有重要意义。
1 材料与方法 1.1 实验材料3 d龄C3H/HeN SPF级小鼠16只,每只体质量约1.5 g,由中国人民解放军陆军特色医学中心实验动物中心提供,使用许可证号:SYXK(渝)2017-0005。成骨细胞系MC3T3-E1购自北纳生物。
1.2 主要器材与试剂倒置显微镜及拍摄系统(Leica),各型号培养皿(NEST),qRT-PCR仪(ABI Q3),恒温细胞培养箱(Thermo),超浄工作台(苏州净化设备有限公司)。
胎牛血清(BI)、Ⅰ型胶原酶(Gibco)、a-MEM培养基(HyClone)、BGJ398(Selleck)、胰酶(HyClone),ALP染色试剂盒(Sigma)、茜素红(Sigma)、Trizol(Invitrogen)、RNA反转试剂盒(TaKaRa)、定量试剂盒(TaKaRa)、β-甘油磷酸钠(Sigma)、地塞米松(Sigma)、抗坏血酸(上海生工)、BCA工作液(上海碧云天)、青霉素和链霉素(HyClone)、山羊抗小鼠RUNX2(Santa)、山羊抗兔COL 1α(Proteintech),山羊抗小鼠Actin(Sigma)。原代成骨细胞及细胞系普通培养基配制:a-MEM培养基+10%胎牛血清+1%青霉素和链霉素。成骨诱导剂培养基配制:普通培养基+50 μg/mL抗坏血酸+10 mmol/L β-磷酸甘油+10 nmoL/L地塞米松。FGFR阻断剂培养基配制:成骨诱导剂培养基+50 μmol/L BGJ398,自诱导分化第1天开始持续使用。1%茜素红染色液配制:2%乙醇+茜素红。
1.3 细胞的分离与培养 1.3.1 原代成骨细胞分离与培养根据文献[6-7]提供的方法结合本实验室实际分离成骨细胞。无菌条件下分离16只3 d龄C3H/HeN小鼠的颅骨,胰酶消化10 min后,用DPBS反复清洗颅骨3~4次,剪成1 mm×1 mm左右碎片,加入0.1%Ⅰ型胶原酶,置于培养箱中消化3~4 h,其间每隔1 h吹打均匀,将消化下来的细胞离心,收集细胞沉淀,培养基重悬后接种培养。24~48 h后观察,铺满培养皿后传代,将P2代细胞接种于3.5 cm培养皿上,换成成骨诱导培养基(加或不加FGFR阻断剂)每2~3 d换液1次,分别培养5、10、15 d后进行ALP染色、茜素红染色、ALP活性测定、成骨分化相关基因和FGFRs的表达检测。
1.3.2 细胞系培养MC3T3-E1是目前最常用于研究成骨细胞功能的细胞系,诱导后可高表达成骨细胞标志性基因。MC3T3-E1接种于3.5 cm培养皿上,待其铺满孔板后换成成骨诱导培养基(加或不加FGFR阻断剂),余下方法同1.3.1。
1.4 成骨细胞形态观察及成骨能力鉴定 1.4.1 细胞形态观察将培养皿置于倒置显微镜下观察、拍照。
1.4.2 碱性磷酸酶染色细胞培养5、10、15 d后,DPBS漂洗后用4%多聚甲醛固定10 min,按ALP染色试剂盒说明配制并加入ALP染液,在37 ℃避光孵育30 min,去离子水漂洗、晾干、扫描。
1.4.3 茜素红染色细胞培养5、10、15 d,用DPBS漂洗后,75%酒精固定15 min,DPBS再次漂洗后加入1%茜素红染液,于室温下放置15 min,余下方法同1.4.2。
1.4.4 ALP活性测定细胞处理后用DPBS漂洗后,每孔加入600 μL细胞裂解液,超声后4 ℃离心,取上清加入ALP活性测定液中,37 ℃反应30 min,加入0.1N的NaOH终止反应,每个样品测定405 nm光密度值;同时吸取上清加入生理盐水中,然后加入BCA工作液,测定D(562)光密度值。每个样本取其D(405) /D(562)的比值做统计分析。
1.4.5 qRT-PCR检测成骨分化相关基因及FGFRs表达细胞RNA采用TRIZOL法提取细胞RNA,所得RNA立即按TaKaRa反转录试剂盒说明书进行反转录反应。用qRT-PCR仪检测成骨细胞和MC3T3-E1分化相关基因Ⅰ型胶原(Collagen Iα,COL 1α)、骨桥蛋白(Osteopontin,OPN)、Runt相关转录因子2(Runt-related transcription factor 2,RUNX2),以及成纤维细胞生长因子受体FGFR1-3在细胞中的表达情况。PCR引物序列:以CYCLOPHILIN为内参,CYCLOPHILIN-F:5′-CGAGCTCTGAGCACTGGAG-3′,CYCLOPHILIN-R:5′-TGGCGTGTAAAGTCACCACC-3′,扩增后长度82 bp;COLⅠα-F:5′-AATGGTGAGACGTGGAAACCCGAG-3′,COLⅠα-R:5′-CGACTCCTACATCTTCTGAGTTTGG-3′,扩增后长度184 bp;OPN-F:5′-TGCACCCAGATCCTA-TAGCC-3′,OPN-R:5′-TGTGGTCATGGCTTTCATTG-3′,扩增后长度150 bp;RUNX2-F:5′-CCTGAACTCTGCACCAAGTC-3′,RUNX2-R:5′-GAGGTGGCAGTGTCATCATC-3′,扩增后长度234 bp;FGFR1-F:5′-TAGCTCCCTACTGGACATCC-3′,FGFR1-R:5′-GCATAGCGAACCTTGTAGCCTC-3′,扩增后长度182 bp;FGFR2-F:5′-GGGTCTCCGAGTATGAGTTGCC-3′,FGFR2-R:5′-CGCCTCCTTGGGTTTGTCTTTA-3′,扩增后长度149 bp;FGFR3-F:5′-CCACCGACAAGGAGCTAGAGG-3′,FGFR3-R:5′-CCACGCAGAGTGATGGGAAA-3′,扩增后长度113 bp。扩增条件是95 ℃ 30 s,[95 ℃ 5 s(变性),58 ℃ 20 s(退火),72 ℃ 15 s(延伸)]×39个循环,95 ℃ 30 s,58 ℃ 30 s,95 ℃ 30 s。
1.4.6 Western blot检测成骨细胞加入FGFR信号阻断剂BGJ398后成骨分化相关基因的蛋白表达各组按要求提取蛋白并检测蛋白浓度后,根据跑胶-转膜-封闭的顺序依次处理,加入β-actin、COL 1α、RUNX2抗体,一抗孵育过夜-二抗室温孵育1 h后洗涤,使用全自动荧光化学发光仪器曝光条带,记录数据。
1.5 统计学分析采用GraphPad Prism软件进行统计,数据用x±s表示,两样本进行t检验,多样本采用单因素方差分析。各实验重复3次。
2 结果 2.1 原代成骨细胞形态特征为明确原代成骨细胞是否分离成功,我们首先观察了分离的原代成骨细胞的形态。在倒置显微镜下看到分离出的原代成骨细胞P2代贴壁生长,多为多边形或梭形,部分细胞表面可见细小突起,与邻近细胞形成连接。与平行培养的MC3T3-E1比较,细胞系生长较快,多呈梭形或锥形,二者形态相似(图 1)。
|
| 图 1 倒置显微镜下细胞贴壁后形态 (×40) |
2.2 原代成骨细胞诱导后成骨细胞成骨分化增加
为了进一步验证分离的原代细胞的成骨能力,在成骨诱导5、10、15 d后对细胞进行ALP染色,发现蓝紫色明显增加,活性测定结果显示ALP活性明显增高,差异有统计学意义(P < 0.05);诱导15 d后,茜素红染色显示红色钙结节明显增加。以上结果表明分离原代成骨细胞成功分离。平行培养的MC3T3-E1细胞系进行相同处理后,表现为一致的趋势(图 2)。

|
| A:原代成骨细胞成骨诱导处理后ALP染色和茜素红染色;B:诱导处理后ALP活性读数(n=3, x±s) a:P < 0.05,与前一时相点比较;b:P < 0.01,与前一时相点比较;C:MC3T3-E1成骨诱导处理后ALP染色和茜素红染色; D: MC3T3-E1成骨诱导处理后ALP活性读数(n=3, x±s) a:P < 0.01,与前一时相点比较 图 2 小鼠成骨细胞和MC3T3-E1成骨分化能力检测 |
2.3 qRT-PCR检测成骨细胞成骨诱导处理后成骨分化相关基因表达
qRT-PCR结果显示,在成骨诱导过程中,随着时间延长,原代成骨细胞和MC3T3-E1成骨分化相关基因COL 1α、RUNX2、OPN表达升高。平行培养的MC3T3-E1细胞系进行相同处理后,表现为一致的趋势(图 3)。这些结果说明原代成骨细胞分离成功,为下一步实验提供了良好的实验材料。
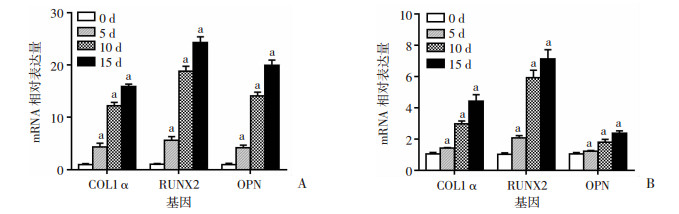
|
| A:原代成骨细胞;B:MC3T3-E1 a: P < 0.01,与前一时相点比较 图 3 qRT-PCR检测原代成骨细胞和MC3T3-E1成骨诱导处理后对成骨分化基因的表达情况 (n=3, x±s) |
2.4 qRT-PCR检测成骨细胞成骨过程中FGFRs的表达情况
利用成功分离的原代成骨细胞和MC3T3-E1细胞系,我们定量检测了FGFR1-3是否参与了成骨分化,通过qRT-PCR结果显示,添加成骨诱导剂后,随着时间增长,原代成骨细胞在成骨分化过程中FGFR1-3的表达均升高。平行培养的MC3T3-E1细胞系进行相同处理后,表现为一致的趋势(图 4)。
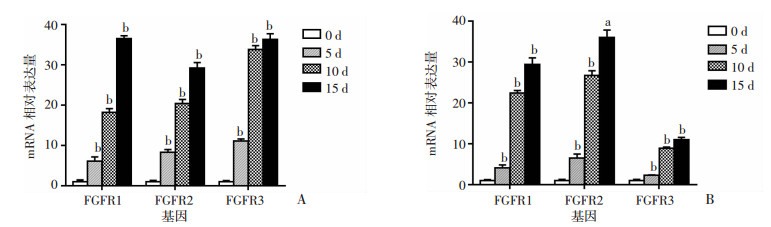
|
| A:原代成骨细胞;B:MC3T3-E1 a: P < 0.05,b: P < 0.01,与前一时相点比较 图 4 qRT-PCR检测原代成骨细胞和MC3T3-E1成骨诱导处理后FGFRs的表达情况 (n=3, x±s) |
2.5 FGFR信号阻断剂BGJ398抑制成骨细胞成骨分化
使用FGFR信号阻断剂后,原代成骨细胞通过ALP染色均发现蓝紫色变浅,茜素红染色发现红色矿化结节形成减少。提取平行培养细胞RNA,qRT-PCR结果显示,与对照组相比,加入FGFR信号阻断剂以后,成骨细胞成骨分化相关基因表达明显降低(P < 0.05),差异有统计学意义。平行培养的MC3T3-E1细胞系进行相同处理后,表现为一致的趋势(图 5)。这说明阻断FGFRs信号可抑制成骨细胞成骨分化能力。
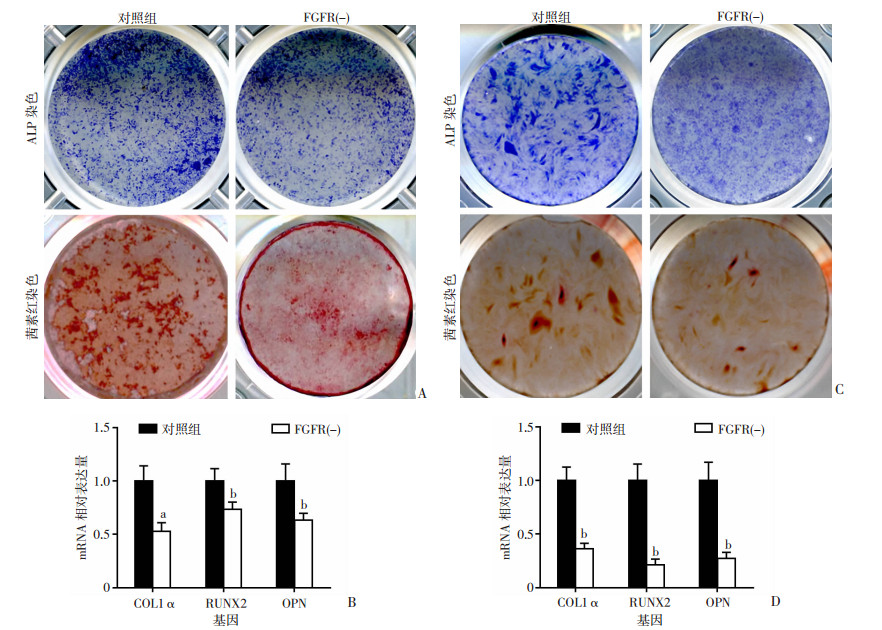
|
| A:原代成骨细胞阻断FGFR信号ALP染色和茜素红染色;B:qRT-PCR发现阻断FGFR信号后发现成骨细胞的成骨分化相关基因表达降低;C:MC3T3-E1阻断FGFR信号茜素红染色和茜素红染色;D:qRT-PCR阻断FGFR信号后发现MC3T3-E1的成骨分化相关基因表达降低。a: P < 0.05, b: P < 0.01, 与对照组比较 图 5 检测加入FGFR信号阻断剂后成骨分化相关基因的表达 (n=3, x±s) |
2.6 FGFR信号阻断剂BGJ398抑制成骨细胞和MC3T3-E1分化相关基因的蛋白表达
Western blot结果显示,与对照组相比,成骨诱导后,原代成骨细胞的成骨分化相关的COL1α、RUNX2的蛋白表达明显增加,但使用FGFR信号阻断剂后,COL1α、RUNX2的蛋白表达明显降低。这说明抑制FGFR信号发挥作用可以抑制成骨细胞成骨。平行培养的MC3T3-E1细胞系进行相同处理后,表现出一致的趋势(图 6)。
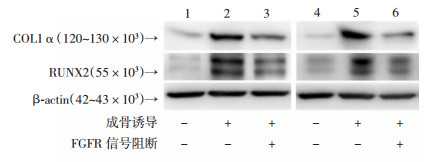
|
| 1:原代成骨细胞对照组;2:原代成骨细胞成骨诱导组;3:原代成骨细胞成骨诱导+FGFR信号阻断组;4:MC3T3-E1对照组;5:MC3T3-E1成骨诱导组;6:MC3T3-E1成骨诱导+FGFR信号阻断组 图 6 Western blot检测加入FGFR信号阻断剂后成骨分化相关基因的蛋白表达 |
3 讨论
成纤维细胞生长因子受体是一类跨膜酪氨酸激酶受体,主要有FGFR1~4四个家族成员,其中FGFR1~3由胞内区、跨膜区和胞外区三部分构成,胞内区包括近膜区2个酪氨酸激酶功能域以及自身可发生磷酸化的C末端,胞外区包括3个免疫球蛋白样功能区以及IgⅠ/Ⅱ之间的酸性区,FGFR1、2、3可在胞外区发生选择性剪切,并产生IgⅢb和IgⅢc两种亚型。IgⅢb主要表达于上皮组织,结合间充质组织中的FGF;IgⅢC主要在间充质中表达,其与间充质组织和上皮组织中的FGF都可以结合[8-9]。
在早期发育和成年期骨重建过程中,成骨细胞合成和分泌骨基质并参与骨骼矿化过程。众多分子参与成骨细胞功能调控,近年来发现FGFR信号在骨骼发育过程中发挥重要作用[10],早期的研究表明,功能增强性FGFR3基因突变可导致各种类型的软骨发育不良性侏儒,其中以ACH最为常见,临床表现为患者身材矮小、短四肢、大头颅等[11-13]。FGFR2基因突变导致以尖头、短头、面中部发育不良及指(趾)畸形为临床表现的Apert综合征[14-15]。后来发现FGFRs对成骨的调控作用与成骨细胞分化阶段有关。FGFR1和FGFR2与间充质细胞衰老有关[16]。抑制FGFR1信号促进成骨细胞增殖,但抑制基质矿化[17]。FGFR2在成骨细胞分化过程中也发挥重要作用。SIMANN等[18-19]发现在间充质细胞中FGFR2可以通过激活ERK1/2和PKCa信号促进RUNX2表达及成骨细胞分化。FGFR3敲除小鼠则出现骨量减少的症状[20]。然而,FGFR对成骨细胞的调控作用和机制仍不明确。在本研究中,我们成功分离小鼠原代成骨细胞,并检测FGFR1-3在原代成骨细胞和成骨细胞系MC3T3-E1成骨分化不同阶段的表达变化,发现FGFR1-3在成骨分化过程中显著上调,而阻断FGFR信号显著抑制成骨分化,这些结果提示FGFR信号参与了成骨细胞的分化调控。
成骨细胞是骨形成的主要细胞,在骨骼发育及稳态维持过程中发挥重要作用。FGFR信号在成骨分化过程中发挥重要调控作用,然而其在成骨分化不同阶段的调节作用以及FGFRs下游信号通路对成骨分化的影响仍然需要进一步研究。另外在成骨分化过程中,不同FGF受体之间的协调作用也值得关注。深入阐释FGFR信号在成骨分化过程中作用和机制可能为成骨异常疾病如骨质疏松等的治疗提供治疗策略。
| [1] |
DIRCKX N, MOORER M C, CLEMENS T L, et al. The role of osteoblasts in energy homeostasis[J]. Nat Rev Endocrinol, 2019, 15(11): 651-665. DOI:10.1038/s41574-019-0246-y |
| [2] |
ILAS D C, CHURCHMAN S M, BABOOLAL T, et al. The simultaneous analysis of mesenchymal stem cells and early osteocytes accumulation in osteoarthritic femoral head sclerotic bone[J]. Rheumatology (Oxford), 2019, 58(10): 1777-1783. DOI:10.1093/rheumatology/kez130 |
| [3] |
BRYLKA L J, SCHINKE T. Chemokines in physiological and pathological bone remodeling[J]. Front Immunol, 2019, 10: 2182. DOI:10.3389/fimmu.2019.02182 |
| [4] |
SARGAR K M, SINGH A K, KAO S C. Imaging of skeletal disorders caused by fibroblast growth factor receptor gene mutations[J]. Radio Graphics, 2017, 37(6): 1813-1830. DOI:10.1148/rg.2017170017 |
| [5] |
ORNITZ D M, MARIE P J. Fibroblast growth factor signaling in skeletal development and disease[J]. Genes Dev, 2015, 29(14): 1463-1486. DOI:10.1101/gad.266551.115 |
| [6] |
MAK W, SHAO X Y, DUNSTAN C R, et al. Biphasic glucocorticoid-dependent regulation of Wnt expression and its inhibitors in mature osteoblastic cells[J]. Calcif Tissue Int, 2009, 85(6): 538-545. DOI:10.1007/s00223-009-9303-1 |
| [7] |
ZHOU H, MAK W, ZHENG Y, et al. Osteoblasts directly control lineage commitment of mesenchymal progenitor cells through Wnt signaling[J]. J Biol Chem, 2008, 283(4): 1936-1945. DOI:10.1074/jbc.M702687200 |
| [8] |
TIONG K H, MAH L Y, LEONG C. Functional roles of fibroblast growth factor receptors (FGFRs) signaling in human cancers[J]. Apoptosis, 2013, 18(12): 1447-1468. DOI:10.1007/s10495-013-0886-7 |
| [9] |
LI D, YUAN Q, YU K, et al. Mg-Zn-Mn alloy extract induces the angiogenesis of human umbilical vein endothelial cells via FGF/FGFR signaling pathway[J]. Biochem Biophys Res Commun, 2019, 514(3): 618-624. DOI:10.1016/j.bbrc.2019.04.198 |
| [10] |
KANG J, CHOI Y J, SEO B Y, et al. A Selective FGFR inhibitor AZD4547 suppresses RANKL/M-CSF/OPG-dependent ostoclastogenesis and breast cancer growth in the metastatic bone microenvironment[J]. Sci Rep, 2019, 9(1): 8726. DOI:10.1038/s41598-019-45278-w |
| [11] |
BENGUR F B, EKMEKCI C G, KARAARSLAN E, et al. P.Ser348Cys mutation in FGFR3 gene leads to "Mild ACH /Severe HCH" phenotype[J]. Eur J Med Genet, 2019 DOI: 10.1016/j.ejmg.2019.04.016.
|
| [12] |
CHANG I J, SUN A, BOUCHARD M L, et al. Novel phenotype of achondroplasia due to biallelic FGFR3 pathogenic variants[J]. Am J Med Genet A, 2018, 176(7): 1675-1679. DOI:10.1002/ajmg.a.38839 |
| [13] |
KUNOVA BOSAKOVA M, VARECHA M, HAMPL M, et al. Regulation of ciliary function by fibroblast growth factor signaling identifies FGFR3-related disorders achondroplasia and thanatophoric dysplasia as ciliopathies[J]. Hum Mol Genet, 2018, 27(6): 1093-1105. DOI:10.1093/hmg/ddy031 |
| [14] |
COLL G, ABED RABBO F, JECKO V, et al. The growth of the posterior cranial Fossa in FGFR2-induced faciocraniosynostosis: A review[J]. Neurochirurgie, 2019, 65. DOI:10.1016/j.neuchi.2019.09.005 |
| [15] |
MOTCH PERRINE S M, WU M, STEPHENS N B, et al. Mandibular dysmorphology due to abnormal embryonic osteogenesis in FGFR2-related craniosynostosis mice[J]. Dis Model Mech, 2019, 12(5): dmm038513. DOI:10.1242/dmm.038513 |
| [16] |
KÄHKÖNEN T E, IVASKA K K, JIANG M, et al. Role of fibroblast growth factor receptors (FGFR) and FGFR like-1 (FGFRL1) in mesenchymal stromal cell differentiation to osteoblasts and adipocytes[J]. Mol Cell Endocrinol, 2018, 461: 194-204. DOI:10.1016/j.mce.2017.09.015 |
| [17] |
ZHANG W, XUE D T, HU D C, et al. Secreted klotho protein attenuates osteogenic differentiation of human bone marrow mesenchymal stem cells in vitro via inactivation of the FGFR1/ERK signaling pathway[J]. Growth Factors, 2015, 33(5/6): 356-365. DOI:10.3109/08977194.2015.1108313 |
| [18] |
SIMANN M, LE BLANC S, SCHNEIDER V, et al. Canonical FGFs prevent osteogenic lineage commitment and differentiation of human bone marrow stromal cells via ERK1/2 signaling[J]. J Cell Biochem, 2017, 118(2): 263-275. DOI:10.1002/jcb.25631 |
| [19] |
KOMORI T. Regulation of proliferation, differentiation and functions of osteoblasts by Runx2[J]. Int J Mol Sci, 2019, 20(7): 1694. DOI:10.3390/ijms20071694 |
| [20] |
CHEN H G, SUN X D, YIN L J, et al. PTH 1-34 ameliorates the osteopenia and delayed healing of stabilized tibia fracture in mice with achondroplasia resulting from gain-of-function mutation of FGFR3[J]. Int J Biol Sci, 2017, 13(10): 1254-1265. DOI:10.7150/ijbs.21258 |



