2. 400014 重庆,重庆市急救医疗中心神经外科
2. Department of Neurosurgery, Chongqing Emergency Medical Center, Chongqing, 400014, China
颅脑创伤患者对冲侧血肿清除后,着力侧血肿增加的现象已有相关文献报道,其发生率在8%~15%[1-3]。血肿增加导致病情进展迅猛,致死率高。因此,区分哪些是可能导致着力侧血肿增加的因素至关重要。既往研究主要集中在后枕部着力所致额颞叶对冲伤,而我们发现颞顶叶着力后,对冲侧血肿清除后着力侧血肿增加的发生率较高,而血肿增加的危险因素尚未探明。既往不同研究存在异质性,多数研究发现着力侧颅骨骨折是对冲侧血肿清除后着力侧血肿增加的危险因素[4-7],但对该现象的影响因素并无统一定论。本研究回顾性分析颅脑创伤颞顶叶为着力侧并首先行对冲侧血肿清除患者的临床资料,研究对冲侧血肿清除后颞顶叶着力侧血肿增加的发生率及危险因素,以期为临床诊断、防治措施及优化手术决策提供参考。
1 资料与方法 1.1 一般资料回顾性研究重庆市急救医疗中心神经外科于2013年1月至2017年9月收治170例颞顶叶为着力侧、行手术治疗的脑创伤患者资料。患者入院立即由神经外科医师查体并行头颅CT检查,收集临床及影像学资料。
纳入标准:(1)颅脑创伤患者颞顶叶为着力侧,头颅CT提示包括着力侧、对冲侧脑挫裂伤及硬膜外、硬膜下、脑实质血肿等。(2)神经外科医师按照指南评估,确定对冲侧为优势病灶,需首先行对冲侧的血肿清除减压手术;手术指征包括,①瞳孔扩大,考虑脑疝表现;②硬膜外血肿>30 mL,颞部>20 mL;③硬膜下血肿>30 mL、颞部>20 mL、血肿厚度>10 mm,或中线移位>5 mm;④脑挫裂伤/脑实质血肿额颞顶叶挫裂伤体积>20 mL,中线移位>5 mm,伴基底池受压。手术方式为首先对冲侧行开颅血肿清除术,标准外伤大骨瓣减压术/扩大标准外伤大骨瓣减压术。
排除标准:(1)首先行颞顶叶着力侧手术患者;(2)虽先行对冲侧手术,后因对冲侧再次出血或并发症,仍行对冲侧手术患者;(3)首先需要同时行着力侧及对冲侧双侧手术患者;(4)合并严重心肺系统疾病史患者;(5)低龄(< 12岁)、高龄(>85岁)及凝血功能异常患者。
血肿增加组定义为:术中对冲侧血肿清除后发生脑膨出;生命体征不稳定,瞳孔变化,如血压及颅内压升高、心率减慢、着力侧瞳孔扩大等表现。经头颅CT检查证实为着力侧血肿较术前增加30%[8-9],排除弥漫性脑肿胀、脑梗死等发生。对照组定义为:术中对冲侧血肿清除后,着力侧血肿无增加。
1.2 预后评估按格拉斯哥预后评分(Glasgow outcome scale, GOS)对患者进行术后随访(6个月内),1分:死亡,2分:植物生存,3分:重残,需他人照顾,4分:轻残,生活自理;5分:良好,恢复正常生活。将预后分为预后好(GOS评分4~5分),预后差(GOS评分1~3分)。
1.3 观察指标临床数据由神经外科医师采集。内容包括:患者年龄、受伤机制、入院时格拉斯哥昏迷评分(Glasgow coma scale, GCS)、入院瞳孔反应、术前休克、血糖水平、受伤至手术时间等7个指标。
CT影像数据由不知病情的影像科医师依据入院时头颅CT采集,包括:着力侧血肿类型、着力侧血肿量、着力侧骨折,中线移位,环池受压情况等5个指标。
血肿量[10]=2/3×S×h。S(CT影像最大血肿层面的血肿面积)=π×a(CT影像最大血肿层面最长径,cm)× b(CT影像最大血肿层面,垂直a的最长径,cm),h(血肿厚度)=CT影像出血层面数×每层间距(cm)。
1.4 统计学分析利用SPSS 19.0统计软件。单因素分析:对计量资料,符合正态分布采用独立样本t检验,非正态分布数据采用非参数检验,对计数资料进行χ2检验或Fisher精确检验,检验水准,α=0.05;多因素分析:将单因素分析P < 0.05的参数纳入多因素Logistic回归分析,最终多因素分析提示P < 0.05视为危险因素,计算优势比(OR)。
2 结果 2.1 一般结果按研究纳入、排除标准收集患者53例,有6例患者因影像学资料及随访资料不完整被排除,最终纳入符合条件病例共计47例。血肿增加组纳入10例,平均年龄55.6岁,其中女性2例,男性8例。对照组纳入37例,平均年龄52.5岁,其中女性8例,男性29例。
研究中共有10例颅脑创伤患者术中对冲侧血肿清除后,颞顶叶着力侧血肿增加,发生率为21.3%(10/47)。10例血肿增加患者中,8例患者通过术中头颅CT复查证实血肿增加,2例患者直接开颅探查证实。10例血肿增加患者均再次行着力侧手术治疗,7例患者行着力侧血肿清除去骨瓣减压术,3例患者行血肿清除术后环纳骨瓣。在手术过程中,在9例(90%)患者中发现了着力侧颅骨骨折,其中粉碎性骨折6例。在6例患者中,发现出血源来自于脑膜中动脉,有2例患者的出血来源不明(表 1)。
| 编号 | 性别/年龄(岁) | 血肿类型 | 出血来源 | 骨折类型 | 初始出血量/mL | GOS评分 |
| 1 | 女/79 | 硬膜外+硬膜下 | 脑膜中动脉 | 线性骨折 | 14 | 4 |
| 2 | 男/57 | 硬膜外 | 不详 | 粉碎骨折 | 24 | 1 |
| 3 | 男/29 | 硬膜外+硬膜下 | 桥静脉 | 粉碎骨折 | 12 | 1 |
| 4 | 男/58 | 硬膜外 | 脑膜中动脉 | 线性骨折 | 12 | 2 |
| 5 | 女/26 | 硬膜下 | 桥静脉 | 无 | 5 | 5 |
| 6 | 男/55 | 硬膜外 | 脑膜中动脉 | 粉碎骨折 | 13 | 4 |
| 7 | 男/48 | 硬膜下 | 不详 | 粉碎骨折 | 8 | 1 |
| 8 | 男/49 | 硬膜外+硬膜下 | 脑膜中动脉 | 线性骨折 | 14 | 3 |
| 9 | 男/42 | 硬膜外+硬膜下 | 脑膜中动脉 | 粉碎骨折 | 20 | 2 |
| 10 | 男/56 | 硬膜外 | 脑膜中动脉 | 粉碎骨折 | 12 | 5 |
2.2 危险因素分析 2.2.1 单因素分析
两组患者年龄、受伤机制、受伤至手术时间、总体病情程度(GCS,入院瞳孔反应、术前休克)等一般情况差异无统计学意义,而血糖水平差异有统计学意义(P < 0.05,表 2)。
| 组别 | n | 年龄/岁 (x±s) |
受伤机制(例) | GCS评分 (x±s) |
瞳孔反应(例) | 术前休克(例) | 血糖水平(例) | 受伤至手术时间(例) | 血肿类型(例) | 着力侧血肿量(例) | 着力侧骨折(例) | 环池情况(例) | 中线移位(例) | |||||||||||||||||||||||
| 摔伤/坠落 | 车祸伤 | 撞击/其他 | 正常 | 迟钝 | 消失 | 有 | 无 | 正常 | 血糖高 | ≤24 h | >24 h | 硬膜外血肿 | 硬膜下血肿 | 硬膜外+下血肿 | ≤10 mL | >10~20 mL | >20 mL | 无 | 有 | 正常 | 受压 | 消失 | ≤10 mm | >10 mm | ||||||||||||
| 血肿增加组 | 10 | 55.6±14.7 | 7 | 3 | 0 | 8.1±4.1 | 4 | 4 | 2 | 3 | 7 | 3 | 7 | 7 | 3 | 4 | 2 | 4 | 2 | 6 | 2 | 1 | 9 | 3 | 4 | 3 | 6 | 4 | ||||||||
| 对照组 | 37 | 52.5±18.9 | 23 | 11 | 3 | 8.3±3.1 | 12 | 14 | 11 | 8 | 29 | 25 | 12 | 26 | 11 | 19 | 11 | 7 | 26 | 7 | 4 | 20 | 17 | 13 | 19 | 5 | 9 | 28 | ||||||||
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | 0.032 | >0.05 | >0.05 | 0.019 | 0.013 | >0.05 | 0.032 | ||||||||||||||||||||||||
CT影像数据显示血肿增加与着力侧血肿类型及环池受压情况无关,而与着力侧血肿量、着力侧骨折,中线移位有关(表 2)。
2.2.2 Logistic回归分析将单因素分析筛选出的4个参数(血糖水平、着力侧血肿量、着力侧骨折、中线移位)纳入Logistic回归分析筛选危险因素。结果表明:颅脑创伤术中对冲侧血肿清除后,颞顶叶着力侧血肿增加关系密切的有着力侧骨折(OR为10.6,P=0.039)和着力侧血肿量(OR为3.0,P=0.045,表 3)。
| 因素 | SE | Wals | P | OR | 95%CI |
| 着力侧骨折 | 1.15 | 4.25 | 0.039 | 10.58 | 1.12~100.79 |
| 着力侧血肿量 | 0.55 | 4.00 | 0.045 | 3.00 | 1.02~8.82 |
2.2.3 血肿增加患者典型病例
分析血肿增加组病例3:男性,29岁,因车祸伤致颅脑创伤入院。入院头颅CT提示右侧颞顶部着力侧硬膜下血肿,合并脑挫裂伤,中线移位并不明显,环池稍受压(图 1A、B),伴颞顶部粉碎性骨折(图 1C)。急诊对冲侧行血肿清除+去骨瓣减压后,术中CT证实着力侧硬膜下/外血肿较前增加(图 1D)。
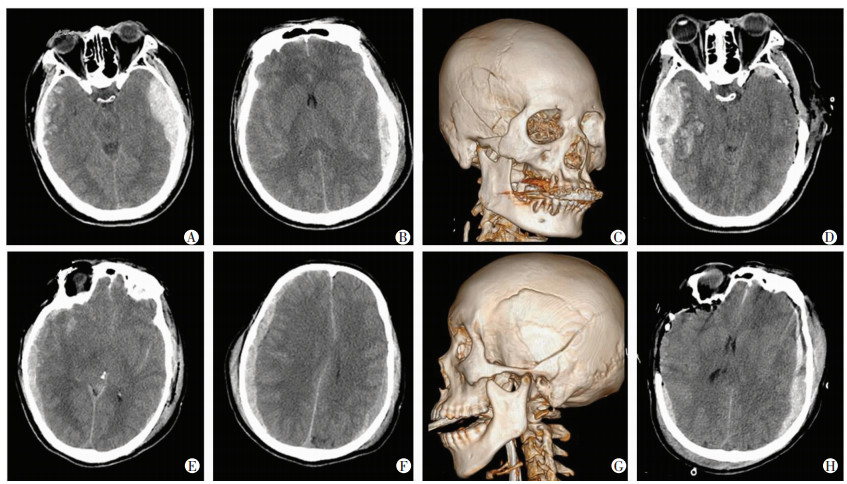
|
| A~D:病例3;E~H:病例7;A、B、E、F:术前CT表现;C、G:术前头颅三维重建影像;D、H:对冲侧血肿清除后,原发侧血肿增加CT表现 图 1 颅脑创伤患者术中对冲侧血肿清除后颞顶叶着力侧血肿增加患者典型影像学特征 |
血肿增加组病例7:男性,48岁,因高坠伤致颅脑创伤入院。入院头颅CT提示左侧颞顶部着力侧硬膜下血肿,合并蛛网膜下腔出血,中线移位不明显(图 1E、F),伴颞顶部粉碎性骨折(图 1G)。手术行对冲侧血肿清除+去骨瓣减压术,术中行CT发现着力侧硬膜下血肿较前增加(图 1H)。
2.3 两组患者预后情况随访患者术后6个月内预后情况(表 4)。血肿增加组患者虽行2次手术,在术后6个月内总体预后情况与对照组比较差异无统计学意义。术后6个月,预后好的患者(GOS评分4~5分)共有20例(42.6%),死亡15例(31.9%)。血肿增加组4例(40%)患者获得良好预后,3例(30%)死亡,GOS评分(2.8分)和对照组(3.1分)比较差异无统计学意义。
| 组别 | n | 住院期间 | 术后3个月 | 术后6个月 | |||||
| 预后好 | 预后差 | 预后好 | 预后差 | 预后好 | 预后差 | ||||
| 血肿增加组 | 10 | 3 | 7 | 4 | 6 | 4 | 6 | ||
| 对照组 | 37 | 12 | 25 | 15 | 22 | 16 | 21 | ||
3 讨论
本研究采用病例对照分析,寻找颅脑创伤患者对冲侧血肿清除后,术中颞顶叶着力侧血肿增加的危险因素。10例血肿增加患者平均年龄55.6岁,GCS平均评分8.1分,6例(60%)出现瞳孔反射异常,7例(70%)出现血糖增高(5例患者承认既往糖尿病史),影像学资料显示大部分患者着力侧血肿量超过10 mL,中线移位不明显,硬膜外血肿为主,并且9例(90%)出现着力侧颅骨骨折。血肿增加有较高致残、致死率,经过术后半年随访,发现血肿增加病例中3例(30%)死亡。有研究报道约30%~50%患者预后良好率(GOS评分4~5)[9],本研究发现4例(40%)预后良好,死亡率及预后良好率与对照组比较差异均无统计学意义。
纳入研究的患者均以对冲侧血肿为优势病灶,首先行对冲侧血肿清除减压术,因为考虑到对冲侧血肿减压后“填塞效应”消失,导致脑组织压力、脑顺应性、脑脊液及血流循环、脑血管自身调节能力的改变,这本身可能是导致着力侧血肿增加的危险因素[5-7, 11]。本研究发现:在导致血肿增加危险因素中,着力侧骨折及着力侧血肿量是关键因素,其风险率分别为10.58、3.00倍,而单因素分析还表明:无明显中线偏移、血糖水平高也是血肿增加的预测条件。
同文献[1, 5, 7, 12]报道一致,本研究无论单因素分析及Logistic回归分析都提示颞顶叶骨折是血肿增加的危险因素。原因可能是颞顶叶丰富的硬膜血管在骨折尤其粉碎性骨折发生后易撕裂、破损,并且颞部骨板薄弱,板障静脉血供丰富,在对冲侧血肿清除减压后容易引起着力侧血肿增加,特别是硬膜外血肿,与本研究约80%为着力侧硬膜外血肿增加符合。文献报道着力侧不同部位的血肿可能是导致血肿增加的预测因素[13],但本研究发现颞顶叶着力侧血肿不同类型在血肿增加有差异,但无统计学意义。
针对着力侧血肿量可能是血肿增加的预测因素[14-15],本研究量化计算颞顶叶着力侧血肿,并进行分类统计分析,回归分析发现:着力侧血肿量超过10 mL是预测因素。估计10 mL是最恰当的体积可抵抗对冲侧血肿压力,所以并不引起中线明显移位,因此不明显的中线偏移(≤10 mm)也是单因素分析显示的预测血肿量增加的因素之一。因为研究对象及研究时间不同,就中线移位,既往文献也有不同观点,KIM等[16]认为明显的中线移位是早期硬膜下血肿及积液增加的危险因素,而HUANG等[17]认为:中线移位并不能预测减压后早期硬膜外血肿增加的概率。
既往研究揭示:在自发性脑出血患者中,高血糖是出血增加的危险因素[18-19],但针对颅脑创伤后血糖与血肿增加的关系鲜有报道。本研究发现血糖可能是血肿增加的预测因素,考虑到研究对象年龄平均在55.6岁,血糖高的患者既往多有2型糖尿病病史,但并未正规监测、控制。颞顶叶包含丰富硬膜及皮层血管,长期血糖增高导致老年患者血管慢性炎症、动脉粥样硬化、血管脆性增加,所以更容易发生血管破裂导致血肿增加[20]。但是将纳入Logistic回归分析并未发现差异[21],这种情况可能与样本量少及分类方式有关。
众所周知,凝血功能异常是导致颅内出血增加的危险因素[22-23],因此,本研究排除了长期口服抗凝、抗血小板药物导致凝血功能异常患者。分析受伤至手术时间发现:早期的手术(伤后24 h)并非血肿增加的预测因素[24]。颅脑创伤发生后早期血肿增加可能性大[25],我们的治疗策略一般是伤后6~8 h估计血肿稳定再进行手术治疗,前期可行颅内压监测及控制颅压治疗,因此界定手术时间为伤后24 h,进行比较发现两组间差异无统计学意义。
本研究发现血肿增加患者术后6个月的预后与对照组差异无统计学意义,提示及时发现血肿增加并采取正确处理方式的重要性。同文献[5-6]报道,我们提倡多模态神经监测,头颅CT的检查也是必不可少的。在术中发生脑膨出时,建议立即行头颅CT检查,确诊着力侧血肿增加,排除脑梗死、弥漫脑肿胀等情况[4]。为了缩短检查时间,MEGURO等[26]报道如果着力侧颅骨骨折,可表面试探性穿刺,判断潜在的硬膜外血肿增加的可能性;也有研究报道术中利用超声检查来判断血肿有无增加的方法[17, 27]。虽然上述做法理论上能缩短检查时间,但无明显证据证明能明确改善患者预后。我们的做法是:患者未出现脑疝情况,生命体征平稳的情况下,急诊术中复查头颅CT,明确是否对冲侧血肿增加,并评估进一步手术方式。如情况紧急(颅内高压、脑疝),也可以在无头颅CT复查下直接行着力侧开颅探查治疗。现在推荐在术中安置颅内压监测装置,颅内压的变化也可为我们判断颅内病情变化提供有价值的信息[28]。
本研究证实颅脑创伤对冲侧血肿清除后,术中颞顶叶着力侧血肿增加发生率为21.3%,稍高于颅脑总体对冲伤后着力侧血肿增加概率。运用Logistic回归分析发现:颅脑创伤着力侧骨折及着力侧血肿量是导致对冲侧血肿清除后术中颞顶叶着力侧血肿增加的危险因素,血肿增加后及时发现并合理处理,并不影响最终预后。本研究结果提示:对有上述危险因素致血肿增加可能性的患者,临床需重视并做好预判,同时注意此类患者后期康复情况,尽可能改善其功能预后。
综上所述,颅脑对冲伤最常见于着力侧为枕叶或后颅窝,对冲至额颞叶损伤,而颞顶叶对冲伤后以对冲侧为优势病灶需首先行血肿清除的发病率较低。随着社会上安全教育的加强,公民提高了安全意识,颅脑创伤总体发病率较以往有下降趋势。结合先进的控制颅压理念,颅脑创伤需行手术治疗患者数量也是有所减少。由于本研究样本量较少,得出的结论有待今后大样本、多中心研究予以验证。
| [1] |
SHIBAHASHI K, HODA H, TAKASU Y. Contralateral subdural hematoma development following unilateral acute subdural hematoma evacuation[J]. Br J Neurosurg, 2017, 31(5): 619-623. DOI:10.1080/02688697.2016.1211251 |
| [2] |
OH M J, JEONG J H, SHIN D S, et al. Postoperative contralateral hematoma in patient with acute traumatic brain injury[J]. Korean J Neurotrauma, 2017, 13(1): 24-28. DOI:10.13004/kjnt.2017.13.1.24 |
| [3] |
SU T M, LAN C M, LEE T H, et al. Risk factors for the development of contralateral epidural hematoma following decompressive craniectomy in patients with calvarial skull fracture contralateral to the craniectomy site[J]. World Neurosurg, 2016, 89: 223-229. DOI:10.1016/j.wneu.2016.02.020 |
| [4] |
FLORDELÍS LASIERRA J L, GARCÍA FUENTES C, TORAL VÁZQUEZ D, et al. Contralateral extraaxial hematomas after urgent neurosurgery of a mass lesion in patients with traumatic brain injury[J]. Eur J Trauma Emerg Surg, 2013, 39(3): 277-283. DOI:10.1007/s00068-013-0268-4 |
| [5] |
SU T M, LEE T H, CHEN W F, et al. Contralateral acute epidural hematoma after decompressive surgery of acute subdural hematoma: clinical features and outcome[J]. J Trauma, 2008, 65(6): 1298-1302. DOI:10.1097/TA.0b013e31815885d9 |
| [6] |
MATSUNO A, KATAYAMA H, WADA H, et al. Significance of consecutive bilateral surgeries for patients with acute subdural hematoma who develop contralateral acute epi-or subdural hematoma[J]. Surg Neurol, 2003, 60(1): 23-30. DOI:10.1016/s0090-3019(03)00023-5 |
| [7] |
MOHINDRA S, MUKHERJEE K K, GUPTA R, et al. Decompressive surgery for acute subdural haematoma leading to contralateral extradural haematoma: a report of two cases and review of literature[J]. Br J Neurosurg, 2005, 19(6): 490-494. DOI:10.1080/02688690500495216 |
| [8] |
CEPEDA S, GÓMEZ P A, CASTAÑO-LEON A M, et al. Traumatic intracerebral hemorrhage: risk factors associated with progression[J]. J Neurotrauma, 2015, 32(16): 1246-1253. DOI:10.1089/neu.2014.3808 |
| [9] |
CHEN H, GUO Y, CHEN S W, et al. Progressive epidural hematoma in patients with head trauma: incidence, outcome, and risk factors[J]. Emerg Med Int, 2012, 2012: 134905. DOI:10.1155/2012/134905 |
| [10] |
ZHAO K J, ZHANG R Y, SUN Q F, et al. Comparisons of 2/3Sh estimation technique to computer-assisted planimetric analysis in epidural, subdural and intracerebral hematomas[J]. Neurol Res, 2010, 32(9): 910-917. DOI:10.1179/016164110X12681290831441 |
| [11] |
COHEN J E, RAJZ G, ITSHAYEK E, et al. Bilateral acute epidural hematoma after evacuation of acute subdural hematoma: brain shift and the dynamics of extraaxial collections[J]. Neurol Res, 2004, 26(7): 763-766. DOI:10.1179/016164104225015930 |
| [12] |
TALBOTT J F, GEAN A, YUH E L, et al. Calvarial fracture patterns on CT imaging predict risk of a delayed epidural hematoma following decompressive craniectomy for traumatic brain injury[J]. AJNR Am J Neuroradiol, 2014, 35(10): 1930-1935. DOI:10.3174/ajnr.A4001 |
| [13] |
SAWAUCHI S, TAYA K, HASHIMOTO T, et al. Progressive brain injury[J]. No Shinkei Geka, 2003, 31(7): 749-755. |
| [14] |
CHANG E F, MEEKER M, HOLLAND M C. Acute traumatic intraparenchymal hemorrhage: risk factors for progression in the early post-injury period[J]. Neurosurgery, 2007, 61(1 Suppl): 222-230. DOI:10.1227/01.neu.0000279217.45881.69 |
| [15] |
OERTEL M, KELLY D F, MCARTHUR D, et al. Progressive hemorrhage after head trauma: predictors and consequences of the evolving injury[J]. J Neurosurg, 2002, 96(1): 109-116. DOI:10.3171/jns.2002.96.1.0109 |
| [16] |
KIM B J, PARK K J, PARK D H, et al. Risk factors of delayed surgical evacuation for initially nonoperative acute subdural hematomas following mild head injury[J]. Acta Neurochir (Wien), 2014, 156(8): 1605-1613. DOI:10.1007/s00701-014-2151-4 |
| [17] |
HUANG A P, CHEN Y C, HU C K, et al. Intraoperative sonography for detection of contralateral acute epidural or subdural hematoma after decompressive surgery[J]. J Trauma, 2011, 70(6): 1578-1579; author reply 1579. DOI: 10.1097/TA.0b013e3182178c71.
|
| [18] |
SUN W P, PAN W Q, KRANZ P G, et al. Predictors of late neurological deterioration after spontaneous intracerebral hemorrhage[J]. Neurocrit Care, 2013, 19(3): 299-305. DOI:10.1007/s12028-013-9894-2 |
| [19] |
QURESHI A I, PALESCH Y Y, MARTIN R, et al. Association of serum glucose concentrations during acute hospitalization with hematoma expansion, perihematomal edema, and three month outcome among patients with intracerebral hemorrhage[J]. Neurocrit Care, 2011, 15(3): 428-435. DOI:10.1007/s12028-011-9541-8 |
| [20] |
WASSINK A M, VAN DER GRAAF Y, SOEDAMAH-MUTHU S S, et al. Metabolic syndrome and incidence of type 2 diabetes in patients with manifest vascular disease[J]. Diab Vasc Dis Res, 2008, 5(2): 114-122. DOI:10.3132/dvdr.2008.019 |
| [21] |
WASSINK A M, VAN DER GRAAF Y, SOEDAMAH-MUTHU S S, et al. Metabolic syndrome and incidence of type 2 diabetes in patients with manifest vascular disease[J]. Diab Vasc Dis Res, 2008, 5(2): 114-122. DOI:10.3132/dvdr.2008.019 |
| [22] |
WAN X Y, FAN T, WANG S, et al. Progressive hemorrhagic injury in patients with traumatic intracerebral hemorrhage: characteristics, risk factors and impact on management[J]. Acta Neurochir (Wien), 2017, 159(2): 227-235. DOI:10.1007/s00701-016-3043-6 |
| [23] |
FOLKERSON L E, SLOAN D, COTTON B A, et al. Predicting progressive hemorrhagic injury from isolated traumatic brain injury and coagulation[J]. Surgery, 2015, 158(3): 655-661. DOI:10.1016/j.surg.2015.02.029 |
| [24] |
HUANG Y H, LEE T C, LEE T H, et al. Remote epidural hemorrhage after unilateral decompressive hemicraniectomy in brain-injured patients[J]. J Neurotrauma, 2013, 30(2): 96-101. DOI:10.1089/neu.2012.2563 |
| [25] |
IACCARINO C, SCHIAVI P, PICETTI E, et al. Patients with brain contusions: predictors of outcome and relationship between radiological and clinical evolution[J]. J Neurosurg, 2014, 120(4): 908-918. DOI:10.3171/2013.12.JNS131090 |
| [26] |
MEGURO K, KOBAYASHI E, MAKI Y. Acute brain swelling during evacuation of subdural hematoma caused by delayed contralateral extradural hematoma: report of two cases[J]. Neurosurgery, 1987, 20(2): 326-328. DOI:10.1227/00006123-198702000-00023 |
| [27] |
KIM P S, YU S H, LEE J H, et al. Intraoperative trans-cranial sonography for detection of contralateral hematoma volume change in patients with traumatic brain injury[J]. Korean J Neurotrauma, 2017, 13(2): 137-140. DOI:10.13004/kjnt.2017.13.2.137 |
| [28] |
MEGUINS L C, SAMPAIO G B, ABIB E C, et al. Contralateral extradural hematoma following decompressive craniectomy for acute subdural hematoma (the value of intracranial pressure monitoring): a case report[J]. J Med Case Rep, 2014, 8: 153. DOI:10.1186/1752-1947-8-153 |



