前列腺癌是老年男性中常见的恶性肿瘤之一。2012年,全球前列腺癌新发病例已达110万例,因病死亡人数达到30.7万[1]。我国前列腺癌的发病率和病死率虽低于发达国家[2-3],然而近年来随着人口不断老龄化及生活方式日益西方化等诸多因素的影响,我国前列腺癌的发病率和病死率呈现不断增高的趋势[4]。前列腺癌前期病程较为隐匿,晚期患者多发生转移,一旦发生转移,患者预后较差,生存期明显缩短[5]。研究表明,自主神经系统参与了前列腺癌细胞的生长及转移的调控[6]。我们前期的研究发现,副交感神经M1受体参与前列腺癌的迁移、侵袭。此外,有研究报道交感神经在肿瘤的早期生长中发挥重要作用[7],然而具体的分子机制目前仍不清楚。交感神经释放神经递质作用于细胞表面的肾上腺素受体通过信号传导发挥作用[8]。肾上腺素受体分为ɑ受体和β受体。在前列腺癌细胞系PC-3和LNCaP中,β2AR是主要的表达亚型[6, 9]。报道显示β2AR及其传导的信号通路可能与前列腺癌的增殖、神经内分泌分化、血管形成等有关[8, 10-11]。在临床研究中发现β2AR抑制剂可能降低前列腺癌的因病死亡率,改善患者预后[12]。然而关于β2AR对前列腺癌发展及具体机制目前仍不清楚。
肿瘤转移是癌症进展的重要标志,是包含多因素多步骤的复杂过程。在肿瘤转移过程中,EMT通过细胞表型的变化使肿瘤的粘附能力下降,迁移扩散能力增强,便于肿瘤浸润和转移[13]。此外肿瘤的转移与细胞的生存状态也密切相关。在肿瘤转移过程中,细胞的凋亡可以使异位的癌细胞死亡从而阻止肿瘤的播散转移,因此细胞凋亡在肿瘤转移中发挥重要的抑制作用[14]。本研究通过观察β2AR对前列腺癌细胞迁移侵袭及凋亡的影响,探讨其对前列腺癌转移的作用,以期为神经受体对前列腺癌的发展及分子靶向治疗提供新的线索。
1 材料与方法 1.1 材料 1.1.1 组织标本及细胞取2012年1月至2015年1月重庆医科大学附属第一医院病理科29例前列腺癌组织,患者年龄59~77岁,平均67岁。根据Gleason评分系统标准,Gleason评分 < 7分的9例,Gleason评分≥7分的20例。本实验经重庆医科大学伦理委员会批准(2019年5月)。人前列腺癌细胞系PC-3和LNCaP细胞于本课题组传代冻存。
1.1.2 数据下载通过UALCAN数据库(http://ualcan.path.uab.edu/index.html)下载前列腺癌患者分析基因的表达量及相关的临床信息,经整理后用于进一步分析。在不同Gleason评分癌组织与癌旁组织表达分析中,共获取544例样本的基因表达量,其中52例癌旁组织,492例癌组织。癌组织按Gleason评分,评分为6的45例,评分为7的247例,评分为8的64例,评分为9的136例。在患者年龄分析中,获取495例患者样本的基因表达量,其中41~60岁的222例,61~80岁273例。
1.1.3 主要试剂DMEM/F12培养基购自Gibco公司,胎牛血清购自Biological Industries公司;SP-0023免疫组化试剂盒和DAB显色试剂盒购自中杉金桥公司;二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;异丙肾上腺素(isoprenaline hydrochloride,ISO)、普萘洛尔(propranolol hydrochloride, PRO)购自MCE公司;Transwell小室购自美国Corning公司;兔抗人β2AR、E-cadherin(E-cad)、N-cadherin(N-cad)和Vimentin(Vim)IgG单克隆抗体购自Abcam公司,Caspase3、cleaved-Caspase 3和PARP抗体购自CST公司;Annexin V-FITC细胞凋亡检测试剂盒购自Invitrogen公司;PrimeScriptTM RT reagent kit购自TaKaRa公司;RT-PCR引物购自上海生工公司;β2AR RNAi以及慢病毒包装由上海吉凯基因化学技术公司完成。
1.2 方法 1.2.1 细胞培养及分组人前列腺癌细胞系PC-3和LNCaP细胞使用含10%胎牛血清的DMEM/F12培养基于37 ℃,5%CO2,饱和湿度的细胞孵箱中进行培养。取生长良好的对数期细胞进行后续实验,实验分为对照组(DMSO)、ISO处理组(2 μmol/L,处理24 h或1、12、24 h)和PRO处理组(1 μmol/L,处理24 h)。
1.2.2 慢病毒稳转株构建取生长良好的PC-3和LNCaP细胞(1×105/孔)分别接种于6孔板中,分为NC组(转染阴性对照)和sh-β2AR组(转染β2AR-RNAi),每组设置3个复孔。待细胞生长到40%~50%时,按照慢病毒转染试剂盒说明步骤对各组细胞进行转染,转染12 h后更换新鲜的完全培养基继续培养。72 h后进行传代培养,再用嘌呤霉素(5 μg/mL)进行稳转细胞株的筛选。
1.2.3 免疫组织化学染色采用SP免疫组化试剂盒检测β2AR的表达情况。光学显微镜下观察拍照,使用Image-Pro-Plus软件进行IOD值的分析。使用GraphPad Prism7软件进行统计分析。
1.2.4 Western blot检测采用RIPA裂解法提取各细胞中的总蛋白,并用BCA法检测蛋白浓度。配置所需浓度的SDS-PAGE凝胶进行电泳及转膜。于5%脱脂牛奶中室温封闭2 h。加入稀释的一抗,1 :1 000的E-cad、N-cad、Vim、Caspase3、cleaved-Caspase 3、PARP、β2AR抗体,4 ℃孵育过夜。次日1 :2 000山羊抗兔二抗或1 :5 000山羊抗鼠二抗室温孵育1.5 h。TBST洗膜3次,每次5 min。加ECL发光液在ChemiDoc成像系统中进行显影。Image J软件进行灰度值分析, 以GAPDH为内参, 目的条带灰度值/内参灰度值表示结果。
1.2.5 实时荧光定量PCRβ2AR上游引物5′-GTCTTGAGGGCTTTGTGCTC-3′,下游引物5′-GGCAG-CTCCAGAAGATTGAC-3′,产物长度139 bp;GAPDH上游引物5′-ACGGATTTGGTCGTATTGGG-3′, 下游引物5′-CGCTCCTGGAAGATGGTGAT-3′,产物长度214 bp。用RNA提取试剂盒获取总RNA,并进行浓度的测定。使用逆转录试剂盒将RNA逆转录为cDNA。将SYBR(5 μL)、上下游引物(各0.3 μL)、DEPC水(3.4 μL)和cDNA(1 μL)混匀加样。上机检测:95 ℃ 5 min,39个循环(95 ℃ 10 s,58 ℃ 30 s, 72 ℃ 20 s)。结果用Bio-Rad CFX Manager软件进行分析,并用Prism7 GraphPad软件统计。
1.2.6 Transwell细胞迁移侵袭实验迁移实验:将对数生长期的细胞用无血清的培养基重悬后以100 μL、3×104/孔接种在Transwell小室的上室中,下室加600 μL含20%胎牛血清的培养基,置于培养箱中培养24 h,取出小室,PBS洗涤2次,用10%的多聚甲醛固定细胞15 min,使用结晶紫染色15 min。用棉签轻轻擦拭掉上室内残余的细胞,PBS洗涤3次,晾干。显微镜下观察并随机选取5个视野采图计数。侵袭实验:将预冷的matrigel :DMEM/F12培养基=1 :3比例稀释后混匀制成matrigel稀释液,取50 μL稀释液滴于Transwell小室的膜上,37 ℃培养箱静置30 min待其凝固。接种以无血清培养基重悬的5×104/孔的细胞悬液100 μL于上室,下室加入600 μL含20%胎牛血清的培养基,常规培养24 h,取出小室,PBS洗涤2次,用10%的多聚甲醛固定细胞15 min,使用结晶紫染色15 min。用棉签轻轻擦拭掉上室中的胶质及液体,PBS洗涤3次,晾干。显微镜下观察并随机选取5个视野采图计数。
1.2.7 流式细胞术检测细胞凋亡收集对数生长期的各组细胞,用PBS洗涤2次重悬后将细胞转移至流式管中,4 ℃、1 000 r/min离心5 min,弃上清。每管加入400 μL Binding buffer重悬细胞后,加入5 μL的Annexin V-FITC,避光室温孵育15 min,加入5 μL的DAPI混匀后避光孵育5 min。上流式细胞仪检测。
1.2.8 透射电镜凋亡检测将对数生长期的各组细胞用细胞刮从培养皿中轻轻刮下来,使细胞呈条状悬浮在培养液中,置于离心管中离心,弃上清,用吸管沿管壁缓慢加入2%的戊二醛,4 ℃固定1.5 h后送电镜室检测。
1.3 统计学分析计量资料以x±s表示,采用GraphPad Prism 7.0统计软件。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 β2AR在前列腺癌组织中的表达增高UALCAN数据库检索结果显示,与癌旁组织相比,不同阶段(Gleason评分为6~9分)的前列腺癌患者组织中β2AR的基因表达水平均显著增高(P < 0.05)。与41~60岁患者相比,61~80岁患者癌组织中β2AR基因表达水平差异无统计学意义(P=0.401)。
2.2 β2AR在高风险的前列腺癌组织中表达增高对29例前列腺癌患者组织标本进行免疫组化染色实验,结果显示,与Gleason评分 < 7的低风险患者前列腺癌组织相比,Gleason评分≥7的高风险患者癌组织中β2AR表达更高(P < 0.01,图 1)。

|
| A:前列腺癌组织中β2AR的表达;B:免疫组化结果的定量分析a: P < 0.01,与Gleason评分 < 7分比较 图 1 免疫组化染色检测29例前列腺癌组织中β2AR的表达(S-P) |
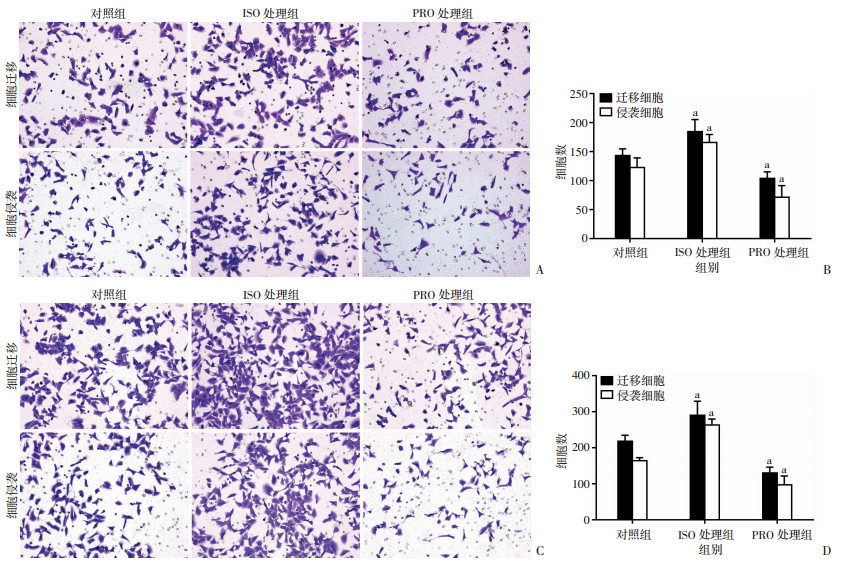
2.3 β2AR激动剂促进前列腺癌细胞的迁移和侵袭,抑制剂则减弱细胞迁移和侵袭
Transwell实验检测前列腺癌细胞PC-3和LNCaP在各处理组作用下的迁移和侵袭能力(图 2),结果显示,与对照组比较,β2AR激动剂ISO处理组迁移和侵袭细胞数明显增加(P < 0.01),而β2AR抑制剂PRO处理组迁移和侵袭细胞数显著下降(P < 0.01)。
|
| A、B:PC-3细胞各组迁移和侵袭能力(×400)及定量分析;C、D:LNCaP细胞各组迁移和侵袭能力(×400)及定量分析;a: P < 0.01,与对照组比较 图 2 β2AR激动剂和抑制剂对PC-3和LNCaP细胞迁移和侵袭的影响 |
2.4 下调β2AR表达减弱前列腺癌细胞的迁移和侵袭
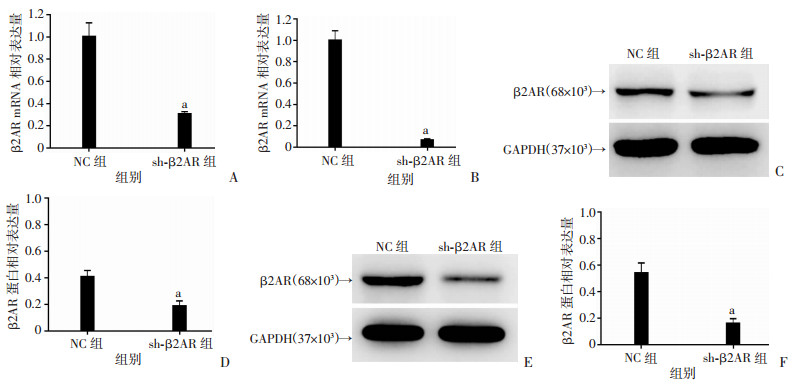
用β2AR RNAi慢病毒感染PC-3和LNCaP细胞,构建了β2AR敲低的稳转株。RT-PCR检测结果显示,与NC组比较,sh-β2AR组的β2AR mRNA水平显著下降(P < 0.01,图 3A、B),Western blot检测发现其蛋白水平较NC组也明显下调(P < 0.01,图 3C~F)。说明癌细胞β2AR基因已被成功敲低。
|
| A:PC-3稳转株细胞RT-PCR检测结果;B:LNCaP稳转株细胞RT-PCR检测结果;C、D:PC-3稳转株细胞Western blot检测结果及蛋白半定量分析;E、F:LNCaP稳转株细胞Western blot检测结果及蛋白半定量分析;a: P < 0.01,与NC组比较 图 3 NC组与sh-β2AR组细胞中β2AR mRNA及蛋白表达 |
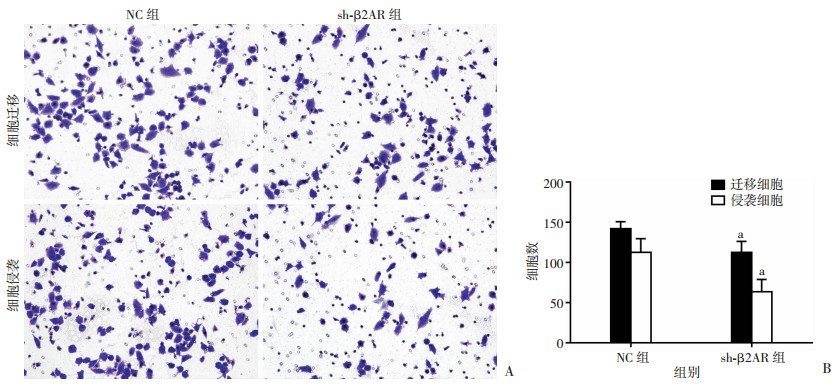
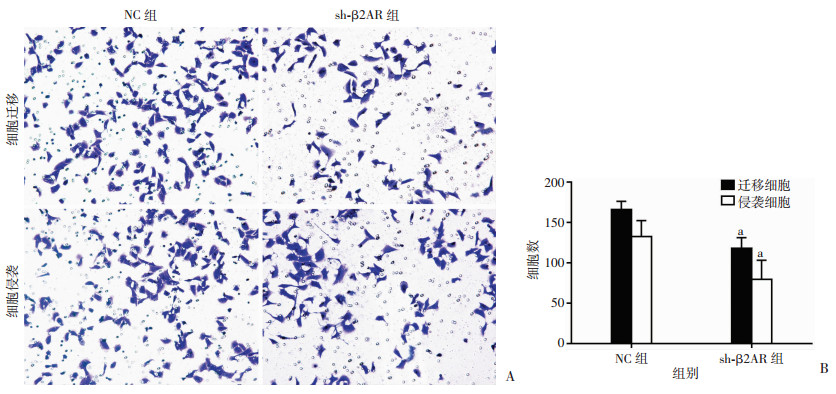
采用Transwell迁移和侵袭实验检测下调β2AR表达对PC-3和LNCaP细胞迁移和侵袭能力的影响(图 4、5),结果显示sh-β2AR组细胞迁移及侵袭数明显低于NC组(P < 0.01),提示下调β2AR的表达细胞的迁移和侵袭能力明显降低。
|
| A:PC-3稳转株细胞迁移和侵袭能力(×400);B:定量分析a: P < 0.01,与NC组比较 图 4 NC组与sh-β2AR组PC-3细胞迁移和侵袭能力 |
|
| A:LNCaP稳转株细胞迁移和侵袭能力(×400);B:定量分析;a: P < 0.01,与NC组比较 图 5 NC组与sh-β2AR组LNCaP细胞迁移和侵袭能力 |
2.5 β2AR激动剂促进细胞EMT形成,抑制剂或下调β2AR表达则抑制EMT的形成
为了深入了解β2AR影响细胞迁移和侵袭的机制,采用Western blot检测在β2AR激动剂ISO和抑制剂PRO处理后,PC-3和LNCaP细胞中EMT相关蛋白E-cadherin、N-cadherin、Vimentin的表达情况。结果显示,与对照组比较,ISO处理组E-cadherin表达下调,N-cadherin和Vimentin的表达上调,说明其对EMT形成具有促进作用;PRO处理组E-cadherin表达上调,N-cadherin和Vimentin的表达下调,说明其抑制细胞EMT的形成(P < 0.05,图 6)。
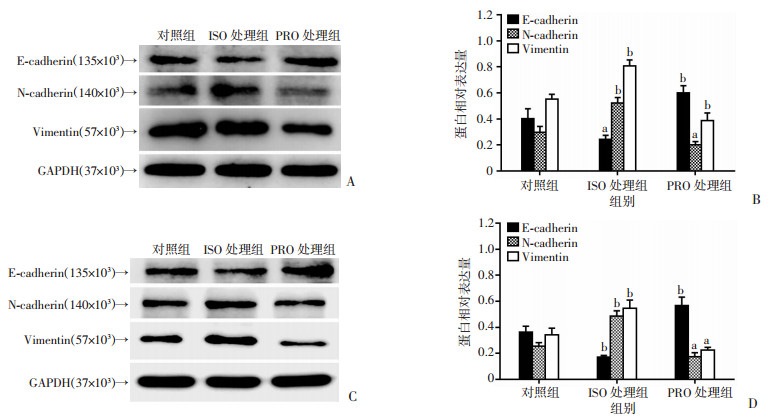
|
| A、B:PC-3各组细胞EMT相关蛋白的表达及半定量分析;C、D:LNCaP各组细胞EMT相关蛋白的表达及半定量分析;a:P < 0.05,b:P < 0.01,与对照组比较 图 6 Western blot检测β2AR激动剂、抑制剂对EMT相关蛋白表达的影响 |
通过Western blot对稳转株中EMT相关蛋白的检测发现,与NC组比较,sh-β2AR组E-cadherin表达上调,N-cadherin和Vimentin的表达下调,说明下调β2AR的表达抑制细胞EMT的形成(P < 0.05,图 7)。

|
| A、B:PC-3稳转株细胞EMT相关蛋白的表达及半定量分析;C、D:LNCaP稳转株细胞EMT相关蛋白的表达及半定量分析;a:P < 0.05,b:P < 0.01,与NC组比较 图 7 Western blot检测下调β2AR的表达对EMT相关蛋白表达的影响 |
2.6 下调β2AR表达的稳转株中凋亡细胞增多
透射电镜检测稳转株细胞的凋亡情况发现,与NC组比较,sh-β2AR组出现较多的凋亡细胞(图 8)。
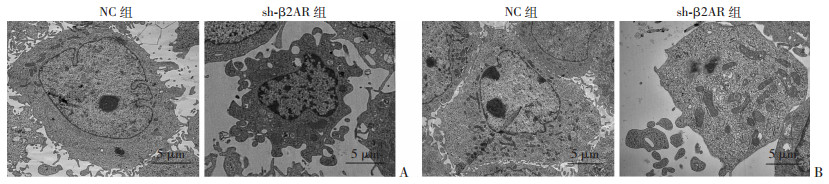
|
| A:PC-3稳转株;B:LNCaP稳转株 图 8 透射电镜检测下调β2AR表达细胞的凋亡情况 |
2.7 抑制或下调β2AR的表达细胞凋亡率明显增加
通过流式细胞术进一步对ISO和PRO处理后的细胞进行凋亡检测发现,与对照组比较,ISO处理组细胞的凋亡率略有降低,而PRO处理组细胞凋亡率明显增加(图 9A、B)。在对β2AR敲低的稳转株进行凋亡检测时发现,与NC组比较,sh-β2AR组细胞凋亡率也明显增加(图 9C、D)。
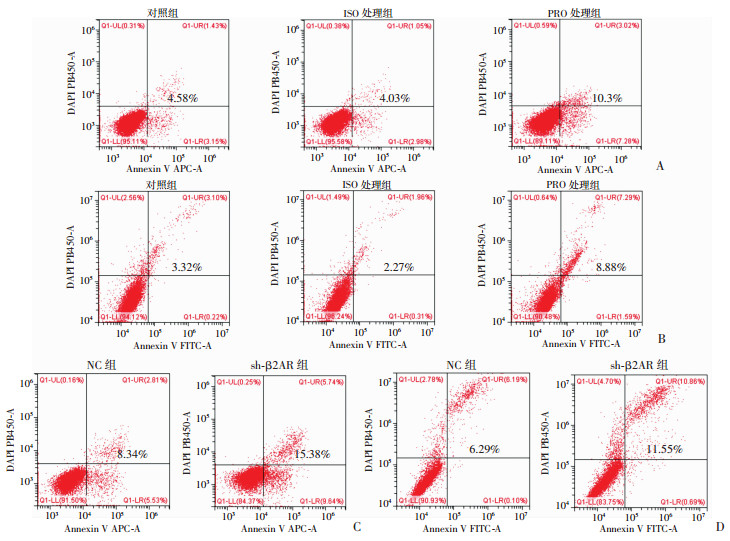
|
| A:流式细胞术检测PC-3各组中细胞的凋亡率;B:LNCaP各组细胞凋亡率;C:PC-3稳转株细胞凋亡率;D:LNCaP稳转株细胞凋亡率 图 9 流式细胞术检测β2AR激动剂、抑制剂及下调β2AR的表达对细胞凋亡的影响 |
2.8 β2AR激动剂下调凋亡相关蛋白的表达,抑制剂及下调β2AR表达则上调凋亡相关蛋白的表达
采用Western blot检测凋亡相关蛋白的表达,结果显示,与对照组相比,ISO处理组在处理1、12、24 h后凋亡相关蛋白Caspase3、cleaved-Caspase3和PARP的表达均明显降低,提示ISO对凋亡的抑制作用;而与ISO处理1 h组相比,ISO处理12 h和24 h组的凋亡蛋白变化不明显,说明ISO对凋亡相关蛋白表达的影响可能不具有时间依赖性;PRO处理组凋亡蛋白表达明显增高(P < 0.05,图 10),提示其对细胞凋亡的促进作用。
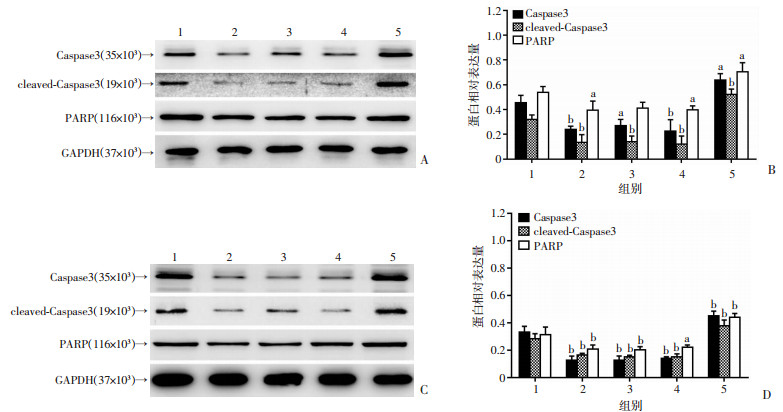
|
| A、B:PC-3各组细胞凋亡相关蛋白的表达及半定量分析;C、D:LNCaP各组细胞凋亡相关蛋白的表达及半定量分析;1:对照组;2:ISO处理1 h组;3:ISO处理12 h组;4:ISO处理24 h组;5:PRO处理24 h组;a:P < 0.05,b:P < 0.01,与对照组比较 图 10 Western blot检测β2AR激动剂、抑制剂对凋亡相关蛋白表达的影响 |
进一步检测稳转株中凋亡相关蛋白的表达情况,结果显示,与NC组相比,sh-β2AR组凋亡相关蛋白的表达明显增加(P < 0.05,图 11),提示下调β2AR的表达细胞的凋亡作用增强。
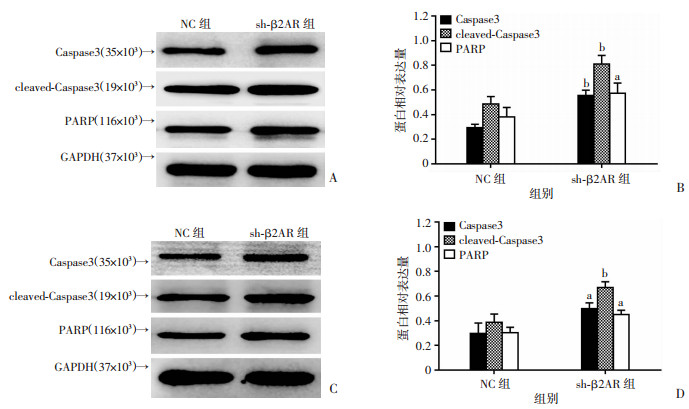
|
| A、B:PC-3稳转株细胞凋亡相关蛋白的表达及半定量分析;C、D:LNCaP稳转株细胞凋亡相关蛋白的表达及半定量分析;a:P < 0.05,b:P < 0.01,与NC组比较 图 11 Western blot检测下调β2AR的表达对凋亡相关蛋白表达的影响 |
3 讨论
交感神经作为自主神经系统的重要组成部分,在前列腺癌的形成和发展过程中发挥了重要作用。研究显示,交感神经纤维在前列腺癌及其周围的正常组织中密集分布,而且与低风险患者相比,高风险前列腺癌患者的交感神经密度更高且肿瘤增殖指数也更高[7]。
β2AR作为交感神经信号传导过程的重要环节,在前列腺癌进展过程中的表达目前仍存在争议[15-17]。本研究回顾分析了UALCAN数据库发现,与癌旁组织相比,β2AR在前列腺癌组织中的基因表达更高;且不同年龄患者间β2AR的表达差异不显著。以上结果提示,β2AR对前列腺癌的发生可能具有重要的影响,而年龄虽然是目前公认的前列腺癌的危险因素之一[18],但对β2AR在前列腺癌中的表达影响不显著,说明年龄可能不是影响β2AR在癌组织中表达的因素。通过对29例患者组织的免疫组化染色观察发现,高风险的前列腺癌组织中β2AR的蛋白表达水平明显高于低风险癌组织,提示在前列腺癌进展中β2AR可能发挥重要的作用。
本研究通过Transwell实验发现β2AR激动剂能显著促进前列腺癌细胞PC-3和LNCaP的迁移以及侵袭,而β2AR抑制剂或下调β2AR的表达则明显抑制癌细胞的迁移及侵袭能力,提示β2AR能够促进前列腺癌细胞迁移及侵袭。
EMT是肿瘤细胞获得形变能力而转化为有运动能力的细胞表型,从而促使癌细胞发生转移的过程[19]。EMT发生时常有上皮表型E-cadherin表达下调、间质表型N-cadherin以及Vimentin上调等特征。在肿瘤细胞的EMT形成过程中,细胞失去胞间连接及细胞极性,出现上皮标记物如E-caderin减少,而N-caderin和Vimentin等间充质标记物逐渐增多,从而使细胞获得高迁移、侵袭的能力[20]。在本研究中,采用Western blot检测E-caderin、N-caderin和Vimentin在β2AR激动剂、抑制剂处理以及下调β2AR表达后的蛋白表达,结果显示,β2AR激动剂下调E-caderin的表达,上调N-caderin和Vimentin的表达,说明β2AR激动剂促进EMT的形成,而β2AR抑制剂或下调β2AR的表达则抑制EMT的形成。提示β2AR能够诱导前列腺癌细胞EMT的形成,增强肿瘤迁移以及侵袭能力。
透射电镜观测细胞凋亡发现下调β2AR的表达后稳转株中出现了较多的凋亡细胞。流式细胞术检测发现,β2AR激动剂具有一定的抑制凋亡的作用,此作用较不明显,原因可能由于细胞本底凋亡率较低所致,但在凋亡相关蛋白的检测中发现,β2AR激动剂使凋亡过程的关键执行者Caspase3,其剪切形式cleaved-Caspase3以及其主要剪切底物PARP的表达明显降低,提示β2AR激动剂能抵抗细胞的凋亡作用。而β2AR抑制剂及下调β2AR的表达明显增加细胞的凋亡率,此外,Caspase3、cleaved-Caspase3以及PARP的蛋白表达明显增加,提示抑制或敲低β2AR的表达促进细胞的凋亡。由此可以说明β2AR能够调节凋亡相关蛋白的表达从而抵抗前列腺癌细胞的凋亡作用。
肿瘤转移是一个复杂且包含多个步骤的过程。肿瘤细胞的成功转移不仅依赖于细胞的迁移、侵袭能力,而且依赖于其逃避凋亡的能力。因此,在肿瘤转移过程中,凋亡抵抗是必不可少的重要环节,而细胞凋亡则能够抑制肿瘤转移[14]。本研究显示,β2AR激动剂能够使癌细胞具有凋亡抗性,从而促进肿瘤的转移播散,β2AR抑制剂或下调β2AR的表达具有明显的促凋亡作用,从而能够抑制肿瘤的转移。
综上所述,β2AR可从两个方面影响肿瘤转移:①β2AR能够促进前列腺癌细胞EMT,增强细胞的迁移及侵袭能力;②β2AR还可以使细胞产生凋亡抵抗,从而能够促进肿瘤的转移播散。而β2AR对前列腺癌转移影响的具体机制还需进一步研究探索。
目前关于β肾上腺素受体抑制剂对乳腺癌、卵巢癌、宫颈癌和结肠癌作用的临床Ⅱ期评估工作已经展开[6, 21],而β肾上腺素受体抑制剂对前列腺癌作用的研究仍需要进一步的临床流行病学以及基础研究的支持[6]。本研究发现β2AR能够通过促进前列腺癌细胞的迁移、侵袭及抑制细胞凋亡,从而可能对肿瘤转移具有促进作用,以期能够为前列腺癌可能的分子靶向药物的寻找提供新的线索。
| [1] |
ZHOU C K, CHECK D P, LORTET-TIEULENT J, et al. Prostate cancer incidence in 43 populations worldwide: An analysis of time trends overall and by age group[J]. Int J Cancer, 2016, 138(6): 1388-1400. DOI:10.1002/ijc.29894 |
| [2] |
PANG C, GUAN Y Y, LI H B, et al. Urologic cancer in China[J]. Jpn J Clin Oncol, 2016, 46(6): 497-501. DOI:10.1093/jjco/hyw034 |
| [3] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
REN S C, CHEN R, SUN Y H. Prostate cancer research in China[J]. Asian J Androl, 2013, 15(3): 350-353. DOI:10.1038/aja.2013.37 |
| [5] |
TSUZUKI S, PARK S H, EBER M R, et al. Skeletal complications in cancer patients with bone metastases[J]. Int J Urol, 2016, 23(10): 825-832. DOI:10.1111/iju.13170 |
| [6] |
BRAADLAND P R, RAMBERG H, GRYTLI H H, et al. Β-adrenergic receptor signaling in prostate cancer[J]. Front Oncol, 2014, 4: 375. DOI:10.3389/fonc.2014.00375 |
| [7] |
MAGNON C, HALL S J, LIN J, et al. Autonomic nerve development contributes to prostate cancer progression[J]. Science, 2013, 341(6142): 1236361. DOI:10.1126/science.1236361 |
| [8] |
TILAN J, KITLINSKA J. Sympathetic neurotransmitters and tumor angiogenesis-link between stress and cancer progression[J]. J Oncol, 2010, 2010: 539706. DOI:10.1155/2010/539706 |
| [9] |
NAGMANI R, PASCO D S, SALAS R D, et al. Evaluation of β-adrenergic receptor subtypes in the human prostate cancer cell line-LNCaP[J]. Biochem Pharmacol, 2003, 65(9): 1489-1494. DOI:10.1016/s0006-2952(03)00105-9 |
| [10] |
FARINI D, PUGLIANIELLO A, MAMMI C, et al. Dual effect of pituitary adenylate cyclase activating polypeptide on prostate tumor LNCaP cells: short- and long-term exposure affect proliferation and neuroendocrine differentiation[J]. Endocrinology, 2003, 144(4): 1631-1643. DOI:10.1210/en.2002-221009 |
| [11] |
CHEN H, LIU D, YANG Z, et al. Adrenergic signaling promotes angiogenesis through endothelial cell-tumor cell crosstalk[J]. Endocr Relat Cancer, 2014, 21(5): 783-795. DOI:10.1530/ERC-14-0236 |
| [12] |
GRYTLI H H, FAGERLAND M W, FOSSÅ S D, et al. Association between use of β-blockers and prostate cancer-specific survival: A cohort study of 3561 prostate cancer patients with high-risk or metastatic disease[J]. Eur Urol, 2014, 65(3): 635-641. DOI:10.1016/j.eururo.2013.01.007 |
| [13] |
MICALIZZI D S, FARABAUGH S M, FORD H L. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2): 117-134. DOI:10.1007/s10911-010-9178-9 |
| [14] |
SU Z, YANG Z, XU Y, et al. Apoptosis, autophagy, necroptosis, and cancer metastasis[J]. Mol Cancer, 2015, 14: 48. DOI:10.1186/s12943-015-0321-5 |
| [15] |
RAMBERG H, EIDE T, KROBERT K A, et al. Hormonal regulation of beta2-adrenergic receptor level in prostate cancer[J]. Prostate, 2008, 68(10): 1133-1142. DOI:10.1002/pros.20778 |
| [16] |
YU J, CAO Q, MEHRA R, et al. Integrative genomics analysis reveals silencing of beta-adrenergic signaling by polycomb in prostate cancer[J]. Cancer Cell, 2007, 12(5): 419-431. DOI:10.1016/j.ccr.2007.10.016 |
| [17] |
CERAMI E, GAO J, DOGRUSOZ U, et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data[J]. Cancer Discov, 2012, 2(5): 401-404. DOI:10.1158/2159-8290.CD-12-0095 |
| [18] |
SALINAS C A, TSODIKOV A, ISHAK-HOWARD M, et al. Prostate cancer in young men: an important clinical entity[J]. Nat Rev Urol, 2014, 11(6): 317-323. DOI:10.1038/nrurol.2014.91 |
| [19] |
FIGIEL S, VASSEUR C, BRUYERE F, et al. Clinical significance of epithelial-mesenchymal transition markers in prostate cancer[J]. Hum Pathol, 2017, 61: 26-32. DOI:10.1016/j.humpath.2016.10.013 |
| [20] |
HARNER-FOREMAN N, VADAKEKOLATHU J, LAVERSIN S A, et al. A novel spontaneous model of epithelial-mesenchymal transition (EMT) using a primary prostate cancer derived cell line demonstrating distinct stem-like characteristics[J]. Sci Rep, 2017, 7: 40633. DOI:10.1038/srep40633 |
| [21] |
CHOI C H, SONG T, KIM T H, et al. Meta-analysis of the effects of beta blocker on survival time in cancer patients[J]. J Cancer Res Clin Oncol, 2014, 140(7): 1179-1188. DOI:10.1007/s00432-014-1658-7 |



