2. 400014 重庆,重庆医科大学附属儿童医院呼吸中心
2. Respiratory Center of Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
支气管哮喘(asthma)是慢性炎症和气道功能紊乱相互作用引起的异质性疾病[1],影响全球约3.34亿人。我国0~14岁儿童哮喘患病率在2015年为2.38%,较10年前上升了43.4% [2]。目前哮喘的主要治疗手段是使用支气管扩张剂和糖皮质激素(glucocorticoid, GCs)[3],大多数患者的哮喘症状得到了令人满意的控制。然而,仍有5%~10%患者的哮喘症状控制欠佳[4],说明现有的治疗手段仍有不足。
气道上皮结构和功能的完整性是抵御有害因素损伤气道继发感染的重要屏障[5]。有研究报道GCs可以促进气道上皮细胞凋亡[6],我们前期研究也显示:地塞米松(dexamethasone,Dex)能够诱导气道上皮凋亡导致哮喘小鼠气道上皮缺损,进而减弱Dex的治疗效果[7],故需新的药物抑制GCs对哮喘气道上皮可能造成的损伤。维生素A(vitamin A,VA)可促进气道纤毛细胞、柱状上皮的分裂和分化,对维持上皮细胞结构和功能正常具有重要意义。临床研究发现哮喘患儿体内VA水平低于健康儿童[8]。我们前期实验结果也表明VA与哮喘小鼠支气管肺泡灌洗液(BALF)中脱落上皮的数量呈负相关[7],提示VA对哮喘可能有治疗作用,可减少气道上皮的损伤,但其具体机制不明确。
基于以上研究基础,在GCs治疗哮喘时,可考虑通过补充VA来抑制气道上皮的过度凋亡,达到既控制哮喘气道炎症又维持气道上皮完整性的目的。本研究通过Dex和/或VA干预C57bl/6哮喘小鼠模型,从气道功能、气道上皮结构和气道上皮分子水平等方面综合评估气道上皮情况,为提高哮喘治疗效果提供理论依据和新的思路。
1 材料与方法 1.1 材料屋尘螨提取物(House dust mites extracets, HDM)购买于美国Stallergenes Greer公司;Dex购买于美国LKT Laboratories公司;富含维生素A饲料(额外添加VA 50 IU/kg)购买于北京科奥协力饲料有限公司;乙酰甲胆碱(methacholine,Ach)购买于美国Sigma-Aldrich公司;快速瑞氏染液试剂盒购买于南京凯基生物科技发展有限公司;糖原PAS染液试剂盒购买于雷根生物技术公司;兔-SP免疫组化检测试剂盒、山羊抗兔lgG/辣根酶标、DAB显色试剂盒购买于中杉金桥生物技术有限公司;E-cadherin兔抗鼠一抗、caspase 3兔抗鼠一抗、β-actin兔抗鼠一抗购买于武汉三鹰生物技术有限公司;cleaved caspase 3兔抗鼠一抗购买于美国CST公司;全蛋白提取试剂盒和ECL化学发光试剂盒购买于凯基生物科技有限公司;BCA蛋白含量检测试剂盒购买于百泰克生物技术有限公司;SDS-PAGE凝胶配置试剂盒购买于碧云天生物技术研究所。
1.2 方法 1.2.1 实验动物及处理SPF级C57bl/6雌性小鼠,6~8周龄,体质量20~22 g,购买于重庆医科大学实验动物中心,饲养在重庆医科大学附属儿童医院实验动物中心SPF级动物房,室温22~26 ℃,湿度55%~ 60%,光照12 h/d。小鼠按随机数字表法分为5组:对照组、asthma组、Dex组、VA组、D+VA组,每批次每组6只,共两批次。哮喘模型的建立依据相关研究[9]。asthma组、Dex组、VA组、D+VA组小鼠于第0、14天滴鼻吸入致敏液(20 μg HDM,溶剂为30 μL 0.9% NaCl),第21天起滴鼻吸入激发液(20 μg HDM,溶剂为30 μL 0.9% NaCl),1次/48 h,连续激发5次(图 1)。Dex组小鼠在最后3次激发前30 min,腹腔注射200 μL Dex溶液(溶剂为0.9% NaCl),5 mg/kg,共3次。VA组小鼠在第21天起给予富含VA饲料,连续10 d。D+VA组小鼠干预方法同Dex组和VA组。对照组小鼠用0.9%NaCl代替致敏和激发液,给药剂量和方式同其他各组。
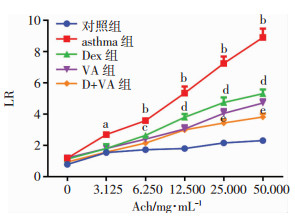
|
| a:P < 0.05, b:P < 0.01, 与对照组比较;c:P < 0.05, d: P < 0.01,与asthma组比较; e: P < 0.01, 与Dex组比较 图 1 各组小鼠气道高反应性变化(n=6) |
1.2.2 气道通气阻力测定
小鼠于末次滴鼻激发24 h内行有创肺功能检测,测定小鼠的气道通气阻力。用2%戊巴比妥钠溶液麻醉小鼠(4 μL/g浓度,腹腔注射),掐小鼠尾部无反应后,行气管插管,连接呼吸机,通过生物记录仪测定小鼠的气道气流和压力变化,从而得出小鼠肺通气阻力值(LR=ΔP/ΔF)。当小鼠呼吸平稳后,记录3 min基础值,再依次用浓度为0、3.125、6.250、12.500、25.000、50.000 mg/mL的Ach溶液进行雾化,每次雾化30 s,记录5 min,收集后3 min的数据用于分析小鼠的气道高反应性(airway hyperresponsiveness,AHR)。
1.2.3 BALF的灌取及细胞分类计数在小鼠末次激发24 h内,将小鼠用2%戊巴比妥钠溶液麻醉,取眼球血,断颈处死,仰卧固定于泡沫板上,充分暴露气管和胸腔,留置针插入气管并用丝线固定,再用止血钳将左肺肺门处夹闭,右肺用预冷无菌的PBS溶液进行支气管肺泡灌洗,共3次,每次0.5 mL,回收率在80%以上。将BALF离心,2 500 r/min,4 ℃,5 min,收集上清液分装保存于-80 ℃。细胞沉渣加入1 mL冷PBS稀释,充分震荡混匀后,取20 μL进行细胞计数。剩余悬液离心,4 ℃,2 500 r/min,5 min,弃上清液,细胞沉渣混匀涂片,晾干后采用快速瑞氏染色行细胞分类计数。
1.2.4 病理组织染色小鼠行支气管肺泡灌洗后,松开左侧肺门处止血钳,取右肺保存于-80 ℃冰箱中,取左肺及未行气管插管的小鼠气管放入4%的中性甲醛中避光固定48 h,再经脱水、石蜡包埋后切成4 μm薄片,黏附于载玻片上,放入60 ℃烘箱烘烤48 h,分别进行HE染色和PAS染色,中性树脂封片,光镜下观察肺组织病理情况,并对其炎症浸润程度进行评分[10]。
1.2.5 肺组织免疫组化染色将烘烤过的石蜡切片常规脱蜡水化后,然后用0.01 mol/L枸橼酸钠(pH=6.0)行抗原修复,加3%过氧化氢放置室温15 min以消除内源性过氧化物酶,用5%BSA 37 ℃封闭30 min,滴加E-cadherin一抗(1 :300稀释),湿盒内4 ℃孵育过夜,37 ℃复温45 min,滴加反应增强液和增强酶标山羊抗兔IgG聚合物,DAB镜下控制显色,苏木精染核,脱水封片,显微镜下观察E-cadherin的表达。最后用Image Pro-Plus 6.0图像分析软件测定阳性区IOD值并进行统计分析。
1.2.6 Western blot检测肺组织蛋白表达利用全蛋白提取试剂盒提取肺组织总蛋白后,BCA法测定蛋白浓度,100 ℃煮沸10 min使蛋白变性。配制12%的SDS-PAGE凝胶,每孔蛋白上样量为100 μg,浓缩胶电泳(60 V,40 min)后转为分离胶电泳(110 V,60 min)。常规湿转法转膜(220 mA,50 min),5%的脱脂奶粉室温摇床上封闭2 h,一抗4 ℃过夜(β-actin:1 :5 000, caspase 3:1 :500,cleaved caspase 3:1 :1 000),二抗(1 :5 000)室温孵育1 h,ECL化学发光,在荧光化学发光凝胶成像系统上显影。
1.3 统计学分析采用Graph Pad Prism 6.0统计软件,数据以x±s表示。方差齐时,各组比较用单因素方差分析或Turkey检验;方差不齐时,各组用Kruskal-Wallis检验;组间比较用双因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 Dex和VA联用时小鼠AHR较单独使用Dex降低随着雾化Ach溶液的浓度增加,各组小鼠的AHR也逐渐升高。在Ach溶液浓度为3.125、6.250、12.500、25.000、50.000 mg/mL时,asthma组LR值较对照组LR值明显升高(P < 0.05);当Ach溶液浓度为6.250、12.500、25.000、50.000 mg/mL时,Dex组LR值明显低于asthma组LR值(P < 0.05);VA组LR值与Dex组没有明显差异,而在Ach溶液浓度为25.000、50.000 mg/mL时,D+VA组LR值低于Dex组LR值(P < 0.01),提示Dex和VA联合应用时,小鼠的气道高反应性较单独使用Dex降低(图 1)。
2.2 BALF细胞总计数及分类计数asthma组BALF细胞总数较对照组明显升高,Dex组细胞总数则较asthma组明显降低(P < 0.01),而VA组细胞总数与asthma组相比无明显差异,同时,D+VA组细胞总数与Dex组无明显差异,提示Dex和VA同时应用于哮喘小鼠时,在肺部炎症细胞总计数中,其效用等同于单用Dex(图 2A);分类计数200个细胞中嗜酸性粒细胞数,asthma组明显高于对照组,Dex组、VA组明显低于asthma组(P < 0.01),但D+VA组与Dex组相比差异无统计学意义(图 2B)。
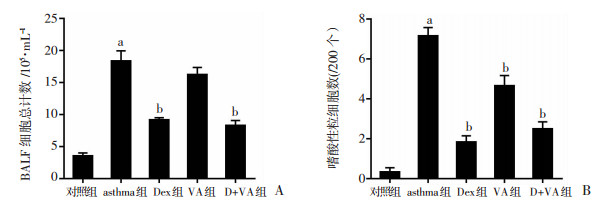
|
| A:BALF细胞总计数; B:嗜酸性粒细胞数 a: P < 0.01, 与对照组比较; b: P < 0.01,与asthma组比较 图 2 各组小鼠BALF细胞总计数和嗜酸性粒细胞分类计数(n=6) |
2.3 Dex和VA联用时小鼠气管和血管周围的炎症浸润明显减轻
对照组小鼠支气管及肺泡结构正常,支气管周围基本无炎症细胞浸润。asthma组小鼠的支气管和血管周围有大量的炎症细胞浸润;Dex干预后,Dex组小鼠支气管及血管周围炎症细胞浸润程度明显降低。而VA干预时,VA组小鼠仍有明显的炎症细胞浸润,较asthma组无明显改变。当Dex和VA同时干预哮喘小鼠后,D+VA组小鼠的气管和血管周围的炎症浸润明显减轻,其炎症浸润程度与Dex组小鼠无明显差异。病理炎症评分结果显示:asthma组评分高于Dex组(P < 0.01),D+VA组与Dex组相比差异无统计学意义(图 3)。
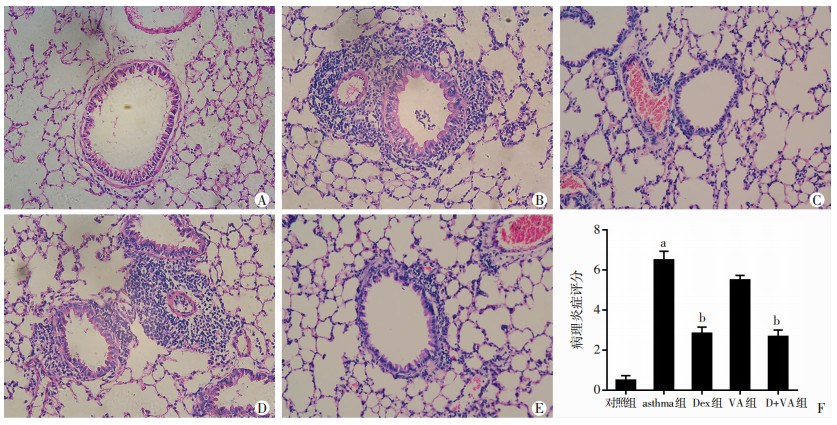
|
| A:对照组; B:asthma组; C:Dex组; D:VA组; E:D+VA组; F:定量分析(n=6) a:P < 0.01,与对照组比较比;b:P < 0.01,与asthma组比较 图 3 各组小鼠肺组织病理学观察(HE ×200) |
2.4 Dex和VA联用时小鼠气道黏液分泌明显减少
对照组小鼠中,其支气管气道上皮细胞无PAS阳性(紫红色)反应结果,没有明显黏液分泌。asthma组小鼠中,气道上皮可见大量的紫红色物质,表明气道有大量的黏液分泌。在Dex组小鼠中,其气道上皮黏液分泌明显减少,紫红色物质与asthma组相比明显降低(P < 0.01)。VA组小鼠气道上皮依然有大量紫红色物质,气道黏液分泌明显。而D+VA组气道上皮未见明显的紫红色物质,表明气道黏液分泌明显减少,同时较Dex组有更明显的降低气道黏液分泌的趋势,但差异无统计学意义(图 4)。
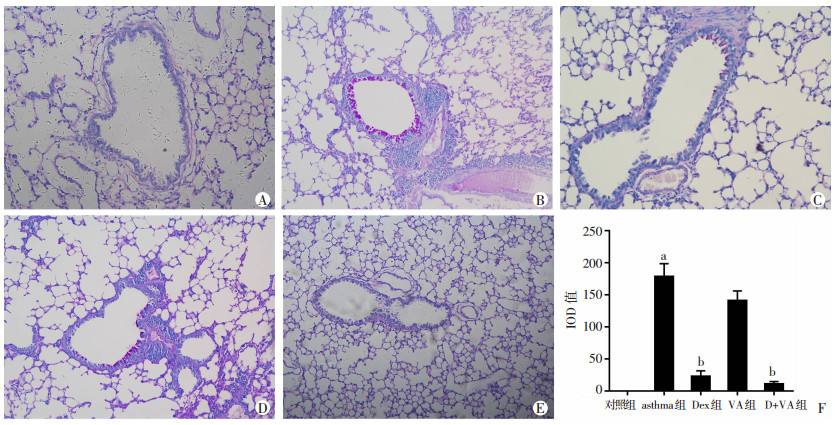
|
| A:对照组; B:asthma组; C:Dex组; D:VA组; E:D+VA组; F:定量分析(n=6) a:P < 0.01,与对照组比较比;b:P < 0.01,与asthma组比较 图 4 各组小鼠肺组织病理学观察(PAS ×200) |
2.5 Dex和VA联用可有效减轻Dex对小鼠气道上皮的损伤
将小鼠气管进行HE染色,观察气道上皮缺损情况。对照组中,小鼠气道上皮细胞连接完整,纤毛无倒伏、缺失。asthma组小鼠中,如箭头所示:气道上皮细胞有缺损,纤毛上皮细胞连接不完整,纤毛缺失。Dex组小鼠气道上皮细胞缺损进一步扩大,部分区域丢失全部上皮细胞,暴露基底。VA组小鼠的气道上皮完整度与asthma组相似,无明显改善作用。在同时用Dex和VA干预哮喘小鼠后发现,D+VA组小鼠的气道上皮完整性较Dex组高,未见裸露的基底,纤毛上皮细胞的缺损较小。提示同时使用Dex和VA,可有效减轻Dex对气道上皮的损伤作用(图 5)。
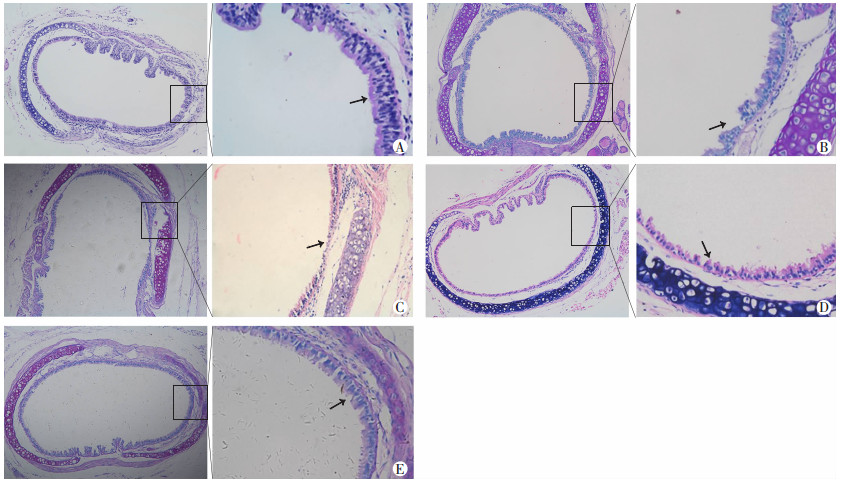
|
| A:对照组;B:asthma组;C:Dex组;D:VA组;E:D+VA组左图:×200;右图:×400;↑示气道上皮脱落情况 图 5 HE染色观察各组小鼠气道上皮损伤 |
2.6 Dex和VA联用可使小鼠气道上皮E-cadherin的表达升高
免疫组化结果显示:E-cadherin主要表达于肺组织的支气管上皮细胞,淡黄色为弱阳性表达,黄色为中度阳性表达,棕黄色为强阳性表达。asthma组气道上皮E-cadherin的表达明显低于对照组(P < 0.01),Dex组较asthma组表达降低(P < 0.05),VA组气道上皮E-cadherin的表达与asthma组无差异,而D+VA组E-cadherin表达量较asthma组升高(P < 0.05),同时D+VA组较Dex组E-cadherin的表达亦升高(P < 0.01,图 6)。

|
| A:对照组;B:asthma组; C:Dex组; D:VA组; E:D+VA组; F:定量分析(n=6) a:P < 0.01, 与对照组比较;b:P < 0.05,与asthma组比较;c:P < 0.01,与Dex组比较 图 6 各组小鼠肺组织气道上皮E-cadherin的表达(S-P ×400) |
2.7 Dex和VA联用时VA可减轻Dex对哮喘气道上皮的促凋亡作用
asthma组肺组织凋亡蛋白caspase 3及其活化片段cl-caspase 3的水平较对照组上升(P < 0.05);同时Dex组caspase 3水平较asthma组升高(P < 0.01),cl-caspase 3水平较asthma组有升高趋势,但差异无统计学意义;而VA组cl-caspase 3水平较Dex组降低(P < 0.01);同时D+VA组caspase 3及cl-caspase 3水平明显低于Dex组(P < 0.01)。提示Dex和VA联合使用时,VA可以减轻Dex对哮喘气道上皮的促凋亡作用(图 7)。
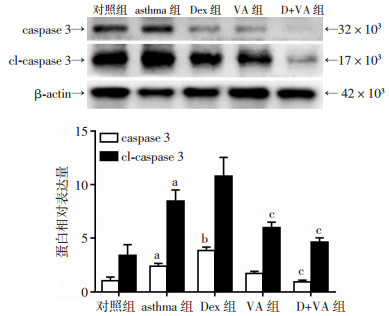
|
| a:P < 0.05, 与对照组比较;b:P < 0.01, 与asthma组比较;c:P < 0.01, 与Dex组比较 图 7 Western blot检测各组小鼠肺组织中caspase 3和cl-caspase 3水平(n=6) |
3 讨论
气道上皮结构和功能的完整性是维护气道局部微环境稳态的重要条件,而气道上皮完整性的破坏是哮喘气道病理特征之一,与哮喘气道高反应性、气道慢性炎症和气道重塑密切相关[11]。临床研究发现:糖皮质激素虽能有效抑制大部分哮喘患者的气道炎症,但对难治性哮喘疗效欠佳[12],推测可能与气道上皮的慢性损伤有关。现有研究表明:VA是上皮细胞的重要激素样生长因子,可维持黏膜上皮的完整性、气道上皮细胞的表型和功能[13]。此外,临床研究显示:血清VA水平与哮喘严重程度呈负相关,重度哮喘患者气道上皮的VA受体表达水平较轻度哮喘者更高,且VA受体的表达与形态完整上皮细胞比例呈正相关[14]。我们前期研究发现VA可促进气道上皮增殖进而有效维持哮喘气道上皮完整性,而Dex可促进哮喘气道上皮的凋亡进而破坏气道上皮的完整性,但VA是否可抑制哮喘气道上皮凋亡从而维持气道上皮的完整性仍不清楚。
Caspase是一组天门冬氨酸特异性的半胱氨酸蛋白酶,其活化是最主要的细胞凋亡途径。尽管在各种凋亡过程中激活的caspase不尽相同,但普遍认为caspase 3是各条凋亡通路的重要枢纽,各种凋亡刺激激活caspase后,最终都通过激活并水解caspase 3为cl-caspase 3,进一步诱导细胞发生凋亡[15]。E-cadherin是一种重要的细胞黏附分子,对维护上皮极性和完整性等方面发挥重要作用[16]。
本研究采用屋尘螨建立小鼠哮喘模型,该模型有明显的AHR,BALF中炎症细胞和嗜酸性粒细胞水平均明显升高,肺组织病理发现气道周围明显炎症浸润和气道内的黏液大量分泌,提示该哮喘模型构建成功。同时我们发现:单独使用Dex干预哮喘小鼠,小鼠的AHR、气道炎症、气道黏液分泌虽然明显下降,但是气道上皮缺损较哮喘小鼠明显加重,气道上皮凋亡标志分子caspase3和cl-caspase3水平升高、E-cadherin分子水平下降,提示Dex可加重气道上皮损伤。而当Dex联合VA干预哮喘小鼠后,除了气道高反应性进一步下降、气道变应性炎症减轻、气道黏液分泌减少外,气道上皮缺损明显减轻,caspase 3和cl-caspase 3水平下降,上皮E-cadherin表达提升,提示Dex联合VA可有效抑制气道上皮细胞凋亡,减轻气道上皮的损伤,但其机制尚不明确。我们推测可能的机制是:联合应用Dex和VA干预哮喘小鼠时,VA不会影响Dex对哮喘小鼠的抗炎作用,Dex可通过抑制气道过敏性炎症,进而减轻气道炎症对气道上皮的损伤,同时VA可能通过影响Fas基因的转录[17]和糖皮质激素诱导的亮氨酸拉链(GILZ)的功能[18],抑制糖皮质激素促凋亡信号通路的传导,从而抑制细胞凋亡蛋白caspase 3的表达,降低cl-caspase 3的水平,最终抑制气道上皮凋亡。
AHR是各类哮喘的共有表现[19],VA可抑制哮喘气道上皮凋亡,进而维护气道上皮完整性可能是其减轻AHR的机制之一。此外,VA可减轻哮喘气道中的嗜酸性粒细胞浸润,可能是其减轻哮喘AHR的另一种机制。VA在气道炎症调节中起一定作用,VA的缺乏可使气道局部SIgA水平下降,导致呼吸道疾病加重。相关学者也指出反复呼吸道感染能降低血清中VA含量,二者互为因果,形成恶性循环[20]。因此,虽然我们发现添加VA可以减少Dex对气道上皮的促凋亡作用,减少气道上皮的损伤,但对于VA是否可用于哮喘治疗,目前仍有争论。争论的焦点在于补充VA是否可加重哮喘的过敏性炎症。部分学者发现VA可诱导机体出现更严重的Th2倾向[21],这与本研究观察结果不一致,推测可能与其用鸡卵清蛋白建立哮喘小鼠实验模型有关,鸡卵清蛋白较屋尘螨易诱发Th2类免疫失调。
综上所述,VA和Dex联合作用哮喘小鼠时,可有效降低小鼠气道炎症,减少气道黏液分泌,且进一步降低小鼠AHR,抑制气道上皮caspase 3和cl-caspase 3水平上升,促进气道上皮E-cadherin分子表达,抑制Dex对气道上皮的促凋亡作用,维护气道上皮的完整性。
| [1] |
REDDEL H K, BATEMAN E D, BECKER A, et al. A summary of the new GINA strategy: a roadmap to asthma control[J]. Eur Respir J, 2015, 46(3): 622-639. DOI:10.1183/13993003.00853-2015 |
| [2] |
刘传合, 洪建国, 尚云晓, 等. 中国16城市儿童哮喘患病率20年对比研究[J]. 中国实用儿科杂志, 2015, 30(8): 596-600. LIU C H, HONG J G, SHANG Y X, et al. Comparison of asthma prevalence in children from 16 cities of China in 20 years[J]. Chin J Pract Pediatr, 2015, 30(8): 596-600. |
| [3] |
RAMADAN A A, GAFFIN J M, ISRAEL E, et al. Asthma and corticosteroid responses in childhood and adult asthma[J]. Clin Chest Med, 2019, 40(1): 163-177. DOI:10.1016/j.ccm.2018.10.010 |
| [4] |
HEKKING P P W, BEL E H. Developing and emerging clinical asthma phenotypes[J]. J Allergy Clin Immunol: Pract, 2014, 2(6): 671-680. DOI:10.1016/j.jaip.2014.09.007 |
| [5] |
GRAS D, CHANEZ P, VACHIER I, et al. Bronchial epithelium as a target for innovative treatments in asthma[J]. Pharmacol Ther, 2013, 140(3): 290-305. DOI:10.1016/j.pharmthera.2013.07.008 |
| [6] |
GERBER A N. Glucocorticoids and thelung[M]//Advances in Experimental Medicine and Biology. New York: Springer, 2015: 279-298. DOI: 10.1007/978-1-4939-2895-8_12
|
| [7] |
NIU C, LIU N, LIU J, et al. Vitamin A maintains the airway epithelium in a murine model of asthma by suppressing glucocorticoid-induced leucine zipper[J]. Clin Exp Allergy, 2016, 46(6): 848-860. DOI:10.1111/cea.12646 |
| [8] |
SCHUSTER G U, KENYON N J, STEPHENSEN C B. Vitamin A deficiency decreases and high dietary vitamin A increases disease severity in the mouse model ofasthma[J]. J Immunol, 2008, 180(3): 1834-1842. DOI:10.4049/jimmunol.180.3.1834 |
| [9] |
KOLMERT J, PIÑEIRO-HERMIDA S, HAMBERG M, et al. Prominent release of lipoxygenase generated mediators in a murine house dust mite-induced asthma model[J]. Prostaglandins Other Lipid Mediat, 2018, 137: 20-29. DOI:10.1016/j.prostaglandins.2018.05.005 |
| [10] |
ZANG N, LI S M, LI W, et al. Resveratrol suppresses persistent airway inflammation and hyperresponsivess might partially via nerve growth factor in respiratory syncytial virus-infected mice[J]. Int Immunopharmacol, 2015, 28(1): 121-128. DOI:10.1016/j.intimp.2015.05.031 |
| [11] |
GANESAN S, COMSTOCK A T, SAJJAN U S. Barrier function of airway tractepithelium[J]. Tissue Barriers, 2013, 1(4): e24997. DOI:10.4161/tisb.24997 |
| [12] |
WALSH G M. Recent developments in the use of biologics targeting IL-5, IL-4, or IL-13 in severe refractoryasthma[J]. Expert Rev Respir Med, 2018, 12(11): 957-963. DOI:10.1080/17476348.2018.1520095 |
| [13] |
CUI WW, ZHANG P, GU J M, et al. Vitamin A deficiency promotes inflammation by induction of type 2 cytokines in experimental ovalbumin-induced asthma murine model[J]. Inflammation, 2016, 39(5): 1798-1804. DOI:10.1007/s10753-016-0415-2 |
| [14] |
MARQUEZ H A, CARDOSO W V. Vitamin A-retinoid signaling in pulmonary development anddisease[J]. Mol Cell Pediatr, 2016, 3(1): 28. DOI:10.1186/s40348-016-0054-6 |
| [15] |
LOSSI L, CASTAGNA C, MERIGHI A. Caspase-3 mediated cell death in the normal development of the mammaliancerebellum[J]. Int J Mol Sci, 2018, 19(12): E3999. DOI:10.3390/ijms19123999 |
| [16] |
HU Y H, DONG H M, ZOU M C, et al. TSLP signaling blocking alleviates E-cadherin dysfunction of airway epithelium in a HDM-induced asthma model[J]. Cell Immunol, 2017, 315: 56-63. DOI:10.1016/j.cellimm.2017.02.003 |
| [17] |
CHEN F, JIANG Z Y, JIANG S Q, et al. Dietary vitamin A supplementation improved reproductive performance by regulating ovarian expression of hormone receptors, caspase-3 and Fas in broiler breeders[J]. Poult Sci, 2016, 95(1): 30-40. DOI:10.3382/ps/pev305 |
| [18] |
BRUSCOLI S, BIAGIOLI M, SORCINI D, et al. Lack of glucocorticoid-induced leucine zipper (GILZ) deregulates B-cell survival and results in B-cell lymphocytosis in mice[J]. Blood, 2015, 126(15): 1790-1801. DOI:10.1182/blood-2015-03-631580 |
| [19] |
LOMMATZSCH M. Airwayhyperresponsiveness: new insights into the pathogenesis[J]. Semin Respir Crit Care Med, 2012, 33(6): 579-587. DOI:10.1055/s-0032-1325617 |
| [20] |
SHOSEYOV D, BIBI H, BIESALSKI H, et al. Repeated allergen challenge in rats increases vitamin A consumption[J]. Chest, 2002, 122(4): 1407-1411. DOI:10.1378/chest.122.4.1407 |
| [21] |
SCHUSTER G U, KENYON N J, STEPHENSEN C B. Vitamin A deficiency decreases and high dietary vitamin A increases disease severity in the mouse model ofasthma[J]. J Immunol, 2008, 180(3): 1834-1842. DOI:10.4049/jimmunol.180.3.1834 |



