2. 400042 重庆, 陆军军医大学(第三军医大学)大坪医院:病理科
2. Department of Pathology, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
前列腺癌为全世界特别是欧美国家中老年男性常见的恶性肿瘤和主要死亡原因之一[1]。有资料统计,前列腺癌已被列为我国21世纪发病率增长较快的肿瘤之一[2]。目前,除前列腺特异抗原(prostate specific antigen,PSA)外的多种肿瘤检测标记物,包括融合基因TMPRSS2-ERG、PSA异构体([-2]proPSA)、长链非编码RNA MALAT-1片段[MALAT-1 derived(MD) miniRNA]等被应用于前列腺癌的早期诊断并开始商业推广[3-6]。但是,上述标记物的敏感性和特异性仍有待提高,尤其是临床上存在部分低PSA前列腺癌的患者,给早期诊断带来一定的困难,而且临床中判定前列腺癌患者预后危险因素之间关系的肿瘤标记物研究较少。有研究发现α-甲酰基辅酶A消旋酶(P504s)和紧密连接蛋白-4(Claudin-4)的异常表达与多种肿瘤的发生和进展有关。在临床中亦有一些机构将P504s表达的检测应用于前列腺癌诊断中,但是Claudin-4的表达与前列腺癌的关系少有研究[7-8],且两者和前列腺癌的发生和进展究竟有何联系目前尚不清楚。本研究通过组织芯片技术检测P504s和Claudin-4蛋白在不同危险因素等级前列腺癌中的表达并进行分析,探讨联合检测P504s和Claudin-4蛋白的表达,进一步提高前列腺癌的检出,并分析其表达与前列腺癌预后的相关性。
1 资料与方法 1.1 标本来源选取我院病理组织库2013年1月至2015年7月的前列腺手术或穿刺标本。所有患者临床和病理资料完整,取标本前均未接受内分泌治疗、放疗及化疗,未合并其他肿瘤性疾病,术前均检测了PSA值并做了盆腔MRI检查及临床分期。筛选出符合条件的患者共154例,其中前列腺癌患者84例,年龄52~83(70.9±7.3)岁;前列腺增生患者70例,年龄51~85(68.2±7.4)岁。前列腺癌根据Gleason评分系统,评分≤6分的41例,≥7分的43例;临床分期按照2017年AJCC的TNM分期系统:分期≤T2a期38例,分期≥T2b期46例。
1.2 方法标本经10%甲醛溶液固定后,石蜡包埋,3 μm厚组织连续切片,制成芯片的所有组织。采用微阵列仪在空白受体蜡块相应位置打孔(直径0.1 cm,间距0.1 cm,深度0.2~0.3 cm)。采用组织芯片制作仪,在供体蜡块对应位置采集前列腺组织切片(直径1.5 mm,采样长度0.8 cm),并置于空白受体蜡块对应小孔中,记录各组织样本所在微阵。构建6×10点阵的组织芯片6个,3个用于免疫组化染色,3个用于阴性对照,固定于多聚赖氨酸载玻片上,烤片6 h,制作完成。MiniCore组织芯片制作仪、石蜡切片机购自英国Mitogen公司。采用Claudin-4兔抗人多抗、P504s兔抗人多抗(购自北京博奥森生物技术有限公司),S-P及DAB试剂盒(购自CST生物有限公司)。严格按试剂盒说明书进行免疫组化染色实验。依次加入一抗,孵育完成后加入二抗继续孵育,各步骤间均以0.1% PBS洗5 min×3次。DAB显色,脱水透明,中性树胶封片,显微镜下观察。以抗体稀释液代替一抗作为阴性对照。
1.3 结果判断由2位有经验的病理科医师对染色结果参照免疫组化表达分级法进行双盲判断。在400倍光学显微镜下每张切片随机观察10个视野,按阳性细胞所占细胞数量百分比进行分级,分为4级:阴性(-);阳性细胞数占比1%~10%为弱阳性(+),占比11%~50%为中等阳性(++),占比>50%为强阳性(+++)。
1.4 分组标准前列腺癌Gleason评分系统是目前国际通用的病理分级。将前列腺癌组织分为主要分级区和次要分级区,每区的分值为1~5分。Gleason评分(总分)=主要分级区Gleason分值+次要分级区Gleason分值,其范围为2~10分。前列腺癌临床分期可以通过前列腺指肛检查(DRE)、MRI、骨扫描以及淋巴结切除来明确,目前国际上最新的为2017年AJCC第8版的前列腺癌TNM分期系统。临床上根据血清PSA、Gleason评分和临床分期将前列腺癌分为低、中、高危3个等级[8],其中低危患者和中、高危患者在治疗方法的选择和预后评估方面都有着截然不同的区别。本研究将前列腺癌患者根据Gleason评分≤6分和≥7分以及前列腺癌分期≤T2a期和≥T2b期进行分组并分析(表 1)。
| 分级标准 | 低危 | 中危 | 高危 |
| PSA/ng·mL-1 | < 10 | 10~20 | >20 |
| Gleason评分 | ≤6 | 7 | ≥8 |
| 临床分期 | ≤T2a | T2b | ≥T2c |
1.5 统计学分析
采用SPSS 22.0统计软件,不同组间率的比较采用χ2检验,计量资料以x±s表示,多个不同组间数据比较采用秩和检验并采用Spearman等级相关检验行相关性分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 P504s和Claudin-4蛋白在前列腺癌组织中的表达P504s蛋白主要表达定位于细胞质内,阳性表达为有黄色至棕黄色(或棕褐色)颗粒着色,Claudin-4蛋白主要表达在细胞膜上,阳性染色为细胞膜出现棕黄色颗粒(图 1)。
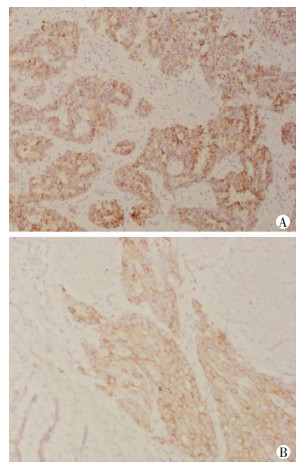
|
| 图 1 免疫组化检测前列腺癌组织中P504s(A)、Claudin-4 (B)蛋白的表达(S-P ×200) |
2.2 P504s和Claudin-4在前列腺增生和前列腺癌组织中的表达
P504s、Claudin-4在前列腺增生组织中的阳性表达率均显著低于前列腺癌组织(P < 0.01,表 2)。
| 组别 | n | P504s | Claudin-4 | |||||
| - | + | 阳性表达率 | - | + | 阳性表达率 | |||
| 前列腺癌 | 84 | 13 | 71 | 84.52 | 27 | 57 | 67.86 | |
| 前列腺增生 | 70 | 65 | 5 | 7.14 | 59 | 11 | 15.71 | |
| χ2值 | 61.04 | 38.93 | ||||||
| P值 | < 0.01 | < 0.01 | ||||||
2.3 P504s和Claudin-4蛋白在前列腺癌不同危险等级患者组织中的表达
Claudin-4蛋白表达在前列腺癌Gleason评分≤6分和≥7分两组之间的阳性表达率比较有明显差异(P < 0.05),在前列腺癌分期≤T2a期和≥T2b期两组之间的阳性表达比较亦有明显差异(P < 0.01)。P504s蛋白在前列腺癌Gleason评分≤6分和≥7分两组之间的阳性表达率没有明显差异,在前列腺癌分期≤T2a期和≥T2b期中阳性表达也未见明显差异(表 3、4)。
| Gleason评分 | n | P504s | Claudin-4 | |||||
| - | + | 阳性表达率 | - | + | 阳性表达率 | |||
| ≤6分 | 41 | 5 | 36 | 87.80 | 16 | 25 | 60.98 | |
| ≥7分 | 43 | 8 | 35 | 81.40 | 11 | 32 | 74.42 | |
| χ2值 | 0.635 | 4.25 | ||||||
| P值 | >0.05 | < 0.05 | ||||||
| 临床分期 | n | P504s | Claudin-4 | |||||
| - | + | 阳性表达率 | - | + | 阳性表达率 | |||
| ≤T2a期 | 38 | 6 | 32 | 84.21 | 17 | 21 | 55.26 | |
| ≥T2b期 | 46 | 7 | 39 | 84.78 | 10 | 36 | 78.26 | |
| χ2值 | 0.417 | 13.36 | ||||||
| P值 | >0.05 | < 0.01 | ||||||
3 讨论
前列腺癌的病理诊断大多依靠肿瘤组织特异性及细胞生物学的特异性,虽然有Gleason评分系统等工具,但有时单凭光镜下诊断会缺乏足够依据,特别是对于穿刺活检等样本较少的病理标本进行明确诊断,难度更大[9]。P504s是一种胞质蛋白,主要存在于过氧化物酶和线粒体上,其基因定位于染色体5p13,参与脂肪酸衍生物和脂肪酸的β氧化过程[10],是一种具有高度敏感性的前列腺癌阳性标记物[11]。本研究结果显示其在前列腺癌中的阳性表达率高达84.52%,表明P504s可以作为前列腺癌高度敏感的标记物,为前列腺癌与良性前列腺增生的鉴别诊断提供参考,进一步提高临床上部分低PSA患者前列腺癌诊断的检出率。但研究结果未发现表达强度和Gleason评分以及临床分期等不同前列腺癌危险因素之间存在相关性。
前列腺癌的发生和进展与基因调节的细胞异常增殖和凋亡功能散失有关。细胞间连接结构和功能的改变后,肿瘤细胞更易于脱离原发灶,穿过细胞间隙进入血管或淋巴管,引起肿瘤细胞的扩散和转移。Claudins蛋白家族是构成紧密连接的重要组成部分,参与维持细胞极化等细胞信号的传导。Claudins在多种上皮来源的恶性肿瘤中存在异常表达,并且与这些肿瘤发生和发展以及生存率有关,例如Claudin-3和Claudin-4在卵巢癌、膀胱癌、胰腺癌中呈现高表达[12-14]。本研究证实Claudin-4蛋白在前列腺癌组织中表达明显增高[15],且通过将Claudin-4蛋白在不同Gleason评分和临床分期等组间的阳性表达情况进行比较,发现在Gleason评分≥7分及临床分期≥T2b期患者中,Claudin-4蛋白阳性表达率有明显升高,提示Claudin-4蛋白可能与临床上前列腺癌疾病进展和异常分化相关,检测结果对前列腺组织标本进行辅助鉴别和明确诊断的同时,对患者的预后评估等方面有重要的意义。
本研究结果表明:联合检测P504s和Claudin-4蛋白的表达,可提高前列腺癌尤其是较复杂的前列腺标本诊断的敏感性,为前列腺癌与良性前列腺增生的鉴别诊断提供进一步参考;而且,Claudin-4蛋白表达可能和前列腺癌疾病进展和异常分化密切相关,对相应患者进行预后评估可起到重要的作用。但是Claudin-4在前列腺癌发生和进展中的具体作用机制以及如何参与前列腺癌的发生和进展,并与晚期前列腺癌转移复发之间有无确切关系等,尚需后续进一步研究探明。
| [1] |
SHOU J F, ZHANG Q, WANG S, et al. The prognosis of different distant metastases pattern in prostate cancer: A population based retrospective study[J]. Prostate, 2018, 78(7): 491-497. DOI:10.1002/pros.23492 |
| [2] |
杨进益, 杨明州, 魏伟, 等. 前列腺癌发生发展的流行病学研究进展[J]. 临床泌尿外科杂志, 2017, 32(9): 721-725. YANG J Y, YANG M Z, WEI W, et al. Epidemiological study on the occurrence and development of prostate cancer[J]. J Clin Urol, 2017, 32(9): 721-725. DOI:10.13201/j.issn.1001-1420.2017.09.018 |
| [3] |
STEPHAN C, JUNG K, SEMJONOW A, et al. Comparative assessment of urinary prostate cancer antigen 3 and TMPRSS2: ERG gene fusion with the serum[-2]proprostate-specific antigen-based prostate health index for detection of prostate cancer[J]. Clin Chem, 2013, 59(1): 280-288. DOI:10.1373/clinchem.2012.195560 |
| [4] |
LAZZERI M, HAESE A, DELA TAILLE A, et al. Serum isoform[-2]proPSA derivatives significantly improve prediction of prostate cancer at initial biopsy in a total PSA range of 2-10 ng/ml: a multicentric European study[J]. Eur Urol, 2013, 63(6): 986-994. DOI:10.1016/j.eururo.2013.01.011 |
| [5] |
REN S C, WANG F B, SHEN J, et al. Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1 derived miniRNA as a novel plasma-based biomarker for diagnosing prostate cancer[J]. Eur J Cancer, 2013, 49(13): 2949-2959. DOI:10.1016/j.ejca.2013.04.026 |
| [6] |
FADARE O, ZHAO C Q, KHABELE D, et al. Comparative analysis of Napsin A, alpha-methylacyl-coenzyme A racemase (AMACR, P504S), and hepatocyte nuclear factor 1 beta as diagnostic markers of ovarian clear cell carcinoma: an immunohistochemical study of 279 ovarian tumours[J]. Pathology, 2015, 47(2): 105-111. DOI:10.1097/PAT.0000000000000223 |
| [7] |
MARTÍNDELA FUENTE L, MALANDER S, HARTMAN L, et al. Claudin-4 expression is associated with survival in ovarian cancer but not with chemotherapy response[J]. Int J Gynecol Pathol, 2018, 37(2): 101-109. DOI:10.1097/PGP.0000000000000394 |
| [8] |
CARTERH B, ALBERTSENP C, BARRYM J, et al. Early detection of prostate cancer: AUA Guideline[J]. J Urol, 2013, 190(2): 419-426. DOI:10.1016/j.juro.2013.04.119 |
| [9] |
JAIN D, GUPTA S, MARWAH N, et al. Evaluation of role of alpha-methyl acyl-coenzyme A racemase/P504S and high molecular weight cytokeratin in diagnosing prostatic lesions[J]. J Cancer Res Ther, 2017, 13(1): 21-25. DOI:10.4103/0973-1482.206239 |
| [10] |
YEVGLEVSKIS M, LEEG L, SUN J, et al. A study on the AMACR catalysed elimination reaction and its application to inhibitor testing[J]. Org Biomol Chem, 2016, 14(2): 612-622. DOI:10.1039/c5ob01541c |
| [11] |
KAWANAMI T, TANAKA T, HAMAGUCHI Y, et al. Selective androgen receptor modulator S42 suppresses prostate cancer cell proliferation[J]. Endocrinology, 2018, 159(4): 1774-1792. DOI:10.1210/en.2018-00099 |
| [12] |
CUIY F, LIUA H, AND Z, et al. Claudin-4 is required for vasculogenic mimicry formation in human breast cancer cells[J]. Oncotarget, 2015, 6(13): 11087-11097. DOI:10.18632/oncotarget.3571 |
| [13] |
BHATA A, AHMAD R, UPPADAS B, et al. Claudin-1 promotes TNF-α-induced epithelial-mesenchymal transition and migration in colorectal adenocarcinoma cells[J]. Exp Cell Res, 2016, 349(1): 119-127. DOI:10.1016/j.yexcr.2016.10.005 |
| [14] |
TOKUHARA Y, MORINISHI T, MATSUNAGA T, et al. Nuclear expression of claudin-3 in human colorectal adenocarcinoma cell lines and tissues[J]. Oncol Lett, 2018, 15(1): 99-108. DOI:10.3892/ol.2017.7281 |
| [15] |
ROMANOV V, WHYARDT C, WALTZERW C, et al. A claudin 3 and claudin 4-targeted Clostridiumperfringens protoxin is selectively cytotoxic to PSA-producing prostate cancer cells[J]. Cancer Lett, 2014, 351(2): 260-264. DOI:10.1016/j.canlet.2014.06.009 |



