自2013年起,随着二代测序在肿瘤及血液病的广泛应用,各肿瘤的基因突变图谱已经逐渐清晰,一种肿瘤常有多种基因突变,不同的基因突变可以出现在同一种肿瘤亚型中[1-2]。不同的基因常可归结为不同的功能类[3];累及血液系统与髓系肿瘤相关的常见基因有[4]:与细胞增殖相关的信号通路相关基因NRAS、KRAS、C-KIT、FLT3、JAK2、CALR、MPL、SETBP1、CBL、CSF3R等;表观遗传学相关基因TET2、IDH1、IDH2、ASXL1、DNMT3A、EZH2、KMT2A等;转录因子相关基因NPM1、CEBPA、GATA2、WT1、RUNX1等;RNA剪接相关基因U2AF1、SF3B1、SRSF2、ZRSR2等;细胞周期相关基因TP53等。研究报道不同的基因在不同的肿瘤中的突变比例有差异,不同的肿瘤常有不同的基因突变类型组合[2, 4],但具体的各功能类的基因在各髓系肿瘤的突变比例和突变率(VAF值)有待更精细的研究。本研究着重对各髓系肿瘤的突变基因按功能类进行分类,讨论不同的功能类基因与肿瘤临床病理特点之间的关系,对本院305例初诊的急性髓系白血病(acute myeloid leukemia,AML)、骨髓增生异常综合征(myelodysplastic syndromes,MDS)、骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)、骨髓增生异常综合征/骨髓增殖性肿瘤(myelodysplastic/myeloproliferative neoplasms,MDS/MPN)等髓系肿瘤的各基因及各通路的基因突变比例及突变率进行比较分析,以助于更深刻地认识疾病的发病机制,更好地辅助临床诊断,诱导更精准的靶向治疗。
1 资料与方法 1.1 研究对象标本取自本院2017年1月至2019年1月初诊的305例髓系肿瘤患者,其中AML 186例,男性89例, 女性97例, 年龄1~70(43)岁;MDS 64例,男性37例, 女性27例, 年龄4~81(62)岁;MPN 27例(因慢性髓系白血病有特异的BCR-ABL融合基因,未纳入本研究中),男性11例, 女性16例, 年龄19~87(63)岁;MDS/MPN 28例,男性14例, 女性14例, 年龄29~92(56)岁。患者具体分型见表 1。采集2~4 mL骨髓标本进行髓系肿瘤常见突变基因二代测序检测。
| AML | MDS | MPN | MDS/MPN | |||||||
| 亚型 | 例数 | 亚型 | 例数 | 亚型 | 例数 | 亚型 | 例数 | |||
| M0 | 2 | RARS | 5 | PV | 4 | CMML | 12 | |||
| M1 | 19 | RCMD | 20 | ET | 17 | aCML | 6 | |||
| M2 | 65 | RAEB1 | 21 | PMF | 6 | RARS-T | 1 | |||
| M3 | 14 | RAEB2 | 18 | MDS/MPN-U | 9 | |||||
| M4 | 35 | |||||||||
| M5 | 43 | |||||||||
| M7 | 1 | |||||||||
| MRC | 7 | |||||||||
1.2 突变基因检测方法
骨髓标本按天根骨髓DNA提取试剂盒操作说明提取DNA,采用上海源奇生命科技有限公司的AML/MDS/MPN相关二代测序试剂盒对基因进行突变检测,检测基因包括NRAS、KRAS、C-KIT、FLT3、JAK2、CALR、MPL、SETBP1、CBL、CSF3R、TET2、IDH1、IDH2、ASXL1、DNMT3A、EZH2、KMT2A、NPM1、CEBPA、GATA2、WT1、RUNX1、U2AF1、SF3B1、SRSF2、ZRSR2、TP53、PHF6等。
1.3 统计学分析利用GraphPad 7.0制作各个患者的基因突变分布图及各基因突变率的分布图;分析各通路基因在AML、MDS、MPN、MDS/MPN的突变比例,比较其差异。
2 结果 2.1 髓系肿瘤的单个基因突变比例305例髓系肿瘤患者共检测到30个基因的606个突变,每例有0~7个基因突变:47例(15.4%)未检测到基因突变,177例(58.0%)检测到2个及以上基因突变,检测到突变基因的病例的突变情况见图 1、2。各髓系肿瘤突变最多的10个基因见表 2。
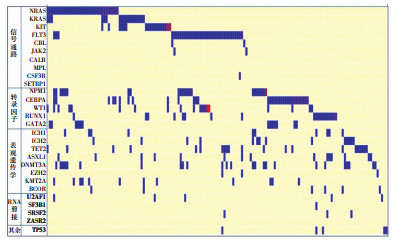
|
| 图 1 159例AML患者的基因突变图谱 |
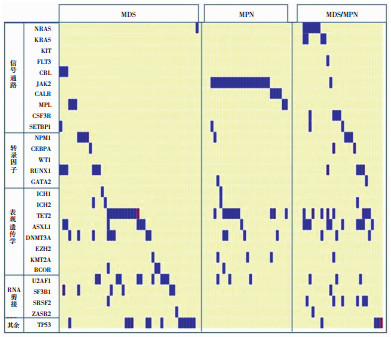
|
| 图 2 46例MDS、26例MPN和27例MDS/MPN患者的基因突变图谱 |
| AML(186例) | MDS(64例) | MPN(27例) | MDS/MPN(28例) | |||||||
| 突变基因 | 比例(%) | 突变基因 | 比例(%) | 突变基因 | 比例(%) | 突变基因 | 比例(%) | |||
| CEBPA | 22.6 | TP53 | 21.9 | JAK2 | 74.1 | TET2 | 39.3 | |||
| NRAS | 22.0 | TET2 | 20.3 | TET2 | 40.7 | ASXL1 | 35.7 | |||
| FLT3 | 20.6 | U2AF1 | 17.2 | DNMT3A | 14.8 | NRAS | 21.4 | |||
| WT1 | 14.5 | DNMT3A | 12.5 | CALR | 14.8 | RUNX1 | 21.4 | |||
| DNMT3A | 13.4 | RUNX1 | 10.9 | KMT2A | 11.1 | TP53 | 21.4 | |||
| C-KIT | 13.4 | SF3B1 | 10.9 | U2AF1 | 11.1 | SRSF2 | 21.4 | |||
| NPM1 | 12.4 | ASXL1 | 9.4 | MPL | 7.4 | KRAS | 14.3 | |||
| TET2 | 11.8 | NPM1 | 7.8 | NPM1 | 3.7 | CEBPA | 14.3 | |||
| RUNX1 | 11.3 | MPL | 4.7 | IDH1 | 3.7 | CSF3R | 14.3 | |||
| KRAS | 10.2 | CBL | 4.7 | IDH2 | 3.7 | NPM1 | 10.7 | |||
2.2 髓系肿瘤基因通路的基因突变比例
305例髓系肿瘤患者各个基因通路中的基因突变比例见表 3。信号通路相关基因在AML、MPN和MDS/MPN中的突变比例均>50%;在MPN中,26例(96.3%)有JAK2、CALR、MPL基因突变中的1种,这3个基因均属于JAK-STAT信号通路;在MDS中其突变比例<10%,而且NRAS、KRAS、KIT和FLT3这几种信号通路相关基因只见于1例MDS,这例MDS的形态学表现为骨髓增生明显活跃,粒系颗粒粗重伴病态造血。转录因子相关基因在AML中的突变比例>50%,在MPN中的突变比例<5%。表观遗传学相关基因在4个髓系肿瘤中突变比例均>50%。RNA剪接相关基因在MDS和MDS/MPN中突变比例均>30%,在AML中的突变比例<5%,在MPN中其突变均出现在原发性骨髓纤维化中。
| 疾病类型 | 信号通路 | 转录因子 | 表观遗传学 | RNA剪接 |
| AML | 59.1 | 61.8 | 57.5 | 4.8 |
| MDS | 7.8 | 17.1 | 50.1 | 31.3 |
| MPN | 96.3 | 3.7 | 74.0 | 11.1 |
| MDS/MPN | 64.3 | 14.3 | 82.1 | 39.3 |
2.3 305例髓系肿瘤常见突变基因的突变率
由于肿瘤的异质性,同一基因不同肿瘤个体的突变率有差异,可能某个基因在某个个体有100%的突变率,而在另一个个体只有10%的突变率。305例髓系肿瘤常见突变基因的突变率(VAF值)及其中位值见图 3。大多数基因的VAF值<50%,说明多数基因可能为单等位基因突变,CEBPA、TET2和DNMT3A基因突变率接近100%的个体较多,可能为早期双等位基因突变。TET2、DNMT3A基因和部分NRAS基因在50%左右突变率处有较为明显的聚集,可能为早期基因突变。NRAS、KRAS和C-KIT基因在低突变率5%左右有较为明显的聚集,可能为晚期基因突变。NRAS、KRAS和C-KIT基因的中位突变率低于其余基因。
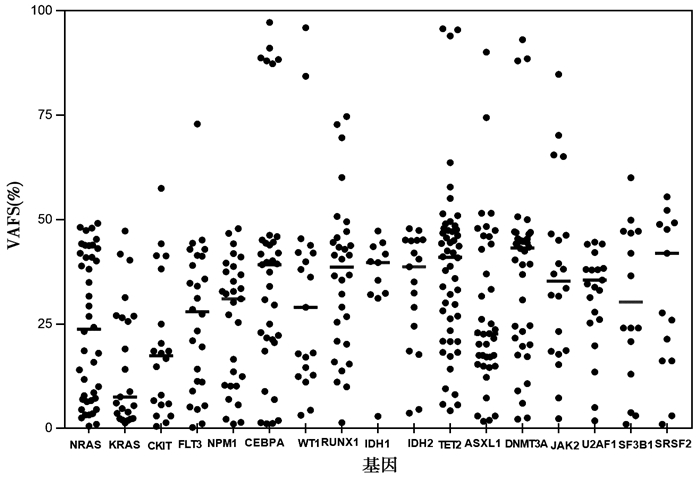
|
| 图 3 305例髓系肿瘤常见突变基因的突变率(VAF值)及其中位值 |
3 讨论
随着二代测序技术的进步和临床普及,AML、MDS等髓系肿瘤的基因改变图谱已经越来越清晰,我国也有相关的研究报道。在2018年上海瑞金医院WANG等[5]的报道中,145例AML患者一共发现了39个基因的503个突变,NPM1、CEBPA、DNMT3A、GATA2、NRAS、TET2、FLT3、IDH2和WT1的突变比例超过10%;2016年北京WANG等[6]对95例患者进行101个基因的筛查,结果CEBPA、NPM1、DNMT3A、FLT3-ITD、NRAS、IDH2、WT1基因的突变比例超过10%。本研究显示,CEBPA、NRAS、FLT3、WT1、DNMT3A、KIT、NPM1、TET2、RUNX1、KRAS的突变比例均超过10%,与文献[5-6]报道类似,且CEBPA、NPM1、DNMT3A、FLT3、NRAS、WT1在3个研究中的突变比例均居于前几位,而排位的差异和其余前几位基因的差异可能来源于病源,如南北差异、病情严重程度差异等。在2017年程焕臣等[7]对57例MDS的研究中,突变前几位的基因为TET2(56.1%),U2AF1、SRSF2(均为10.5%),SF3B1、DNMT3A、TP53、CEBPA(均为5.3%),与本研究的数据类似。随着CALR基因突变的发现[8],MPN的基因突变已比较明确,90%以上的除CML以外的MPN都有JAK2、CALR和MPL突变中的一种。本研究纳入的MPN病例数偏少,仅为27例,这些病例96.3%检测到JAK2、CALR和MPL基因突变的一种,且有66.7%的病例检测到2种及以上基因突变。MDS/MPN临床较少见,诊断具有难度,大规模的研究也较少[9],本研究纳入28例形态学诊断比较典型的MDS/MPN,仍有9例归类为MDS/MPN-U。MDS/MPN中仅1例(3.6%)未检测到基因突变,17例(60.1%)检测到2个及以上基因突变,基因突变率高,基因检测有助于辅助临床诊断。
单纯对比各个髓系肿瘤前10位基因的突变比例有一定差异,单独的基因改变对疾病的诊断也有一定的辅助意义,例如在AML中,CEBPA双突变和NPM1突变的AML均被WHO2016单独列为一类[10]。在本研究中CEBPA和NPM1在AML中的突变比例相对高,但这两个基因在MDS/MPN和MDS中也分别有一定的突变比例;CSF3R突变被认为是慢性中性粒细胞白血病(chronic neutrophilic leukemia,CNL)特征性的基因改变[10]。本研究中CSF3R突变阳性的4例肿瘤,2例被诊断为CMML,2例被诊断为MDS/MPN-U,这4例肿瘤的CNL的形态学和临床表现均很不充分,故即使在应用指南中提到的对疾病的诊断具有重要意义的基因突变时也需要结合特定的形态学和临床背景。同一基因改变可出现在不同的肿瘤亚型中,即使是对疾病诊断分型有重要意义的基因仍有此种情况发生,让我们考虑用另一种方式比较不同肿瘤的突变基因的差异。即把这些基因按照功能归类后,比较其差异。一种肿瘤的基因改变类型与其病理和表型特点密切相关,在上述4个髓系肿瘤中,MDS以病态造血为主要病理特点,MPN以过度增殖为主要特点,MDS/MPN有病态造血和过度增殖两个主要特点,AML以细胞分化受阻停留在原始阶段为主要特点,部分病例伴过度增殖,部分伴有典型病态造血[10]。信号通路相关基因与细胞增殖相关,转录因子相关基因与细胞分化相关,故MPN和增殖旺盛的肿瘤以信号通路相关基因突变为特点,而AML和可能向AML转化的肿瘤则转录因子相关基因突变比例高。RNA剪接相关基因突变与MDS和MDS/MPN关系密切,可能与病态造血有一定关联[11]。表观遗传学基因调控整个机体的表观遗传学和基因表达状态,作用比较广谱,其突变与髓系肿瘤特别是年龄相关的多个肿瘤关系密切[12]。
不同功能类的基因可同时出现突变,AML的发病机制长期以来都被认为符合“二次打击模型”,即影响细胞分化的转录因子相关基因突变和影响细胞增殖的信号通路相关基因突变同时作用导致细胞的恶性转化和增殖,如PML-RARα和FLT3基因突变同时作用导致AML-M3的形成。近年来随着表观遗传学及RNA剪接相关基因突变的发现,有人提出AML发病机制新的模型,即符合多个功能类基因随机相继发生突变的一个老虎机模型[2, 13]。本研究中,177例(58.0%)检测到2个及以上基因突变,4个功能类的基因突变可以任意2个或者3个组合发生。理论上认为,同一功能类内的基因常不倾向于同时发生突变,因为其将对细胞造成致命性的打击,而非恶性转化[13-14];但是在AML中,信号通路相关基因常可同时出现在同一病例中[2]。本研究中,信号通路内不同基因同时出现突变的比例为13.8%(22/159),表观遗传学内不同基因同时出现突变的比例为18.6%(34/182),高于转录因子的6.1%(12/131)和RNA剪接的2.3%(1/43);信号通路内不同基因突变的同时出现可能是因为其出现的细胞不一样,如NRAS突变出现在细胞1,C-KIT突变出现在细胞2,而表观遗传学内不同基因突变同时出现的比例高,可能是因为表观遗传学对细胞的功能影响作用相对较小[14]。
肿瘤的形成不仅有多个基因突变的共同作用,其突变的先后顺序也不一样,被认为是一个符合达尔文自然选择理论的多步骤进化演变过程[14]。在CMML中,先后出现的基因改变决定了肿瘤的表型[9, 15],TET2、SRSF2、ASXL1基因常最早出现突变,而后期如果出现RAS突变的CMML的表型主要特点是增殖过度,如果出现SF3B1和U2AF1突变的CMML的表型主要特点是病态造血。本研究中,TET2、DNMT3A和部分NRAS基因在50%左右突变率处聚集,部分NRAS、KRAS和C-KIT基因在低突变率5%左右聚集为早期、晚期基因突变的判断提供了一个参考;可能多数表观遗传学相关基因突变更倾向于早期突变,信号通路相关基因突变更倾向于晚期突变(突变率低)。肿瘤的克隆结构与靶向治疗的效果密切相关。目前针对信号通路相关基因FLT3、C-KIT、RAS、ABL和表观遗传学相关基因都有相应的靶向药物应用于临床[16],但是疗效和使用范围还需要进一步探索。如果这些靶向药物作用的基因为晚期突变或只突变于部分细胞,则不能起到根治的目的,未杀死的细胞成为一个复发源。所以对于不同髓系肿瘤突变的基因种类和突变率的认识有助于加深对疾病本质的认识,同时辅助临床诊断和靶向治疗。
| [1] |
KANDOTH C, MCLELLAN M D, VANDIN F, et al. Mutational landscape and significance across 12 major cancer types[J]. Nature, 2013, 502(7471): 333-339. DOI:10.1038/nature12634 |
| [2] |
Cancer Genome Atlas Research Network, LEY T J, MILLER C, et al. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia[J]. N Engl J Med, 2013, 368(22): 2059-2074. DOI:10.1056/NEJMoa1301689 |
| [3] |
GARRAWAY L A, LANDER E S. Lessons from the cancer genome[J]. Cell, 2013, 153(1): 17-37. DOI:10.1016/j.cell.2013.03.002 |
| [4] |
HUSSAINI M O, MIRZA A S, KOMROKJI R, et al. Genetic landscape of acute myeloid leukemia interrogated by next-generation sequencing: A large cancer center experience[J]. Cancer Genom Proteom, 2018, 15(2): 121-126. DOI:10.21873/cgp.20070 |
| [5] |
WANG S, ZHANG Y X, HUANG T, et al. Mutation profile and associated clinical features in Chinese patients with cytogenetically normal acute myeloid leukemia[J]. Int J Lab Hematol, 2018, 40(4): 408-418. DOI:10.1111/ijlh.12802 |
| [6] |
WANG B, LIU Y, HOU G, et al. Mutational spectrum and risk stratification of intermediate-risk acute myeloid leukemia patients based on next-generation sequencing[J]. Oncotarget, 2016, 7(22): 32065-32078. DOI:10.18632/oncotarget.7028 |
| [7] |
程焕臣, 刘生伟, 刘宇, 等. 二代测序在AML/MDS诊治中的应用研究[J]. 中国实验血液学杂志, 2017, 25(6): 1631-1635. CHENG H C, LIU S W, LIU Y, et al. Application of next generation sequencing for AML/MDS diagnosis and treatment[J]. J Exp Hematol, 2017, 25(6): 1631-1635. |
| [8] |
KLAMPFL T, GISSLINGER H, HARUTYUNYAN A S, et al. Somatic mutations of calreticulin in myeloproliferative neoplasms[J]. N Engl J Med, 2013, 369(25): 2379-2390. DOI:10.1056/NEJMoa1311347 |
| [9] |
PATEL B J, PRZYCHODZEN B, THOTA S, et al. Genomic determinants of chronic myelomonocytic leukemia[J]. Leukemia, 2017, 31(12): 2815-2823. DOI:10.1038/leu.2017.164 |
| [10] |
ARBER D A, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391-2405. DOI:10.1182/blood-2016-03-643544 |
| [11] |
SHALLIS R M, AHMAD R, ZEIDAN A M. The genetic and molecular pathogenesis of myelodysplastic syndromes[J]. Eur J Haematol, 2018, 101(3): 260-271. DOI:10.1111/ejh.13092 |
| [12] |
SPERLING A S, GIBSON C J, EBERT B L. The genetics of myelodysplastic syndrome: from clonal haematopoiesis to secondary leukaemia[J]. Nat Rev Cancer, 2017, 17(1): 5-19. DOI:10.1038/nrc.2016.112 |
| [13] |
MURATI A, BRECQUEVILLE M, DEVILLIER R, et al. Myeloid malignancies: mutations, models and management[J]. BMC Cancer, 2012, 12: 304. DOI:10.1186/1471-2407-12-304 |
| [14] |
BOWMAN R L, BUSQUE L, LEVINE R L. Clonal hematopoiesis and evolution to hematopoietic malignancies[J]. Cell Stem Cell, 2018, 22(2): 157-170. DOI:10.1016/j.stem.2018.01.011 |
| [15] |
DEININGER M W N, TYNER J W, SOLARY E. Turning the tide in myelodysplastic/myeloproliferative neoplasms[J]. Nat Rev Cancer, 2017, 17(7): 425-440. DOI:10.1038/nrc.2017.40 |
| [16] |
PERL A E. The role of targeted therapy in the management of patients with AML[J]. Hematology Am Soc Hematol Educ Program, 2017, 2017(1): 54-65. DOI:10.1182/asheducation-2017.1.54 |



