2. 基础医学院病理生理学教研室
2. Department of Pathophysiology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
脑出血(intracerebral hemorrhage,ICH)是一种极具破坏性的卒中亚型,全球年死亡率约为43.1人/10万人[1],5年病死率约为70%[2],大多数幸存者患有不同程度的神经功能障碍[3]。虽历经多年研究,但其治疗手段仍有限,探索新的治疗方式是近年来的研究热点。研究表明,脑出血急性期诱发的氧化应激是加剧脑出血后继发脑损伤的关键因素。ICH后,机体释放的大量活性氧(reactive oxygen species, ROS)和自由基致脂质过氧化、线粒体功能障碍和溶酶体损伤等加速神经细胞的死亡和加重脑损伤[4-5]。因此,探寻脑出血后氧化应激损伤相关的内源性蛋白质可能为脑出血的基础研究和治疗提供新的依据。
酪氨酸激酶Fyn(tyrosine kinase Fyn)是Src激酶家族(Src family kinases, SFK)中的一员,参与神经细胞的生长、分化、信号转导等[6]。研究表明,酪氨酸磷酸酶的抑制减轻了急性肺损伤的氧化应激损伤[7],突变Fyn的酪氨酸213位点致人肝母细胞瘤Nrf2与NQO1表达减低,此外Fyn的缺失在抑郁症、帕金森和阿尔茨海默等多种神经疾病中发挥神经保护作用[8-12],但其在脑出血中的作用仍未可知。
核因子E2相关因子2(factor erythroid 2-related factor 2, Nrf2)是细胞抵抗氧化损伤的主要调节因子[13],通过调控抗氧化反应元件(anti-oxidative response element, ARE)诱导下游抗氧化基因表达,如GST、HO-1、SOD、NQO-1等,在减轻氧化应激损伤和维持体内氧化和抗氧化的平衡中起着重要作用[14-16]。多项研究表明,在脑缺血(middle cerebral artery occlusion, MCAO)模型后24 h,Nrf2及其靶向抗氧化基因HO-1和SOD的蛋白表达水平在大鼠的缺血半暗带周围皮质中增加[17]。ICH模型中,Nrf2激活对大鼠具有抗氧化应激损伤作用[18]。
本研究采用小干扰片段侧脑室注射的方法抑制Fyn的表达,用自体血法构建大鼠ICH模型,探讨抑制Fyn在大鼠脑出血后氧化应激中的作用及其可能的机制,为临床治疗ICH提供新思路和基础实验依据。
1 材料与方法 1.1 实验材料Nrf2、β-actin、兔二抗及鼠二抗抗体购于武汉三鹰,HO-1购于上海生工,NQO-1购于美国Affinity。Evans blue及尼氏染色试剂盒购于美国Sigma。总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(WST-1法)、丙二醛(malondialdehyde,MDA)测定试剂盒(TBA法)、还原型谷胱甘肽(glutathione,GSH)测定试剂盒(分光光度法)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测定试剂盒(比色法)、过氧化氢测定试剂盒(比色法)均购于南京建成生物科技公司。
1.2 体内转染siRNAICH建模前24 h侧脑室注射大鼠Fyn基因的小干扰片段(Si-Fyn,上海吉玛),Negative control RNA(Si-NC)作为阴性对照。大鼠麻醉后固定于脑立体定位仪,用微量注射泵将Si-RNA(浓度250 μmol/L,体积10 μL)以0.5 μL/min的速度注入大鼠右侧侧脑室(前囟后1.0 mm, 右旁开2.0 mm,深3.5 mm),留针10 min后缝合头皮。Fyn siRNA序列:正义链:5′-CCC-AAGAGGUACCUUUCUUTT-3′,反义链:5′-AAGAAAGGUACCUCUUGGGTT-3′;Negative control RNA序列:正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′。
1.3 ICH模型的制备及分组8~12周龄、体质量(300±20)g的SPF级雄性SD大鼠,由重庆医科大学实验动物中心提供。本研究获得重庆医科大学医学研究伦理委员会批准(2017年11月15日)。大鼠经4%水合氯醛(1 mL/100 g)腹腔注射麻醉后,分离股动脉并采血50 μL备用,固定大鼠于脑立体定位仪(深圳瑞沃德),用微量注射泵将50 μL自体血于10 min内匀速(5 μL/min)注射入大鼠右基底节(前囟后0.2 mm, 右旁开3 mm,深5.8 mm),留针10 min以防止血液反流,缓慢拔针,缝合头皮。术中维持大鼠体温(37.0±0.5)℃。96只大鼠编号后采用随机数字表法分为4组:Sham组、ICH组、ICH+Si-NC组和ICH+Si-Fyn组,其中Sham组24只;ICH组初建模28只,ICH 1 d后存活24只;ICH+Si-NC组初建模29只,ICH 1 d后存活24只;ICH+Si-Fyn组初建模25只,ICH 1 d后存活24只。Sham组注入50 μL生理盐水[19],ICH组仅建立ICH模型,ICH+Si-NC组侧脑室注射Si-NC 24 h后建立ICH模型,ICH+Si-Fyn组侧脑室注射Si-Fyn 24 h后建立ICH模型。ICH 24 h后,每组6只大鼠评分后用于Nissl染色,每张切片取同侧大脑半球血肿周围髓质中6个显微镜视野(×200倍)。另外,每组6只大鼠ICH 24 h后生理盐水灌注取脑用于Western blot检测,6只用于氧化应激试剂盒的检测,其余每组6只用于血脑屏障通透性的检测。
1.4 尼氏染色石蜡切片脱蜡脱苯后,焦油紫工作液染色15 min,蒸馏水中漂洗10 min,将切片依次在70%、85%、95%和100%乙醇中各2 min,随后将切片置于二甲苯中约10 min, 滴加中性树胶加盖盖玻片封片。
1.5 神经功能评分ICH 24 h后采用改良加西亚评分[20]和平衡木实验评分[21]。改良加西亚评分主要包括6项:自发运动、四肢运动的对称性、前爪伸展、本体感觉、触碰反应和触须反应。评分越低损伤越重,而平衡木实验评分越高损伤越重。
1.6 血脑屏障通透性检测ICH 24 h后,大鼠股静脉内给予伊文思蓝(Evans Blue)染料(4%EB,5 mL/kg,Sigma),使其循环1 h后先用生理盐水灌注,后予以4%多聚甲醛灌注后取脑,置于4%多聚甲醛中固定2 d,10%、20%、30%蔗糖梯度脱水,快速冰冻后切片(厚度8 μm),Olympus共聚焦显微镜采图。
1.7 分光光度计检测ICH大鼠血肿周围脑组织的SOD、GSH、GSH-PX、MDA、H2O2含量ICH 24 h后,取各组血肿周围脑组织约0.5 g研磨匀浆,离心取上清液后,按照各试剂盒说明书分别检测。
1.8 Western blot检测取右基底节血肿周围约150 mg脑组织研磨并提取组织上清液后,用BCA法测蛋白浓度。将蛋白质样品(50 μg/泳道)上样于10%或12% SDS聚丙烯酰胺凝胶上,电泳分离并电转至PVDF膜(Millipore公司),5%的脱脂牛奶室温封闭2 h。将PVDF膜转入Fyn、Nrf2、HO-1和NQO1的一抗稀释液(1 :1 000 TBST稀释)4 ℃孵育过夜,之后用TBST洗膜(5 min×4次),二抗室温孵育1 h后再次用TBST洗膜(5 min×4次),随后用化学发光液检测试剂盒(Affinity公司)显影。使用Image Lab软件分析蛋白条带。
1.9 统计学分析数据以x±s表示。使用GraphPad Prism 7.0进行统计分析。单因素方差分析进行组间比较,非配对t检验用于两组之间的统计分析。检验水准α=0.05。
2 结果 2.1 验证小干扰片段抑制Fyn表达的效果大鼠侧脑室注射Fyn干扰片段48 h(即ICH建模后24 h)后, Western blot检测干扰效果:与sham组相比,ICH组Fyn表达增加(P < 0.01);ICH组与ICH+Si-NC组差异无统计学意义;与ICH+Si-NC组相比,ICH+Si-Fyn组Fyn表达明显减低(P < 0.01,图 1),提示Fyn干扰片段可有效抑制Fyn的表达。
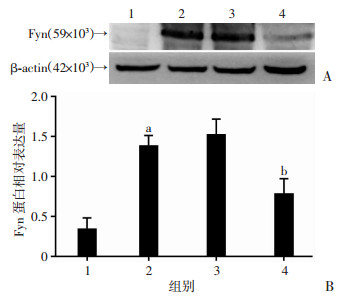
|
| 1:Sham组;2:ICH组;3:ICH+Si-NC组;4:ICH+Si-Fyn组;A:大鼠脑组织Fyn蛋白表达;B:大鼠脑组织Fyn相对蛋白表达量分析a:P < 0.01,与Sham组比较; b:P < 0.01,与ICH+Si-NC组比较 图 1 侧脑室注射Fyn基因的小干扰片段对大鼠脑组织Fyn蛋白表达的影响 |
2.2 抑制Fyn后可减少ICH大鼠神经元变性坏死
大鼠脑组织尼氏染色切片荧光显微镜镜下观察:与Sham组相比,ICH组染色较浅,大鼠脑组织间质疏松肿胀,神经元数量及尼氏小体明显减少,细胞核固缩、移位、溶解。ICH组与ICH+Si-NC组无明显差异。与ICH+Si-NC组相比,ICH+Si-Fyn组染色较深,脑组织间质疏松减轻,神经元数量及尼氏小体增加,细胞核固缩、移位、溶解减轻(图 2)。
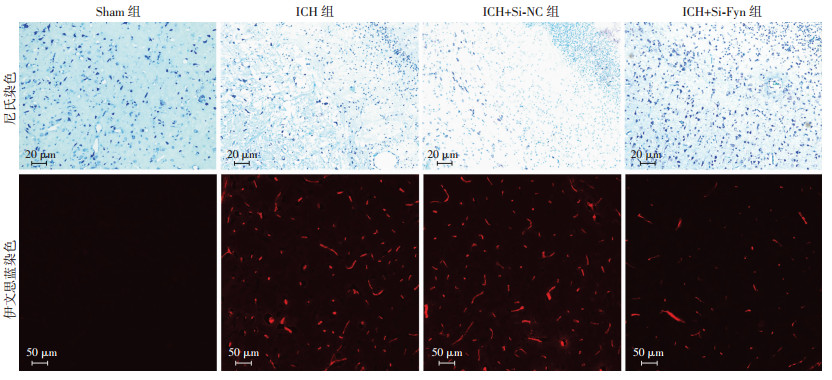
|
| 图中红色荧光示渗透入大鼠脑组织中的伊文思蓝 图 2 抑制Fyn对各组大鼠脑组织和血脑屏障通透性的影响 |
2.3 抑制Fyn后可降低ICH大鼠血脑屏障通透性
图 2中红色荧光含量表示渗透入大鼠脑组织中的伊文思蓝染料,红色荧光含量越多,表示渗透入大鼠脑组织中的伊文思蓝染料越多,即对血脑屏障的破坏越重。ICH组在ICH 24 h后用伊文思蓝法检测血脑屏障通透性,结果显示:与sham组相比,ICH组红色荧光含量明显增多;ICH组与ICH+Si-NC组无明显差异;与ICH+Si-NC组相比,ICH+Si-Fyn组红色荧光含量明显减少。
2.4 抑制Fyn后可改善ICH大鼠神经功能评分与Sham组相比,ICH组在ICH 24 h后改良Garcia评分显著减低(P < 0.01, 图 3A),平衡木实验评分明显增加(P < 0.01, 图 3B),提示ICH引起大鼠显著的神经功能缺损,而ICH组与ICH+Si-NC组差异无统计学意义,表明ICH+Si-NC组RNA处理不影响神经学结果。与ICH+Si-NC组相比,ICH+Si-Fyn组改良Garcia评分增加,平衡木实验评分明显减低(P < 0.01)。
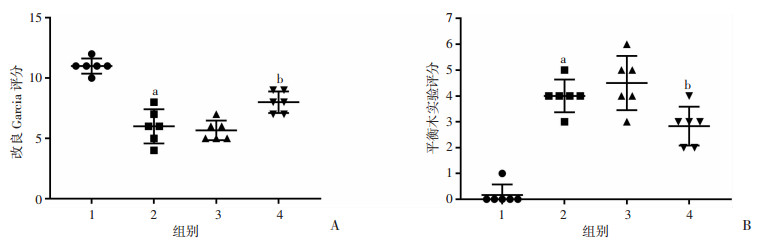
|
| 1:Sham组;2:ICH组;3:ICH+Si-NC组;4:ICH+Si-Fyn组;A:改良Garcia评分;B:平衡木实验评分a:P < 0.01,与Sham组比较;b:P < 0.05,与ICH+Si-NC组比较 图 3 抑制Fyn对各组大鼠神经功能的影响 |
2.5 抑制Fyn后可增加ICH大鼠脑组织SOD、GSH、GSH-PX含量
ICH后24 h, 取大鼠血肿周围脑组织用于检测SOD、GSH、GSH-PX含量。与Sham组相比,ICH组氧化损伤加重,SOD(图 4A)、GSH(图 4B)、GSH-PX活力(图 4C)减低(P < 0.01),ICH组与ICH+Si-NC组差异无统计学意义。与ICH+Si-NC组相比,抑制Fyn可有效增加血肿周围脑组织中SOD、GSH、GSH-PX活力(P < 0.01)。
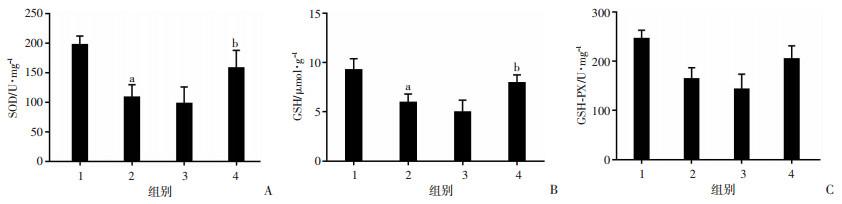
|
| 1:Sham组;2:ICH组;3:ICH+Si-NC组;4:ICH+Si-Fyn组;A: SOD;B:GSH;C:GSH-PX活力a:P < 0.01,与Sham组比较;b:P < 0.01,与ICH+Si-NC组比较 图 4 抑制Fyn对各组大鼠脑组织SOD、GSH、GSH-PX含量的影响 |
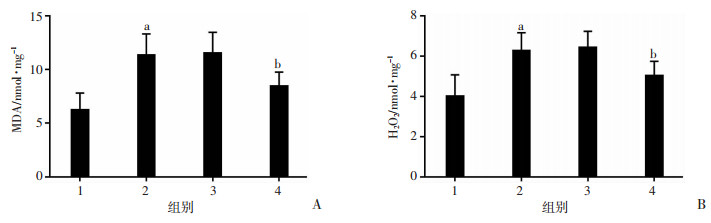
2.6 抑制Fyn后可减低ICH大鼠MDA、H2O2含量
ICH后24 h, 取大鼠血肿周围脑组织用于检测MDA、H2O2含量。与Sham组相比,ICH组氧化损伤加重,MDA(图 5A)、H2O2(图 5B)含量增加(P < 0.01),ICH组与ICH+Si-NC组无统计学差异。与ICH+Si-NC组相比,抑制Fyn可有效减低血肿周围脑组织中MDA、H2O2含量(P < 0.01)。
|
| 1:Sham组;2:ICH组;3:ICH+Si-NC组;4:ICH+Si-Fyn组;A:大鼠脑组织MDA含量;B:大鼠脑组织H2O2含量a:P < 0.01,与Sham组比较;b:P < 0.01,与ICH+Si-NC组比较 图 5 抑制Fyn后对大鼠脑组织MDA、H2O2含量的影响 |
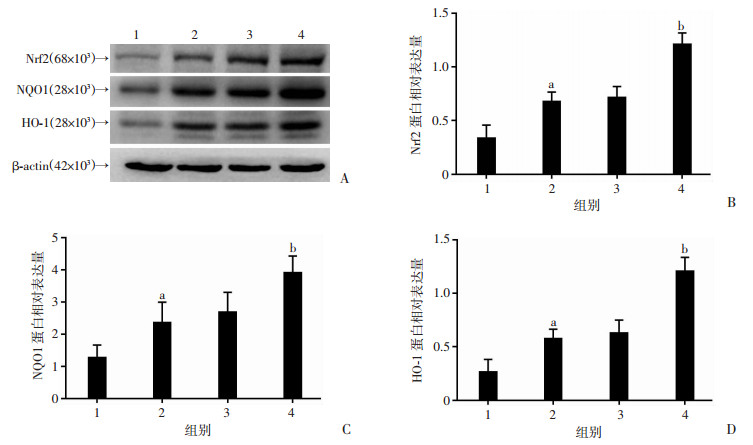
2.7 抑制Fyn增加脑组织中Nrf2、HO-1、NQO1的表达
ICH后24 h, Western blot检测大鼠血肿周围脑组织中Nrf2、HO-1、NQO1的表达,结果示:与Sham组相比,ICH组Nrf2及其下游蛋白HO-1、NQO1表达增加(P < 0.01);ICH组与ICH+Si-NC组差异无统计学意义;与ICH+Si-NC组相比,ICH+Si-Fyn组Nrf2、HO-1、NQO1表达明显减低(P < 0.01, 图 6)。
|
| 1:Sham组;2:ICH组;3:ICH+Si-NC组;4:ICH+Si-Fyn组;A:大鼠脑组织Nrf2、HO-1、NQO1蛋白表达;B:大鼠脑组织Nrf2蛋白相对表达量;C:大鼠脑组织NQO1蛋白相对表达量;D:大鼠脑组织HO-1蛋白相对表达量a:P < 0.01,与Sham组比较;b:P < 0.01,与ICH+Si-NC组比较 图 6 抑制Fyn对大鼠脑组织Nrf2、HO-1、NQO1表达的影响 |
3 讨论
抑制脑出血后继发神经功能损伤对于脑出血患者生活质量的提升具有重要的意义,因此,深入探究ICH的后氧化应激、炎症、线粒体功能障碍、凋亡与自噬等引起的继发损伤的机制对该疾病的发生、发展至关重要[17, 22]。体内氧化和抗氧化的失衡诱发氧化应激,而氧化应激损伤被证实是加剧脑出血后继发脑损伤的关键因素,研究认为清除体内过量的自由基和活性ROS有利于减轻脑出血后脑损伤[4-5]。
Fyn参与多种疾病的氧化应激损伤,如抑制Fyn可减轻高糖诱导的内皮细胞损伤[23],抑制GSK-3β/Fyn通路可减轻由内质网应激介导的铀诱导的肾细胞凋亡等[24]。且Fyn参与多种神经疾病的发生、发展, 研究表明,在AD小鼠模型中,过表达Fyn加速神经细胞中的突触丢失和认知障碍的发作[25]。另一项研究表明,抑制Fyn的表达可减轻癫痫发生过程中的神经炎症[12]。但Fyn在脑出血的作用尚未探明。本研究证实SFK家族成员Fyn可减轻ICH大鼠脑出血后氧化应激损伤。通过siRNA干扰的方式抑制Fyn的蛋白表达,Western blot检测侧脑室注射小干扰片段对Fyn蛋白表达的抑制效果,结果显示:与ICH+Si-NC组相比,Fyn的蛋白表达量明显降低,提示Fyn的表达被有效抑制。与ICH+Si-NC组相比,抑制Fyn可显著减轻ICH大鼠神经元的变性坏死,改善神经功能评分和降低血脑屏障通透性。
Nrf2是机体维持氧化和抗氧化平衡的重要转录因子,本研究检测了Nrf2/ARE信号通路中Nrf2的蛋白表达水平及其下游因子HO-1,NQO1的表达。研究发现:与ICH+Si-NC组相比,抑制Fyn后Nrf2的蛋白表达量明显增高,其下游因子HO-1,NQO1也显著增加,说明抑制Fyn激活了Nrf2/ARE信号通路的活性,从而有效促进了下游抗氧化因子的表达,对抗ICH后的氧化应激对脑组织的损伤,改善神经功能。SOD、GSH、GSH-PX是体内重要的抗氧化物酶,对于机体抵抗氧化损伤至关重要[26]。本研究结果表明:与ICH+Si-NC组相比,抑制Fyn后脑组织SOD、GSH、GSH-PX活力明显增加,表明抑制Fyn可增加抗氧化能力。MDA是脂质过氧化的副产物,是氧化损伤的可靠标志物,H2O2是ROS的重要组成部分[27]。因此,本研究检测了血肿周围组织MDA和H2O2含量。与ICH+Si-NC组相比,抑制Fyn后脑组织MDA和H2O2含量显著减低,上述结果表明抑制Fyn可减轻大鼠脑出血后氧化应激损伤,再次验证抑制Fyn激活了Nrf2/ARE信号通路。但在此模型中,通过侧脑室注射干扰片段,我们仅证实抑制Fyn减轻大鼠脑出血后氧化应激损伤可能与激活Nrf2信号通路有关,还需进一步确认该通路的激活及效应。而且实验仅涉及蛋白层面,抑制Fyn对Nrf2/ARE信号通路的mRNA的影响,是否涉及Fyn和Nrf2的核转位和磷酸化,是否存在蛋白与蛋白的直接或间接相互作用,以及在生理状态下Fyn的上游调控机制等,这些问题仍值得进一步探究。
综上,本研究表明:抑制Fyn可减轻大鼠脑出血后氧化应激损伤,改善神经功能和减轻血脑屏障通透性。这种作用可能通过诱导Nrf2/ARE信号通路的活化,增加Nrf2/ARE信号通路下游HO-1、NQO1、SOD等抗氧化因子的表达来实现。因此,抑制Fyn蛋白的表达水平可能是减轻脑出血后氧化应激损伤的一种新策略。
| [1] |
GBD CAUSES OF DEATH COLLABORATORS. Global, regional, and national age-sex specific mortality for 264 causes of death, 1980-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1151-1210. DOI:10.1016/S0140-6736(17)32152-9 |
| [2] |
POON M T, FONVILLE A F, AL-SHAHI SALMAN R. Long-term prognosis after intracerebral haemorrhage: systematic review and meta-analysis[J]. J Neurol Neurosurg Psychiatry, 2014, 85(6): 660-667. DOI:10.1136/jnnp-2013-306476 |
| [3] |
HEMPHILL J C 3rd, GREENBERG S M, ANDERSON C S, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: A guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2015, 46(7): 2032-2060. DOI:10.1161/STR.0000000000000069 |
| [4] |
XU W L, LI T, GAO L S, et al. Sodium benzoate attenuates secondary brain injury by inhibiting neuronal apoptosis and reducing mitochondria-mediated oxidative stress in a rat model of intracerebral hemorrhage: possible involvement of DJ-1/akt/IKK/NFκB pathway[J]. Front Mol Neurosci, 2019, 12: 105. DOI:10.3389/fnmol.2019.00105 |
| [5] |
ZHENG J W, SHI L G, LIANG F, et al. Sirt3 ameliorates oxidative stress and mitochondrial dysfunction after intracerebral hemorrhage in diabetic rats[J]. Front Neurosci, 2018, 12: 414. DOI:10.3389/fnins.2018.00414 |
| [6] |
BARE D J, LAUDER J M, WILKIE M B, et al. P59fyn in rat brain is localized in developing axonal tracts and subpopulations of adult neurons and Glia[J]. Oncogene, 1993, 8(6): 1429-1436. |
| [7] |
DUAN J X, YANG Z, HUANG J, et al. Inhibition of tyrosine kinases protects against lipopolysaccharide-induced acute lung injury by preventing nuclear export of Nrf2[J]. J Cell Biochem, 2019, 120(8): 12331-12339. DOI:10.1002/jcb.28497 |
| [8] |
KASPAR J W, JAISWAL A K. Tyrosine phosphorylation controls nuclear export of Fyn, allowing Nrf2 activation of cytoprotective gene expression[J]. FASEB J, 2011, 25(3): 1076-1087. DOI:10.1096/fj.10-171553 |
| [9] |
MAO L M, WANG J Q. Tyrosine phosphorylation of glutamate receptors by non-receptor tyrosine kinases: roles in depression-like behavior[J]. Neurotransmitter (Houst), 2016, 3: e1118. |
| [10] |
NYGAARD H B. Targeting Fyn kinase in Alzheimer's disease[J]. Biol Psychiatry, 2018, 83(4): 369-376. DOI:10.1016/j.biopsych.2017.06.004 |
| [11] |
PANICKER N, SARKAR S, HARISCHANDRA D S, et al. Fyn kinase regulates misfolded α-synuclein uptake and NLRP3 inflammasome activation in microglia[J]. J Exp Med, 2019, 216(6): 1411-1430. DOI:10.1084/jem.20182191 |
| [12] |
SHARMA S, CARLSON S, PUTTACHARY S, et al. Role of the Fyn-PKCδ signaling in SE-induced neuroinflammation and epileptogenesis in experimental models of temporal lobe epilepsy[J]. Neurobiol Dis, 2018, 110: 102-121. DOI:10.1016/j.nbd.2017.11.008 |
| [13] |
HAYES J D, DINKOVA-KOSTOVA A T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism[J]. Trends Biochem Sci, 2014, 39(4): 199-218. DOI:10.1016/j.tibs.2014.02.002 |
| [14] |
LIU L, VOLLMER M K, FERNANDEZ V M, et al. Korean red ginseng pretreatment protects against long-term sensorimotor deficits after ischemic stroke likely through Nrf2[J]. Front Cell Neurosci, 2018, 12: 74. DOI:10.3389/fncel.2018.00074 |
| [15] |
MA Q. Role of nrf2 in oxidative stress and toxicity[J]. Ann Rev Pharmacol Toxicol, 2013, 53: 401-426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [16] |
LIU L, LOCASCIO L M, DORÉ S. Critical role of Nrf2 in experimental ischemic stroke[J]. Front Pharmacol, 2019, 10: 153. DOI:10.3389/fphar.2019.00153 |
| [17] |
ZHAO Y, FU B, ZHANG X, et al. Paeonol pretreatment attenuates cerebral ischemic injury via upregulating expression of pAkt, Nrf2, HO-1 and ameliorating BBB permeability in mice[J]. Brain Res Bull, 2014, 109: 61-67. DOI:10.1016/j.brainresbull.2014.09.008 |
| [18] |
CHEN-ROETLING J, REGAN R F. Targeting the Nrf2-heme oxygenase-1 axis after intracerebral hemorrhage[J]. Curr Pharm Des, 2017, 23(15): 2226-2237. DOI:10.2174/1381612822666161027150616 |
| [19] |
FAN X Z, MU L S. The role of heme oxygenase-1 (HO-1) in the regulation of inflammatory reaction, neuronal cell proliferation and apoptosis in rats after intracerebral hemorrhage (ICH)[J]. Neuropsychiatr Dis Treat, 2017, 13: 77-85. DOI:10.2147/NDT.S120496 |
| [20] |
MA Q Y, HUANG B, KHATIBI N, et al. PDGFR-α inhibition preserves blood-brain barrier after intracerebral hemorrhage[J]. Ann Neurol, 2011, 70(6): 920-931. DOI:10.1002/ana.22549 |
| [21] |
YOU D, YOU H. Repression of long non-coding RNA MEG3 restores nerve growth and alleviates neurological impairment after cerebral ischemia-reperfusion injury in a rat model[J]. Biomed Pharmacother, 2019, 111: 1447-1457. DOI:10.1016/j.biopha.2018.12.067 |
| [22] |
ZHENG H P, CHEN C L, ZHANG J, et al. Mechanism and therapy of brain edema after intracerebral hemorrhage[J]. Cerebrovasc Dis, 2016, 42(3/4): 155-169. DOI:10.1159/000445170 |
| [23] |
CHEN G, CHEN X J, NIU C, et al. Baicalin alleviates hyperglycemia-induced endothelial impairment 1 via Nrf2[J]. J Endocrinol, 2018, 240(1): JOE-J18-0457.R1. DOI:10.1530/JOE-18-0457 |
| [24] |
YI J, YUAN Y, ZHENG J F, et al. Hydrogen sulfide alleviates uranium-induced kidney cell apoptosis mediated by ER stress via 20S proteasome involving in Akt/GSK-3β/Fyn-Nrf2 signaling[J]. Free Radic Res, 2018, 52(9): 1020-1029. DOI:10.1080/10715762.2018.1514603 |
| [25] |
KAUFMAN A C, SALAZAR S V, HAAS L T, et al. Fyn inhibition rescues established memory and synapse loss in Alzheimer mice[J]. Ann Neurol, 2015, 77(6): 953-971. DOI:10.1002/ana.24394 |
| [26] |
DUAN X C, WEN Z J, SHEN H T, et al. Intracerebral hemorrhage, oxidative stress, and antioxidant therapy[J]. Oxid Med Cell Longev, 2016, 2016: 1203285. DOI:10.1155/2016/1203285 |
| [27] |
TSIKAS D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges[J]. Anal Biochem, 2017, 524: 13-30. DOI:10.1016/j.ab.2016.10.021 |



