2. 00010 重庆,重庆医科大学:病毒性肝炎研究所,附属第二医院感染科
2. Key Laboratory of Molecular Biology for Infectious Diseases, Institute for Viral Hepatitis, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
高迁移率族蛋白B1(high mobility group box 1, HMGB1)是一种广泛存在于真核细胞内外的具有多种功能的非组蛋白染色体结合蛋白。数十年来研究发现,HMGB1不仅可以在胞核内负责维持核小体的结构与稳定、促使转录因子结合到对应DNA的位点上从而增强DNA的转录,还可以通过主动分泌及被动分泌到胞质及胞外,且参与了包括细胞自噬、坏死性凋亡、肿瘤形成及迁徙等众多重要的生理与病理过程[1-3]。
噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis,HLH),又名噬血细胞综合征(hemophagocytic syndrome,HPS),是一种以多器官、多系统受累及、进行性加重伴免疫功能紊乱为特点的巨噬细胞增生性疾病,典型表现为持续发热、肝脾肿大、全血细胞减少。该病较为罕见,因其临床表现缺乏特异性、病情进展迅速、早期确诊困难、缺乏安全有效的治疗策略等临床特点,使大多数患者死于炎症导致的多器官功能衰竭,临床预后较差[4]。
作为一种高度全身性炎症反应疾病,HLH的病理核心环节在于各种因素导致的巨噬细胞、细胞毒T细胞过度激活并分泌大量炎症因子[5]。而HMGB1作为一种经典的损伤相关模式分子(damage associated molecular patterns, DAMP),广泛参与了多种炎症性疾病,目前主要研究方向集中于自身免疫性疾病、实体及血液肿瘤、脓毒症等[6-9],而关于HMGB1与HLH的关系目前尚不清楚。因此,本研究检测HLH患者外周血的HMGB1蛋白水平及HMGB1 mRNA表达,分析其与患者临床特点的关系,从而探讨HMGB1在HLH中的临床意义。
1 资料与方法 1.1 研究对象 1.1.1 HLH患者组收集2018年7月至2019年5月重庆医科大学附属第二医院血液内科明确诊断为HLH的患者共计26例。符合HLH-2004诊断标准中任何一条时可以诊断HLH:1)分子诊断符合HLH,在目前已知的HLH相关致病基因中,如PRF1、UNC13D、STX11、STXBP2、Rab27a、LYST、SH2D1A、BIRC4、ITK、AP381、MAGT1、CD27等发现病理性突变。2)符合以下8条中的5条:①持续性发热,体温>38.5 ℃,持续>7 d;②脾大;③血细胞减少(累及外周血两系或三系),血红蛋白<90 g/L,血小板<100×109/L,中性粒细胞<1.0×109/L;④高甘油三酯血症(>3 mmol/L)和(或)低纤维蛋白原血症(<1.5 g/L);⑤在骨髓、脾脏、肝脏或淋巴结里找到噬血细胞;⑥血清铁蛋白>500 μg/L;⑦NK细胞活性降低或缺如;⑧可溶性白细胞介素-2受体(sCD25)升高。排除标准:疾病严重不宜参加本试验;未签署知情同意书。
1.1.2 健康志愿者组收集重庆医科大学附属第二医院体检中心健康志愿者30例。纳入标准:①血常规、肝功能、甘油三酯结果未见异常;②自愿签署知情同意书。排除标准:存在活动性肝炎、结核等慢性感染性疾病、慢性心脑血管疾病。
采集患者或健康志愿者外周静脉血进行后续实验,同时收集相关临床资料,包括性别、年龄、原发疾病、肝脾是否肿大、骨髓是否存在噬血现象,以及实验室检查结果:血常规、肝功能(ALT、AST)、细胞因子谱(IL-1、sIL-2R、IL-6、IL-8、IL-10、TNF-α)、甘油三酯、高密度脂蛋白、纤维蛋白原、铁蛋白、乳酸脱氢酶。本研究经本院伦理委员会审批通过[2019年科伦审第(22)号]。
1.2 主要试剂用于ELISA实验的重组人HMGB1蛋白购自北京傲锐东源生物科技有限公司,鼠抗人HMGB1多克隆抗体购自Arigobio公司,过氧化物酶结合的山羊抗小鼠IgG抗体购自ATGene公司,TMB单组分显色液购自北京索莱宝科技有限公司,牛血清白蛋白购自北京索莱宝科技有限公司,TRIzol试剂购自上海玉博生物科技有限公司,人外周血淋巴细胞分离液购自天津灏洋华科生物科技有限公司,逆转录及实时荧光定量PCR试剂购自宝生物工程(大连)有限公司,GoldviewⅠ型核酸染色剂购自北京索莱宝科技有限公司。
1.3 实验方法 1.3.1 间接法ELISA检测HLH患者及健康志愿者外周血中HMGB1含量以倍比稀释法按2 000、1 000、500、250、125、62.5、31.25、0 ng/mL浓度梯度配置HMGB1蛋白标准品,同时按1 :10稀释比例稀释待检测血清,加入96T酶标板中,每例样品设置3个复孔,4 ℃包被过夜。隔日弃掉废液后,3% BSA 100 μL 37 ℃封闭2 h,以1 :6 000鼠抗人HMGB1抗体100 μL 37 ℃反应2 h,以1 :10 000 HRP标记的山羊抗鼠抗体100 μL 37 ℃反应1 h,以TMB单组分显色液100 μL,37℃避光显色20 min,最后加入2 mol/L H2SO4 100 μL终止反应,于450 nm波长处测定每孔的光密度值。以浓度为横坐标,对应光密度值为纵坐标绘制标准曲线,根据每例样品光密度值计算样品浓度。
1.3.2 实时荧光定量PCR法检测外周血中HMGB1 mRNA的表达利用primer-BLAST和Oligo 7工具设计人HMGB1引物和内参照人GAPDH引物,人HMGB1上下游引物:5′-TGCAGATGACAAGCAGCCTT-3′,5′-GCTGCATCAGGCTTTCCTTT-3′,扩增产物为102 bp。人GAPDH上下游引物:5′-TGCCAAATATGATGACATCAAGAA-3′,5′-GGAGTGGGTGTCGCTGTTG-3′,扩增产物为121 bp。利用人血淋巴细胞分离液分离出抗凝外周血单个核细胞,以少量PBS重悬细胞后,利用TRIzol法提取总RNA,进行浓度测定及总RNA琼脂糖凝胶电泳后,进行逆转录及实时荧光定量PCR。其中PCR采用12.5 μL体系,包含:SYBR Premix Ex Taq Ⅱ 6.25 μL,正向引物0.5 μL,反向引物0.5 μL,cDNA 1 μL,H2O 4.25 μL。以两步法进行PCR反应:预变性95 ℃ 30 s,循环1次;PCR反应95 ℃ 5 s,60 ℃ 30 s,循环40次。利用2-ΔΔCt法进行PCR数据分析。
1.4 统计学分析采用SPSS 22.0统计软件。数据以x±s表示,两组间比较前先进行正态性检验及方差齐性检验,若任意一组符合偏态分布,采用Mann-Whitney秩和检验;若两组均符合正态分布且方差齐则采用非配对t检验,若两组方差不齐,采用近似t检验。多组间差异比较采用单因素方差分析。HMGB1与临床资料相关性采用Spearman分析。采用ROC法及尤登指数分析HMGB1诊断HLH的灵敏度、特异度及最佳阈值。双侧检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 HLH患者一般临床资料26例HLH患者与30例健康志愿者的临床资料见表 1。26例HLH患者中原发HLH 2例,感染相关性HLH 13例,自身免疫疾病相关HLH 5例,恶性肿瘤相关HLH 6例;首次发作HLH 16例,复发10例;23例HLH患者骨髓中有噬血现象,3例无噬血现象;18例HLH患者有脾肿大,8例无脾肿大。
| 临床信息 | 健康志愿者(n=30) | HLH患者(n=26) |
| 性别[例(%)] | ||
| 男 | 12(40.0) | 12(46.2) |
| 女 | 18(60.0) | 14(53.8) |
| 年龄/岁 | 40.97±15.03 | 46.08±19.48 |
| 实验室检查 | ||
| 白细胞/×109·L-1 | 5.65±1.34 | 4.28±3.29a |
| 红细胞/×1012·L-1 | 4.84±0.52 | 2.90±1.03a |
| 血红蛋白/g·L-1 | 145.07±14.25 | 78.08±21.64a |
| 血小板/×109·L-1 | 213.57±49.19 | 92.65±90.34a |
| 谷丙转氨酶/U·L-1 | 23.67±14.92 | 93.80±90.49a |
| 谷草转氨酶/U·L-1 | 20.89±6.99 | 109.54±130.69a |
| 甘油三酯/mmol·L-1 | 1.30±0.67 | 2.48±1.44a |
| 乳酸脱氢酶/U·L-1 | — | 574.67±333.48 |
| 纤维蛋白/g·L-1 | — | 3.38±2.20 |
| 铁蛋白/ng·mL-1 | — | 718.52±393.52 |
| IL-1β/pg·mL-1 | — | 10.95±17.54 |
| IL-2受体/U·mL-1 | — | 3 109.36±2 109.22 |
| IL-6/pg·mL-1 | — | 95.33±210.96 |
| IL-8/pg·mL-1 | — | 299.36±838.26 |
| IL-10/pg·mL-1 | — | 103.16±241.81 |
| TNF-α/pg·mL-1 | — | 52.09±58.42 |
| a: P < 0.05,与健康志愿者比较 | ||
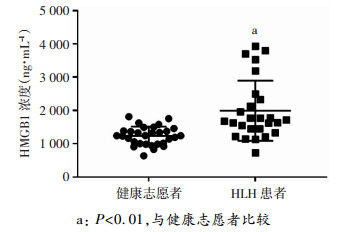
2.2 HLH患者血清中HMGB1浓度显著高于健康志愿者
HLH患者和健康志愿者血清中HMGB1蛋白浓度见图 1,HLH患者血清中HMGB1蛋白含量为(1 992.77± 883.74)ng/mL,显著高于健康志愿者[(1 237.49±272.85)ng/mL,P < 0.01]。
|
| a: P < 0.01,与健康志愿者比较 图 1 HLH患者及健康志愿者血清中HMGB1含量比较 |
2.3 HLH患者外周血HMGB1 mRNA表达显著高于健康志愿者
成功检测了18例HLH患者和18例健康志愿者的外周血HMGB1 mRNA水平。实时荧光定量PCR检测结果显示,HLH患者外周血HMGB1 mRNA相对表达量为(4.56±2.10),显著高于健康志愿者[(2.34±1.32),P < 0.05]。
2.4 HMBG1表达水平与HLH患者临床资料的关系 2.4.1 HMGB1表达水平与HLH患者红细胞、血红蛋白、血小板计数相关性分析结果显示,HLH患者血清中HMGB1含量与红细胞、血红蛋白、血小板计数呈负相关(P < 0.05,表 2),与白细胞、IL-1β、TNF-α、IL-2R、IL-6、IL-8、IL-10、铁蛋白、乳酸脱氢酶、甘油三酯、纤维蛋白原水平无明显相关性(P>0.05,表 2)。
| 指标 | 相关系数r | P值 |
| 白细胞 | -0.073 5 | 0.721 2 |
| 红细胞 | -0.514 6 | 0.007 1 |
| 血红蛋白 | -0.453 6 | 0.019 9 |
| 血小板 | -0.505 5 | 0.008 4 |
| IL-1β | 0.019 7 | 0.923 9 |
| TNF-α | 0.206 2 | 0.292 4 |
| IL-2受体 | 0.456 0 | 0.119 8 |
| IL-6 | 0.173 9 | 0.416 4 |
| IL-8 | -0.128 5 | 0.540 6 |
| IL-10 | 0.111 8 | 0.680 6 |
| 铁蛋白 | 0.620 9 | 0.074 3 |
| 乳酸脱氢酶 | -0.054 2 | 0.847 9 |
| 甘油三酯 | -0.221 3 | 0.310 1 |
| 纤维蛋白 | 0.201 4 | 0.323 9 |
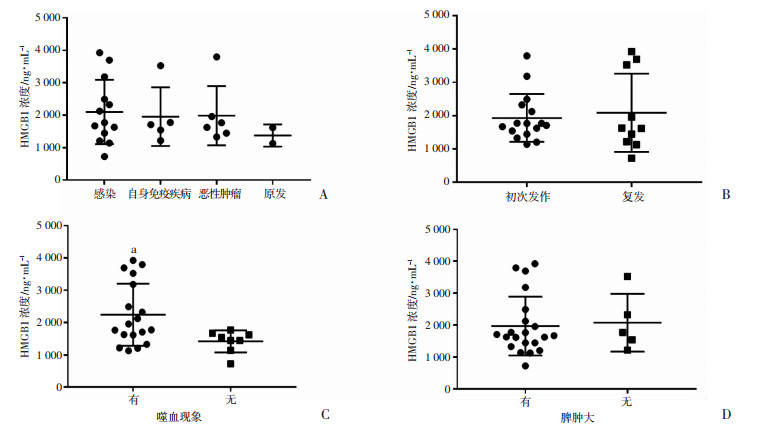
2.4.2 HLH患者的HMGB1表达与不同临床情况的关系
结果显示,骨髓中有噬血现象HLH患者的HMGB1表达水平显著高于骨髓中无噬血现象HLH患者(P < 0.05)。其余情况(感染/自身免疫性疾病/恶性肿瘤/原发、初次发作/复发、有脾肿大/无脾肿大)组间血清HMGB1水平差异无统计学意义(图 2)。
|
| A:不同类型HLH患者HMGB1表达情况;B:初次发作与复发HLH患者HMGB1表达情况;C:骨髓中有无噬血现象HLH患者HMGB1表达情况a:P < 0.05,与无噬血现象比较;D:有无脾肿大HLH患者HMGB1表达情况 图 2 HLH患者血清HMGB1水平与临床资料的关系 |
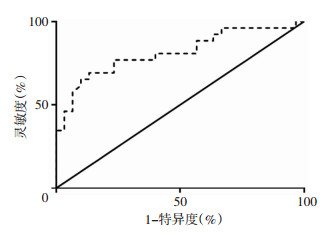
2.5 利用HMGB1诊断HLH的最佳阈值、灵敏度及特异度
以ROC法分析HLH患者与健康志愿者的血清 HMGB1水平,结果显示:曲线下面积(AUC)为0.812 2 (P < 0.01)。计算以不同浓度HMGB1诊断HLH的尤登指数[(灵敏度+特异度)-100%],取尤登指数最大值时的HMGB1浓度为最佳诊断阈值。结果显示,当HMGB1浓度为1 522 ng/mL时尤登指数达到最大,提示HMGB1浓度为1 522 ng/mL时为最佳诊断阈值,对应灵敏度为69.23%,特异度为86.67%。见图 3。
|
| 图 3 利用HMGB1诊断HLH的ROC分析 |
3 讨论
高迁移率族蛋白B1(HMGB1)于1973年在小牛胸腺染色质中首次被发现,因其在聚丙烯酞胺凝胶电泳(PAGE)中迁移速度快而得名[10]。早期研究发现,HMGB1的主要功能是在胞核内负责维持核小体的稳定,以及促使转录因子结合到对应DNA的位点上。而后随着研究的深入,发现HMGB1不仅分布于细胞核和细胞质内,还可以通过主动分泌及被动分泌到胞外,且参与了众多重要的生理与病理过程。近年来针对HMGB1与各种炎症相关疾病的一系列研究[6-9]发现,HMGB1作为一种经典炎症介质,经主动或被动释放途径,通过介导上述疾病中单核/巨噬细胞、树突状细胞等炎症细胞的激活、下游细胞因子的分泌等途径,从而参与并促进了各炎症疾病的病理过程[11-13]。
鉴于HMGB1水平在多种炎症相关疾病中均有不同程度的升高[8-9, 14],本研究检测HMGB1在HLH患者体内的转录和翻译水平,发现该疾病患者体内HMGB1的转录和翻译水平均显著高于健康志愿者,进一步针对病因的分析发现,无论是原发HLH还是各种因素(感染、自身免疫性疾病、恶性肿瘤)引发的继发HLH,HMGB1的差异并未表现出统计学意义,提示HMGB1在HLH患者体内均处于表达及分泌上调的状态。
在HLH患者中,红细胞及血小板降低多提示预后不良。国外多项分析显示[15-16],高龄、EBV相关HLH、红细胞及血小板减少等与HLH的诊断及临床预后不良密切相关,HLH患者的外周血红细胞、血红蛋白及血小板计数越少,患者临床结局越差,提示上述指标对HLH的诊断及预后有一定的预测意义。
噬血现象作为噬血细胞性淋巴组织细胞增多症的诊断标准之一,多项临床分析表明,噬血现象对于HLH患者的临床预后具有一定意义。有报道指出,在对101例结外NKT淋巴瘤合并HLH患者的回顾性分析中,确诊时EB病毒DNA高拷贝数或有噬血现象的患者,其PFS率和OS率要劣于EB病毒DNA低拷贝数或无噬血现象的患者[17]。另一项针对血管内大B细胞淋巴瘤合并HLH患者的分析同样表明,伴有噬血现象的患者,其3年OS率要低于不伴噬血现象的患者(29.6% vs 75.0%, P=0.046)[18]。提示噬血现象对于HLH的预后有一定指导价值。
本研究通过检测与分析发现,HLH患者血清HMGB1与红细胞、血红蛋白及血小板水平存在负相关,与噬血现象呈正相关。巨噬细胞作为HLH发病的核心环节,在接受来自于上游的γ-干扰素等信号介质后,一方面脾、淋巴结、骨髓中的巨噬细胞大量吞噬各个阶段的白细胞、红细胞、血小板,导致外周血细胞计数降低;另一方面巨噬细胞开始大量分泌各种炎症介质,包括IL-1、IL-6、IL-10、TNF-α以及HMGB1等。这些细胞因子随即参与到下游的炎症反应,导致一系列临床表现[5, 19]。鉴于HLH患者体内巨噬细胞激活的程度与其分泌细胞因子的能力和吞噬能力呈正相关,故HMGB1可以作为反映HLH患者体内巨噬细胞激活程度,同时也可以作为HLH疾病严重程度及预后的衡量指标之一。本研究暂未发现HMGB1与IL-1在内的多种细胞因子之间存在明显相关性,我们推测可能的原因在于,与体外的巨噬细胞实验不同,在体内环境中各种细胞因子被巨噬细胞所分泌后,会继续参与到下游的进一步反应当中,在此过程中各种细胞因子的消耗程度不尽相同,从而导致了血清中的含量差异,目前该推测仍有待进一步的体内实验加以验证。
在实际临床工作中,明确诊断HLH存在着诸多困难。对于原发性HLH,获取致病基因检测结果通常需要较长时间,而对于发病率更高的继发性HLH来说,标准中的发热、脾大、血细胞减少、铁蛋白升高、噬血现象等并非特异性诊断指标,以上原因导致HLH的诊断率低下。本研究分析了利用HMGB1诊断HLH的可能性。结果显示,HMGB1单独诊断HLH有一定的价值(AUC=0.812 2,P < 0.05),且HMGB1的最佳阈值为1 522 ng/mL,对应的诊断灵敏度为69.23%,特异度为86.67%,其特异度较灵敏度更高,提示血清HMGB1水平在确定非HLH患者方面的应用价值更高,有助于临床工作中迅速区分HLH患者与非HLH患者,从而降低不必要的医疗资源消耗,降低临床工作风险。
综上所述,本研究发现HLH患者血清HMGB1水平较健康人异常增高,其水平与噬血现象呈正相关,与血红蛋白、红细胞及血小板呈负相关,且具有一定的诊断价值。提示HMGB1有望作为一项临床上用于噬血细胞性淋巴组织细胞增多症的诊断、病情评估、预后分析的实用指标。
| [1] |
SHRIVASTAVA S, MANSURE J J, ALMAJED W, et al. The role of HMGB1 in radioresistance of bladder cancer[J]. Mol Cancer Ther, 2016, 15(3): 471-479. DOI:10.1158/1535-7163.MCT-15-0581 |
| [2] |
QU L H, CHEN C, CHEN Y Y, et al. High-mobility group box 1 (HMGB1) and autophagy in acute lung injury (ALI): A review[J]. Med Sci Monit, 2019, 25: 1828-1837. DOI:10.12659/MSM.912867 |
| [3] |
TRIPATHI A, SHRINET K, KUMAR A. HMGB1 protein as a novel target for cancer[J]. Toxicol Rep, 2019, 6: 253-261. DOI:10.1016/j.toxrep.2019.03.002 |
| [4] |
SHAH A R, MUZZAFAR T, ASSI R, et al. Hemophagocytic lymphohistiocytosis in adults: An under recognized entity[J]. BBA Clin, 2017, 7: 36-40. DOI:10.1016/j.bbacli.2016.12.002 |
| [5] |
SKINNER J, YANKEY B, SHELTON B K. Hemophagocytic lymphohistiocytosis[J]. AACN Adv Crit Care, 2019, 30(2): 151-164. DOI:10.4037/aacnacc2019463 |
| [6] |
MUSUMECI D, ROVIELLO G N, MONTESARCHIO D. An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1-related pathologies[J]. Pharmacol Ther, 2014, 141(3): 347-357. DOI:10.1016/j.pharmthera.2013.11.001 |
| [7] |
URBONAVICIUTE V, FVRNROHR B G, MEISTER S, et al. Induction of inflammatory and immune responses by HMGB1-nucleosome complexes: implications for the pathogenesis of SLE[J]. J Exp Med, 2008, 205(13): 3007-3018. DOI:10.1084/jem.20081165 |
| [8] |
DENG M H, SCOTT M J, FAN J, et al. Location is the key to function: HMGB1 in sepsis and trauma-induced inflammation[J]. J Leukoc Biol, 2019, 106(1): 161-169. DOI:10.1002/JLB.3MIR1218-497R |
| [9] |
TANAKA A, ITO T, KIBATA K, et al. Serum high-mobility group box 1 is correlated with interferon-α and may predict disease activity in patients with systemic lupus erythematosus[J]. Lupus, 2019, 28(9): 1120-1127. DOI:10.1177/0961203319862865 |
| [10] |
MARTINOTTI S, PATRONE M, RANZATO E. Emerging roles for HMGB1 protein in immunity, inflammation, and cancer[J]. Immunotargets Ther, 2015, 4: 101-109. DOI:10.2147/ITT.S58064 |
| [11] |
XU B, ZANG S C, LI S Z, et al. HMGB1-mediated differential response on hippocampal neurotransmitter disorder and neuroinflammation in adolescent male and female mice following cold exposure[J]. Brain Behav Immun, 2019, 76: 223-235. DOI:10.1016/j.bbi.2018.11.313 |
| [12] |
KIDA T, SENO T, NAGAHARA H, et al. Roles of high-mobility group box 1 and thrombin in murine pulmonary fibrosis and the therapeutic potential of thrombomodulin[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(3): L473-L483. DOI:10.1152/ajplung.00287.2017 |
| [13] |
UGRINOVA I, PASHEVA E. HMGB1 protein: A therapeutic target inside and outside the cell[J]. Adv Protein Chem Struct Biol, 2017, 107: 37-76. DOI:10.1016/bs.apcsb.2016.10.001 |
| [14] |
MANGANELLI V, CAPOZZI A, TRUGLIA S, et al. Elevated serum level of HMGB1 in patients with the antiphospholipid syndrome[J]. J Immunol Res, 2017, 2017: 4570715. DOI:10.1155/2017/4570715 |
| [15] |
YOON J H, PARK S S, JEON Y W, et al. Treatment outcomes and prognostic factors in adult patients with secondary hemophagocytic lymphohistiocytosis not associated with malignancy[J]. Haematologica, 2019, 104(2): 269-276. DOI:10.3324/haematol.2018.198655 |
| [16] |
MINOIA F, BOVIS F, DAVÌ S, et al. Development and initial validation of the macrophage activation syndrome/primary hemophagocytic lymphohistiocytosis score, a diagnostic tool that differentiates primary hemophagocytic lymphohistiocytosis from macrophage activation syndrome[J]. J Pediatr, 2017, 189: 72-78. DOI:10.1016/j.jpeds.2017.06.005 |
| [17] |
SU Y J, WANG P N, CHANG H, et al. Extranodal NK/T-cell lymphoma, nasal type: Clinical features, outcome, and prognostic factors in 101 cases[J]. Eur J Haematol, 2018, 101(3): 379-388. DOI:10.1111/ejh.13126 |
| [18] |
HONG J Y, KIM H J, KO Y H, et al. Clinical features and treatment outcomes of intravascular large B-cell lymphoma: a single-center experience in Korea[J]. Acta Haematol, 2014, 131(1): 18-27. DOI:10.1159/000351060 |
| [19] |
MADKAIKAR M, SHABRISH S, DESAI M. Current updates on classification, diagnosis and treatment of hemophagocytic lymphohistiocytosis (HLH)[J]. Indian J Pediatr, 2016, 83(5): 434-443. DOI:10.1007/s12098-016-2037-y |



