2. 400016 重庆,重庆医科大学附属第一医院:内分泌乳腺外科;
3. 400016 重庆,重庆医科大学附属第一医院:消化内科
2. Department of Endocrine and Breast Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3. Department of Gastroenterology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
Na+, K+-ATP酶作为已被熟知的膜蛋白,广泛参与了人体生理及病理各个过程[1]。有研究发现:在肿瘤细胞中,除了经典的对膜内外离子浓度的影响外,Na+, K+-ATP酶被证实在与其配体强心苷类药物(cardiac glycosides,CGs)结合的情况下,能够引起多条信号通路相关蛋白含量和活性的改变,如PLC/PKC信号通路、MEK/ERK信号通路、PI3K/Akt信号通路等,而Na+, K+-ATP酶对这些通路的调节离不开它的催化亚基--α亚基的介导[2-5]。
Na+, K+-ATP酶由α、β、FXYD蛋白所构成,其中α亚基上包含Mg2+、Na+、K+离子、ATP以及CGs等分子的结合位点,所以它被认为是Na+, K+-ATP酶的催化亚基;而β亚基是一种糖蛋白,是一种调节间隙连接蛋白的粘附分子。它参与全酶的结构和功能成熟,促进α亚单位向质膜的转运和上皮细胞外膜中酶的维持;FXYD蛋白能调节酶的功能,从而使活性钠离子和钾离子转运的动力学特性适应不同细胞的特殊需要[1, 6-7]。
Na+, K+-ATP酶的各亚基均有不同的亚型,α亚基有4种不同的亚型,但是这4种亚型的功能并不完全相同。其中,α1也就是ATP1A1,在恶性胶质瘤、小细胞肺癌、黑色素瘤等肿瘤中被认为发挥了促进肿瘤的作用[8-12],在肾细胞癌中又被认为具有抑制肿瘤的作用[13-14];α3(ATP1A3)被认为有促结肠癌增殖和转移的能力[15];α4(ATP1A4)只存在于睾丸组织中[6-7];而α2(ATP1A2)与肿瘤的关系鲜有研究报道。因此,本研究观测ATP1A2在乳腺癌中的表达情况,并探讨其对乳腺癌细胞MDA-MB-231和SK-BR-3侵袭和迁移的影响,以期拓展Na+-ATP酶对肿瘤作用的认识,为临床实践中治疗乳腺癌提供新思路。
1 材料与方法 1.1 材料 1.1.1 ATP1A2相关数据ATP1A2的mRNA及相关临床数据来自the Cancer Genome Atlas (TCGA) (http://tcga-data.nci.nih.gov/tcga/)数据库。
1.1.2 乳腺癌组织及癌旁组织12对乳腺癌及癌旁组织来自2014-2016年重庆医科大学附属第一医院。患者均签署知情同意书。组织的使用经重庆医科大学附属第一医院伦理委员会审批同意[2017年科研伦理(2017-012)号]。
1.1.3 细胞及质粒乳腺癌细胞(BT549、MAD-MB-231、MCF-7、T47D、SK-BR-3、ZR-75-1)及正常乳腺细胞MCF-10A购自美国ATCC。pEZ-M35-ATP1A2和空载vector-pEZ-M35质粒购自美国Genecopoeia公司。
1.1.4 主要试剂TRIzol试剂、SYBR Green kit、脂质体LipofectamineTM 2000、质粒提取试剂盒、胎牛血清、链霉素+青霉素试剂购自美国Invitrogen公司,逆转录试剂盒、PCR试剂盒购自美国Promega公司,Cocktail、PMSF、RIPA试剂、SDS-PAGE凝胶配制试剂盒购自碧云天生物技术有限公司,多聚甲醛购自川东化工有限公司,Matrigel购自美国Bio-Rad公司,结晶紫染料购自新加坡ICM Pharma公司,BCA蛋白定量试剂盒购自美国Thermo Pierce公司,PVDF膜购自美国Millipore公司,RPMI1640培养基(1640培养基)购自德国Gibco-BRL公司。抗体:Anti-ATP1A2 (orb312157)购自英国Biorbyt公司,Anti-c-Src (sc-130124)、Anti-p-c-Sr (sc-166860)、Anti-PI3K (sc-12930)、Anti-p-PI3K (sc-12929)、Anti-β-actin(sc-47778)购自美国Santa Cruz公司,Anti-Akt (WL0003b)购自万类生物有限公司,Anti-p-Akt (66444-1-ig)、Anti-goat IgG (SA00001-4)购自美国Proteintech Group公司,Anti-mouse (7076)、IgG Anti-rabbit IgG (7074)购自美国Cell Signaling Technology公司。ATP1A2正向引物:5′-CACCACCGAAG-ATCAGTCTGG-3′,反向引物:5′-CGCTTAGACACGGAGATGTTC-3′, 产物长度:132 bp。;β-actin正向引物:5′-CCTGTGGCATCCACGAAACT-3′,反向引物:5′-GAAGCATTTGCGGTGGACGAT-3′, 产物长度:314 bp。
1.2 方法 1.2.1 RNA提取组织:在液氮的研钵中,将组织研磨成粉,移至无酶EP管中。细胞及组织:向EP管(培养板)中加入1 mL TRIzol,在室温下静置10 min;将上层液体移至新的无酶EP管中,加入异丙醇500 μL,室温下静置10 min;4 ℃、12 000×g离心10 min;弃上清,加入75%乙醇1 mL,4 ℃、7 500×g离心5 min;弃上清;加入适量DEPC水混匀,测浓度;-80 ℃冰箱保存。
1.2.2 RT-PCROligo (dT) Primer 0.5 μL,RNA 1 μg,DEPC,定容至5 μL;混匀,70 ℃加热10 min,冰上3 min;5×M-MLV Buffer 4 μL,MgCl2 2 μL,RNase inhibitor 0.5 μL,Reverse Transcriptase 1 μL,dNTP(10 mmol/L)1 μL,DEPC水6.5 μL;将两种液体混匀,放入PCR仪,程序设为:42 ℃ 1 h,70 ℃ 15 min,4 ℃ 10 min;5×Flexi Buffer 1.6 μL,MgCl2 (25 mmol/L) 0.4 μL,DEPC水4.75 μL,F-primer 0.6 μL,R-primer 0.6 μL,Go-Taq DNA Polymerase 0.05 μL,cDNA 2 μL;将液体混匀,放入PCR仪,程序为:95 ℃ 2 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s;目的基因进行32次循环,内参基因β-actin进行23次循环;72 ℃ 3 min。加热使液体沸腾且琼脂颗粒完全溶解,每20毫升加入液体1 μL的核酸染料,混匀,放置室温至凝固;将凝固的2%琼脂糖凝胶放入电泳槽中,依次加入DNA Marker和PCR产物;电泳:120 V,25 min;紫外灯下曝光,进行结果分析。
1.2.3 qRT-PCR将cDNA浓度稀释10倍;SYBR 5 μL,F-primer 0.25 μL,R-primer 0.25 μL,DEPC水2.5 μL,cDNA 2 μL;混匀;设立3个复孔,每孔2 μL混合液;放入定量PCR仪,将程序设置为:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 15 s,目的及内参均进行40次循环,95 ℃ 15 s;绘制溶解曲线;以内参β-actin为标准,通过2-ΔΔCt法进行数据分析。
1.2.4 ATP1A2稳定株建立将MDA-MB-231和SK-BR-3细胞种于6孔板内,待细胞生长覆盖孔底70%~80%;将4 μg质粒加至500 μL的无血清1640培养液中,混匀;将5 μL LipofectamineTM 2000加至500 μL无血清1640培养基中,混匀;两液均在室温下静置5 min;将两液混合均匀,室温下静置20 min;弃6孔板中旧液,PBS清洗3次,每孔加入1 mL转染用混合液,置于37 ℃ CO2细胞培养箱中培养4~6 h后,更换混合液为2 mL不含双抗、含10%胎牛血清的1640培养液。在细胞转染48 h后,向细胞培养液中按比例加入适量G418进行筛选,2~3 d换液1次;筛选14 d后,进行RT-PCR和Western blot验证目的基因的表达;验证筛选成功后,细胞继续使用减半量的G418维持筛选效果。
1.2.5 细胞划痕实验将细胞种至背面画了均匀3条横线的6孔板中,待细胞覆盖满后,用小枪头垂直于所画横线画线;用1 mL PBS洗2遍,加入2 mL无血清1640;分别于0、12、24 h于倒置显微镜下观察。
1.2.6 Transwell细胞迁移实验将细胞消化离心,800 r/min,5 min;计数,调整细胞数为2×105/mL,在下室加入800 μL含10%血清的培养液,上室加入100 μL细胞悬液,MDA-MB-231细胞在37 ℃孵箱中培养18 h,SK-BR-3细胞培养24 h;取出小室,吸干上室液体,移到800 μL的4%多聚甲醛中,室温固定30 min;取出小室,吸干液体,移至800 μL结晶紫中,室温染色30 min;清水轻柔冲洗浸泡数次,取出小室,吸干液体,用湿棉棒擦去小室底部膜表面上的细胞;显微镜下拍照,统计。
1.2.7 Transwell细胞侵袭实验将Matrigel放在4 ℃过夜融化;用4 ℃预冷的无血清培养液稀释Matrigel,Matrigel胶:无血清1640= 1 :7;向上室中加入70 μL稀释后的Matrigel,37 ℃温育4~5 h;消化细胞,800 r/min离心5 min,重悬细胞,计数,调整细胞数为2×105/mL;在下室加入800 μL含10%血清的培养液,上室加入100 μL细胞悬液,MDA-MB-231细胞继续在37 ℃孵箱中培养24 h,SK-BR-3细胞培养36 h;取出小室,同迁移实验,使用4%多聚甲醛固定、结晶紫中染色。清洗擦拭后显微镜下拍照,统计。
1.2.8 Western blot检测用细胞裂解液裂解各组细胞,提取细胞总蛋白,用BCA法测定蛋白浓度;将蛋白与含β-巯基乙醇的2×loading buffer以2 :1的比例混合混匀,100 ℃加热10 min;加入蛋白Marker 5 μL和待测蛋白样本40 μg进行10%SDS-PAGE凝胶电泳(开始60 V,当蛋白跑至浓缩胶和分离胶交界处时,调至80 V,跑至整块胶正中时调电压至100 V,直到最后);将PVDF膜放入无水乙醇中5 min后进行转膜,100 V,100 min;取出PVDF膜,放入5%脱脂牛奶中,放置于摇床上,室温封闭1 h;将膜用PBST洗净牛奶,放入适宜浓度的一抗中,放在4 ℃摇床中,过夜孵育;PBST摇床清洗膜,10 min,3次;将膜放入适宜浓度的二抗中,摇床上室温孵育1 h;PBST摇床洗膜,10 min,3次;向膜上滴加适量配制好的发光液,Las-4000成像系统进行显影,分析结果。
1.3 统计学分析采用GraphPad 5.0及SSPS 19.0统计软件。数据以x±s表示;两组比较用非配对独立样本t检验。检验水准α=0.05。每项实验均独立重复至少3次。
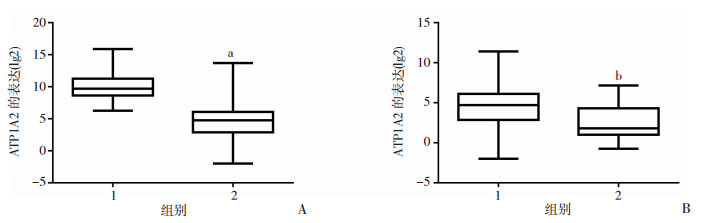
2 结果 2.1 TCGA数据库中乳腺癌组织ATP1A2的表达情况通过从TCGA数据库中下载ATP1A2的mRNA表达情况及患者的临床特征分析发现:对比112例正常乳腺组织和801例乳腺癌组织,ATP1A2的mRNA表达在乳腺癌中显著下调(图 1A);进一步分析有无远处转移的患者乳腺癌组织中ATP1A2 mRNA表达后发现:13例远处转移患者组织中ATP1A2的表达显著低于691例未发生远处转移的患者(图 1B)。提示ATP1A2可能作为一个抑制转移和侵袭的相关因素在乳腺癌中发挥作用。
|
| A:ATP1A2在乳腺癌组织和正常乳腺组织中的表达 1:正常组;2:乳腺癌组;a:P < 0.001,与正常组比较;B:ATP1A2在有无远处转移患者乳腺组织中的表达 1:无远处转移组;2:远处转移组;b:P=0.004,与无远处转移组比较 图 1 TCGA数据库中ATP1A2的表达情况 |
2.2 ATP1A2在临床组织样本中和乳腺癌细胞系中的表达
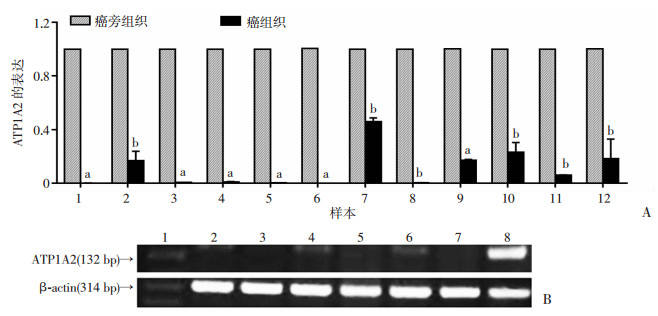
提取12对乳腺癌组织和癌旁组织总mRNA,qRT-PCR检测结果显示:乳腺癌组织中ATP1A2的表达较癌旁组织显著降低(图 2A)。
|
| A:ATP1A2在12对乳腺癌和癌旁组织中的表达 a:P < 0.05,b:P < 0.01与癌旁组织组比较;B:ATP1A2在乳腺癌细胞及正常乳腺细胞中的表达 1:标准; 2: BT-549; 3: MDA-MB-231; 4: MCF-7; 5: T47D; 6: SK-BR-3; 7: ZR-75-1; 8: MCF-10A 图 2 ATP1A2在临床组织样本和乳腺癌细胞系中的表达 |
RT-PCR检测乳腺癌细胞(BT549、MAD-MB-231、MCF-7、T47D、SK-BR-3、ZR-75-1)和正常乳腺细胞MCF-10A中ATP1A2的表达,发现在这些乳腺癌细胞中,ATP1A2的mRNA表达都很低,有的甚至没有明显的条带(图 2B)。
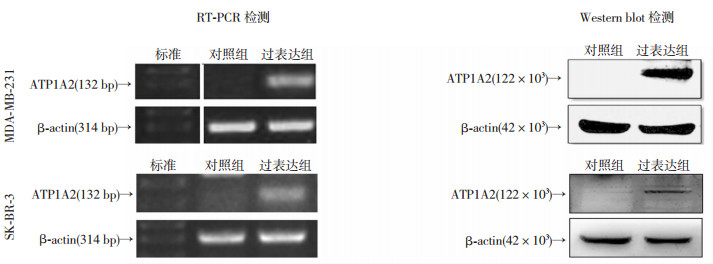
2.3 ATP1A2在MDA-MB-231和SK-BR-3细胞中过表达因ATP1A2在各乳腺癌细胞中的表达都很低,选取了在实验室条件下较为容易获取和培养的MDA-MB-231及SK-BR-3进行ATP1A2的过表达。在14 d的G418筛选后,采用RT-PCR和Western blot验证过表达结果,以转染空载质粒的细胞作为对照,发现不论是mRNA水平,还是蛋白质水平(图 3),ATP1A2均有效地发生了过表达。
|
| 图 3 ATP1A2在乳腺癌细胞MDA-MB-231和SK-BR-3中的过表达 |
2.4 ATP1A2对MDA-MB-231和SK-BR-3细胞迁移和侵袭的影响
将过表达组及对照组的细胞同时进行细胞划痕实验(图 4)、Transwell迁移(图 5A)和侵袭实验(图 5B),发现过表达ATP1A2能够显著抑制MDA-MB-231和SK-BR-3细胞的迁移和侵袭能力。

|
| a:P < 0.05,b:P < 0.01,与对照组比较 图 4 划痕实验观察MDA-MB-231细胞(A)和SK-BR-3细胞(B)的迁移 |

|
|
a:P < 0.05,b:P < 0.01,与对照组比较 A:Transwell迁移实验观察MDA-MB-231细胞和SK-BR-3细胞迁移;B:Transwell侵袭实验观察MDA-MB-231细胞和SK-BR-3细胞侵袭 图 5 ATP1A2对MDA-MB-231和SK-BR-3细胞迁移和侵袭的影响 |
2.5 ATP1A2过表达对Src/PI3K/Akt信号通路相关蛋白的影响
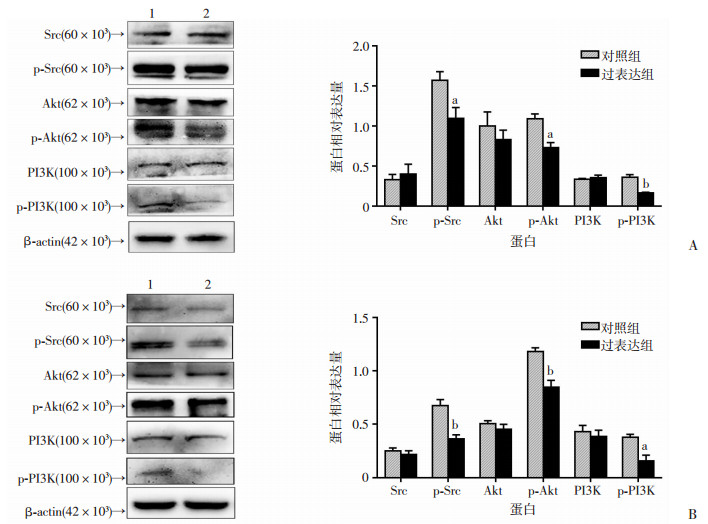
Western blot检测Src、PI3K、Akt蛋白及其磷酸化水平。与对照组比较,过表达组的Src、PI3K、Akt蛋白磷酸化水平明显降低(图 6),提示ATP1A2能够抑制它们的激活,表明ATP1A2可能通过Src/PI3K/Akt信号通路来调节乳腺癌细胞的迁移和侵袭能力。
|
| 1:对照组;2:过表达组;a:P < 0.05,b:P < 0.01,与对照组比较 图 6 Western blot检测ATP1A2过表达在MDA-MB-231细胞(A)和SK-BR-3细胞(B)中对Src、PI3K、Akt及其磷酸化蛋白的影响 |
3 讨论
Na-K-ATP酶作为CGs类药物的目标蛋白,在心力衰竭、心律失常等疾病中被广泛研究和应用,而它的信号传导功能被研究者们逐渐发现和认识,其中,它在肿瘤中发挥的作用是关注的重点之一[1, 3]。
ATP1A2作为Na-K-ATP酶α亚单的2亚型并没有如ATP1A1或者ATP1A3那样在肿瘤中受到关注,究其原因可能是其本身的组织特异性所致[6-7]。α1亚型的分布是普遍存在的,它也是肾脏中表达的主要亚型;α2亚型主要在成人心脏、血管平滑肌、骨骼肌、大脑、脂肪细胞、软骨和骨骼中表达;α3亚型主要在可兴奋组织和心脏传导系统中表达,在中枢和周围神经组织中最丰富;而α4亚型具有睾丸组织特异性[6-7]。可能正因为这种组织特异性,才使得大多数的目光聚集到了ATP1A1上,而忽略了在某些组织中,即使ATP1A2含量不高,可能仍然对肿瘤细胞的活动具有明显的调节功能。
本研究表明:ATP1A2即使在乳腺组织中相较于ATP1A2和ATP1A3的含量不高,但其在乳腺癌和乳腺正常组织或者细胞中的含量变化却仍然显著:乳腺癌患者的癌组织中ATP1A2含量明显低于正常乳腺组织。并且乳腺癌远处转移患者癌组织中ATP1A2的含量也低于无远处转移患者的癌组织,这提示ATP1A2在乳腺癌的发生和发展中可能起到了一定的抑癌作用。
基于有/无远处转移的患者乳腺癌组织中的ATP1A2含量的明显差异,本研究观察ATP1A2对MDA- MB-231和SK-BR-3细胞迁移和侵袭功能的影响,结果显示:在两种乳腺癌细胞中过表达ATP1A2后,细胞的迁移和侵袭能力受到了明显的抑制。这说明ATP1A2可能有调控乳腺癌细胞迁移和侵袭能力的作用。
Src基因作为原癌基因在正常人体中发挥了调控细胞增殖和分化等生理功能,但当它的表达或者功能出现异常时就可能会促进人体肿瘤的发生、发展,如促进它们的增殖和转移等。它的异常在乳腺癌的发病中也发挥了十分重要的作用。而Src蛋白作为已被广泛研究的促癌因子,它可以影响许多下游信号分子产生相应的促癌作用,于是也产生了许多针对于它的相关治疗方法[16-17]。现有研究表明:ATP1A1能够与Src蛋白直接结合,并在存在Na-K-ATP酶配体强行苷类药物的情况下,能够激活Src蛋白,调节下游一系列相关分子,达到促进或者抑制肿瘤的作用[1, 3-4, 10, 18]。但是,ATP1A2能否影响与Src蛋白结合尚有争议[19-20]。本研究验证了过表达ATP1A2能够调节Src蛋白的活性,引起Src蛋白磷酸化水平的抑制,同时引起下游蛋白PI3K、Akt蛋白的磷酸化水平抑制,抑制了它们的活性。也就是说ATP1A2能抑制Src/PI3K/Akt信号通路的激活,是ATP1A2对乳腺癌细胞MDA-MB-231和SK-BR-3迁移和侵袭发挥抑制作用的途径。但是,ATP1A2是否如ATP1A1一样能与Src蛋白直接结合、它是如何对Src蛋白的进行调节的等问题还需要深入研究。
综上所述,本研究表明:ATP1A2可能通过抑制Src/PI3K/Akt信号通路而抑制了乳腺癌细胞的侵袭和迁移,这拓展了对乳腺癌发病的理论认知,也为诊断和治疗乳腺癌提供了新的思路。
| [1] |
LINGREL J B. The physiological significance of the cardiotonic steroid/ouabain-binding site of the Na, K-ATPase[J]. Annu Rev Physiol, 2010, 72(1): 395-412. DOI:10.1146/annurev-physiol-021909-135725 |
| [2] |
XIE Z. Na+-K+-ATPase-mediated signal transduction: from protein interaction to cellular function[J]. Mol Interv, 2003, 3(3): 157-168. DOI:10.1124/mi.3.3.157 |
| [3] |
NEWMAN R A, YANG P, PAWLUS A D, et al. Cardiac glycosides as novel cancer therapeutic agents[J]. Mol Interv, 2008, 8(1): 36-49. DOI:10.1124/mi.8.1.8 |
| [4] |
MENGER L, VACCHELLI E, ADJEMIAN S, et al. Cardiac glycosides exert anticancer effects by inducing immunogenic cell death[J]. Sci Transl Med, 2012, 4(143): 143ra99. DOI:10.1126/scitranslmed.3003807 |
| [5] |
BAGROV A Y, SHAPIRO J I, FEDOROVA O V. Endogenous cardiotonic steroids: physiology, pharmacology, and novel therapeutic targets[J]. Pharmacol Rev, 2009, 61(1): 9-38. DOI:10.1124/pr.108.000711 |
| [6] |
SWEADNER K J. Isozymes of the Na+/K+-ATPase[J]. Biochim Et Biophys Acta, 1989, 988(2): 185-220. DOI:10.1016/0304-4157(89)90019-1 |
| [7] |
LINGREL J B, KUNTZWEILER T. Na+, K+-ATPase[J]. J Biol Chem, 1994, 269(31): 19659-19662. |
| [8] |
MIJATOVIC T, ROLAND I, VAN QUAQUEBEKE E, et al. The α1 subunit of the sodium pump could represent a novel target to combat non-small cell lung cancers[J]. J Pathol, 2007, 212(2): 170-179. DOI:10.1002/path.2172 |
| [9] |
BENARROCH E E. Na+, K+-ATPase: Functions in the nervous system and involvement in neurologic disease[J]. Neurology, 2011, 76(3): 287-293. DOI:10.1212/wnl.0b013e3182074c2f |
| [10] |
MIJATOVIC T, DUFRASNE F, KISS R. Na+/K+-ATPase and cancer[J]. Pharm Pat Anal, 2012, 1(1): 91-106. DOI:10.4155/ppa.12.3 |
| [11] |
MATHIEU V, PIRKER C, MARTIN DE LASSALLE E, et al. The sodium pump alpha1 sub-unit: a disease progression-related target for metastatic melanoma treatment[J]. J Cell Mol Med, 2009, 13(9B): 3960-3972. DOI:10.1111/j.1582-4934.2009.00708.x |
| [12] |
XU Z W, WANG F M, GAO M J, et al. Targeting the Na+/K+-ATPase α1 subunit of hepatoma HepG2 cell line to induce apoptosis and cell cycle arresting[J]. Biol Pharm Bull, 2010, 33(5): 743-751. DOI:10.1248/bpb.33.743 |
| [13] |
HE Y, ZHANG P, ZHANG D, et al. Combined assessment of low PGRMC1/positive ATP1A1 levels has enhanced prognostic value for renal cell carcinoma[J]. Oncol Rep, 2018, 40(3): 1467-1476. DOI:10.3892/or.2018.6541 |
| [14] |
ZHANG D, ZHANG P, YANG P B, et al. Downregulation of ATP1A1 promotes cancer development in renal cell carcinoma[J]. Clin Proteom, 2017, 14: 15. DOI:10.1186/s12014-017-9150-4 |
| [15] |
BAKER BECHMANN M, ROTOLI D, MORALES M, et al. Na, K-ATPase isozymes in colorectal cancer and liver metastases[J]. Front Physiol, 2016, 7: 9. DOI:10.3389/fphys.2016.00009 |
| [16] |
GOJIS O, RUDRARAJU B, GUDI M, et al. The role of SRC-3 in human breast cancer[J]. Nat Rev Clin Oncol, 2010, 7(2): 83-89. DOI:10.1038/nrclinonc.2009.219 |
| [17] |
KIM L C, SONG L X, HAURA E B. Src kinases as therapeutic targets for cancer[J]. Nat Rev Clin Oncol, 2009, 6(10): 587-595. DOI:10.1038/nrclinonc.2009.129 |
| [18] |
MIJATOVIC T, INGRASSIA L, FACCHINI V, et al. Na+/K+-ATPase α subunits as new targets in anticancer therapy[J]. Expert Opin Ther Targets, 2008, 12(11): 1403-1417. DOI:10.1517/14728222.12.11.1403 |
| [19] |
XIE J, YE Q, CUI X, et al. Expression of rat Na-K-ATPase α2 enables ion pumping but not ouabain-induced signaling in α1-deficient Porcine renal epithelial cells[J]. Am J Physiol Cell Physiol, 2015, 309(6): C373-C382. DOI:10.1152/ajpcell.00103.2015 |
| [20] |
STAEHR C, HANGAARD L, BOUZINOVA E V, et al. Smooth muscle Ca2+ sensitization causes hypercontractility of middle cerebral arteries in mice bearing the familial hemiplegic migraine type 2 associated mutation[J]. J Cereb Blood Flow Metab, 2019, 39(8): 1570-1587. DOI:10.1177/0271678x18761712 |



