2. 400038 重庆, 陆军军医大学(第三军医大学):极端环境医学教育部重点实验室;
3. 400038 重庆, 陆军军医大学(第三军医大学):全军高原医学重点实验室;
4. 400038 重庆, 陆军军医大学(第三军医大学):军事预防医学系热带医学教研室
2. Key Laboratory of Extreme Environmental Medicine of Ministry of Education;
3. Key Laboratory of High Altitude Medicine, Faculty of High Altitude Military Medicine;
4. Department of Tropical Medicine, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
高原脑水肿(high altitude cerebral edema,HACE)是由于机体急速暴露于高原缺氧环境而引起的严重脑功能障碍,以严重的神经精神症状、昏迷或共济失调为主要表现的一种急性高原病。由于高原脑水肿的病情重、病死率高,积极研究寻求有效的防治措施一直是高原医学领域研究的前沿和重点[1]。缺氧预适应被认为是预防急性高原病, 提高部队战斗力的有效方法。但它对设备要求高,实施困难,保护效应时间短,因此急需寻找一种简单、方便、易行的方法来预防急性高原病。机体长期反复接受中等强度热刺激可出现一系列适应性反应,称之为热习服(heat acclimatization,HA)。研究显示,热习服后不仅对高热应激具有保护作用,对其它应激也有积极保护作用[2],可有效保护大鼠创伤性脑损伤,并减轻继发脑水肿的形成。有关热习服是否可有效预防高原脑水肿尚不清楚,本研究旨在探讨热习服对大鼠高原脑水肿的预防效应及其机制,为高原脑水肿的防护提供新的策略和方法。
1 材料与方法 1.1 实验动物与主要试剂 1.1.1 实验动物及分组8~9周龄健康雄性SD大鼠由陆军军医大学实验动物中心提供,体质量200~250 g,采用随机数字表法分为正常对照组(C组)、热习服组(HA组)、缺氧组(H组)、热习服+缺氧组(HHA组)。C组正常饲养,HA组与H组按1.2.1所述方法处理,HHA组为达到HA后再给予H组处理条件处理。饲养及实验过程中遵守实验动物管理与保护准则。
1.1.2 主要试剂丙二醛检测试剂盒购于南京建成公司(货号A003-1),AQP4抗体购于美国Abcam公司(货号ab46182),β-actin抗体购于美国Sigma公司(货号A2228),HSP70抗体购于美国Bioworld公司(货号BS2741),FJB染料购于美国Millipore公司(货号AG310),其余常规试剂均购于上海碧云天生物科技有限公司。
1.2 方法 1.2.1 HA组和H组动物模型的建立根据文献[3]报道构建热习服模型(HA组),大鼠置于温度(34±1)℃热习服室连续30 d,自由进食饮水,照明7:00-19:00,研究已证实该条件下大鼠可达到稳定的热习服状态。根据文献[4-5]报道构建HACE模型(H组),大鼠置于高原环境模拟实验舱(贵州风雷),上升速率5 m/s,升至7 600 m后缺氧24 h,期间自由饮水进食。缺氧结束后实验人员进入低压舱内(模拟4 000 m)进行后续操作。
1.2.2 脑组织含水量测定不同实验条件处理后,立刻断颈处死大鼠,快速取出全脑,去除脑膜和小脑,擦去血液,称质量(湿质量)后置于95 ℃烤箱中烤至恒重(干质量,2次称量差≤0.2 mg),以脑组织湿干质量比=湿质量/干质量表示脑组织含水量。
1.2.3 观察脑组织病理形态学和超微结构的改变用4 ℃生理盐水从左心室冲洗全身血液,冲洗干净后用4%多聚甲醛灌注固定,完整取出大脑置于4%多聚甲醛固定液中4 ℃保存备用。常规脱水、透明、浸蜡、包埋后连续进行冠状切片,然后进行HE染色。大脑切片置于1%NaOH-80%乙醇混合液浸泡、蒸馏水洗涤、0.06%高锰酸钾溶液浸泡15 min,洗涤后放入新鲜配制的0.000 4% FJB工作液中避光染色30 min、洗涤、脱水、透明、抗荧光淬灭剂封片,激光共聚焦显微镜下(激发光波长为450~490 nm)观察大脑皮层,并拍照。于前额叶皮层处剪下1 mm×1 mm×1 mm立方块,经戊二醛固定,1%锇酸后固定,系列丙酮脱水,环氧树脂618原位包埋,超薄(厚60 nm)切片,双铅染色,置于透射电镜下观察、采集图像。
1.2.4 血液学参数、血红蛋白氧解离曲线、血气分析检测大鼠缺氧结束后,麻醉,暴露腹主动脉,用采血针采集腹主动脉血液,置于两管含EDTA-K2抗凝剂的采血管中,一管用全自动血液分析仪测定血常规指标,另一管通过HENOX-ANALYZER血氧分析仪测定血红蛋白氧饱和度为50%时对应的血氧分压(oxygen half-staturation of hemoglobin,P50),绘制血红蛋白氧解离曲线。同时用1 mL已肝素化的注射器采动脉血0.5 mL,采血后立即用橡皮塞密封注射器针尖,2 h内用全自动血气分析仪进行血气分析检测。未缺氧组则在常氧条件下进行同样的取血和检测。
1.2.5 测定脑组织匀浆MDA含量大鼠处死后,快速取出大脑皮层,一部分置于4 ℃生理盐水中,制备成10%匀浆,4 ℃离心后取上清放4 ℃冰箱备用;另外一部分置于裂解液中,提取大脑皮层蛋白,4 ℃离心后取上清放入-80 ℃冰箱中备用。MDA检测具体操作按南京建成试剂盒说明书操作。
1.2.6 Western blot检测HSP70和AQP4蛋白表达取出上一步提取的蛋白样品置于冰上,并用BCA法测定蛋白浓度,变性后进行SDS-PAGE凝胶电泳,湿转法将蛋白转移至PVDF膜,5%脱脂奶粉溶液封闭1 h,TBST洗涤后分别孵育一抗AQP4(1 :1 000)、HSP70(1 :1 000)和内参β-actin(1 :1 000),置于4 ℃过夜,TBST洗涤3次,辣根过氧化物酶标记山羊抗兔、山羊抗小鼠二抗IgG(1 :2 000)室温孵育2 h,洗涤,ECL化学发光法显影,使用Bio-Rad凝胶成像系统采集图像,Image-J软件分析灰度值,目的条带灰度值分别与内参条带灰度值进行比较。
1.3 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,采用单因素方差分析,通过LSD法进行两两比较。检验水准α=0.05。
2 结果 2.1 脑组织含水量测定与C组比较,H组含湿干质量比显著升高,提示缺氧处理后脑含水量升高;与H组比较,HHA组湿干质量比显著降低(P < 0.05,图 1)。
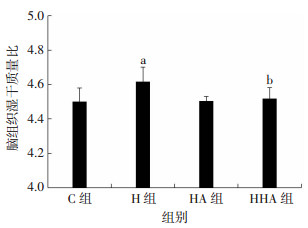
|
| a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 图 1 各组大鼠脑组织含水量(n=6) |
2.2 脑组织HE染色观察
C组脑组织结构正常,胞质与胞核结构清晰;H组细胞肿胀,胞质疏松,细胞水肿明显,部分空泡化,提示缺氧后脑细胞受损;HA组脑组织结构正常,细胞无明显水肿;HHA组细胞水肿程度明显轻于H组,提示HA预处理减轻了缺氧导致的脑组织损伤(图 2)。
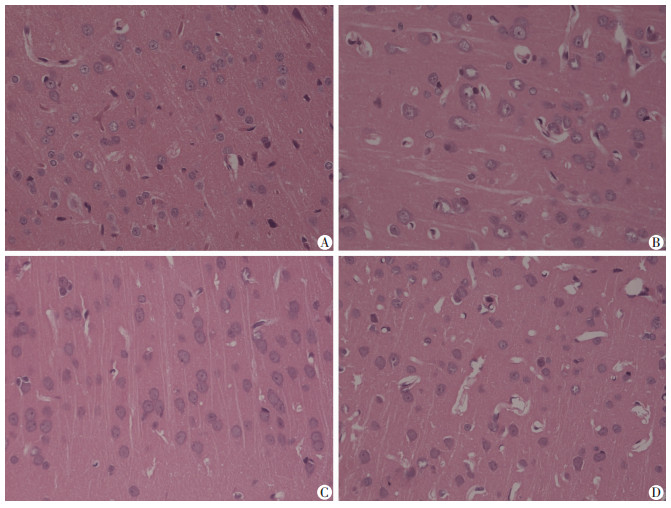
|
| A:C组;B:H组;C:HA组;D:HHA组 图 2 HE染色观察大鼠大脑皮层病理改变 (×400) |
2.3 脑组织FJB染色检测神经元变性
各组大鼠脑组织切片FJB染色结果如图 3所示,绿色荧光为FJB阳性细胞。与C组比较,H组阳性细胞显著增加,提示缺氧导致神经元变性;与H组比较,HHA组阳性细胞显著减少,提示热习服可减轻缺氧导致的神经元变性。
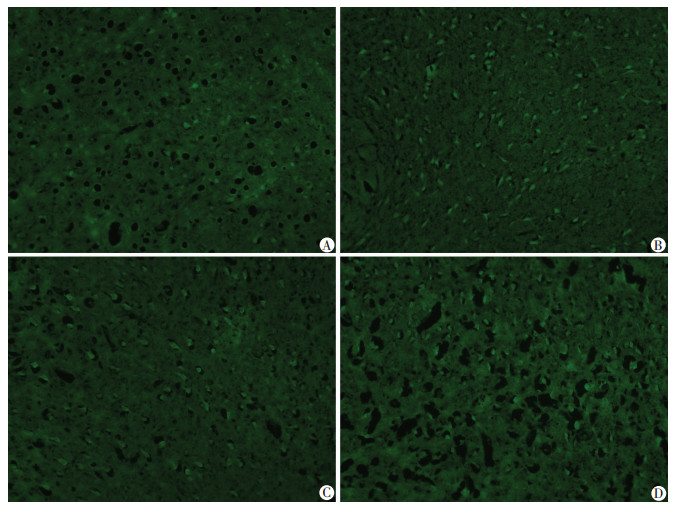
|
| A:C组;B:H组;C:HA组;D:HHA组 图 3 FJB染色观察大鼠大脑皮层神经元变性 (×200) |
2.4 电镜检测大鼠神经元超微结构
C组大鼠神经元超微结构正常,细胞核核膜结构完整,染色质分布均匀,胞浆内线粒体、粗面内质网、核糖体等结构清晰。与C组比较,H组大鼠神经细胞核膜结构不连贯,核内染色质分布不均匀;细胞浆内线粒体、粗面内质网、核糖体等细胞器溶解消失,胞浆明显肿胀;与H组比较,HHA组大鼠神经元胞核呈圆形,核内染色质分布均匀,胞浆内线粒体轻度肿胀,但粗面内质网、核糖体等结构清晰(图 4)。
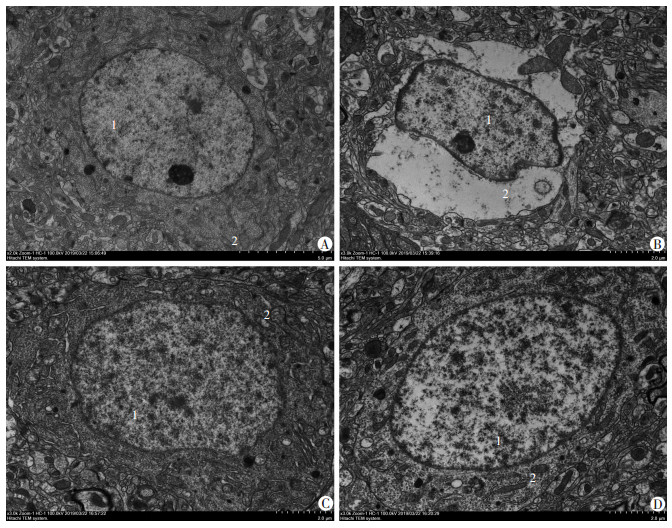
|
| A:C组;B:H组;C:HA组;D:HHA组1:细胞核;2:胞浆线粒体等细胞器 图 4 各组大鼠大脑皮层神经元超微结构观察 (×3 000) |
2.5 血液学检测
与C组比较,H组大鼠血红蛋白、红细胞和红细胞压积显著升高;但与H组比较,HHA组大鼠血红蛋白、红细胞和红细胞压积进一步升高(P < 0.05)。提示热习服后高原缺氧暴露大鼠的血液携氧能力增强。
与C组比较,H组大鼠中性粒细胞百分比明显升高;与H组比较,HHA组大鼠中性粒细胞百分比显著降低(P < 0.05)。提示热习服后高原缺氧暴露大鼠血液中的中性粒细胞降低(表 1)。
| 组别 | RBC/1012·L-1 | HGB/g·L-1 | HCT(%) | NEU(%) |
| C组 | 8.73±0.33 | 160.67±8.29 | 46.32±2.58 | 30.98±8.11 |
| H组 | 9.40±0.66a | 170.30±9.02a | 49.50±2.80a | 57.31±10.69a |
| HA组 | 9.07±0.97 | 161.82±14.70 | 46.25±3.94 | 31.43±8.43 |
| HHA组 | 10.21±0.62b | 182.10±7.46b | 53.00±2.59b | 47.19±6.42b |
| a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 | ||||
2.6 血气分析
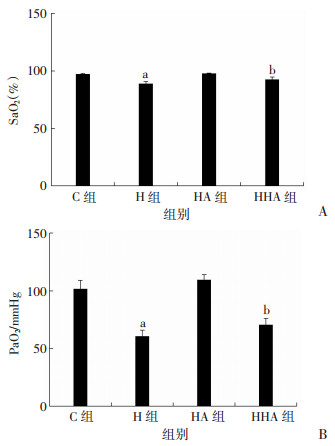
与C组比较,H组大鼠血氧饱和度、血氧分压显著下降;与H组比较,HHA组大鼠血氧饱和度、血氧分压显著升高(P < 0.05)。提示热习服增强了高原缺氧暴露大鼠的供氧能力(图 5)。
|
| A:各组大鼠动脉血氧饱和度;B:各组大鼠动脉血氧分压;a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 图 5 各组大鼠动脉血血气分析 (n=6) |
2.7 血红蛋白氧解离曲线测定
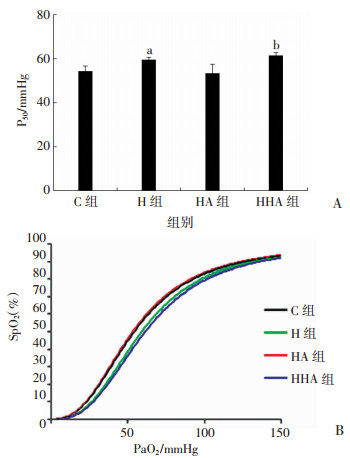
与C组比较,H组的P50(血红蛋白氧饱和度为50%时对应的血氧分压)显著升高(P < 0.05);与H组相比,HHA组的P50明显升高(P < 0.05),提示血红蛋白释放氧的能力进一步加强。与C组相比,H、HHA组氧解离曲线发生右移(图 6)。
|
| A:各组大鼠动脉血P50;B:各组大鼠动脉血氧解离曲线;a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 图 6 各组大鼠血红蛋白氧解离曲线(n=8) |
2.8 脑组织丙二醛含量检测
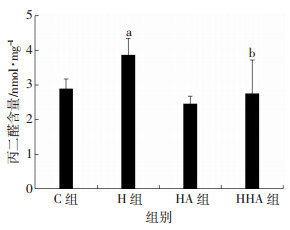
与C组比较,H组大鼠脑组织MDA含量显著升高(P < 0.05),提示缺氧后脑组织脂质过氧化增加;与H组比较,HHA组MDA含量显著降低(P < 0.05),提示热习服处理后可以显著减少缺氧造成的大鼠脑组织脂质过氧化增加(图 7)。
|
| a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 图 7 各组大鼠大脑皮层MDA含量 (n=8) |
2.9 大鼠大脑皮层HSP70、AQP4的蛋白表达变化
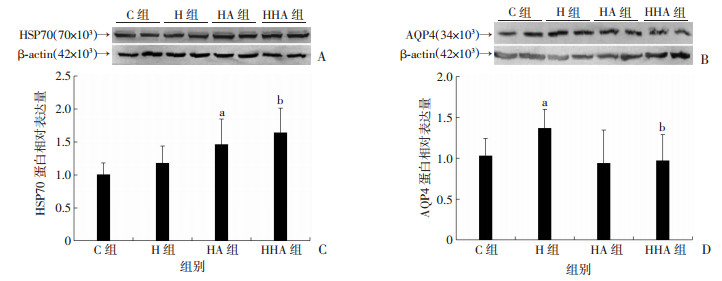
与C组相比,HA组HSP70显著升高,提示热习服模型构建成功。与H组相比,HHA组HSP70显著升高(P < 0.05);与C组相比,H组AQP4表达显著增加(P < 0.05);而与H组比较,HHA组AQP4的表达显著下降(P < 0.05,图 8)。
|
| A:Western blot检测各组大鼠大脑皮层中HSP70蛋白表达;B:Western blot检测各组大鼠大脑皮层中AQP4蛋白表达;C:各组大鼠大脑皮层中HSP70蛋白表达半定量分析;D:各组大鼠大脑皮层中AQP4蛋白表达半定量分析a:P < 0.05,与C组比较;b:P < 0.05,与H组比较 图 8 Western blot检测HSP70、AQP4蛋白在大鼠大脑皮层中的表达(n=8) |
3 讨论
高原脑水肿是一种严重的急性高原病,但是目前其发病机制还不清楚,缺氧是其发生的基本病因。热习服是机体为适应热环境而自发产生的一系列适应性变化,主要表现为基础代谢率下降、出汗率增加、皮肤血流量增加,以维持体液和细胞能量平衡[6-7]。热习服是机体增强耐热能力的有效方法,诸多研究证实热习服不仅对损伤性热刺激具有很好的保护作用,对其他损伤因素也有保护作用,如大鼠发生缺血、缺氧、再灌注等损伤时,其心肌细胞损伤程度显著低于未经热习服的大鼠[8]。此外有研究表明热习服预处理后,小鼠发生创伤性脑损伤时,损伤程度显著减轻,且恢复更快[9]。然而其是否能预防高原脑水肿并减轻缺氧造成的脑损伤目前仍不清楚。
本研究发现缺氧组大鼠脑湿干重比显著增加,提示缺氧导致了高原脑水肿的发生,HE、FJB染色和电镜结果观察到明显脑组织损伤病理形态学变化,表明缺氧可明确导致脑损伤。然而,热习服预处理后的大鼠暴露于缺氧环境后,损伤明显减轻,表现为脑湿干重比显著下降,组织病理损伤减轻,变性神经元减少,细胞水肿减轻,说明热习服对缺氧导致的脑损伤具有明显的保护作用。
官立彬等[10]研究发现,缺氧后大鼠P50升高,而我们发现与单纯缺氧组相比,热习服加缺氧组大鼠血红蛋白P50显著升高,氧解离曲线右移,血红蛋白释放氧能力增强,可能是由于红细胞的无氧糖酵解活动增强,2, 3-二磷酸甘油酸含量迅速增加,从而导致P50增加,氧解离曲线右移,血红蛋白释放氧的能力增强[11]。人急进高原后,饮水量减少,造成血浆容量减少,红细胞、血红蛋白和红细胞压积含量相对升高,而缺氧后促红细胞生成素(EPO)合成增多,进一步促进红细胞生成,红细胞最主要的动能就是运输氧气。它们是缺氧后的一种代偿反应[4],有研究发现,热习服后可显著增加机体血浆容量[12],然而血液中的红细胞压积并不会降低,说明循环中的红细胞总量增加。红细胞最主要的功能就是运输氧气,本研究中热习服加缺氧组大鼠,其红细胞、血红蛋白和红细胞压积均高于单纯缺氧组,它可能通过此途径缓解缺氧造成的脑损伤。此外,越来越多的证据表明炎症在高原脑水肿的发生发展中起着重要作用[13-15],有研究发现热习服在对创伤性脑损伤的保护中具有抑制炎症作用[16],我们的研究结果表明热习服可以使缺氧条件下血液中的中性粒细胞比例降低,提示在高原脑水肿发生过程中,热习服可能通过抑制缺氧诱发的炎症来发挥保护作用。
有研究认为氧化应激损伤在高原脑水肿的发生发展中具有重要作用[17]。本研究发现,热习服预处理可减少缺氧引起的MDA含量的增加并减轻缺氧造成的神经元损伤,可能与热习服增强了机体的抗氧化应激能力有关[18]。而热应激蛋白参与了体内的抗氧化应激过程。热应激蛋白按分子量大小可分为:HSP70、HSP90、HSP100及小分子HSP家族等,每个家族又有很多成员。其中HSP70家族是研究最为广泛的家族,它可分为HSP70、HSC70、HSP75、GRP78。HSP70家族的功能众多,具有分子伴侣作用、细胞保护作用、抗氧化和抗凋亡作用,可以对多种应激起保护作用[19]。在热习服过程中HSP70的表达量升高与机体重新达到新稳态有着密切的关系。本研究发现热习服后大鼠脑组织HSP70表达升高,热习服复合缺氧组升高更为显著,而单独缺氧时HSP70也有升高趋势但是无显著差异,可能与缺氧时间较短有关。文献报道,HSP70升高可以逆转高原脑水肿的发生,使用HSP70抗体作用后高原脑水肿加重[20-21],提示热习服后升高的HSP70对高原脑水肿发挥了保护效应。AQP4是一种细胞膜转运蛋白,它主要表达于中枢神经系统。MANLEY等[22]研究发现AQP4基因敲除的大鼠制作水中毒模型时,与野生型大鼠制作的水中毒模型相比,其脑组织含水量显著降低。最近研究发现了AQP4参与了高原脑水肿的形成,通过抑制AQP4蛋白的表达后,可有效预防高原脑水肿发生[23]。我们发现缺氧后AQP4显著升高,热习服复合缺氧组大鼠脑组织的AQP4表达量显著下调,提示热习服可能通过降低AQP4的表达从而预防高原脑水肿。
本研究证明了热习服可以预防大鼠高原脑水肿的发生,并对其机制进行了初步探讨,为军事人员急进高原提供了一种简单、方便、操作性强的预防急性高原病发生的新方法。但热习服诱导的缺氧交叉耐受的具体机制还需进一步研究。
| [1] |
WEST J B. High-altitude medicine[J]. Am J Respir Crit Care Med, 2012, 186(12): 1229-1237. DOI:10.1164/rccm.201207-1323ci |
| [2] |
HOROWITZ M. Heat acclimation-mediated cross-tolerance: origins in within-life epigenetics?[J]. Front Physiol, 2017, 8: 548. DOI:10.3389/fphys.2017.00548 |
| [3] |
YACOBI A, STERN BACH Y, HOROWITZ M. The protective effect of heat acclimation from hypoxic damage in the brain involves changes in the expression of glutamate receptors[J]. Temperature (Austin), 2014, 1(1): 57-65. DOI:10.4161/temp.29719 |
| [4] |
SARADA S K, TITTO M, HIMADRI P, et al. Curcumin prophylaxis mitigates the incidence of hypobaric hypoxia-induced altered ion channels expression and impaired tight junction proteins integrity in rat brain[J]. J Neuroinflammation, 2015, 12: 113. DOI:10.1186/s12974-015-0326-4 |
| [5] |
GONG G, YIN L, YUAN L B, et al. Ganglioside GM1 protects against high altitude cerebral edema in rats by suppressing the oxidative stress and inflammatory response via the PI3K/AKT-Nrf2 pathway[J]. Mol Immunol, 2018, 95: 91-98. DOI:10.1016/j.molimm.2018.02.001 |
| [6] |
PÉRIARD J D, RACINAIS S, SAWKA M N. Adaptations and mechanisms of human heat acclimation: Applications for competitive athletes and sports[J]. Scand J Med Sci Sports, 2015, 25(Suppl 1): 20-38. DOI:10.1111/sms.12408 |
| [7] |
HOROWITZ M. Epigenetics and cytoprotection with heat acclimation[J]. J Appl Physiol, 2016, 120(6): 702-710. DOI:10.1152/japplphysiol.00552.2015 |
| [8] |
GIBSON O R, TAYLOR L, WATT P W, et al. Cross-adaptation: heat and cold adaptation to improve physiological and cellular responses to hypoxia[J]. Sports Med, 2017, 47(9): 1751-1768. DOI:10.1007/s40279-017-0717-z |
| [9] |
UMSCHWEIF G, SHEIN N A, ALEXANDROVICH A G, et al. Heat acclimation provides sustained improvement in functional recovery and attenuates apoptosis after traumatic brain injury[J]. J Cereb Blood Flow Metab, 2015, 35(11): 1901. DOI:10.1038/jcbfm.2015.207 |
| [10] |
官立彬, 李晓栩, 李锦松, 等. 5-羟甲基糠醛对模拟高原大鼠血红蛋白氧结合特性及游泳耐力和空间记忆能力的影响[J]. 第三军医大学学报, 2015, 37(15): 1561-1565. GUAN L B, LI X X, LI J S, et al. Effect of 5-HMF on hemoglobin-oxygen affinity, swimming endurance and spatial memory ability of rats in high altitude simulated environment[J]. J Third Mil Med Univ, 2015, 37(15): 1561-1565. DOI:10.16016/j.1000-5404.201411147 |
| [11] |
ELLIS S S, PEPPLE D J. Sildenafil increases the p50 and shifts the oxygen-hemoglobin dissociation curve to the right[J]. J Sex Med, 2015, 12(12): 2229-2232. DOI:10.1111/jsm.13038 |
| [12] |
LORENZO S, HALLIWILL J R, SAWKA M N, et al. Heat acclimation improves exercise performance[J]. J Appl Physiol, 2010, 109(4): 1140-1147. DOI:10.1152/japplphysiol.00495.2010 |
| [13] |
SONG T T, BI Y H, GAO Y Q, et al. Systemic pro-inflammatory response facilitates the development of cerebral edema during short hypoxia[J]. J Neuroinflammation, 2016, 13(1): 63. DOI:10.1186/s12974-016-0528-4 |
| [14] |
ZHOU Y Z, HUANG X, ZHAO T, et al. Hypoxia augments LPS-induced inflammation and triggers high altitude cerebral edema in mice[J]. Brain Behav Immun, 2017, 64: 266-275. DOI:10.1016/j.bbi.2017.04.013 |
| [15] |
HIMADRI P, KUMARI S S, CHITHARANJAN M, et al. Role of oxidative stress and inflammation in hypoxia-induced cerebral edema: a molecular approach[J]. High Alt Med Biol, 2010, 11(3): 231-244. DOI:10.1089/ham.2009.1057 |
| [16] |
SHEIN N A, DORON H, HOROWITZ M, et al. Altered cytokine expression and sustained hypothermia following traumatic brain injury in heat acclimated mice[J]. Brain Res, 2007, 1185: 313-320. DOI:10.1016/j.brainres.2007.09.024 |
| [17] |
LISK C, MCCORD J, BOSE S, et al. Nrf2 activation: a potential strategy for the prevention of acute mountain sickness[J]. Free Radic Biol Med, 2013, 63: 264-273. DOI:10.1016/j.freeradbiomed.2013.05.024 |
| [18] |
EYNAN M, ERTRACHT O, GANCZ H, et al. Prolonged latency to CNS-O2 toxicity induced by heat acclimation in rats is associated with increased antioxidative defenses and metabolic energy preservation[J]. J Appl Physiol, 2012, 113(4): 595-601. DOI:10.1152/japplphysiol.00228.2012 |
| [19] |
KIM J Y, HAN Y, LEE J E, et al. The 70-kDa heat shock protein (Hsp70) as a therapeutic target for stroke[J]. Expert Opin Ther Targets, 2018, 22(3): 191-199. DOI:10.1080/14728222.2018.1439477 |
| [20] |
LIN H, CHANG C P, LIN H J, et al. Attenuating brain edema, hippocampal oxidative stress, and cognitive dysfunction in rats using hyperbaric oxygen preconditioning during simulated high-altitude exposure[J]. J Trauma Acute Care Surg, 2012, 72(5): 1220-1227. DOI:10.1097/TA.0b013e318246ee70 |
| [21] |
WU H H, NIU K C, LIN C H, et al. HSP-70-mediated hyperbaric oxygen reduces brain and pulmonary edema and cognitive deficits in rats in a simulated high-altitude exposure[J]. Biomed Res Int, 2018, 2018: 4608150. DOI:10.1155/2018/4608150 |
| [22] |
MANLEY G T, FUJIMURA M, MA T, et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J]. Nat Med, 2000, 6(2): 159-163. DOI:10.1038/72256 |
| [23] |
WANG C, YAN M Y, JIANG H, et al. Mechanism of aquaporin 4 (AQP 4) up-regulation in rat cerebral edema under hypobaric hypoxia and the preventative effect of puerarin[J]. Life Sci, 2018, 193: 270-281. DOI:10.1016/j.lfs.2017.10.021 |



